 Este texto consolidado es de carácter informativo y no tiene valor jurídico.
Este texto consolidado es de carácter informativo y no tiene valor jurídico.[Disposición derogada]
El organismo nocivo Ralstonia solanacearum (Smith) Yabuuchi et al., conocido anteriormente por Pseudomonas solanacearum (Smith) Smith, es causa de las enfermedades de la «podredumbre parda» en los tubérculos de patata y de la «marchitez bacteriana» en las plantas de patata, tomate y otras especies de solanáceas, y representa una grave amenaza para las producciones de estos cultivos.
Debido a que en los últimos años han aparecido brotes de las enfermedades citadas en algunas partes de la Comunidad Europea y que aún subsisten algunos focos de infección aislados, y en particular respecto a España se han producido algunas intercepciones en Castilla y León y Galicia y, dicha bacteria está presente con una distribución localizada en la isla de La Palma en Canarias; considerando la importancia económica de los citados productos vegetales; y teniendo en cuenta que el conocimiento actual de la biología y epidemiología de Ralstonia solanacearum en las condiciones europeas es incompleto y que puede preverse la necesidad de revisar en el futuro las medidas y los procedimientos de análisis aquí establecidos, se hace preciso adoptar las medidas mínimas necesarias contempladas en la Directiva 98/57/CE del Consejo, de 20 de julio de 1998, sobre el control de Ralstonia solanacearum (Smith) Yabuuchi et al. mediante el correspondiente programa de erradicación y control y ello sin perjuicio de que se adopten las medidas adicionales más estrictas que resulten necesarias.
En consecuencia, mediante este Real Decreto, se incorpora al ordenamiento interno la Directiva 98/57/CE, del Consejo, de 20 de julio, de acuerdo con las competencias atribuidas al Estado con carácter exclusivo por el artículo 149.1.13.a de la Constitución Española en materia de bases y coordinación de la planificación general de la actividad económica.
En la elaboración de la presente disposición han sido consultadas las Comunidades Autónomas y los sectores afectados.
En su virtud, a propuesta del Ministro de Agricultura, Pesca y Alimentación, previo informe del Ministro de Administraciones Públicas, de acuerdo con el Consejo de Estado, y previa deliberación en el Consejo de Ministros del día 22 de octubre de 1999,
DISPONGO:
La presente disposición establece el programa de erradicación y control del organismo Ralstonia solanacearum (Smith) Yabuuchi et al., anteriormente denominado Pseudomonas solanacearum (Smith) Smith (denominado en lo sucesivo «del organismo») de acuerdo con el artículo 12 del Real Decreto 1190/1998, de 12 de junio, por el que se regulan los programas nacionales de erradicación o control de organismos nocivos de los vegetales aún no establecidos en el territorio nacional, con el fin de que, en lo que respecta a las plantas huésped del organismo indicadas en la sección I del anexo I del presente Real Decreto (denominadas en lo sucesivo «del material vegetal indicado»), se adopten las medidas necesarias para:
a) localizar el organismo y determinar su distribución;
b) impedir su aparición y propagación; y
c) en caso de que aparezca, evitar su propagación y controlarlo con vistas a su erradicación.
2. Se declaran de utilidad pública las medidas contempladas en el presente Real Decreto, de conformidad con lo establecido en el Real Decreto 1190/1998.
1. El programa que se aprueba y las medidas de él dimanantes serán de aplicación en todo el territorio nacional.
2. En tanto la Comisión de las Comunidades Europeas no se pronuncie al respecto, la duración del programa se prevé ilimitada. En todo momento y como consecuencia de la situación de la enfermedad, el Ministerio de Agricultura, Pesca y Alimentación podrá introducir las modificaciones que se consideren necesarias o determinar su conclusión.
1. Los organismos oficiales responsables de cada Comunidad Autónoma, a los que se hace referencia en el artículo 11.2 b) del Real Decreto 2071/1993, de 26 de noviembre, relativo a las medidas de protección contra la introducción y difusión, en el territorio nacional y de la Comunidad Europea, de organismos nocivos para los vegetales o productos vegetales; así como para la exportación y tránsito hacia países terceros y el órgano competente de la Comunidad Autónoma de Canarias, llevarán a cabo anualmente exámenes oficiales sistemáticos para detectar la posible presencia del organismo en el material vegetal indicado originario de su territorio.
Con objeto de determinar otras posibles fuentes de contaminación existentes para el cultivo del material vegetal indicado, los organismos oficiales responsables de cada Comunidad Autónoma llevarán a cabo una evaluación de riesgo y, salvo que no se haya detectado riesgo alguno de propagación durante dicha evaluación, efectuarán, en las zonas productoras de dicho material, exámenes oficiales orientados específicamente a la detección del organismo en plantas distintas de ese material, incluidas las solanáceas silvestres huésped, así como en las aguas de superficie que se utilicen para regar tal material y en los residuos líquidos vertidos por las instalaciones industriales de transformación o de embalaje en las que se manipule el material indicado y que se utilicen para regar el material vegetal indicado. La extensión de estos exámenes orientados se determinará en función del riesgo observado.
Los organismos oficiales responsables de cada Comunidad Autónoma podrán realizar también exámenes oficiales destinados a la detección del organismo en otros materiales, como el medio de cultivo, el suelo y los residuos sólidos procedentes de las instalaciones industriales de transformación o de embalaje.
2. Los exámenes oficiales previstos en el apartado 1 del artículo 3 se efectuarán:
a) en el caso del material vegetal indicado, de acuerdo con las normas establecidas en el punto 1 de la sección II del anexo I del presente Real Decreto; y,
b) en el caso de las plantas huésped del organismo distintas del material vegetal indicado y en el de las aguas, incluidos los residuos líquidos, aplicando métodos apropiados y, cuando proceda, tomando muestras y sometiéndolas a análisis de laboratorio oficiales o bajo supervisión oficial;
c) cuando resulte apropiado, en el caso de otros materiales, utilizando métodos adecuados.
Para la realización de esos exámenes, los pormenores de los procedimientos de inspección así como el número, origen y clasificación de las muestras y el calendario de su recogida serán decididos por los organismos oficiales responsables de cada Comunidad Autónoma basándose en principios científicos y estadísticos sólidos y en la biología del organismo y teniendo en cuenta, según la región de que se trate, los sistemas concretos que se utilicen para la producción del material vegetal indicado y, en su caso, de otras plantas huésped del organismo.
3. Los detalles y resultados de los exámenes oficiales previstos en el apartado 1 del artículo 3 serán notificados al Ministerio de Agricultura, Pesca y Alimentación, y éste, a su vez, a través del cauce correspondiente, a los demás Estados miembros y a la Comisión Europea cada año, siguiendo, a tal efecto, las disposiciones del punto 2 de la sección II del anexo I del presente Real Decreto. Estas notificaciones se presentarán, a más tardar, el 15 de mayo, salvo en el caso de las patatas utilizadas para siembra en la propia explotación, que se presentarán, a más tardar, el 15 de agosto. Los detalles y resultados relativos a los cultivos se referirán a la producción del año anterior.
Los productores, los almacenes colectivos y los centros de expedición de los materiales contemplados en la sección I del anexo I del presente Real Decreto deberán notificar inmediatamente a los organismos oficiales responsables de cada Comunidad Autónoma, en las que estén situadas sus parcelas o establecimientos, la aparición sospechosa o la presencia confirmadas del organismo en el material que produzca o comercialice.
1. En todos los casos de sospecha de brote, los organismos oficiales responsables de cada Comunidad Autónoma afectada velarán por la realización de análisis de laboratorio oficiales o bajo supervisión oficial en los que se aplique, para el material vegetal indicado, el método pertinente establecido en el anexo II y en las condiciones determinadas en el punto 1 del anexo III del presente Real Decreto o, en todos los demás casos, cualquier otro método aprobado oficialmente que permita confirmar o despejar la sospecha en cuestión. En caso de confirmación, serán de aplicación los requisitos dispuestos en el punto 2 del anexo III del presente Real Decreto.
2. En espera de la confirmación o disipación de la sospecha a la que se refiere el apartado 1 del artículo 5, en todos los casos en que:
i) se hayan observado síntomas de las enfermedades causadas por el organismo y se hayan obtenido resultados positivos en la prueba o pruebas de detección rápida que se contemplan en el punto 1 de la sección I y en el punto 1 de la sección II del anexo II del presente Real Decreto; o ii) se haya obtenido un resultado positivo en la prueba o pruebas de detección contempladas en el punto 2 de la sección I y en la sección III del anexo II del presente Real Decreto,
Los organismos oficiales responsables de cada Comunidad Autónoma, en lo que respecta a la producción propia:
a) prohibirán la circulación de las plantas y tubérculos de todos los cultivos, lotes o partidas de los que se hayan tomado las muestras, salvo que tal circulación tenga lugar bajo su control y siempre que se haya comprobado que no existe ningún riesgo identificable de propagación del organismo;
b) tomarán las medidas necesarias para descubrir el origen del presunto brote;
c) establecerán, en lo que respecta especialmente a la producción del material vegetal indicado y al movimiento de lotes de patata de siembra distintos de los mencionados en la letra a), producidos en el lugar de producción del que se hayan obtenido las muestras mencionadas en la letra a), medidas preventivas complementarias que, basándose en el nivel de riesgo estimado, sean adecuadas para prevenir toda propagación del organismo.
3. En los casos de sospecha de brote en que exista un riesgo de contaminación del material vegetal indicado o de las aguas de superficie que procedan o se dirijan a otra u otras Comunidades Autónomas o, en su caso, a otro Estado miembro, la Comunidad Autónoma en la que se haya observado el presunto brote informará inmediatamente al Ministerio de Agricultura, Pesca y Alimentación de los detalles de dicho brote y del nivel de riesgo identificado para que éste a su vez, a través del cauce correspondiente, informe a las Comunidades Autónomas o a los Estados miembros afectados, y dichas Comunidades Autónomas cooperarán en consecuencia. Las Comunidades Autónomas a las que así se informe aplicarán medidas preventivas acordes con lo dispuesto en la letra c) del apartado 2 del artículo 5 y tomarán cualquier otra medida que resulte adecuada de conformidad con lo dispuesto en los apartados 1 y 2 del mismo.
1. Si la presencia del organismo en una muestra, tomada en cumplimiento del presente Real Decreto, fuere confirmada por análisis de laboratorios oficiales o bajo supervisión oficial en los que se utilice, para el material vegetal indicado, el método establecido en el anexo II del presente Real Decreto o, para todos los demás casos, cualquier otro método oficialmente aprobado, los organismos oficiales responsables de cada Comunidad Autónoma, basándose a tal efecto en principios científicos sólidos, en la biología del organismo y en los sistemas concretos de producción, comercialización y transformación que se utilicen en su territorio para las plantas huésped del organismo, adoptarán las siguientes medidas:
a) en el caso del material vegetal indicado:
i) emprenderán una investigación para determinar el alcance y la fuente o fuentes primarias de la contaminación, con arreglo a las disposiciones del anexo IV del presente Real Decreto y efectuando nuevos análisis, de conformidad con el apartado 1 del artículo 4, como mínimo, en todas las existencias de patata de siembra relacionadas clónicamente;
ii) declararán contaminados el material vegetal indicado, la partida o el lote de los que se haya tomado la muestra, así como la maquinaria, vehículo, nave, almacén, o unidades de éste, y cualesquiera otros objetos, incluido el material de embalaje, que hayan estado en contacto con el material vegetal indicado al que pertenezca la muestra tomada; asimismo, declararán contaminados, en su caso, el campo o campos, la unidad o unidades de producción de cultivos protegidos y el lugar o lugares de producción en los que se haya cosechado el material vegetal indicado y de los que proceda la muestra; además, en el caso de las muestras tomadas durante la fase de cultivo, declararán contaminados el campo o campos, el lugar o lugares de producción y, si procediere, la unidad o unidades de producción de cultivos protegidos de los que se haya tomado la muestra;
iii) determinarán, con arreglo a las disposiciones del punto 1 del anexo V del presente Real Decreto, el alcance de la contaminación que probablemente se haya producido por contactos anteriores o posteriores a la cosecha, por nexos en la producción, riego o por relaciones clonales con la contaminación declarada; y
iv) delimitarán una zona en función de tres factores: la declaración de contaminación contemplada en el inciso ii) anterior, el alcance de la contaminación probable que se determine en el marco del inciso iii) anterior y la posible propagación del organismo, con arreglo a las disposiciones del inciso i) del punto 2 del anexo V del presente Real Decreto.
b) en el caso de los cultivos de plantas huésped distintas del material mencionado en la letra a) en los que se haya identificado un riesgo para la producción del material vegetal indicado:
i) emprenderán una investigación de acuerdo con lo dispuesto en el inciso i) de la letra a);
ii) declararán contaminadas las plantas huésped del organismo de las que se haya tomado la muestra; y iii) con respecto a la producción del material vegetal indicado, determinarán el alcance de la contaminación probable y delimitarán una zona de conformidad con los incisos iii) y iv) de la letra a), respectivamente.
c) en el caso de las aguas de superficie (incluidos los vertidos de residuos líquidos procedentes de instalaciones industriales de transformación o envasado en las que se manipule el material vegetal indicado) y en el de las solanáceas silvestres huésped del organismo asociadas en las que, por causa del riego, aspersión o inundación con dichas aguas, se haya identificado un riesgo para la producción del material vegetal indicado:
i) emprenderán una investigación para determinar el alcance de la contaminación, realizando en los momentos oportunos, un examen oficial de muestras de las aguas de superficie y, en su caso, de las solanáceas silvestres huésped del organismo;
ii) procederán, en la medida que sea pertinente y sobre la base de la investigación mencionada en el inciso i), a declarar contaminadas las aguas de superficie de las que se hayan tomado la muestra o muestras; y,
iii) determinarán el alcance de la contaminación probable y delimitarán una zona en función de la declaración de contaminación contemplada en el inciso ii) anterior y de la posible propagación del organismo, teniendo en cuenta las disposiciones del punto 1 y del inciso ii) del punto 2 del anexo V del presente Real Decreto.
2. De conformidad con las disposiciones de los puntos 3 y 4 del anexo V del presente Real Decreto, las Comunidades Autónomas notificarán inmediatamente al Ministerio de Agricultura, Pesca y Alimentación, y éste, a su vez, a través del cauce correspondiente, a los otros Estados miembros y a la Comisión Europea, cualquier caso de contaminación declarada en virtud del inciso ii) de la letra a) y del inciso ii) de la letra c) del apartado 1 del artículo 6, así como los datos relativos a la zona que se haya delimitado con arreglo al inciso iv) de la letra a) del apartado 1 del artículo 6 y, en su caso, al inciso iii) de la letra c) de ese mismo apartado.
3. Como resultado de la notificación dispuesta en el apartado 2 y de los datos en ella contenidos, las Comunidades Autónomas afectadas emprenderán una investigación de acuerdo con el inciso i) de la letra a) del apartado 1 del artículo 6 y, en su caso, con el inciso i) de la letra c) del mismo apartado, y tomarán las medidas complementarias que sean adecuadas de conformidad con los apartados 1 y 2 del artículo 6.
4. Se crea en el Ministerio de Agricultura, Pesca y Alimentación un registro de las explotaciones, los almacenes colectivos y los centros de explotación afectados.
1. Se prohíbe la plantación del material vegetal indicado que se haya declarado contaminado en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6 y, bajo el control y aprobación de los organismos oficiales responsables de cada Comunidad Autónoma, dicho material será sometido a una de las disposiciones del punto 1 del anexo VI del presente Real Decreto con el fin de que pueda establecerse que no existe ningún riesgo identificable de propagación del organismo.
2. Se prohíbe la plantación del material vegetal indicado que, en virtud del inciso iii) de la letra a) y del inciso iii) de la letra c) del apartado 1 del artículo 6, se haya considerado probablemente contaminado, incluido el material vegetal indicado respecto del que se haya detectado la existencia de algún riesgo, producido en lugares de producción que con arreglo al inciso iii) de la letra a) del apartado 1 del artículo 6 se hayan considerado probablemente contaminados, y, bajo el control de los organismos oficiales responsables de cada Comunidad Autónoma, dicho material se destinará a un uso adecuado o se eliminará de acuerdo con el punto 2 del anexo VI del presente Real Decreto a fin de que pueda establecerse que no existe ningún riesgo identificable de propagación del organismo.
3. Toda maquinaria, vehículo, nave, almacén o unidades de éstos y cualesquiera otros objetos, incluido el material de embalaje, que se hayan declarado contaminados en virtud del inciso ii) de la letra a) y del inciso iii) de la letra c) del apartado 1 del artículo 6 o que se hayan considerado probablemente contaminados en virtud del inciso iii) de la letra a) del apartado 1 del mismo artículo será destruido o descontaminado, aplicando métodos apropiados, de conformidad con el punto 3 del anexo VI del presente Real Decreto. Tras su descontaminación, todos estos objetos dejarán de considerarse contaminados.
4. Sin perjuicio de las medidas que se ejecuten en virtud de los apartados 1, 2 y 3 del artículo 7, en la zona delimitada con arreglo a los incisos iv) de la letra a) y iii) de la letra c) del apartado 1 del artículo 6 se aplicarán una serie de medidas acordes con lo dispuesto en los puntos 4.1 y 4.2 del anexo VI del presente Real Decreto. Cada año se notificarán detalles de estas medidas al Ministerio de Agricultura, Pesca y Alimentación, y éste, a su vez, a través del cauce correspondiente, a los demás Estados miembros y a la Comisión Europea.
5. Las medidas fitosanitarias ordenadas por los organismos oficiales responsables de cada Comunidad Autónoma contempladas en los apartados 1, 2, 3 y 4 del artículo 7 serán realizadas, bajo control oficial, por el propietario del material afectado.
En el caso de que los afectados no ejecuten a su debido tiempo y forma las medidas a que se refiere el párrafo anterior, la Comunidad Autónoma procederá a ejecutarlas, con sus propios medios o empleando servicios ajenos, cargando los gastos correspondientes a los interesados, cuyo importe podrá exigírseles por vía de apremio, con independencia de las sanciones a que hubiere lugar.
1. Las patatas de siembra deberán reunir los requisitos del Real Decreto 2071/1993 y proceder, en línea directa, de patatas que, habiéndose obtenido en el marco de un programa oficialmente aprobado, hayan dado resultados negativos en cuanto a la presencia del organismo en análisis oficiales u oficialmente supervisados en los que se haya utilizado el método pertinente establecido en el anexo II del presente Real Decreto.
2. Dichos análisis serán efectuados:
a) en los casos en que se haya confirmado la presencia del organismo en la producción propia de patatas de siembra,
i) analizando el material propagado anteriormente, incluida la selección clonal inicial y analizando sistemáticamente los clones de patatas de siembra de base, o ii) en los casos en que se haya demostrado que no hay relación clonal, analizando todos los clones de patatas de siembra de base o el material propagado anteriormente, incluida la selección clonal inicial, y
b) en los demás casos, analizando en cada una de las plantas de la selección clonal inicial o muestras representativas de las patatas de siembra de base o del material propagado anteriormente.
Se prohíbe la conservación y manipulación del organismo a que se refiere el presente Real Decreto.
Sin perjuicio de las disposiciones del Real Decreto, 2071/1993, se podrán autorizar excepciones a lo dispuesto en los artículos 7 y 9 del presente Real Decreto, de conformidad con las normas establecidas para la realización de pruebas e investigaciones científicas o de estudios en materia de selecciones varietales en el Real Decreto 401/1996, de 1 de marzo, por el que se establecen las condiciones para la introducción en el territorio nacional de determinados organismos nocivos, vegetales, productos vegetales y otros objetos, con fines de ensayo, científicos y para la actividad de selección de variedades y en el Real Decreto 39/1998, de 16 de enero, por el que se modifica el Real Decreto 401/1996, de 1 de marzo, por el que se establecen las condiciones para la introducción en el territorio nacional de determinados organismos nocivos vegetales, productos vegetales y otros objetos, con fines de ensayo, científicos y para la actividad de selección de variedades.
1. Los órganos competentes de las Comunidades Autónomas podrán adoptar las medidas complementarias o más estrictas que sean necesarias para combatir el organismo o impedir su propagación, siempre que tales medidas se ajusten a las disposiciones del Real Decreto 2071/1993.
2. Los detalles de estas medidas deberán ser notificados al Ministerio de Agricultura, Pesca y Alimentación, y éste, a su vez, los notificará, a través del cauce correspondiente, a los demás Estados miembros y a la Comisión.
1. Se aplicará el sistema de indemnizaciones previsto en el artículo 18 del Real Decreto 1190/1998, de 12 de junio, por el que se regulan los programas nacionales de erradicación o control de organismos nocivos de los vegetales aún no establecidos en el territorio nacional.
2. No son indemnizables los gastos ocasionados ni el material vegetal destruido en aplicación de una medida oficial, cuando el propietario de los vegetales o productos vegetales afectados haya incumplido la normativa vigente y, especialmente, lo determinado en el Real Decreto 2071/1993, de 26 de noviembre, relativo a las medidas de protección contra la introducción y difusión en el territorio nacional y de la Comunidad Económica Europea de organismos nocivos para los vegetales o productos vegetales; así como para la exportación y tránsito hacia países terceros.
3. En el caso de que el afectado por la contaminación de un lote suministrado por un productor, almacenista u operador que hubiera incumplido lo determinado en la legislación vigente, percibiera indemnización por parte de cualquiera de estos sujetos, y por parte de la Administración, reembolsará a la Administración la indemnización percibida.
4. El Ministerio de Agricultura, Pesca y Alimentación, dentro de los límites establecidos por los créditos disponibles para estos fines, participará, con cargo a sus presupuestos, en la cuantía del 50 por 100 de los gastos ocasionados en la ejecución del programa.
En tanto no se pronuncie la Comisión Europea y para garantizar unos niveles de seguridad comparables entre las diferentes Comunidades Autónomas, se podrán adoptar, previo informe favorable del Comité Fitosanitario Nacional:
Los métodos apropiados para los exámenes y análisis previstos en las letras b) y c) del párrafo primero del apartado 2 del artículo 3 y cualquier precisión de los procedimientos previstos en el párrafo segundo del apartado 2 del mismo.
Las medidas complementarias previstas en la letra c) del apartado 2 del artículo 5.
Las normas de desarrollo de la letra a) del apartado 2 del artículo 8 y las disposiciones aplicables a las muestras representativas a las que se refiere la letra b) del mismo apartado y artículo.
El Ministerio de Agricultura, Pesca y Alimentación solicitará su adopción a la Comisión Europea a través del cauce establecido en el artículo 16 bis de la Directiva 77/93/CEE, del Consejo, de 21 de diciembre de 1976, relativa a las medidas de protección contra la introducción en la Comunidad de organismos nocivos para los vegetales o productos vegetales y contra su propagación en el interior de la Comunidad.
Sin perjuicio de las notificaciones estipuladas en los apartados 3 de los artículos 3 y 5, en el apartado 2 del artículo 6 y en el artículo 11 los órganos competentes de las Comunidades Autónomas, comunicarán al Ministerio de Agricultura, Pesca y Alimentación:
a) Los resultados de las investigaciones a que se refiere el apartado 3 del artículo 6 del presente Real Decreto.
b) Los datos del registro de explotaciones, almacenes colectivos y centros de expedición afectados en cada Comunidad Autónoma.
c) Las medidas fitosanitarias realizadas por las Comunidades Autónomas a que se refiere el artículo 7 de este Real Decreto.
d) Los análisis establecidos en el artículo 8 de este Real Decreto, realizados por los órganos competentes de las Comunidades Autónomas.
El Real Decreto 2071/1993, de 26 de noviembre, relativo a las medidas de protección contra la introducción en el territorio nacional y de la Comunidad Económica Europea de organismos nocivos para los vegetales o productos vegetales y el Real Decreto 1190/1998, de 12 de junio, por el que se regulan los programas nacionales de erradicación o control de organismos nocivos de los vegetales aún no establecidos en el territorio nacional serán aplicables sin perjuicio de las normas específicas del presente Real Decreto.
Lo dispuesto en el presente Real Decreto tendrá carácter de normativa básica, al amparo de lo establecido en el artículo 149.1.13.a de la Constitución, que reserva al Estado la competencia en materia de bases y coordinación de la planificación general de la actividad económica.
Se faculta al Ministro de Agricultura, Pesca y Alimentación para dictar, en el ámbito de sus competencias, las disposiciones necesarias para el desarrollo y aplicación del presente Real Decreto y, en particular, previo informe del Comité Fitosanitario Nacional, las normas provisionales de desarrollo de las letras a) y b) del apartado 2 del artículo 8 y, a la vista de la evolución de los conocimientos científicos o técnicos, las modificaciones que sea preciso introducir en los anexos del presente Real Decreto, en tanto la Comisión Europea no resuelva al respecto.
El presente Real Decreto entrará en vigor el día siguiente al de su publicación en el «Boletín Oficial del Estado».
Dado en Madrid a 22 de octubre de 1999.
JUAN CARLOS R.
El Ministro de Agricultura, Pesca y Alimentación,
JESÚS POSADA MORENO
SECCIÓN I
Lista de plantas huésped de Ralstonia solanacearum (Smith) Yabuuchi et al.a las que se refiere el artículo 1
Plantas (incluidos los tubérculos), salvo las semillas verdaderas, de Solanum tuberosum L.: Patata.
Plantas, salvo las semillas y los frutos, de Lycopersicum lycopersicum (L.) Karsten ex Farw.: Tomate.
SECCIÓN II
Exámenes
1. Los exámenes oficiales contemplados en la letra a) del apartado 2 del artículo 3 se basarán en la biología del organismo, así como en los sistemas de producción concretos que se utilicen en la Comunidad Autónoma de que se trate, e incluirán lo siguiente:
i) en el caso de las patatas:
en los momentos oportunos, una inspección visual del cultivo en crecimiento, y/o muestras de patatas de siembra y de otras patatas durante la fase de crecimiento o almacenadas; estas muestras se someterán a una inspección visual oficial o bajo supervisión oficial, para lo cual se procederá a seccionar los tubérculos, y
en el caso de las patatas de siembra y, si procede, de otras patatas, análisis de laboratorio oficiales o bajo supervisión oficial en los que se utilice el método establecido en el anexo II del presente Real Decreto;
ii) en el caso de los tomates:
en los momentos oportunos, una inspección visual de, al menos, el cultivo en crecimiento de plantas destinadas a la replantación para utilización profesional.
2. La notificación de los exámenes oficiales dispuesta en el apartado 3 del artículo 3 incluirá los datos siguientes:
i) en el caso de los exámenes de patatas:
la superficie total estimada, en hectáreas, de los cultivos de patatas de siembra y de otras patatas,
la clasificación por categorías (de siembra y de consumo) y, en su caso, por regiones,
la cantidad de muestras tomadas para los análisis y el momento de su recogida,
el número de inspecciones visuales efectuadas en el campo,
el número de inspecciones visuales realizadas en tubérculos (y la cantidad de muestras);
ii) en el caso de los exámenes de, al menos, el cultivo en crecimiento de plantas de tomate destinadas a la replantación para utilización profesional:
la cantidad total estimada de plantas,
el número de inspecciones visuales;
iii) en el caso de los exámenes de plantas huésped del organismo distintas de la patata y el tomate, incluidas las solanáceas silvestres huésped:
la especie,
la cantidad de muestras tomadas y el momento de su recogida,
la zona o río objeto del muestreo, según proceda, el método de análisis;
iv) en el caso de los exámenes de aguas y de los vertidos de residuos líquidos procedentes de las instalaciones industriales de transformación o de embalaje:
la cantidad de muestras tomadas y el momento de su recogida,
la zona, río o ubicación de la instalación objeto del
muestreo, según corresponda, el método de análisis.
El presente método describe los diversos procedimientos involucrados en:
i) el diagnóstico de la podredumbre parda en tubérculos de patata y de la marchitez bacteriana en plantas de patata y de tomate;
ii) la detección de Ralstonia solanacearumen muestras de tubérculos de patata;
iii) la identificación de Ralstonia solanacearum.
En los apéndices se facilitan detalles para la preparación de los materiales para las pruebas, entre otros, medios nutritivos, tampones, soluciones y reactivos.
SECCIÓN I
Aplicación del método
1. Diagnóstico de la podredumbre parda en los tubérculos de patata y de la marchitez bacteriana en las plantas de patata y de tomate:
El procedimiento de análisis se refiere a los tubérculos de patata que presentan síntomas típicos de la podredumbre parda y a las plantas de patata y de tomate que presentan síntomas típicos o que permiten la sospecha de marchitez bacteriana e incluye una prueba de selección rápida, el aislamiento del patógeno del tejido vascular infectado en un medio de cultivo apropiado y, en caso de resultado positivo, la identificación del cultivo como Ralstonia solanacearum.
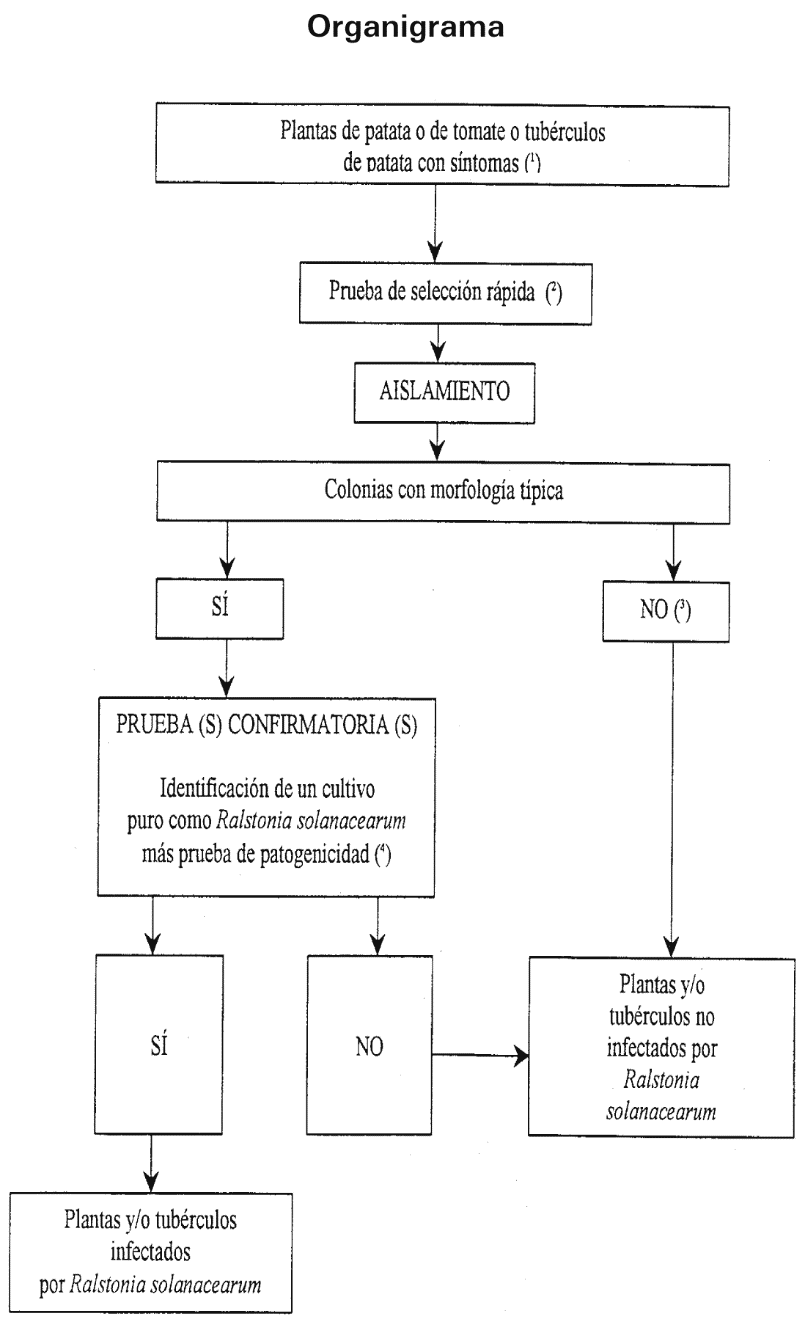
Notas:
(1) La descripción de los síntomas se presenta en el punto 1 de la sección II.
(2) Las pruebas de selección rápida facilitan un diagnóstico presuntivo.
Son pruebas adecuadas:
la prueba de la exudación del tejido vascular del tallo (punto 2 de la sección II),
la prueba de detección de gránulos de poli-ß-hidroxibutirato (punto 2 de la sección II),
la prueba IF (punto 2 de la sección III),
la prueba ELISA (punto 3 de la sección III),
la prueba PCR (punto 4 de la sección III).
(3) Aunque el aislamiento del patógeno de material vegetal con síntomas típicos es sencillo mediante siembra de diluciones, el cultivo puede fallar en estados avanzados de infección. Las bacterias saprofitas que crecen en el tejido enfermo pueden enmascarar o inhibir el patógeno en el medio de aislamiento. Si el aislamiento es negativo, pero los síntomas de la enfermedad son los típicos, deberá repetirse el aislamiento, preferentemente valiéndose de una siembra en medio selectivo.
(4) La identificación fiable de un cultivo puro de Ralstonia solanacearumse consigue utilizando al menos una de las pruebas que se enumeran en el punto 4.1 de la sección II, en combinación con una prueba de patogenicidad (punto 4.3 de la sección II). La caracterización de la cepa es facultativa, aunque se recomienda cada vez que se presente un caso nuevo.
2. Detección e identificación de Ralstonia solanacearumen muestras de tubérculos de patata:
El procedimiento se destina a la detección de infecciones latentes en tubérculos de patata mediante una o, preferiblemente, varias pruebas de selección que, de ser positivas, se complementan con el aislamiento del patógeno; en caso de aislamiento de colonias típicas, se procede a continuación a la identificación de un cultivo puro como Ralstonia solanacearum.
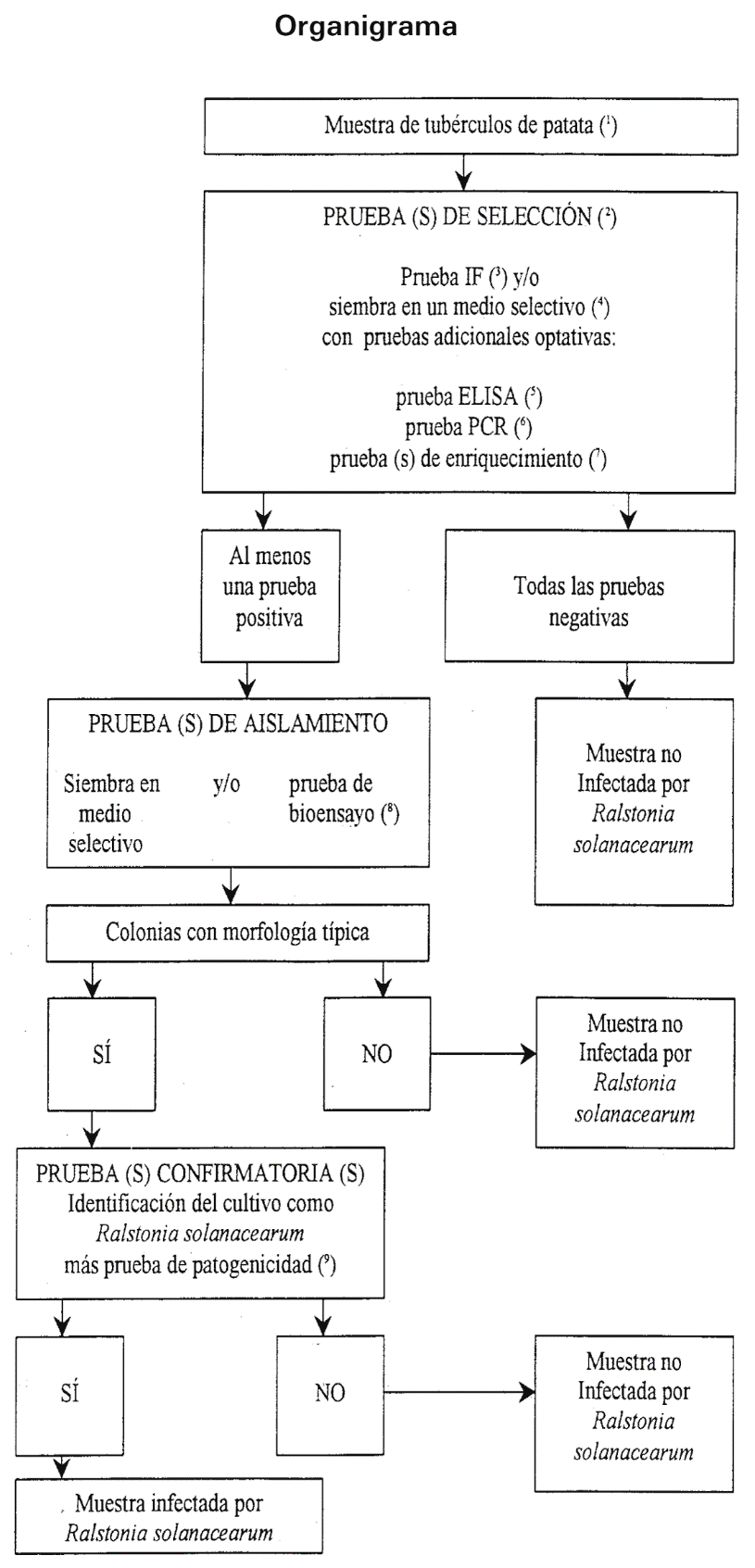
Notas:
(1) Tamaño de la muestra: El tamaño normal de la muestra es de 200 tubérculos. Sin embargo, el procedimiento puede adaptarse convenientemente para muestras con menos de 200 tubérculos.
(2) Pruebas de selección: Es posible que una única prueba no sea lo suficientemente sensible o fiable para detectar Ralstonia solanacearum en una muestra. Por ello se recomienda realizar más de una prueba y que se basen en principios biológicos diferentes.
(3) Prueba de inmunofluorescencia (IF): La prueba IF es una prueba de selección plenamente reconocida, lo que supone una ventaja frente a otras pruebas que aún no han sido puestas a punto o convalidadas completamente. La prueba se usa para otras muchas bacterias, por ejemplo Clavibacter michiganensis ssp. sepedonicus. Los parámetros de lectura que se especifican en este método hacen que resulte una prueba sensible (con límites de detección de 103-104 células por ml de precipitado resuspendido). Se prefiere el método indirecto. El método directo puede aplicarse si la prueba tiene un grado de sensibilidad y especificidad equivalente al del método indirecto.
El factor crítico en que se basa la fiabilidad de los resultados es la calidad del antisuero. Sólo es aceptable un antisuero con un título elevado (2000, como mínimo, para el antisuero crudo) y todas las pruebas deben realizarse a la dilución del título del antisuero o con una dilución por debajo de éste.
La prueba IF presenta la ventaja de la interpretación subjetiva de la morfología de la tinción celular y de la intensidad de la fluorescencia, que facilitan información sobre la especificidad de la reacción. Son frecuentes las reacciones cruzadas producidas por bacterias serológicamente afines, procedentes del suelo o asociadas a tejidos de la patata, con morfología celular de Ralstonia solanacearum. Aunque la prueba IF puede utilizarse como única prueba de selección, cuando se sospeche que se han producido reacciones cruzadas convendrá efectuar una prueba de selección alternativa basada en principios biológicos diferentes. En tales casos la siembra en medio selectivo es la prueba más adecuada.
(4) Pruebas de siembra en medio selectivo: El medio SMSA modificado y el procedimiento que se especifican en este método hacen que ésta sea una prueba sensible y selectiva para la detección de Ralstonia solanacearum, cuyos resultados pueden conocerse de tres a seis días después de la siembra. El agente patógeno se obtiene directamente en cultivo y puede identificarse fácilmente. Para poder aprovechar plenamente el potencial de la prueba, es necesario preparar con cuidado las cuñas para evitar otras bacterias asociadas al tubérculo de la patata que compiten con Ralstonia solanacearum en el medio y pueden afectar el desarrollo del agente patógeno. Algunas cepas pueden crecer insuficientemente, ya que los componentes del medio pueden afectar al organismo buscado. Asimismo, debe tenerse cuidado para diferenciar Ralstonia solanacearum de otras bacterias que pueden desarrollarse en el medio. Aunque la siembra en medio selectivo puede utilizarse como única prueba de selección, cuando se obtengan resultados negativos y se sospeche que se ha producido una inhibición del crecimiento de Ralstonia solanacearum, debido a la presencia de otras bacterias en el medio, será conveniente realizar una segunda prueba de selección. En tal caso, la prueba IF será la más apropiada.
(5) Prueba ELISA: En general, la prueba ELISA es menos sensible que la prueba IF (límites de detección: 104-105 células por ml de precipitado de extracto de patata). Se trata de una prueba barata y rápida, que, no obstante, en lo que a resultados se refiere, está en general más expuesta a dar resultados falsos positivos (reacciones cruzadas) y falsos negativos (inhibición causada por moléculas fenólicas presentes en el extracto de patata). El antisuero debe poseer una especificidad muy elevada. La prueba ELISA no puede utilizarse como única prueba de selección.
(6) Prueba PCR: Esta prueba posee el potencial necesario para una gran sensibilidad de detección, pero puede ser inhibida fácilmente por componentes del extracto de planta o tubérculo, con el consiguiente resultado falso negativo. Algunos cultivares de patata contienen más inhibidores que otros, que es necesario eliminar. La inhibición puede reducirse mediante dilución, si bien con ello se diluyen también las poblaciones de Ralstonia solanacearum. Debe tenerse mucho cuidado en todas las fases de preparación de las muestras y de la prueba para evitar contaminaciones que darían lugar a resultados positivos falsos. También pueden darse resultados falsos positivos debido a secuencias homólogas de otros organismos. De ahí que la prueba PCR directa no pueda utilizarse como única prueba de selección.
(7) Prueba de enriquecimiento: La incubación de muestras de extracto de patata en un caldo semiselectivo, como el caldo SMSA modificado, permite la multiplicación de Ralstonia solanacearum y, lo que es más importante quizás, también diluye los inhibidores potenciales de las pruebas ELISA o PCR. De este modo, Ralstonia solanacearum puede detectarse mediante las pruebas IF, ELISA y PCR en un caldo de enriquecimiento. No recomendamos la realización de cultivos directos a partir de caldos enriquecidos, ya que estos métodos de enriquecimiento no se han ensayado y probado a fondo. Si se incluyen aquí es porque poseen un potencial considerable. No obstante, debido a la relativa falta de experiencia que se tiene de ellos, no pueden utilizarse como métodos de detección únicos.
(8) Prueba de bioensayo: La prueba de bioensayo se usa para el aislamiento de Ralstonia solanacearum a partir de extracto de patatas mediante enriquecimiento selectivo de la bacteria en una planta huésped, y puede realizarse en plantas de tomate o en berenjenas. Exige que las condiciones de incubación sean óptimas, según se especifican en este método. Es muy probable que las bacterias inhibidoras de Ralstonia solanacearum en medio SMSA no interfieran en esta prueba.
(9) Pruebas confirmatorias: La identificación fiable de un cultivo puro de Ralstonia solanacearumse efectúa mediante alguna de las pruebas que se enumeran en el punto 4.1 de la sección II, en combinación con una prueba de patogenicidad (punto 4.3 de la sección II). Aunque la caracterización de la cepa es optativa, se recomienda en cada caso nuevo.
SECCIÓN II
Diagnóstico de la podredumbre parda en los tubérculos de patata y de la marchitez bacteriana en las plantas de patata y de tomate
1. Síntomas:
1.1 Síntomas en la patata:
En la planta. La fase inicial de la infección se caracteriza por un marchitamiento de las hojas en progresión ascendente hacia el extremo superior de la planta, bajo el efecto de las temperaturas diurnas altas, con una recuperación durante la noche. El marchitamiento se hace rápidamente irreversible y ocasiona la muerte de la planta. El tejido vascular de los tallos de las plantas marchitadas cortados transversalmente puede volverse pardo, y en la superficie del corte suele observarse un exudado mucoso blanquecino o éste puede extraerse apretando el tallo. Si se coloca verticalmente un tallo cortado en agua, de los haces vasculares salen hilos viscosos de dicho exudado.
En el tubérculo. Los tubérculos de patata deben cortarse transversalmente cerca de la parte basal (estolón). En la fase inicial de la infección se produce una decoloración entre amarillo vítreo y pardo claro de la línea vascular, de la cual suele fluir espontáneamente un exudado mucoso crema pálido al cabo de varios minutos o cuando se hace una ligera presión con los pulgares en la piel próxima a la superficie del corte. Posteriormente, la decoloración vascular adquiere un tono pardo más marcado y la necrosis puede extenderse al tejido parenquimático. En las fases avanzadas, la infección progresa desde la parte basal y los ojos, pudiendo dar lugar a que se produzcan en la piel lesiones ligeramente hundidas de color pardo rojizo por las que fluyen bacterias, lo que hace que se adhieran partículas del suelo.
1.2 Síntomas en el tomate:
En la planta. El primer síntoma visible es el aspecto fláccido de las hojas más jóvenes. En condiciones medioambientales favorables para el patógeno (temperatura del suelo de unos 25 oC, humedad saturada) se produce epinastia y marchitamiento de una parte o de la totalidad de la planta en pocos días, que desemboca en el colapso total de la misma. En condiciones menos favorables (temperatura del suelo por debajo de 21 oC) pueden surgir numerosas raíces adventicias del tallo. En ocasiones se observa un cordón grasiento a lo largo del tallo que demuestra la existencia de necrosis en el sistema vascular. Al cortar transversalmente el tallo, los tejidos vasculares del mismo, que presentan una decoloración parda, exudan gotas de líquido bacteriano blanco o amarillento.
2. Pruebas de selección rápida: Las pruebas de selección rápida facilitan un diagnóstico presuntivo. Realícese una o más de las siguientes pruebas:
Prueba de la exudación del tallo: La presencia de Ralstonia solanacearumen tallos de patata o de tomate marchitos puede evaluarse utilizando la sencilla prueba que se indica a continuación.
Cortar el tallo justo por encima del nivel del suelo. Colocar la superficie del corte en un vaso de precipitados que contenga agua. Poco después, de los haces vasculares saldrán espontáneamente hilos de exudado bacteriano. Este fenómeno no se producirá con ninguna otra bacteria que cause infecciones vasculares en las plantas de patata o de tomate.
Prueba de la detección de gránulos de poli-ß-hidroxibutirato (PHB): Los gránulos de PHB de las células de Ralstonia solanacearum se visualizan tiñendo con azul Nilo A o negro Sudán B.
Preparar un frotis del exudado o del tejido sospechoso en un portaobjetos, o un frotis de un cultivo de 48 horas en YPGA o SPA (apéndice 1). Preparar frotis de control positivo de una cepa de biovar 2 y raza 3 y, si se considera útil, un frotis de un control negativo. Dejar secar. Pasar con rapidez varias veces por la llama la cara inferior del portaobjetos hasta que el frotis quede fijado.
Prueba del azul Nilo:
1. Bañar el frotis fijado con solución acuosa al 1 por 100 de azul Nilo A. Incubar durante 10 minutos a 55 oC.
2. Escurrir la solución de tinción. Lavar suavemente al grifo durante unos instantes. Eliminar el agua sobrante con un pañuelo de papel.
3. Bañar el frotis con ácido acético acuoso al 8 por 100. Incubar durante 1 minuto a temperatura ambiente. 4. Lavar suavemente al grifo durante unos instantes. Secar con un pañuelo de papel.
5. Humedecer de nuevo con una gota de agua.
Tapar con un cubreobjetos.
6. Examinar el frotis tintado con un microscopio equipado con epifluorescencia a 450 nm con aceite de inmersión, a 1.000 aumentos.
Observar si se produce la fluorescencia naranja brillante de los gránulos de PHB. Observar también con la luz normal para cerciorarse de que los gránulos son intracelulares y de que la morfología celular es la típica de Ralstonia solanacearum.
Prueba del negro Sudán:
1. Bañar el frotis fijado con una solución de negro Sudán B al 0,3 por 100 en etanol del 70 por 100. Dejar en incubación durante 10 minutos a temperatura ambiente.
2. Escurrir la solución de tinción. Lavar suavemente con agua del grifo durante unos instantes. Eliminar el agua sobrante con un pañuelo de papel.
3. Sumergir brevemente el frotis en xilol. Secar con un pañuelo de papel. Precaución al usar el xilol que es un producto nocivo. Trabajar en campana de humos.
4. Bañar el frotis con safranina acuosa al 0,5 por 100 (p/v) y dejar durante 10 minutos a temperatura ambiente. Precaución al usar la safranina que es un producto nocivo. Trabajar en campana de humos.
5. Lavar suavemente al grifo durante unos instantes. Secar con un pañuelo de papel. Tapar con un cubreobjetos.
6. Examinar la tinción con un microscopio óptico con luz transmitida con aceite de inmersión, a 1.000 aumentos.
Los gránulos de PHB de las células de Ralstonia solanacearum se tiñen de negro azulado, mientras que las paredes de las células lo hacen de rosa.
Otras pruebas: Otras pruebas adecuadas para una selección rápida son la prueba IF (punto 2 de la sección III), la prueba ELISA (punto 3 de la sección III) y la prueba PCR (punto 4 de la sección III).
3. Proceso de aislamiento:
3.1 Coger exudado o pequeñas secciones de tejido decolorado del anillo vascular del tubérculo o de los haces vasculares del tallo de la planta de patata o de tomate. Poner en suspensión en un volumen reducido de agua destilada estéril o en tampón fosfato 50mM. Dejar reposar de 5 a 10 minutos.
3.2 Preparar series de diluciones decimales de la suspensión, por ejemplo 1/10 y 1/100, o más si se considera necesario.
3.3 Añadir un volumen normalizado de la suspensión y de las diluciones a un medio nutritivo general (NA, YPGA y SPA; apéndice 1) y/o a un medio de tetrazolio de Kelman (apéndice 1) y/o a un medio selectivo SMSA (apéndice 7). Extender o hacer estrías con una técnica adecuada de dilución en placas. Si se considera útil, preparar un conjunto de placas distintas con un cultivo de una suspensión celular diluida de una cepa virulenta de Ralstonia solanacearum de biovar 2 y raza 3 que se utilizará como control positivo.
3.4 Dejar en incubación las placas tres días a 28oC. La incubación puede prolongarse hasta seis días si el crecimiento es lento, pero las colonias en SMSA con frecuencia se vuelven atípicas y mueren.
En un medio nutritivo general, los aislados virulentos de Ralstonia solanacearum desarrollan colonias de color blanco nacarado, planas, irregulares y fluidas, que con frecuencia presentan los verticilos característicos.
En el medio de tetrazolio de Kelman, las colonias típicas de aislados virulentos de Ralstonia solanacearum son de color crema, planas, irregulares, con anillos de color rojo sangre en el centro. Las colonias avirulentas de Ralstonia solanacearum son butirosas y de color rojo fuerte.
En el medio SMSA, las colonias típicas de los aislados virulentos de Ralstonia solanacearum son de color blanco lechoso, planas, irregulares y fluidas, y presentan centros de un marcado color rojo sangre.
Las formas avirulentas de Ralstonia solanacearum desarrollan colonias menos fluidas, cuyo color oscila entre completamente rosa y rojo en el medio SMSA.
3.5 Purificar las colonias de morfología característica mediante subcultivo en un medio nutritivo general. Evitar los subcultivos continuos que pueden dar lugar a una pérdida de virulencia.
4. Pruebas de confirmación:
4.1 Identificación de Ralstonia solanacearum: Identificar los cultivos puros de Ralstonia solanacearum mediante uno, como mínimo, de los siguientes procedimientos.
Nota: Incluir los controles adecuados en cada prueba.
Pruebas nutricionales y enzimáticas: Las siguientes propiedades fenotípicas de Ralstonia solanacearum están universalmente presentes o ausentes:
| Pigmento fluorescente | - |
| Inclusiones de PHB | + |
| Prueba O/F | O+/F- |
| Catalasa | + |
| Oxidasa de Kovacs | + |
| Reducción de nitratos | + |
| Utilización de citrato | + |
| Crecimiento a 40 oC | - |
| Crecimiento en NaCl al 1 por 100 | + |
| Crecimiento en NaCl al 2 por 100 | - |
| Dihidrolasa de arginina | - |
| Licuación de gelatina | - |
| Hidrólisis del almidón | - |
| Hidrólisis de la esculina | - |
| Producción de levano | - |
Los medios y métodos se encuentran en Lelliott y Stead (1987).
Prueba IF: Preparar una suspensión de 106 células por ml del cultivo y de las cepas de control positivo. Preparar una serie de diluciones a 1/2 del antisuero. Aplicar el procedimiento de IF (punto 2 de la sección III). El título IF del cultivo debe ser equivalente al del control positivo.
Prueba ELISA: Preparar una suspensión de más de 106 células por ml del cultivo y de las cepas de control positivo. Aplicar el procedimiento ELISA (punto 3 de la sección III). El valor ELISA del cultivo debe ser equivalente al del control positivo.
Prueba PCR: Preparar una suspensión de 106 células por ml del cultivo y de las cepas de control positivo. Aplicar el procedimiento PCR (punto 4 de la sección III). El producto de PCR del cultivo debe tener el mismo tamaño y posteriormente las mismas bandas en el análisis con la enzima de restricción (REA), que el control positivo.
Hibridación fluorescente in situ (Fluorescent in situ hybridisation o FISH): Preparar una suspensión de 106 células por ml del cultivo y de las cepas de control positivo. Aplicar el procedimiento FISH (Van Beuningen et al., 1995) con el iniciador OLI-1 PCR (Seal et al., 1993). El cultivo debe mostrar la misma reacción que el control positivo.
Perfiles de proteínas: Las proteínas de células enteras desnaturalizadas se separan mediante electroforesis en gel de poliacrilamida (PAGE) según Stead (1992a).
Perfiles de ácidos grasos (Fatty acid profilingo FAP): Mantener el cultivo y la cepa de control positivo en agar de tripticasa de soja durante 48 horas a 28 oC y aplicar el procedimiento FAP (Janse, 1991; Stead, 1992a; Stead 1992b). El perfil del cultivo debe ser idéntico al del control positivo. En las condiciones especificadas, los ácidos grasos característicos son 14:0 3OH, 16:0 2OH, 16:1 2OH y 18:1 2OH.
4.2 Caracterización de las cepas: La caracterización de las cepas es optativa, pero se recomienda en cada caso nuevo, utilizando, al menos, unas de las pruebas siguientes:
Determinación de los biovares: Ralstonia solanacearum se divide en biovares en función de la capacidad de producir ácido de tres hexosas alcohólicas y tres azúcares (Hayward, 1964 y 1994).
| Biovar | |||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| Utilización de: | |||||
| Maltosa | - | + | + | - | + |
| Lactosa | - | + | + | - | + |
| Celobiosa | - | + | + | - | + |
| Mannitol | - | - | + | + | + |
| Sorbitol | - | - | + | + | - |
| Dulcitol | - | - | + | + | - |
El biovar 2 se diferencia en subfenotipos mediante pruebas adicionales (Hayward, 1994):
| Biovar 2 | Biovar 2-A | Biovar 2-T | |
|---|---|---|---|
| Utilización de trehalosa. | - | + | + |
| Utilización de inositol.. | + | - | + |
| Utilización de D-ribosa. | - | - | + |
| Actividad pectolítica... | baja | baja | alta |
Determinación de las razas: La raza (Buddenhagen et al., 1962) puede determinarse con una prueba de patogenicidad en plantas de tomate o en berenjenas y en plantas de tabaco, y mediante una reacción de hipersensibilidad (HR) en hojas de tabaco (Lozano y Sequeira, 1970):
| Raza (*) | |||
|---|---|---|---|
| 1 | 2 | 3 | |
| Reacción en: | |||
| Plantas de tomate/berenjenas. | Marchitamiento | Sin reacción | Marchitamiento |
| Plantas de tabaco. | Marchitamiento | Sin reacción | Sin reacción |
| Hojas de tabaco. | Necrosis (48 h) marchitamiento (7-8 días) | HR (12-24 h) | Clorosis (2-8 días) |
(*) La raza 4 (patógena en el jengibre y en algún otro huésped) y la raza 5 (patógena sólo en la morera) no están incluidas.
La caracterización de la raza a través de pruebas de patogenicidad o hipersensibilidad en hojas de tabaco puede no ser muy fiable, pero podrá ser deducida a partir del biovar y del huésped original.
El cultivo puede caracterizarse aún más mediante lo siguiente:
Obtención de la huella dactilar genómica.
La diferenciación molecular de las cepas en el complejo de Ralstonia solanacearum puede realizarse del modo siguiente:
Análisis RFLP (Cook et al.,1989).
PCR de secuencia repetitiva [REP-, ERIC- & BOX-PCR (Louws et al.,Smith et al.,1995)].
4.3 Prueba de patogenicidad: Esta prueba se destina a confirmar el diagnóstico de Ralstonia solanacearum y comprobar la virulencia de los cultivos identificados como Ralstonia solanacearum.
Preparar un inóculo de 106 células por ml de cultivo y una cepa de control positivo. Inocular de 5 a 10 plantas de tomate o berenjenas, preferentemente en la fase de la tercera hoja verdadera o posterior (punto 6 de la sección III). Dejar en incubación hasta dos semanas entre 22 y 28 oC con alta humedad relativa y riego diario. Observar si se produce marchitamiento y/o epinastia, clorosis o enanismo.
Aislar la bacteria de las plantas sintomáticas de la forma siguiente:
separar secciones del tallo 2 cm por encina del punto de inoculación,
dilacerar y suspender en un pequeño volumen de agua estéril o en tampón fosfato 50mM. Sembrar, dejar en incubación y buscar colonias con morfología típica de Ralstonia solanacearum.
SECCIÓN III
Detección e identificación de Ralstonia solanacearum en muestras de tubérculos de patata
Nota: El tamaño normal de la muestra es de 200 tubérculos. Sin embargo, el procedimiento puede adaptarse convenientemente para muestras con menos de 200 tubérculos.
1. Preparación de la muestra para el análisis:
Observación: El extracto de patata obtenido con este procedimiento puede emplearse también para la detección de Clavibacter michiganensis ssp. sepedonicus.
Opciones previas al análisis, en caso de considerarlas útiles:
i) incubar la muestra a 25-30 oC durante un período de hasta dos semanas para favorecer la multiplicación de las poblaciones latentes de Ralstonia solanacearum; ii) lavar los tubérculos con agua corriente utilizando desinfectantes y detergentes apropiados. Secar al aire los tubérculos.
1.1 Quitar la epidermis de la parte basal (ombligo) del tubérculo con un bisturí o un cuchillo limpio y desinfectado, de modo que los tejidos vasculares queden a la vista. Extraer con cuidado una pequeña cuña cónica (de 3 a 5 mm de diámetro) de tejido vascular de la parte basal de cada tubérculo. Extraer el mínimo volumen posible de tejido no vascular. Procesar cada uno de los tubérculos de la muestra.
Observación: El examen visual de los tubérculos (punto 1 de la sección II) puede efectuarse en esta fase. Retirar los tubérculos que presenten síntomas o estén muy podridos y analizarlos individualmente (sección II).
1.2 Colocar las cuñas en un recipiente cerrado. Es conveniente procesarlas inmediatamente. De no ser posible, pueden almacenarse durante un período de 24 horas como máximo o, si se mantienen a 4 oC, que no supere las 72 horas.
1.3 Procesar las cuñas por uno de los métodos siguientes:
i) Colocar las cuñas en un recipiente adecuado.
Añadir solución tampón de maceración (apéndice 2) en cantidad suficiente para que las cubra.
Desmenuzarlas en una trituradora Waring Blender o Ultra Thurrax hasta lograr una homogeneización completa pero no excesiva.
Dejar el macerado en remojo de 15 a 30 minutos.
ii) Colocar las cuñas en un recipiente adecuado.
Añadir solución tampón de maceración en cantidad suficiente para que las cubra.
Colocar el recipiente en un agitador rotatorio.
Incubar a 50-100 rpm durante 4 horas a 20-22 oC o durante 16-24 horas a 4 oC. iii) Colocar las cuñas dentro de una bolsa de maceración desechable que sea resistente (por ejemplo, una bolsa Stomacher, de 105 x 150 mm, estéril por radiación).
Machacar con cuidado las cuñas valiéndose de un instrumento adecuado, como, por ejemplo, un martillo, hasta lograr una homogeneización completa.
Añadir solución tampón de maceración en cantidad suficiente para que cubra las cuñas.
Dejar reposar el macerado durante 15-30 minutos.
1.4 Extraer las bacterias de las cuñas procesadas mediante uno de los procedimientos siguientes:
i) Decantar suavemente el macerado en un tubo de centrifugar y dejar los residuos en el recipiente o la bolsa. Si el decantado presenta un aspecto turbio, centrifugar a 180 g, como máximo, durante 10 minutos, a una temperatura inferior a 10 oC.
Centrifugar el decantado o el sobrenadante obtenido en la primera centrifugación, a 7.000 g durante 15 minutos o a 10.000 g durante 10 minutos a una temperatura inferior a 10 oC.
Eliminar el sobrenadante sin perturbar el precipitado.
ii) Filtrar el macerado mediante un sistema de filtración cuyos poros tengan un tamaño de 40-100 mm. Acelerar la filtración utilizando una bomba de vacío.
Recoger el filtrado en un tubo de centrifugar.
Lavar el filtro con un tampón de maceración.
Centrifugar el filtrado a 7.000 g durante 15 minutos o a 10.000 g durante 10 minutos a una temperatura inferior a 10 oC.
Descartar el sobrenadante sin perturbar el precipitado.
1.5 Resuspender el precipitado en 1 ml de tampón de precipitado (apéndice 2).
Dividir en dos partes iguales y poner cada parte en un microvial.
Utilizar un solo microvial para la prueba. Conservar el extracto sobrante a 4 oC durante el análisis.
Añadir glicerol estéril al 10-25 por 100 (v/v) al otro microvial. Homogeneizar por agitación. Guardar a -18 oC (semanas) o a -70 oC (meses).
2. Prueba de inmunofluorescencia (IF): Utilizar un antisuero para Ralstonia solanacearum, de preferencia para raza 3 y biovar 2. Determinar el título en una suspensión de 106 células por ml de la cepa homóloga de Ralstonia solanacearum con una dilución apropiada del conjugado de isotiocianato de fluoresceína (FITC), según las recomendaciones del fabricante. El antisuero crudo debería presentar un título IF de al menos 1:2.000.
Utilizar portaobjetos de pocillos múltiples, de preferencia con 10 pocillos de 6 mm de diámetro como mínimo.
Incluir en cada portaobjetos un control de conjugado FITC. Deberá repetirse la prueba con el control PBS incluido, si se observa alguna célula positiva en el control FITC.
Preparar en otro portaobjetos controles positivos con una suspensión de 106 células por ml de una cepa de raza/biovar adecuados de Ralstonia solanacearum. Incluir un portaobjetos en cada serie de pruebas.
2.1 Preparar los portaobjetos según uno de los procedimientos siguientes:
i) Para precipitados con una cantidad relativamente pequeña de almidón:
Echar con una pipeta un volumen determinado (15 µl es suficiente para pocillos de 6 mm de diámetro; aumentar el volumen si el diámetro es mayor) del precipitado resuspendido en una fila de pocillos. La otra fila puede utilizarse como duplicado o para una segunda muestra, tal como se indica en la figura 1.
ii) Para otros precipitados:
Preparar diluciones decimales, por ejemplo 1/10, 1/100 y 1/1.000, del precipitado resuspendido en tampón de precipitado. Echar con una pipeta un volumen normalizado medido (15 µl es suficiente para pocillos de 6 mm de diámetro; aumentar el volumen si el diámetro es mayor) del precipitado resuspendido y de cada dilución en una fila de pocillos. La otra fila puede utilizarse como duplicado o para una segunda muestra, tal como se indica en la figura 2.
2.2 Dejar secar las gotitas. Fijar las células bacterianas al portaobjetos calentándolo, flameándolo o mediante etanol del 95 por 100.
2.3 Procedimiento IF:
i) Si el portaobjetos se ha preparado según el inciso i) de punto 2.1: Preparar un conjunto de diluciones a 1/2 del antisuero en el tampón IF (apéndice 3): 1/4 del título (T/4), 1/2 del título (T/2), el título (T) y dos veces el título (2T).
ii) Si el portaobjetos se ha preparado según el inciso ii) del punto 2.1: Preparar la dilución de trabajo (DT) del antisuero en el tampón IF. La dilución de trabajo es la dilución del antisuero con especificidad óptima, y normalmente es a la mitad del título.
FIGURA 1
Preparación del portaobjetos según el inciso i) de los puntos 2.1 y 2.3
DILUCIÓN NORMALIZADA DEL PRECIPITADO RESUSPENDIDO
(T=título)
| FITC | T/4 | T/2 | T | 2T | ☐ Diluciones a 1/2 de antisuero | |
| Muestra 1 | J1 | J2 | J3 | J4 | J5 | |
| Duplicado de la muestra 1 o muestra 2 | J6 | J7 | J8 | J9 | J10 |
FIGURA 2
Preparación del portaobjetos según el inciso ii) de los puntos 2.1 y 2.3
FITC DILUCIÓN NORMALIZADA DE ANTISUERO
| Nada | Nada | 1/10 | 1/100 | 1/1.000 | ☐ Dilución decimal precipitado suspendido | |
| Muestra 1 | J1 | J2 | J3 | J4 | J5 | |
| Duplicado de la muestra 1 o muestra 2 | J6 | J7 | J8 | J9 | J10 |
2.3.1 Colocar los portaobjetos en un pañuelo de papel humedecido.
Añadir a los pocillos correspondientes la dilución o diluciones de antisuero. Aplicar PBS en los pocillos FITC. El volumen del antisuero aplicado en los pocillos debe ser equivalente al volumen de extracto aplicado.
2.3.2 Tapar y dejar incubar durante 30 minutos a temperatura ambiente.
2.3.3 Sacudir las gotitas de antisuero del portaobjetos y enjuagar cuidadosamente los portaobjetos con tampón IF. Lavar durante 5 minutos con tampón IF-Tween. Repetir la operación con tampón IF (apéndice 3). Eliminar cuidadosamente el exceso de humedad.
2.3.4 Colocar los portaobjetos en un pañuelo de papel humedecido.
Cubrir los pocillos en cuestión y el pocillo FITC con la dilución del conjugado FITC utilizado para determinar el título. El volumen de conjugado aplicado en los pocillos debe ser idéntico al volumen de antisuero aplicado.
2.3.5 Tapar y dejar en incubación durante 30 minutos a temperatura ambiente.
2.3.6 Sacudir las gotitas de conjugado del portaobjetos. Enjuagar y lavar como antes (2.3.3). Eliminar cuidadosamente el exceso de humedad.
2.3.7 Echar con una pipeta de 5 a 10 µl de tampón fosfato glicerol de 0,1 M (apéndice 3) o un volumen similar en cada pocillo y colocar un cubreobjetos.
2.4 Lectura de la prueba IF:
Examinar los portaobjetos en un microscopio epifluorescente con filtros adecuados para que se produzca la excitación del FITC, con aceite de inmersión y a 500-1.000 aumentos. Recorrer los pocillos a lo largo de dos diámetros perpendiculares entre sí y alrededor del perímetro.
En primer lugar, comprobar el control positivo. Las células deben ser fluorescentes brillantes y estar completamente teñidas.
Nota: La prueba debe repetirse si la tinción no es buena en el control positivo.
Leer los portaobjetos. Observar primero la ausencia de células fluorescentes en los pocillos FITC. Si existieran, indicaría una unión no específica del conjugado, autofluorescencia o contaminación.
Nota: En este caso, repetir la prueba.
Comprobar si hay células fluorescentes brillantes con morfología característica de Ralstoniasolanacearum en los pocillos problema. La intensidad de la fluorescencia debe ser equivalente a la de la cepa de control positivo a la misma dilución del antisuero. Deberán descartarse las células que presenten una tinción incompleta o cuya fluorescencia sea escasa, a menos que haya muchas células de este tipo (véase la interpretación de los resultados de la prueba IF).
Interpretación de los resultados de la prueba IF:
i) La prueba será negativa si en la muestra no se encuentran células fluorescentes brillantes con morfología característica.
ii) Si se encuentran células fluorescentes brillantes con morfología característica, determinar el número medio de células por campo microscópico y calcular el número de células (N) por ml de precipitado resuspendido (apéndice 4).
Se considera que el límite de detección para la prueba IF está alrededor de 103 células por ml de precipitado resuspendido:
en las muestras con NT103 células por ml, la prueba IF se considera positiva,
en las muestras con N≤103 células por ml, la prueba IF puede considerarse positiva.
iii) Si hay un gran número de células (T105 células por ml) incompletamente teñidas o con fluorescencia débil en el título, deberá realizarse una segunda prueba:
bien una prueba basada en un principio biológico distinto,
bien repetir la prueba IF, ya sea con un segundo antisuero o con una dilución decimal del precipitado.
3. Prueba de inmunoabsorción enzimática (Enzyme Linked Immuno Sorbent Assay o ELISA) (basada en Robinson-Smith et al.,1995).
Utilizar antisuero para Ralstonia solanacearum, preferiblemente de la raza 3 y biovar 2. Determinar el título en una suspensión de 106 células por ml de la cepa homóloga de Ralstonia solanacearum
Se recomienda utilizar placas de microtitulación NUNC Polysorp.
Incluir un control negativo de extracto de patata y un control de tampón fosfato salino (PBS).
Utilizar una suspensión de más de 106 células por ml de una cepa de Ralstonia solanacearum biovar 2, raza 3, como control positivo. Procesarlo de la misma manera que la muestra o muestras, pero bien separado de éstas en la placa de microtitulación.
3.1 Echar con una pipeta de 100 a 200 µl del precipitado resuspendido en un microvial.
Calentar durante 4 minutos a 100 oC. Colocar el microvial en hielo.
3.2 Añadir un volumen igual de tampón de tapizado de carbonato de doble concentración (apéndice 5). Homogeneizar por agitación.
3.3 Añadir alícuotas de 100 µl a cada uno de dos pocillos, como mínimo, de la placa de microtitulación.
Dejar en incubación durante una hora a 37 oC o durante una noche a 4 oC.
3.4 Quitar los extractos de los pocillos. Lavar éstos tres veces con PBS-Tween (apéndice 5), dejando en ellos la última solución de lavado durante al menos 5 minutos.
3.5 Preparar la dilución adecuada de antisuero de Ralstoniasolanacearum en tampón de bloqueo (apéndice 5). Echar 100 µl de dilución de antisuero en los pocillos.
Dejar en incubación durante una hora a 37 oC.
3.6 Quitar el antisuero de los pocillos. Lavar éstos como en el punto 3.4.
3.7 Preparar la dilución adecuada de conjugado de fosfatasa alcalina en tampón de bloqueo. Echar 100 µl de dilución de conjugado en los pocillos.
Dejar en incubación durante una hora a 37 oC.
3.8 Quitar el conjugado de los pocillos. Lavar éstos como en los puntos 3.4 y 3.6.
3.9 Preparar la solución de sustrato de fosfatasa alcalina (apéndice 5). Echar 100 µl en los pocillos. Dejar en incubación de 30 minutos a una hora en la oscuridad a temperatura ambiente.
3.10 Leer la absorbancia a 405 nm.
Interpretación de la prueba ELISA: La prueba ELISA será negativa si la densidad óptica (DO) de la muestra es R 2 x DO del control negativo.
La prueba ELISA será positiva si la DO de la muestra es T 2 x DO del control negativo.
4. ;Prueba de polimerización en cadena (Polymerase Chain Reaction o PCR) (Basado en Seal et al., 1993).
Observación: Deberán utilizarse puntas de pipeta ajustadas con filtro en todas las fases de preparación de la muestra y siempre que haya que manejar PCR.
Preparar una suspensión de 106 células por ml de una cepa de Ralstonia solanacearum de raza 3 y biovar 2 como control positivo. Actuar del mismo modo que con la muestra o muestras.
4.1 Echar con una pipeta 100 µl del precipitado resuspendido en un microvial.
Otra alternativa es echar 90 µl del precipitado resuspendido en un microvial que contenga 10 µl de NaOH 0,5 M. Mezclar invirtiendo el vial repetidamente.
4.2 Calentar durante 4 minutos a 100 oC. Colocar el microvial en hielo inmediatamente.
4.3 Preparar, por lo menos, dos diluciones decimales, por ejemplo 1/10 y 1/100, o más si se considera útil, en agua destilada estéril o ultrapura (UPW).
4.4 Preparar la mezcla de reacción PCR (apéndice 6) en un vial estéril añadiendo los componentes siguientes en el orden en que se citan:
Volumen de reacción de 50 µl
| Componente |
Cantidad — µl |
Concentración final |
|---|---|---|
| Agua destilada estéril o ultra pura. | 30,8-33,8 | |
| 10 x tampón PCR | 5,0 | 1 x |
| d-ATP | 1,0 | 0,2 mM |
| d-CTP | 1,0 | 0,2mM |
| d-GTP | 1,0 | 0,2 mM |
| d-TTP | 1,0 | 0,2 mM |
| Iniciador OLI-1 (20 µM) | 2,5 | 1 mM |
| Iniciador Y-2 (20 µM) | 2,5 | 1 mM |
| Polimerasa Taq (5 U/µl) | 0,2 | 1,0 U |
| Volumen total | 45-48 |
Para más reacciones:
Calcular la cantidad de cada componente para el número de reacciones necesario.
Mezclar los componentes y poner 45-48 µl de la mezcla en viales PCR estériles.
Colocar los viales con la mezcla de la reacción PCR en hielo.
Para volúmenes de reacción de 25 µl.
Reducir los componentes proporcionalmente.
4.5 Amplificación de la PCR.
4.5.1 Optativo: centrifugar con impulsos los viales que contienen la muestra hervida y el control positivo.
Añadir, en el orden indicado, 2-5 µl de la muestra o muestras, el control de agua y el control positivo a los viales que contienen la mezcla de la reacción PCR. Colocar los viales en el calentador del termociclador de ADN.
4.5.2 Aplicar el siguiente programa: Un ciclo de:
i) Dos minutos a 96 oC: desnaturalización de la cadena molde;
50 ciclos de:
ii) Veinte segundos a 94 oC: desnaturalización,
iii) Veinte segundos a 68 oC: hibridación de iniciador,
iv) Treinta segundos a 72 oC: extensión de la copia;
Un ciclo de:
v) Diez minutos a 72 oC: nueva extensión;
Un ciclo de:
vi) Mantenimiento de la temperatura a 4 oC.
Observación: Estos parámetros son para un aparato Perkin Elmer 9600. Para otros termocicladores tal vez se precise una capa de aceite mineral en los viales de la reacción PCR y/o modificar la duración de las fases ii), iii) y iv) de amplificación.
4.5.3 Retirar los viales del termociclador. Analizar el producto de la PCR. Si esta operación no se realiza inmediatamente, almacenar los viales a 4 oC si se van a utilizar el mismo día o a ‒18 oC, si el período de espera va a ser mayor.
4.6 Análisis del producto de la PCR:
Los fragmentos de la PCR se detectan mediante electroforesis en gel de agarosa y tinción con bromuro de etidio.
4.6.1 Preparar un gel de agarosa apropiado llevando suavemente la agarosa a ebullición en un tampón de tris-acetato para electroforesis (TAE).
4.6.2 Enfriar la agarosa fundida a 50-60 oC, verterla en el molde de la unidad de electroforesis e insertar el peine. Dejar solidificar el gel.
4.6.3 Retirar el peine. Sumergir el gel en TAE de modo que quede cubierto (2-3 mm) con el tampón.
4.6.4 Poner gotitas de 3 µl de tampón de carga en parafilm. Añadir 12 µl del producto de la PCR procedentes de las muestras, del control positivo o del control de agua, y mezclar aspirando suavemente en la punta de la pipeta antes de la carga. Los volúmenes dados pueden modificarse para que se ajusten a la capacidad de los pocillos en el gel de agarosa.
4.6.5 Cargar con cuidado los pocillos del gel. Incluir un marcador ADN apropiado al menos en un pocillo, para que sirva de referencia.
4.6.6 Conectar los cables al generador de electricidad y al equipo de electroforesis. Dejar correr el gel a 5-8 V/cm hasta que la parte delantera del indicador de seguimiento se halle a 1 cm del final del gel.
4.6.7 Cortar el suministro de electricidad. Desconectar los cables de la unidad de electroforesis.
Retirar el gel con cuidado. Sumergirlo en una solución de bromuro de etidio durante un período comprendido entre treinta y cuarenta y cinco minutos.
Observación: Deben llevarse guantes desechables cada vez que se manipule bromuro de etidio, ya que es un mutágeno muy fuerte.
4.6.8 Desteñir en agua destilada durante 10-15 minutos.
4.6.9 Visualizar el fragmento o los fragmentos de ADN amplificados mediante transiluminación UV. El producto de la PCR de Ralstonia solanacearum con el conjunto de iniciadores OLI-1 e Y-2 tiene una longitud de 288 bp. Cotejar con el marcador de ADN y con el control positivo.
Observación: El control de agua debe ser negativo en cualquier caso. De lo contrario, repetir la prueba.
4.6.10 Hacer una fotografía del gel, en caso de necesitarse una prueba permanente.
4.6.11 Confirmar la autenticidad del fragmento amplificado mediante un análisis de la enzima de restricción (REA).
4.7 Análisis de la enzima de restricción (REA):
4.7.1 Echar 8,5 µl del producto de la PCR (4.5.3) en un microvial nuevo. Añadir 1 µl de tampón de enzima 10 × y 0,5 µl de enzima de restricción AvaII.
4.7.2 Mezclar aspirando suavemente en la punta de la pipeta. Si quedan gotas en las paredes del vial, dar un pulso en una microcentrífuga. Dejar incubar durante una hora a 37 oC.
4.7.3 Analizar el fragmento de la PCR digerido mediante electroforesis en gel de agarosa, tal como se indica en el punto 4.6.
Interpretación de los resultados de la prueba PCR:
La prueba PCR es negativa si no se detecta el fragmento 288 bp característico y si se detecta para la cepa de control positivo de Ralstonia solanacearum.
La prueba PCR es positiva si se detecta el fragmento 288 bp y el análisis REA del fragmento amplificado es idéntico al de la cepa de control positivo de Ralstonia solanacearum.
5. Pruebas de siembra en medio selectivo (basadas en Elphinstone et al., 1996):
5.1 Realizar la prueba mediante una técnica de dilución en placas apropiada, como, por ejemplo:
i) Preparar, al menos, dos diluciones decimales, por ejemplo 1/10 y 1/100, o más, si se considera necesario, del sedimento resuspendido en tampón de precipitado. Echar con una pipeta un volumen normalizado medido (50-100 µl) del sedimento resuspendido y de cada dilución en el medio selectivo SMSA modificado (apéndice 7) y extender con una varilla de vidrio por toda la superficie del medio.
Si se considera útil, realizar también una estría de dilución con un asa cargada con 10 µl del sedimento resuspendido. Flamear el asa entre cada siembra.
ii) Poner un volumen estándar medido (50-100 µl) del sedimento resuspendido en el medio selectivo SMSA modificado y extender con una varilla de vidrio por toda la superficie del medio. Pasar la varilla sin flamearla al menos por otras dos placas de SMSA modificado.
5.2 Añadir, mediante la misma técnica de dilución en placas, una suspensión de 106 células por ml de una cepa de Ralstonia solanacearum de raza 3 y biovar 2 como control positivo a un conjunto diferente de placas de SMSA modificado.
5.3 Dejar incubar las placas a 28 oC. Iniciar su lectura al cabo de tres días. Si el resultado es negativo, esperar hasta seis días como máximo. Los aislados virulentos de Ralstonia solanacearum desarrollan colonias de color blanco lechoso, planas, irregulares y fluidas, con unos centros de color rojo sangre y que pueden presentar rayas o espirales internas.
5.4 Purificar las colonias de morfología característica mediante subcultivo en un medio nutritivo general (apéndice 1).
5.5 Identificar los cultivos puros (punto 4.1 de la sección II) y confirmar los cultivos de Ralstonia solanacearum mediante una prueba de patogenicidad (punto 4.3 de la sección II).
Interpretación de los resultados de la siembra en medio selectivo:
La siembra en medio selectivo es negativa si no se aíslan colonias bacterianas al cabo de seis días ni se aíslan colonias típicas de Ralstonia solanacearum, siempre que no haya sospechas de inhibición producida por colonias de otras bacterias y que en los controles positivos se encuentren colonias típicas de Ralstonia solanacearum.
La siembra en medio selectivo es positiva si se aíslan colonias típicas de Ralstonia solanacearum.
6. Pruebas de bioensayo (basadas en Janse, 1988):
6.1 Utilizar en cada muestra 10 plántulas de tomate o de berenjena de variedades que sean sensibles a Ralstonia solanacearum, en la fase de la tercera hoja verdadera. Las plantas no deben regarse durante las 24 horas previas a la inoculación.
6.2 Distribuir entre las plantas 100 µl de sedimento resuspendido, inoculándolo en el tallo, entre los cotiledones, y en uno o varios puntos más.
6.3 Utilizando esta misma técnica, inocular 10 plántulas con una suspensión de 106 células por ml de una cepa virulenta de Ralstonia solanacearum de raza 3 y biovar 2 como control positivo y con tampón de precipitado como control negativo. Separar físicamente las plantas inoculadas con el control positivo de las otras para evitar contaminaciones.
6.4 Dejar que las plantas sigan creciendo hasta cuatro semanas a 22-28 oC con alta humedad relativa y riego diario. Comprobar si se aprecian síntomas de marchitamiento, epinastia, clorosis y/o crecimiento reducido.
6.5 Aislar de las plantas infectadas (sección II). Identificar los cultivos puros de morfología característica (punto 4.1 de la sección II) y confirmar los cultivos de Ralstonia solanacearum mediante una prueba de patogenicidad (punto 4.3 de la sección II).
6.6 Si se considera útil, comprobar si se ha producido infección en los lotes que no presenten síntomas. Separar del tallo de cada planta una sección de 1 cm que esté 2 cm por encima del punto de inoculación. Homogeneizar los tejidos en tampón de maceración. Llevar a cabo la siembra por dilución en placas (punto 5.1 de la sección III). De obtenerse un resultado positivo, identificar los cultivos puros de morfología característica (punto 4.1 de la sección II) y confirmar la presencia de cultivos de Ralstonia solanacearum mediante una prueba de patogenicidad (punto 4.3 de la sección II).
Interpretación de los resultados de la prueba del bioensayo:
La prueba del bioensayo es negativa si las plantas no están infectadas por Ralstonia solanacearum, siempre que se detecte Ralstonia solanacearumen los controles positivos.
La prueba del bioensayo es positiva si las plantas están infectadas por Ralstonia solanacearum.
7. Pruebas de enriquecimiento (basadas en Elphinstone et al., 1996):
7.1 Echar 100 µl de sedimento resuspendido en 3 ml de caldo SMSA modificado (apéndice 7).
7.2 Dejar incubar a 28 oC durante 48 horas y, en cualquier caso, durante un máximo de 72 horas, manteniendo el tapón del tubo sin apretar para que haya aireación.
7.3 Ajustar el tapón y mezclar. Hacer partes alícuotas para la prueba IF (punto 2 de la presente sección), la prueba ELISA (punto 3 de la presente sección) y/o la prueba PCR (punto 4 de la presente sección).
8. Pruebas de patogenicidad:
Véase el punto 4.3 de la sección II.
APÉNDICE 1
Medios nutritivos para el aislamiento y el cultivo de Ralstonia solanacearum
Agar nutritivo (NA):
Agar nutriente (Difco): 23 g.
Agua destilada: 1 l.
Preparar volúmenes de 0,5 litros del medio en matraces de 1 l.
Disolver los ingredientes.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
Enfriar hasta 50 oC. Distribuir en placas.
Agar levadura peptona glucosa (YPGA):
Extracto de levadura (Difco): 5 g.
Bacto peptona (Difco): 5 g.
D (+) glucosa (monohidrato): 10 g.
Bacto agar (Difco): 15 g.
Agua destilada: 1 l.
Preparar volúmenes de 0,5 l del medio en matraces de 1 l.
Disolver los ingredientes.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
Enfriar hasta 50 oC. Distribuir en placas.
Agar de sacarosa y peptona (SPA):
Sacarosa: 20 g. Peptona: 5 g.
K2HPO4: 0,5 g.
MgSO4 · 7H2O: 0,25 g.
Bacto agar (Difco): 15 g.
Agua destilada: 1 l.
Preparar volúmenes de 0,5 l del medio en matraces de 1 l.
Disolver los ingredientes. Si es necesario, ajustar el pH a 7,2-7,4.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
Enfriar hasta 50 oC. Distribuir en placas.
Medio de tetrazolio de Kelman:
Casamino ácidos (Difco): 1 g.
Bacto peptona (Difco): 10 g.
Dextrosa: 5 g.
Bacto agar (Difco): 15 g.
Agua destilada: 1 l.
Preparar volúmenes de 0,5 litros del medio en matraces de 1 l.
Disolver los ingredientes.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
Enfriar hasta 50 oC.
Añadir una solución acuosa de cloruro de trifenil tetrazolio (Sigma), esterilizada por filtración, para conseguir una concentración final de 50 mg/l. Distribuir en placas.
APÉNDICE 2
Materiales para la preparación de muestras
Tampón de maceración: tampón fosfato 50 mM, pH 7,0:
Este tampón se utiliza para macerar tejidos.
Na2HPO4: 4,26 g. KH2PO4: 2,72 g.
Agua destilada: 1 l.
Disolver los ingredientes y comprobar el pH. Preparar las alícuotas necesarias.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
Para la realización de la prueba PCR directa, se recomienda añadir polivinilpirrolidona-40.000 MWT (PVP-40) al 5 por 100, para reducir la incidencia de la inhibición de amplificación por moléculas aromáticas presentes en el extracto.
En el caso de utilizarse los procedimientos de homogeneización con Waring Blender o con Ultra Turrax para la maceración de los tejidos de patata, se recomienda la utilización de un defloculante, un agente antiespumante o un antioxidante.
Copos de lubrol: 0,5 g/l.
Antiespumante DC silicona: 1,0 ml/l.
Tetrasodiopirofosfato: 1,0 g/l.
Esterilizar separadamente en un autoclave. Añadir hasta obtener la concentración deseada.
Tampón del precipitado: tampón fosfato 10 mM, pH 7,2:
Este tampón se utiliza para la resuspensión y dilución de los precipitados y de las cuñas de patata.
Na2HPO4 · 12H2O: 2,7 g. NaH2PO4 · 2H2O: 0,4 g.
Agua destilada: 1 l.
Disolver los ingredientes y comprobar el pH. Preparar las alícuotas necesarias.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
APÉNDICE 3
Materiales para la prueba IF
Tampón IF: tampón fosfato salino (PBS) 10 mM, pH 7,2:
Este tampón se utiliza para la dilución de antisueros.
Na2HPO4 · 12H2O: 2,7 g.
NaH2PO4 · 2H2O: 0,4 g.
NaCl: 8,0 g.
Agua destilada: 1 l.
Disolver los ingredientes y comprobar el pH. Preparar las alícuotas necesarias.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
Tampón IF-Tween:
Este tampón se utiliza para lavar los portaobjetos. Añadir 0,1 por 100 de Tween 20 al tampón IF.
Tampón fosfato glicerol 0,1 M, pH 7,6:
Este tampón se utiliza como fluido de montaje en los pocillos de los portaobjetos de IF para aumentar la fluorescencia.
Na2HPO4 · 12H2O: 3,2 g. NaH2PO4 · 2H2O: 0,15 g.
Glicerol: 50 ml.
Agua destilada: 100 ml.
APÉNDICE 4
Determinación del nivel de contaminación en la prueba IF
Superficie (S) del pocillo del portaobjetos múltiple
| en que D = diámetro del pocillo. | [1] |
Superficie (s) del campo del objetivo
| en que d = diámetro del campo. | [2] |
Calcular d bien por medición directa, bien con las fórmulas siguientes:
|
|
[3] |
en que
i = coefeciente de campo (depende del tipo del ocular y varía de 8 a 24),
K = coeficiente del tubo (1 ó 1,25),
G = aumento (100x, 40x, etc.) del objetivo.
De [2]:
|
|
[4] |
De [3]:
Contar el número de células fluorescentes típicas por campo (c).
Calcular el número de células fluorescentes típicas por pocillo (C):
Calcular el número de células fluorescentes típicas por ml de precipitado (N):
En que = volumen de precipitado en el pocillo,
F= factor de dilución del precipitado.
APÉNDICE 5
Materiales para la prueba ELISA
Tampón carbonato doble para tapizado, pH 9,6:
Na2CO3: 6,36 g.
NaHCO3: 11,72 g.
Agua destilada: 1 l.
Disolver los ingredientes y comprobar el pH. Preparar las alícuotas necesarias.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
Si el extracto contiene una alta proporción de moléculas aromáticas, puede añadirse como antioxidante sulfito de sodio con una concentración final de 0,2 por 100.
Tampón fosfato salino (PBS) 10 x, pH 7,4:
NaCl: 80 g.
KH2PO4: 2 g.
Na2HPO4 · 12H2O: 29 g.
KCl: 2 g.
Agua destilada: 1 l.
Disolver los ingredientes y comprobar el pH. Preparar las alícuotas necesarias.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
Tampón fosfato salino-Tween (PBS-T):
PBS 10 x: 100 ml.
Solución al 10 por 100 de Tween 20: 5 ml.
Agua destilada: 895 ml.
Tampón de bloqueo (anticuerpos) (debe prepararse en el momento de su utilización):
PBS 10 x: 10 ml.
Polivinilpirrolidona-44000 MWT (PVP-44): 2,0 g.
Solución al 10 por 100 de Tween 20: 0,5 g.
Leche en polvo: 0,5 g.
Agua destilada: Hasta completar 100 ml.
Solución de sustrato fosfatasa alcalina, pH 9,8:
Dietanolamina: 97 ml.
Agua destilada: 800 ml.
Mezclar y ajustar el pH a 9,8 con HCl concentrado.
Completar hasta 1 l con agua destilada.
Añadir 0,2 g de MgCl2.
Disolver dos pastillas de 5 mg de sustrato fosfatasa (Sigma) por cada 15 ml de solución.
APÉNDICE 6
Materiales para la prueba PCR
Secuencia del oligonucleótido iniciador:
Iniciador OLI-1: 5’-GGGGGTAGCTTGCTACCTGCC-3’ Iniciador Y-2: 5’CCCACTGCTGCCTCCCGTAGGAGT-3’ Para los materiales véase Seal et al.,1993.
APÉNDICE 7
Materiales para las pruebas de siembra en medio selectivo y de enriquecimiento
Medio selectivo SMSA (Engelbrecht, 1994, modificado por Elphinstone et al.,1996):
Medio base
Casamino ácidos (Difco): 1 g.
Bacto peptona (Difco): 10 g.
Glicerol: 5 ml.
Agar (Difco): 15 g.
Agua destilada: 1 l.
Preparar volúmenes de 0,5 ls del medio en matraces de 1 l.
Disolver los ingredientes y comprobar el pH. Si es necesario, ajustar el pH a 6,5 antes de esterilizar. Ralstoniasolanacearumno se desarrolla bien con un pH › 7,0.
Esterilizar en un autoclave a 121 oC durante 15 minutos.
Enfriar hasta 50 oC.
Añadir los siguientes ingredientes (todos de Sigma) para obtener las concentraciones finales especificadas:
Violeta cristal: 5 mg/l.
Polimixina B sulfato: 100 mg/l (aproximadamente 600.000 unidades) Sigma P-1004.
Bacitracina (*): 25 mg/l (aproximadamente 1.250 unidades) Sigma B-0125.
Cloranfenicol: 5 mg/l Sigma C-3175.
Penicilina G: 0,5 mg/l (aproximadamente 825 unidades9 Sigma P-3032.
Sales de tetrazolio: 50 mg/l.
Disolver los ingredientes en etanol del 70 por 100 para obtener las concentraciones indicadas para el volumen de diluyente preparado. Algunos ingredientes, como, por ejemplo, la polimixina B y el cloranfenicol, exigen un ligero calentamiento y agitación.
Caldo SMSA (Elphinstone et al.,1996).
Preparar de forma idéntica al medio selectivo SMSA, pero suprimir el agar y las sales de tetrazolio. Distribuir en alícuotas de 3 ml, en tubos desechables Universal de 30 ml.
—————————
(*) Si se considera necesario, el aumento de la concentración de bacitracina hasta 300 ppm puede reducir la contaminación por bacterias saprofitas sin reducir la recuperación de Ralstonia solanacearum.
REFERENCIAS
Buddenhagen, I. W., Sequeira, L., y Kelman, A., 1962: «Description of races in Pseudomonas solanacearum», Phytopathology, número 52, página 726.
Cook, D., Elizabeth, B., y Sequeira, L., 1989: «Genetic diversity of Pseudomonas solanacearum: Detection of restriction fragment length polymorphism with DNA probes that specify virulence and hypersensitive respons», Molecular Plant-Microbe Interactions, número 2, páginas 113-121.
Dinesen, I. G., y DeBoer, S. H., 1995: «Extraction of Clavibacter michiganensis subsp. sepedonicus from composite samples of potato tubers», American Potato Journal, número 72, páginas 133-142.
Elphinstone, J. G., Hennessy, J., Wilson, J., y Stead, D. E., 1996: «Sensitivity of different methods for the detection of Pseudomonas solanacearum (Smith) Smith in potato tuber extracts», EPPO Bulletin, número 26.
Engelbrecht, M. C., 1994: «Modification of a semi-selective medium for the isolation and quantification of Pseudomonas solanacearum», ACIAR Bacterial Wilt Newsletter, número 10, páginas 3-5.
Hayward A. C., 1964: «Characteristics of Pseudomonas solanacearum», Journal of Applied Bacteriology, número 27, páginas 265-277.
Hayward A. C., 1994: «Systematic and phylogeny of Pseudomonas solanacearum and related bacteria», Bacterial Wilt: The disease and its causative agent, Pseudomonas solanacearum, A. C. Hayward y G. L. Hartman, eds., Cab International Oxford, páginas 127-135.
Janse, J. D., 1988: «A detection method for Pseudomonas solanacearum in symptomless potato tubers and some data on its sensitivity and specificity», EPPO Bulletin, número 18, páginas 343-351.
Janse, J. D., 1991: «Infra- and intraspecific classification of Pseudomona ssolanacearum strains using whole cell fatty acid analysis», Systematic and Applied Microbiology, número 14, páginas 335-345.
Kelman, A., 1954: «The relationship of pathogenicity in Pseudomonas solanacearum to colony appearance on a tetrazolium medium», Phytopathology, número 64, páginas 293-695.
Lelliot, R. A., y Stead, D. E., 1987: Methods for the diagnosis of bacterial diseases of plants, T.F. Preece ed., Blackwell Scientific Publications, Oxford, 216 páginas.
Louws, F. J., Fulbright, D. W., Stephens, C. T., y de Brujin, F. J., 1995: «Differentiation of genomic structure by rep-PCR fingerprinting to rapidly classify Xanthomonas campestris pv. vesicatoria», Phytopathology, número 85, páginas 528-536.
Lozano, J. C., y Sequeira, L., 1970: «Differentiation of races of Pseudomonas solanacearum by a leaf infiltration technique», Phytopathology, número 60, página 838.
Mirza, M. S., Rademaker, J. W. L., Janse, J. D., y Akkermans, A. D. L., 1993: «Specific 16S ribosomal RNA targeted oligonucleotide probe against Clavibacter michiganensis subsp. sepedonicus»,Canadian Journal of Microbiology, número 39, páginas 1029-1034.
Robinson-Smith, A., Jones, P., Elphinstone, J. G., y Forde, S.M.D., 1995: «Production of antibodies to Pseudomonas solanacearum, the causative agent of bacterial wilt», Food and Agricultural Immunology, número 7, páginas 67-79.
Seal, S. E., Jackson, L. A., Young, J. P. W., y Daniels, M.J., 1993: «Differentiation of Pseudomonas solanacearum, P. syzygii, P. picketti and the blood disease bacterium by partial 16S rRNA sequencing: construction of oligonucleotide primers for sensitive detection by polymerase chain reaction», Journal of General Microbiology, número 139, páginas 1587-1594.
Smith, J. J., Offord, L. C., Holderness, M., y Saddler, G. S., 1995: «Genetic diversity of Burkholderia solanacearum (synonym Pseudomonas solanacearum) race 3 in Kenya», Applied and Environmental Microbiology, número 61, páginas 4262-4268.
Stead, D. E., 1992a: «Techniques for detecting and identifying plant pathogenic bacteria», Techniques for rapid detection of plant pathogens, J. M. Duncan y L. Torrance, eds., Blackwell Scientific Publications, Oxford, páginas 76-111.
Stead, D. E., 1992b: «Grouping of plant pathogenic and some other Pseudomonas spp. using cellular fatty acid profiles», International Journal of Systematic Bacteriology, número 42, páginas 281-295.
Van Beuningen, A., Derks, H., y Janse J. D., 1995: «Detection and identification of Clavibacter michiganensis subsp. sepedonicus with special attention to fluorescent in-situ hybridisation (FISH) using a 16S rRNA targeted oligonucleotide probe», Züchtungsforschung, número 2, páginas 266-269.
1. En todos los casos en que se sospeche la presencia del organismo y, habiéndose obtenido un resultado positivo en pruebas de detección realizadas con arreglo al método correspondiente establecido en el anexo II del presente Real Decreto para el material vegetal indicado o a cualquier otro método oficialmente aprobado, para todos los demás casos, se espere a la conclusión de dicho método para confirmar o disipar la sospecha, deberán retenerse y conservarse convenientemente hasta ese momento:
— siempre que sea posible, el lote, o la parte del mismo (del que se haya tomado la muestra) en su embalaje original con etiqueta,
— siempre que sea posible, la parte restante de las muestras,
— cualquier extracto que sobre y cualquier material adicional que se haya preparado para la prueba o pruebas de detección (por ejemplo, las placas de inmunofluorescencia),
— toda la documentación pertinente.
2. En los casos en que finalmente se confirme la presencia del organismo, deberán retenerse y conservarse convenientemente durante al menos el mes siguiente al procedimiento de notificación dispuesto en el apartado 2 del artículo 6:
— el material mencionado en el punto 1, y
— una muestra del material de tomate o berenjena infectado que se haya inoculado con el extracto de tubérculo o planta en su caso, y
— el cultivo aislado del organismo.
Los elementos de la investigación que dispone el inciso i) de la letra a) del apartado 1 del artículo 6 serán, cuando proceda, los siguientes:
i) los lugares de producción:
— en los que se estén cultivando o se hayan cultivado patatas que estén relacionadas clónicamente con aquellas en las que se haya comprobado la infección por el organismo,
— en los que se estén cultivando o se hayan cultivado tomates que procedan de las mismas fuentes que aquellos en los que se haya comprobado la infección por el organismo,
— en los que se estén cultivando o se hayan cultivado patatas o tomates que se hayan puesto bajo control oficial por sospecharse la presencia del organismo,
— en los que se estén cultivando o se hayan cultivado patatas que estén relacionadas clónicamente con las que hayan sido cultivadas en lugares de producción de los que se sospeche la infección por el organismo,
— en los que se cultiven patatas o tomates y que estén localizados en las proximidades de los lugares de producción infectados, incluidos aquellos en los que se compartan equipos e instalaciones de producción directamente o por intervención de un contratista común,
— en los que se utilicen para las labores de riego o aspersión aguas de superficie de cualquier fuente en la que se haya confirmado o de la que se sospeche la infección por el organismo,
— en los que se utilicen para las labores de riego o aspersión aguas de superficie de una fuente explotada en común con lugares de producción en los que se haya confirmado o de los que se sospeche la infección por el organismo,
— que estén o hayan sido inundados con aguas de superficie en las que se haya confirmado o de las que se sospeche la infección por el organismo; y
ii) las aguas de superficie que se utilicen para el riego o aspersión, o para la inundación, de un campo o campos o de un lugar o lugares de producción en los que se haya confirmado la infección por el organismo.
1. Al determinar, con arreglo al inciso iii) de la letra a) y al inciso iii) de la letra c) del apartado 1 del artículo 6, el alcance de la contaminación probable, se incluirán los elementos siguientes, cuando proceda:
— el material vegetal indicado obtenido en un lugar de producción que haya sido declarado contaminado en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6,
— el lugar o lugares de producción que tengan una relación de producción con el material vegetal indicado que haya sido declarado contaminado en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6, incluidos aquellos lugares que compartan equipos e instalaciones de producción directamente o por intervención de un contratista común,
— el material vegetal indicado que se haya producido en el lugar o lugares de producción contemplados en el guión anterior o que estuviera presente en tales lugares durante el tiempo en que el material vegetal indicado declarado contaminado en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6, se hallará presente en los lugares de producción mencionados en el primer guión,
— los almacenes que hayan manipulado el material vegetal indicado procedente de los lugares de producción a los que se refieren los guiones anteriores,
— cualquier maquinaria, vehículo, nave, almacén o unidades de éstos y cualesquiera otros objetos, incluido el material de embalaje, que puedan haber estado en contacto con el material vegetal indicado declarado contaminado en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6,
— cualquier material vegetal indicado que haya sido almacenado o haya estado en contacto con cualquiera de las estructuras y los objetos mencionados en el guión anterior antes de la limpieza y desinfección de éstos,
— como resultado de la investigación y de los análisis contemplados en el inciso i) de la letra a) del apartado 1 del artículo 6: en el caso de las patatas, aquellos tubérculos o plantas que tengan una relación clonal fraterna o parental con el material vegetal indicado declarado contaminado en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6, y que, según los resultados de la investigación, tengan probabilidades de estar contaminados; y, en el caso de los tomates, aquellas plantas que procedan de las mismas fuentes que dicho material y con respecto a las cuales, aunque las pruebas de detección del organismo hayan sido negativos, parezca probable la contaminación a través de un vínculo clonal,
— el lugar o lugares de producción del material vegetal indicado a que se refiere el guión anterior,
— el lugar o lugares de producción del material vegetal indicado en los que se utilicen para las labores de riego o rociamiento de aguas que hayan sido declaradas contaminadas en virtud del inciso ii) de la letra c) del apartado 1 del artículo 6,
— el material vegetal indicado producido en campos anegados con aguas de superficie en las que se haya confirmado la infección por el organismo.
2. Para la determinación de la posible propagación a la que se refieren el inciso iv) de la letra a) y el inciso iii) de la letra c) del apartado 1 del artículo 6, deberán tenerse en cuenta los elementos siguientes:
i) en los casos contemplados en el inciso iv) de la letra a) del apartado 1 del artículo 6:
— la proximidad de otros lugares de producción en los que se cultive el material vegetal indicado,
— la producción y utilización comunes de existencias de patatas de siembra,
— los lugares de producción en los que se utilicen aguas de superficie para el riego o aspersión del material vegetal indicado cuando exista o haya existido el riesgo de escorrentía, o de inundación, de aguas superficiales procedentes de un lugar o lugares de producción que hayan sido declarados contaminados en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6;
ii) en los casos en que se hayan declarado contaminadas aguas de superficie en virtud del inciso ii) de la letra c) del apartado 1 del artículo 6:
— el lugar o lugares productores del material vegetal indicado contiguos a las aguas superficiales declaradas contaminadas, o que corran el riesgo de ser inundados con estas aguas,
— cualquier fuente de riego separada que se comunique de alguna forma con las aguas superficiales declaradas contaminadas.
3. La notificación a la que se refiere el párrafo primero del apartado 2 del artículo 6 incluirá los datos siguientes:
— la fecha en la que se haya tenido noticia de la presunta presencia del organismo en virtud del artículo 5 y las fechas de la toma de muestras y de la confirmación de la presencia de dicho organismo con arreglo al artículo 6, según los casos,
— una descripción de los elementos de la declaración de contaminación y de la delimitación de zonas.
4. La notificación a la que se refiere el párrafo primero del apartado 2 del artículo 6 incluirá los datos siguientes:
— en el caso de cualquier partida o lote de patatas declarado contaminado, los documentos de acompañamiento prescritos en el artículo 7 del Real Decreto 2071/1993, el número de pasaporte o número de registro de los productores de patata, de los almacenes colectivos y de los centros de distribución, según proceda,
— en el caso de cualquier partida o lote de tomateras declarado como contaminado, los documentos de acompañamiento prescritos en el artículo 7 del Real Decreto 2071/1993 y el número de pasaporte de acuerdo con la lista que se recoge en el punto 2.2 de la sección I de la parte A del anexo V del Real Decreto 2071/1993.
— en el caso de las existencias de patatas de siembra y, si fuere posible, en todos los demás casos, el nombre y la categoría de la variedad,
— cualesquiera otros datos que requiera el Ministerio de Agricultura, Pesca y Alimentación relativos al brote confirmado.
1. Con respecto al apartado 1 del artículo 7, se dispondrá lo siguiente:
— la incineración,
— la utilización como piensos, previo tratamiento térmico adecuado, de forma que no haya riesgo alguno de supervivencia del organismo, o
— el enterramiento profundo en un vertedero donde no exista ningún riesgo de filtración a tierras agrícolas ni de contacto con fuentes de agua que puedan utilizarse para riego de dichas tierras,
— la transformación industrial, previa entrega directa e inmediata del material a una planta de transformación con instalaciones que estén oficialmente autorizadas para la eliminación de residuos y, se ajusten a las disposiciones del anexo VII del presente Real Decreto, u,
— otras medidas, siempre que se haya establecido que no existe ningún riesgo identificable de propagación del organismo y a condición de que tales medidas sean notificadas inmediatamente al Ministerio de Agricultura, Pesca y Alimentación y éste a su vez, a través del cauce correspondiente, a la Comisión y a los demás Estados miembros.
2. El uso adecuado o la eliminación del material vegetal indicado dispuestos en el apartado 2 del artículo 7 deberán efectuarse bajo el control de los organismos oficiales responsables interesados, así como con la oportuna comunicación entre estos organismos para garantizar en todo momento dicho control, y con la aprobación del organismo oficial de cada Comunidad Autónoma donde vayan a envasarse o transformarse las patatas, en lo que se refiere a los vertederos citados en los guiones primero y segundo, y consistirán en los siguiente:
i) en el caso de los tubérculos de patata:
— el uso como patatas de consumo que se embalen en lugares con instalaciones apropiadas para la eliminación de residuos, listas para la entrega y uso directos sin necesidad de nuevo embalaje, y que se destinen a esa entrega y uso directos, o
— el uso como patatas de consumo que se destinen a la transformación industrial y a la entrega directa e inmediata a una planta de transformación con instalaciones apropiadas para la eliminación de residuos, o
— algún otro tipo de uso o eliminación, siempre que se establezca que no existe ningún riesgo identificable de propagación del organismo, y previa aprobación de los citados organismos oficiales responsables. Dichas medidas se notificarán inmediatamente al Ministerio de Agricultura, Pesca y Alimentación y éste a su vez, a través del cauce correspondiente, a la Comisión y a los demás Estados miembros;
ii) en el caso de las otras partes de las plantas, incluidos los detritos del tallo y de las hojas:
— la destrucción, o
— algún otro tipo de uso o eliminación, siempre que se establezca que no existe ningún riesgo identificable de propagación del organismo y a condición de que ese uso o eliminación sean notificados al Ministerio de Agricultura, Pesca y Alimentación y éste, a su vez, a través del cauce correspondiente, a la Comisión y a los demás Estados miembros.
3. Los métodos adecuados para la descontaminación de los objetos a los que se refiere el apartado 3 del artículo 7 consistirán en una limpieza y, en su caso, una desinfección que permitan descartar todo riesgo identificable de propagación del organismo; estas operaciones se efectuarán bajo la supervisión de los organismos oficiales responsables de las Comunidades Autónomas.
4. La serie de medidas mencionadas en el apartado 4 del artículo 7 que se deberán aplicar dentro de la zona o zonas delimitadas que se hayan establecido en virtud del inciso iv) de la letra a) y del inciso iii) de la letra c) del apartado 1 del artículo 6 serán las siguientes:
4.1 En los casos en que en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6, se hayan declarado contaminados lugares de producción, las medidas consistirán en lo siguiente:
a) en los campos o unidades de producción de cultivos protegidos que se hayan declarado contaminados en virtud de esa misma disposición:
i) durante al menos los cuatro años de cultivo siguientes a la declaración de la contaminación:
— se adoptarán medidas para eliminar las patatas y tomateras espontáneas así como otras plantas huésped del organismo, incluidas las malas hierbas solanáceas; — no se plantarán:
patatas ni tubérculos de patata,
tomateras y semillas de tomate,
— teniendo en cuenta la biología del organismo:
otras plantas huésped,
plantas de especies de Brassica para las que exista un riesgo identificado de supervivencia o propagación del organismo,
otros cultivos para los que exista un riesgo identificado de supervivencia o propagación del organismo;
— en la primera temporada de cultivo de patatas o tomates siguiente al período indicado en el guión anterior y, siempre que se haya comprobado que durante al menos los dos años de vegetación inmediatamente anteriores a la plantación, el campo estuvo libre de patatas y tomateras espontáneas y de otras plantas huésped del organismo, incluidas las malas hierbas solanáceas:
en el caso de las patatas, se plantarán patatas de siembra certificadas oficialmente para la producción de patatas de consumo exclusivamente, y
se efectuará un examen oficial, acompañado de los análisis oportunos, según se dispone en el apartado 1 del artículo 3;
— en la temporada de cultivo de patatas o tomates siguiente a la indicada en el guión anterior y tras un ciclo de rotación adecuado, se procederá, en el caso de las patatas, a la plantación de patatas de siembra certificadas oficialmente para la producción de patatas de siembra o de consumo y, en el caso de las patatas y tomates, a la realización del examen oficial que dispone el apartado 1 del artículo 3; o
ii) durante los cinco años de cultivo siguientes al de la declaración de la contaminación:
— se adoptarán medidas para eliminar las patatas y tomateras espontáneas así como otras plantas que puedan ser huésped del organismo, incluidas las malas hierbas solanáceas, y
— durante los tres primeros años, se dejará y mantendrá el campo, bien en barbecho completo, bien para el cultivo de cereales, con arreglo al riesgo que se haya determinado, bien como pasto permanente, con siega intensa y frecuente o pastoreo intensivo, o bien como pastizal para la producción de semillas y, a continuación, en los dos años subsiguientes, se plantarán plantas que no sean huésped del organismo para las que no exista ningún riesgo identificado de supervivencia o propagación de éste;
— en la primera temporada de cultivo de patatas o tomates siguiente al período indicado en el guión anterior:
en el caso de las patatas, se plantarán exclusivamente patatas de siembra certificadas oficialmente para la producción de patatas de siembra o de consumo, y
se efectuará el examen oficial, acompañado de los análisis oportunos, que dispone el apartado 1 del artículo 3.
b) en otros campos, las medidas consistirán en lo siguiente:
— durante el año de cultivo siguiente a la declaración de la contaminación:
no se plantarán patatas ni tubérculos de patata ni otras plantas que puedan ser huésped del organismo, y se adoptarán medidas para eliminar las patatas y tomateras espontáneas así como otras plantas que puedan ser huésped del organismo, incluidas las malas hierbas solanáceas, o
en el caso de los tubérculos de patata, se podrán plantar exclusivamente patatas de siembra certificadas oficialmente, para la producción de patatas de consumo, con la condición de que los organismos oficiales responsables hayan quedado plenamente convencidos de la eliminación de riesgos a través de plantas espontáneas de patatas y tomateras y otros hospederos del organismo, incluidas las malas hierbas solanáceas; durante la fase de crecimiento, se inspeccionarán los cultivos en los momentos oportunos, las patatas espontáneas se someterán a análisis para la posible detección del organismo y, al final, se inspeccionarán los tubérculos cosechados; en el primer año de cultivo siguiente al indicado en el guión anterior:
en el caso de las patatas, se plantarán exclusivamente patatas de siembra certificadas oficialmente para la producción de patatas de siembra o de consumo; durante al menos el segundo año de cultivo siguiente al indicado en el primer guión:
en el caso de las patatas, se plantarán para la producción de patatas de siembra o de consumo exclusivamente patatas de siembra certificadas oficialmente o patatas de siembra que se hayan cultivado bajo control oficial a partir de patatas de siembra certificadas oficialmente;
en cada uno de los años de cultivo indicados en los guiones anteriores, se adoptarán medidas para eliminar las patatas y tomateras espontáneas así como otras plantas que puedan ser huésped del organismo, incluidas las malas hierbas solanáceas; además, se efectuará el examen oficial que dispone el apartado 1 del artículo 3 y, en los casos en que se planten patatas de siembra para la producción de ese mismo tipo de patatas, se someterán a análisis los tubérculos.
c) Inmediatamente después de haberse declarado la contaminación en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6, y en cada uno de los años de cultivo subsiguientes hasta, inclusive, la primera temporada de cultivo permisible de patatas o tomates en el campo o campos declarados contaminados que se contemplan en la letra a) anterior:
— toda la maquinaria e instalaciones de almacenamiento del lugar de producción que se utilicen en la producción de patatas o tomates se limpiarán y, en su caso, desinfectarán utilizando métodos adecuados de la forma que se dispone en el punto 3, y
— con el fin de impedir la propagación del organismo, se efectuarán controles oficiales de los planes de riego y aspersión y, en caso necesario, se prohibirán los mismos.
d) En el caso de las unidades de producción de cultivos protegidos que hayan sido declaradas contaminadas en virtud del inciso ii) de la letra a) del apartado 1 del artículo 6, y en las que sea posible una sustitución total de los medios de cultivo:
— no se plantarán patatas ni tubérculos de patata ni otras plantas que puedan ser huésped del organismo, incluidas tomateras y semillas de tomate, a menos que, por una parte, dichas unidades se hayan sometido a medidas oficialmente supervisadas que, teniendo por objeto la eliminación del organismo y la retirada de todo el material vegetal huésped, incluyan, como mínimo, un cambio completo de los medios de cultivo y una limpieza y, en su caso, una desinfección de tales unidades y de todo el equipo y que, por otra parte, los organismos oficiales responsables hayan dado subsiguientemente su autorización para la producción de patatas o tomates, y
además, la producción procederá, en el caso de la patata, de patatas de siembra certificadas oficialmente o de minitubérculos o microplantas obtenidos de fuentes analizadas,
asimismo, con objeto de impedir la propagación del organismo, se efectuarán controles oficiales de los planes de riego y aspersión y, en su caso, se prohibirán los mismos.
4.2 Dentro de la zona delimitada y sin perjuicio de las medidas dispuestas en el punto 4.1, las Comunidades Autónomas:
a) inmediatamente después de la declaración de contaminación y durante un período de al menos tres años de cultivo:
aa) en los casos en que la delimitación de la zona se haya efectuado en virtud del inciso iv) de la letra a) del apartado 1 del artículo 6:
— garantizarán que sus organismos oficiales responsables supervisen las instalaciones que cultiven, almacenen o manipulen tubérculos de patata o tomates, así como aquellas otras instalaciones que utilicen en el marco de un contrato maquinaria para la producción de patatas o tomates,
— exigirán que la maquinaria y los almacenes de esas instalaciones se limpien y, en su caso, desinfecten utilizando métodos adecuados de la forma que se dispone en el punto 3,
— requerirán que para todos los cultivos de patata dentro de la zona delimitada, se planten exclusivamente semillas certificadas o semillas cultivadas bajo control oficial, y se efectúe un análisis después de cosechar los cultivos de patatas de siembra en lugares de producción determinados como probablemente contaminados según el inciso iii) de la letra a) del apartado 1 del artículo 6,
— dispondrán que en todas las instalaciones situadas en la zona se manipulen separadamente las existencias cosechadas de patatas de siembra y las de patatas de consumo,
— efectuarán el examen oficial que dispone el apartado 1 del artículo 3;
ab) en los casos en que, en virtud del inciso ii) de la letra c) del apartado 1 del artículo 6, se hayan declarado contaminadas aguas de superficie o en que, por disposición del punto 2 del anexo V del presente Real Decreto, se hayan incluido dichas aguas entre los factores de la posible propagación del organismo:
— realizarán un examen anual, en los momentos oportunos, con una toma de muestras de las aguas de superficie y de las plantas huésped solanáceas presentes en las fuentes hídricas pertinentes, así como análisis con arreglo a:
en el caso del material vegetal indicado, el método correspondiente establecido en el anexo II del presente Real Decreto, o
en otros casos, cualquier otro método oficialmente autorizado;
— con el fin de impedir la propagación del organismo, establecerán controles oficiales de los planes de riego y aspersión así como una prohibición (revisable a la vista de los resultados del examen anual arriba mencionado) del uso de las aguas declaradas contaminadas para el riego y aspersión del material vegetal indicado y, en su caso, de otras plantas huésped;
— en los casos en que se hayan contaminado por vertidos de residuos líquidos, establecerán controles oficiales de la eliminación de los residuos procedentes de las instalaciones industriales de transformación o envasado que manipulen el material vegetal indicado;
b) establecerán, cuando así proceda, un programa para la sustitución en un plazo adecuado de todas las existencias de patatas de siembra.
Las instalaciones de eliminación de residuos autorizadas oficialmente a las que se refiere el cuarto guión del punto 1 del anexo VI del presente Real Decreto deberán cumplir las disposiciones que se indican a continuación con el fin de evitar todo riesgo de propagación del organismo:
i) los residuos procedentes de la transformación de patatas y tomates (incluidas las patatas y tomates rechazados y las peladuras), así como cualquier otro residuo sólido que acompañe a las patatas y tomates, se eliminarán:
— mediante su enterramiento profundo en un vertedero donde no exista ningún riesgo de filtración a tierras agrícolas ni de contacto con fuentes de agua que puedan utilizarse para el riego de dichas tierras; los residuos se conducirán directamente al vertedero en las condiciones necesarias para evitar todo riesgo de pérdida de los mismos, o
— mediante su incineración;
ii) los residuos líquidos procedentes de la transformación que contengan elementos sólidos en suspensión se filtrarán o se someterán a procesos de sedimentación para la separación de dichos elementos. Éstos se eliminarán de la forma dispuesta en el inciso i).
Por su parte, los residuos líquidos se someterán a alguna de las medidas siguientes:
— calentamiento a una temperatura mínima de 70 0C durante al menos treinta minutos antes de la eliminación, o
eliminación por otro sistema que, aprobado oficialmente y aplicado bajo control oficial, descarte todo riesgo de contacto de los residuos con tierras agrícolas o con fuentes de agua que puedan utilizarse para el riego de tierras agrícolas. Las características de tal sistema serán notificadas al Ministerio de Agricultura, Pesca y Alimentación y éste a su vez, a través del cauce correspondiente, a los demás Estados miembros y a la Comisión.
Este documento es de carácter informativo y no tiene valor jurídico.
Ayúdenos a mejorar: puede dirigir sus comentarios y sugerencias a nuestro Servicio de atención al ciudadano
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid