Edukia ez dago euskaraz
El artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, en redacción dada al mismo por la Disposición final tercera de la Ley 16/2003, de 28 de mayo, de cohesión y calidad del Sistema Nacional de Salud, modifica la configuración del sistema de precios de referencia en la financiación de medicamentos con cargo a fondos de la Seguridad Social o a fondos estatales afectos a la sanidad.
Dicha modificación afecta, principalmente, a las condiciones requeridas para el establecimiento de los conjuntos y a la exclusión, a efectos de integración en los mismos, de las formas farmacéuticas innovadoras hasta tanto se autorice la especialidad farmacéutica genérica correspondiente. Resulta necesario, por tanto, delimitar el concepto jurídico «formas farmacéuticas innovadoras». Se señala que, a tales efectos, se ha optado por facultar a la máxima autoridad del organismo autónomo con competencias científico-técnicas en el ámbito del medicamento y de los productos sanitarios para decidir sobre dicho aspecto, encomendándole que, a tales efectos, tenga en cuenta la evidencia clínica disponible orientada al incremento directo o indirecto de la eficacia terapéutica.
El citado precepto modifica también la fórmula de cálculo de la cuantía del precio de referencia en cada conjunto, que se concreta ahora en la media aritmética de los tres costes/tratamiento/día menores, calculados según la dosis diaria definida, de las presentaciones de especialidades farmacéuticas agrupadas en el mismo por cada vía de administración; el resultado de dicha fórmula se somete, no obstante, al cumplimiento de una condición: que se garantice el abastecimiento a las oficinas de farmacia. Por tanto, resulta necesario, en aras del principio de seguridad jurídica, delimitar el concepto «garantía de abastecimiento». A tales efectos, se consideran las exigencias, general y específica, contenidas en, respectivamente, los artículos 3.1 y 2 y 94.6, quinto párrafo, de la Ley del Medicamento. Además, se tiene en cuenta un precedente de rango legislativo: el establecimiento, por el artículo 1. Uno, segundo párrafo, del Real Decreto-ley 12/1999, de 31 de julio, de Medidas urgentes para la contención del gasto farmacéutico en el Sistema Nacional de Salud, de una cuantía mínima en el precio de venta de laboratorio, por debajo de la cual no se consideró posible la cobertura de costes industriales de fabricación. Siguiendo esta premisa, se opta por no seleccionar, para calcular el precio de referencia, presentaciones cuyo precio de venta de laboratorio sea inferior a 2 euros. Por el mismo motivo, se decide mantener dicho límite mínimo en la cuantía de los precios de venta de laboratorio utilizados para establecer el correspondiente precio de referencia.
Continuando con la mención de las modificaciones introducidas en el sistema de precios de referencia por el vigente artículo 94.6 de la Ley del Medicamento, se señala, por último, la obligada dispensación, en los casos de prescripción por encima de precio de referencia y por principio activo, de la especialidad farmacéutica genérica de menor precio.
Por otra parte, el artículo 94.6 conlleva, en su nueva versión, la modificación de una parte del Real Decreto 1035/1999, de 18 de junio, por el que se regula el sistema de precios de referencia en la financiación de medicamentos con cargo a fondos de la Seguridad Social o a fondos estatales afectos a la sanidad. El texto legal deroga, de forma expresa, los artículos 1, 2, 5, así como los apartados 3 y 4 del artículo 6 de la mencionada norma reglamentaria, permaneciendo, en consecuencia, vigentes los artículos 3 y 4 así como los apartados 1 y 2 del artículo 6 del citado Real Decreto 1035/1999. Por consiguiente, habida cuenta que el artículo 94.6 de la Ley del Medicamento, en relación con el artículo 3.1 del Real Decreto 1035/1999, establece que el Ministro de Sanidad y Consumo, previo informe del Consejo Interterritorial del Sistema Nacional de Salud, determinará tanto los conjuntos como sus respectivos precios de referencia a efectos de limitar la financiación pública de las presentaciones de especialidades farmacéuticas en ellos incluidas, procede cumplimentar formalmente los citados mandatos.
En virtud de lo anterior, de acuerdo con el Consejo de Estado, dispongo:
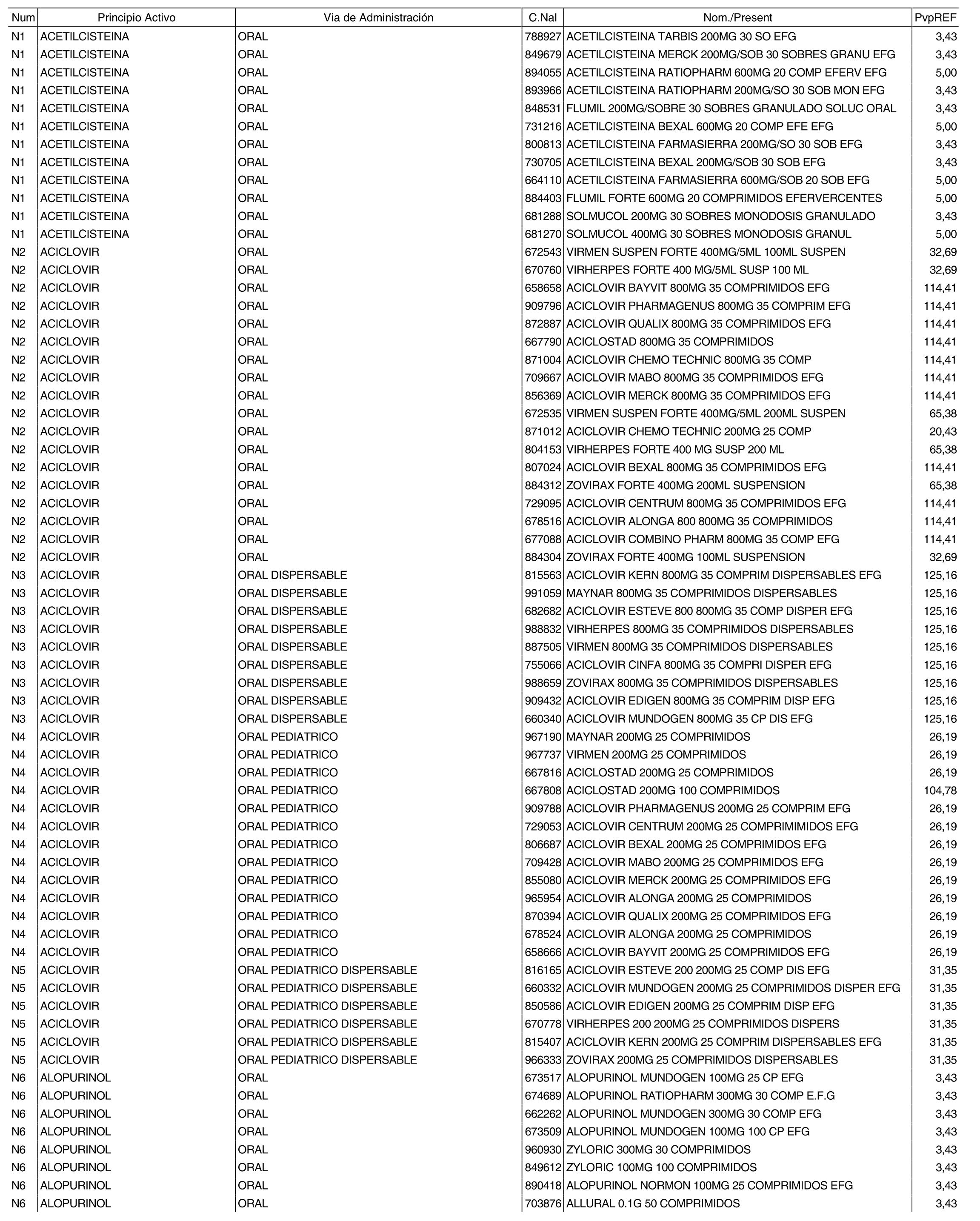
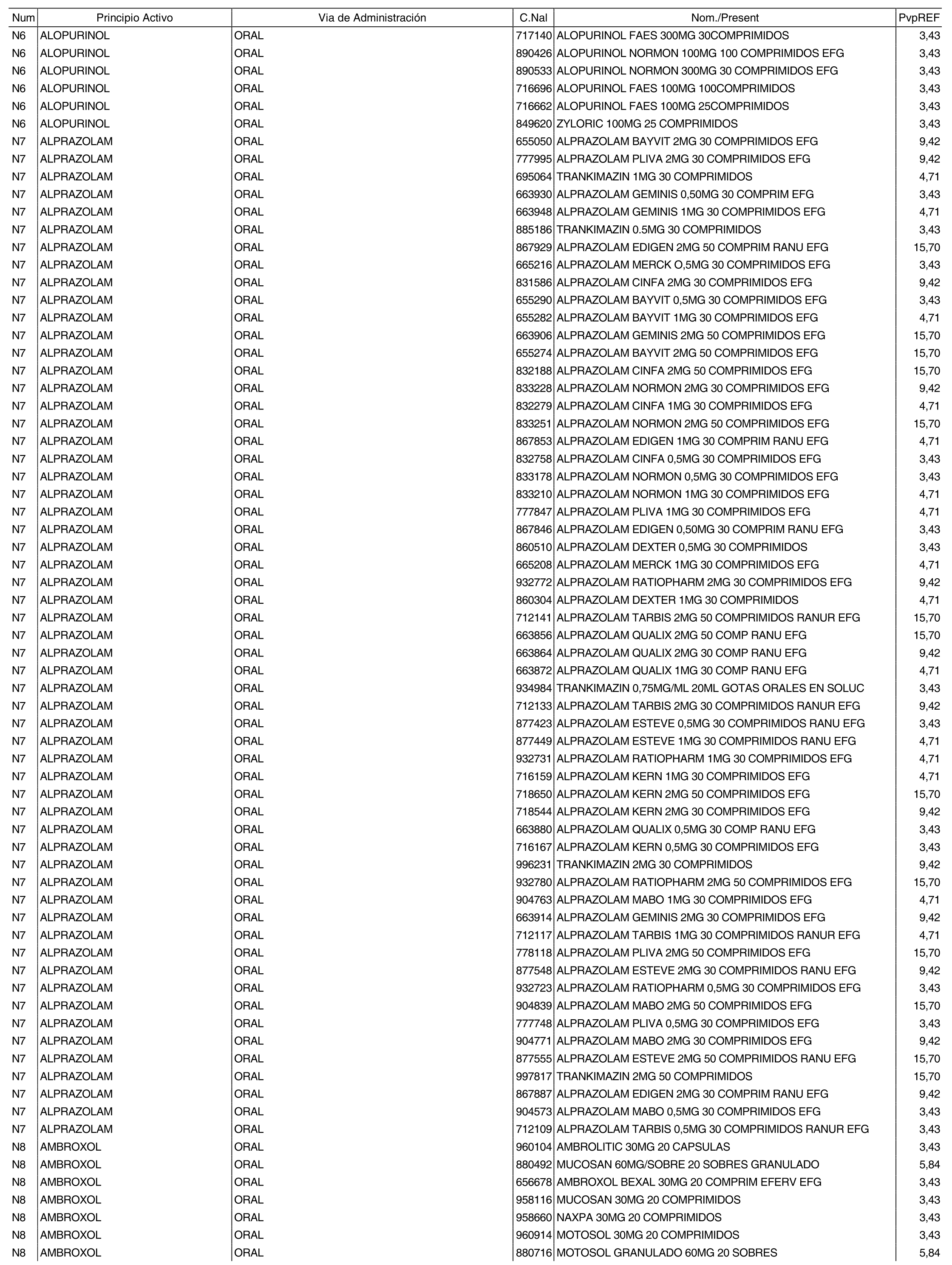
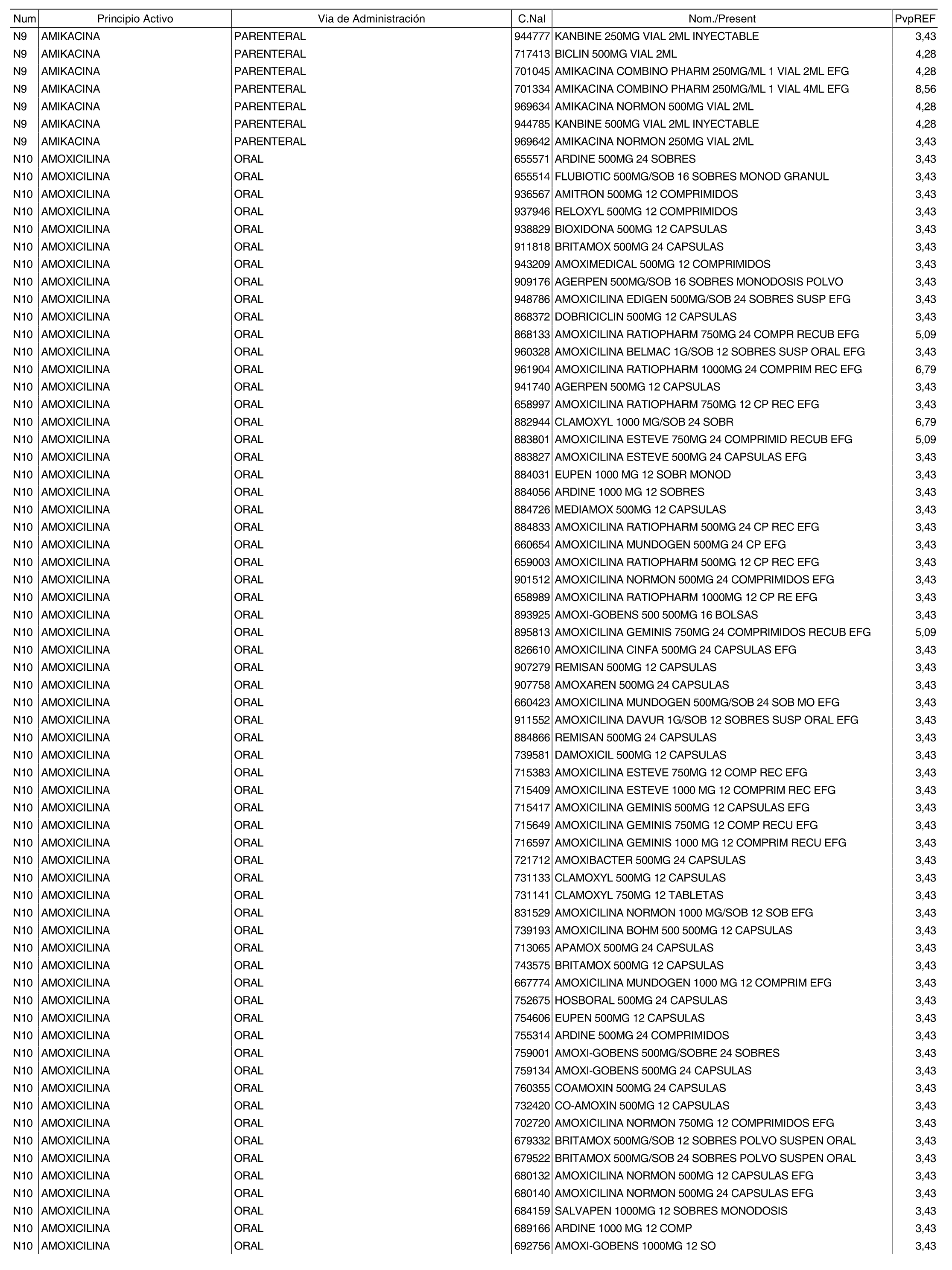
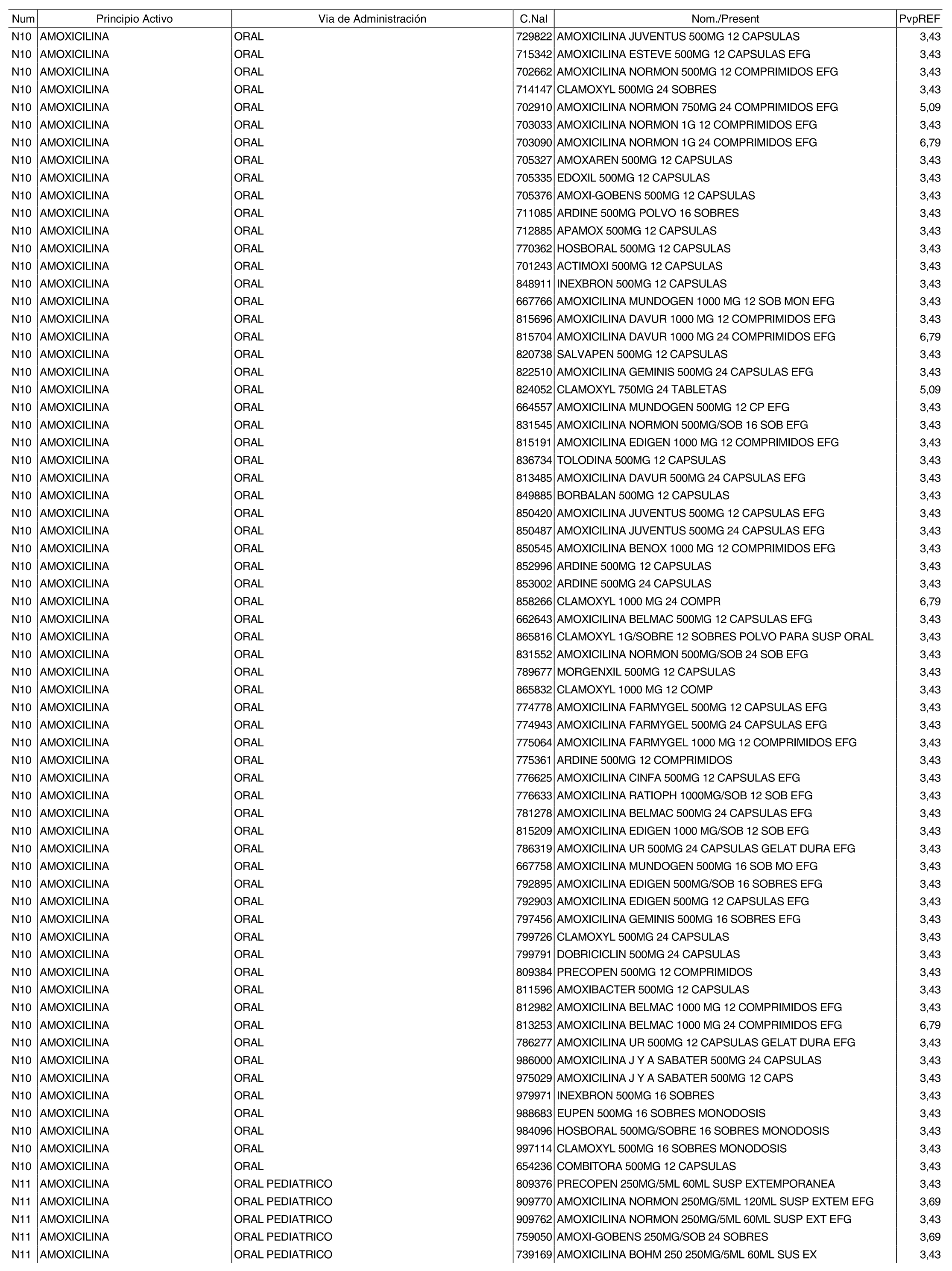
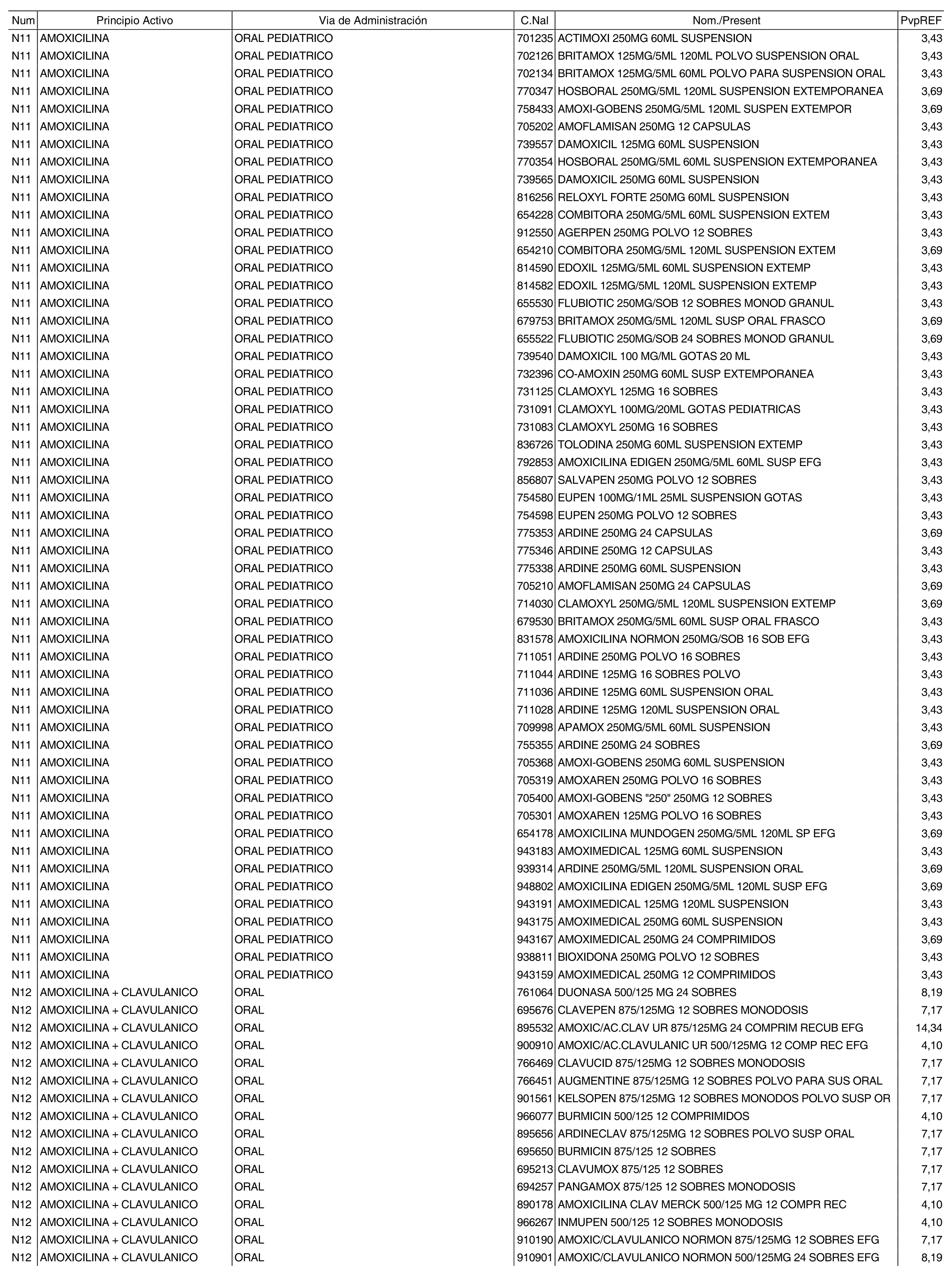
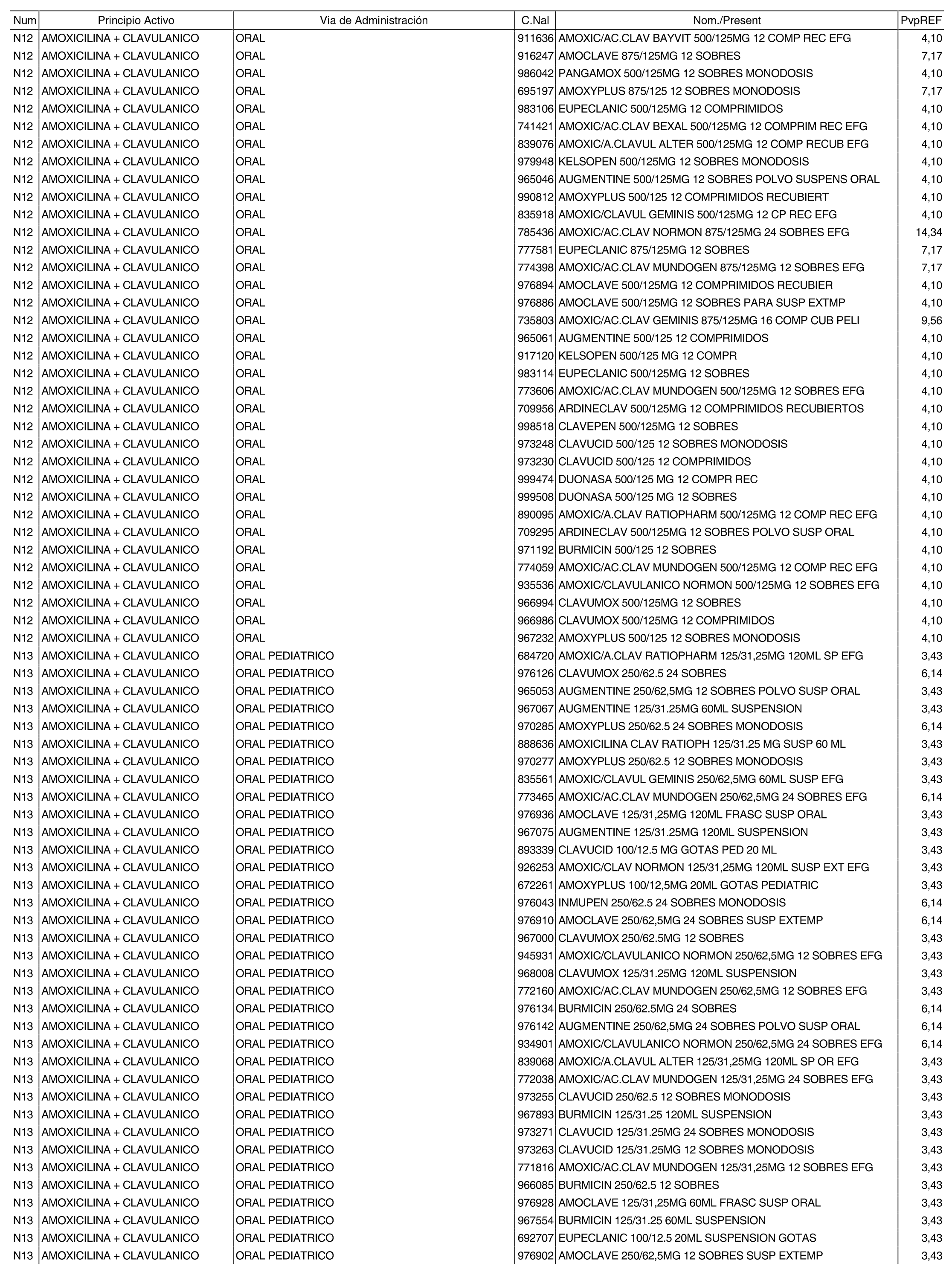
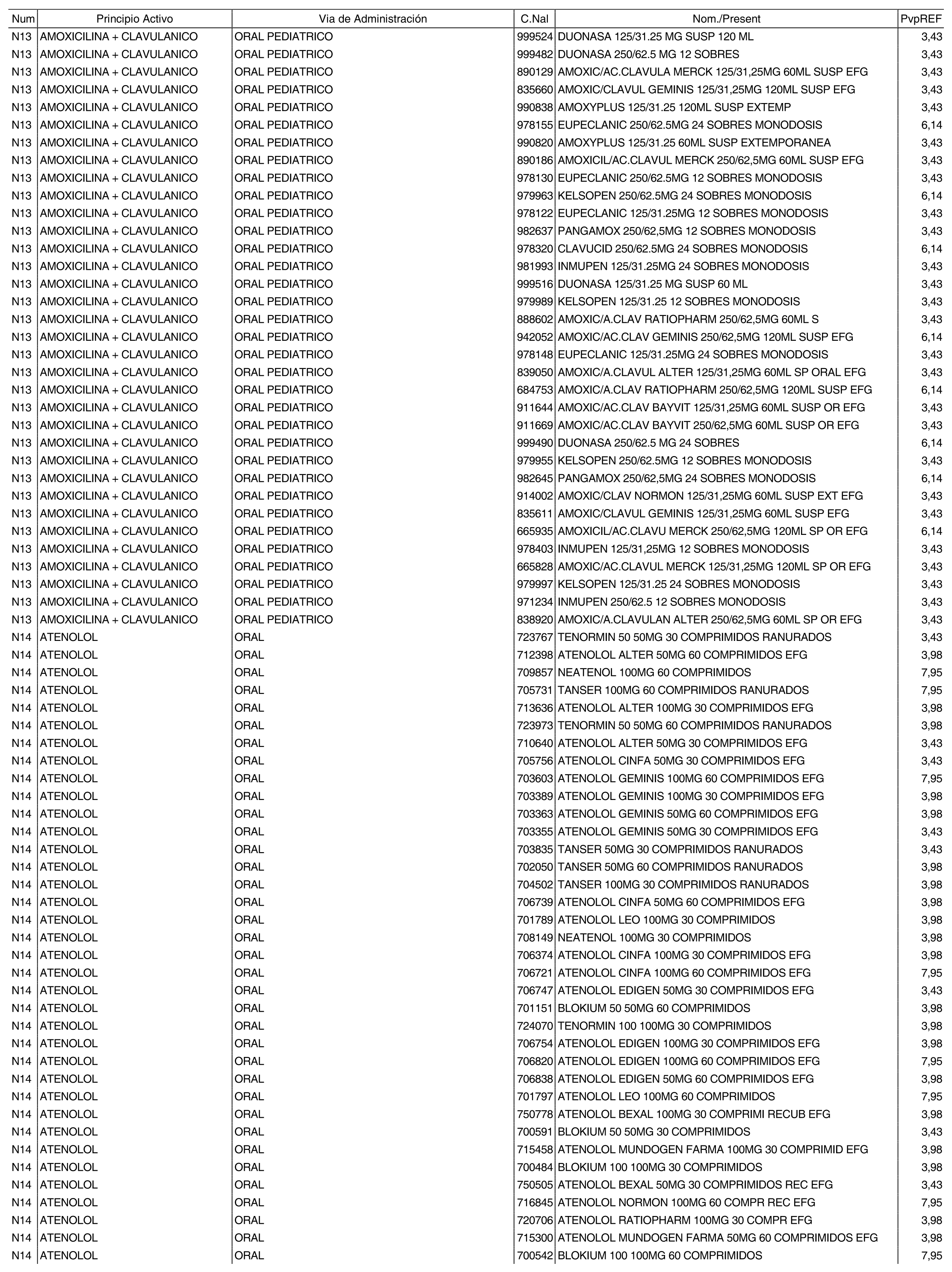
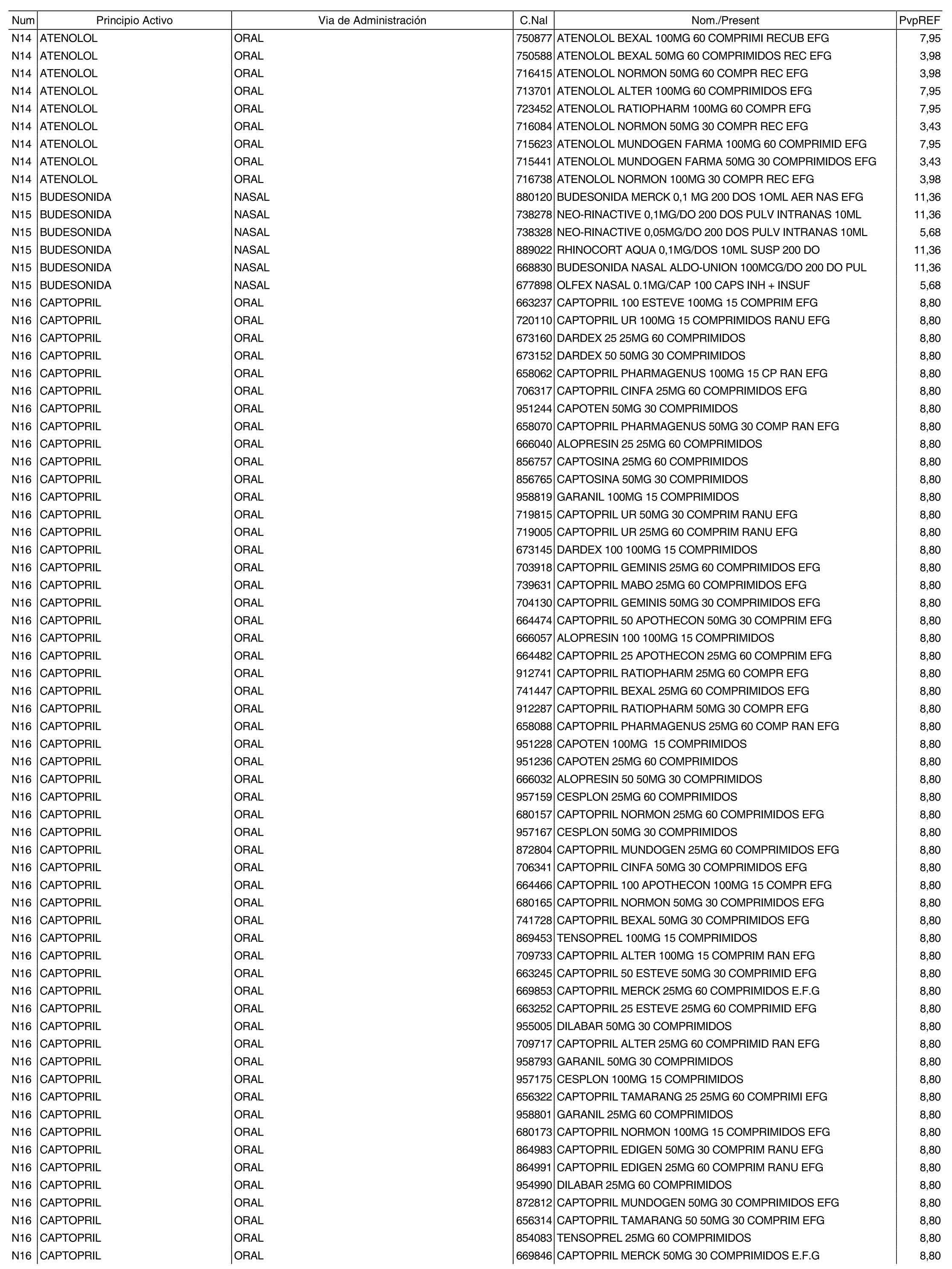
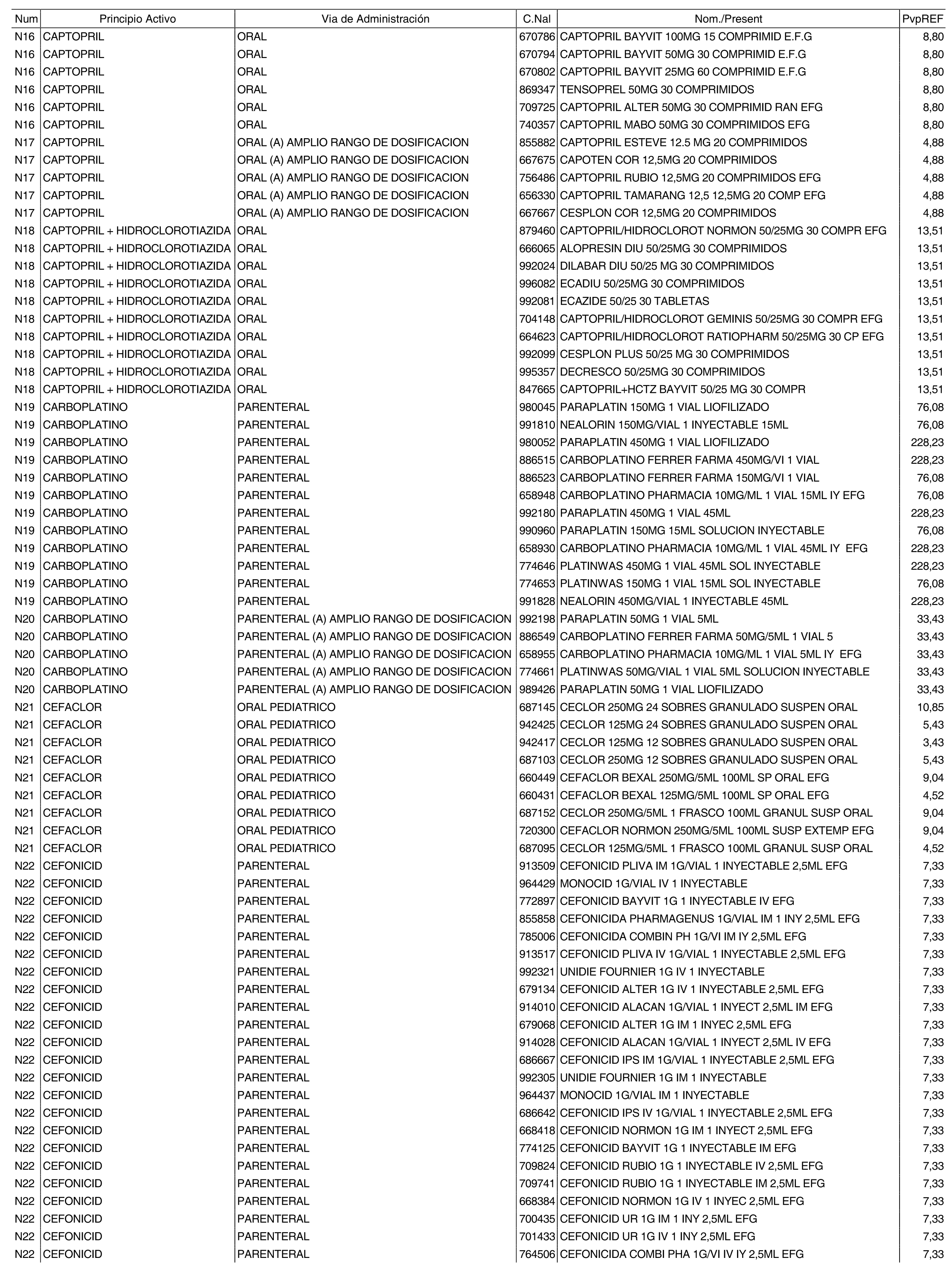
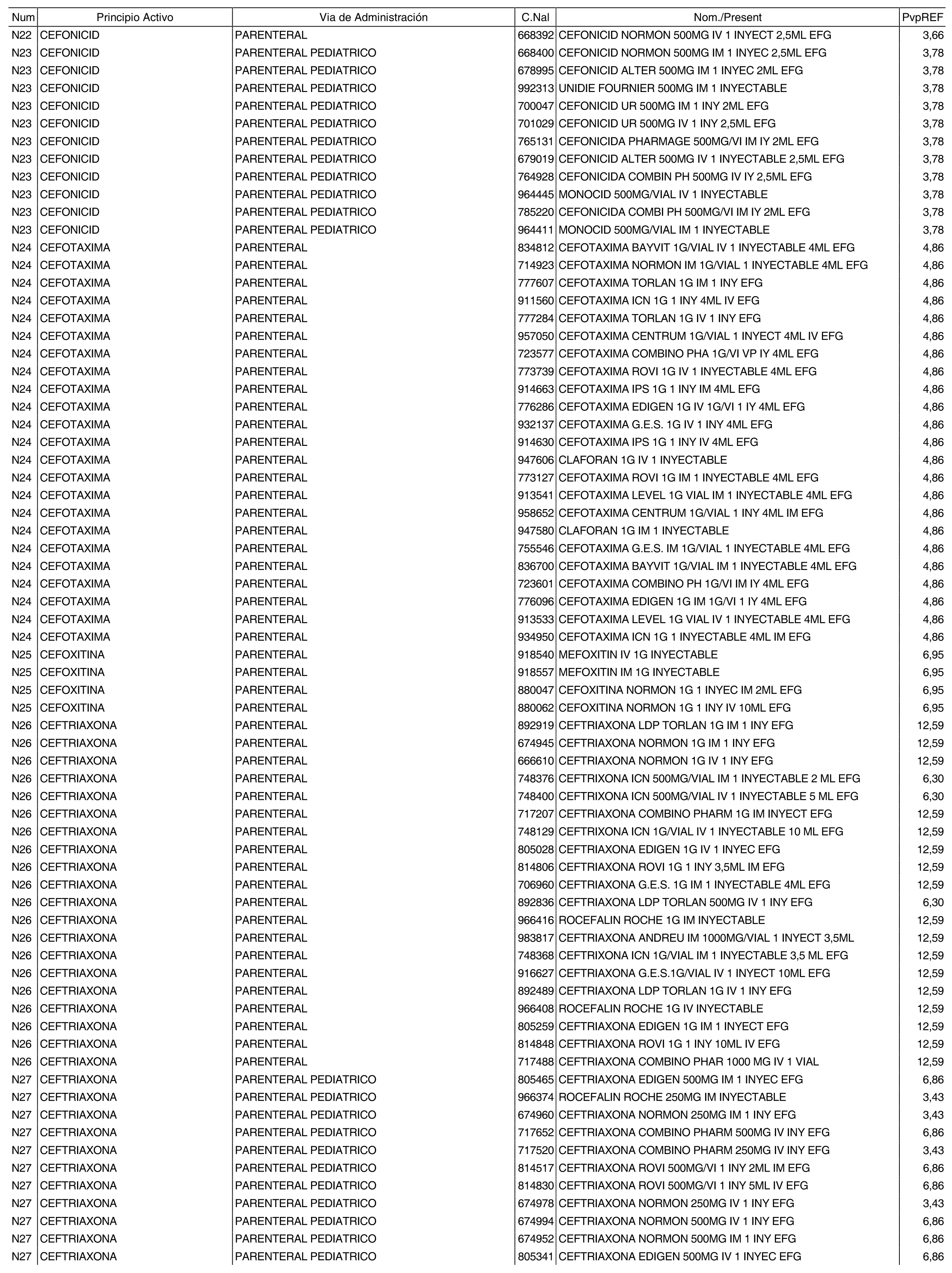
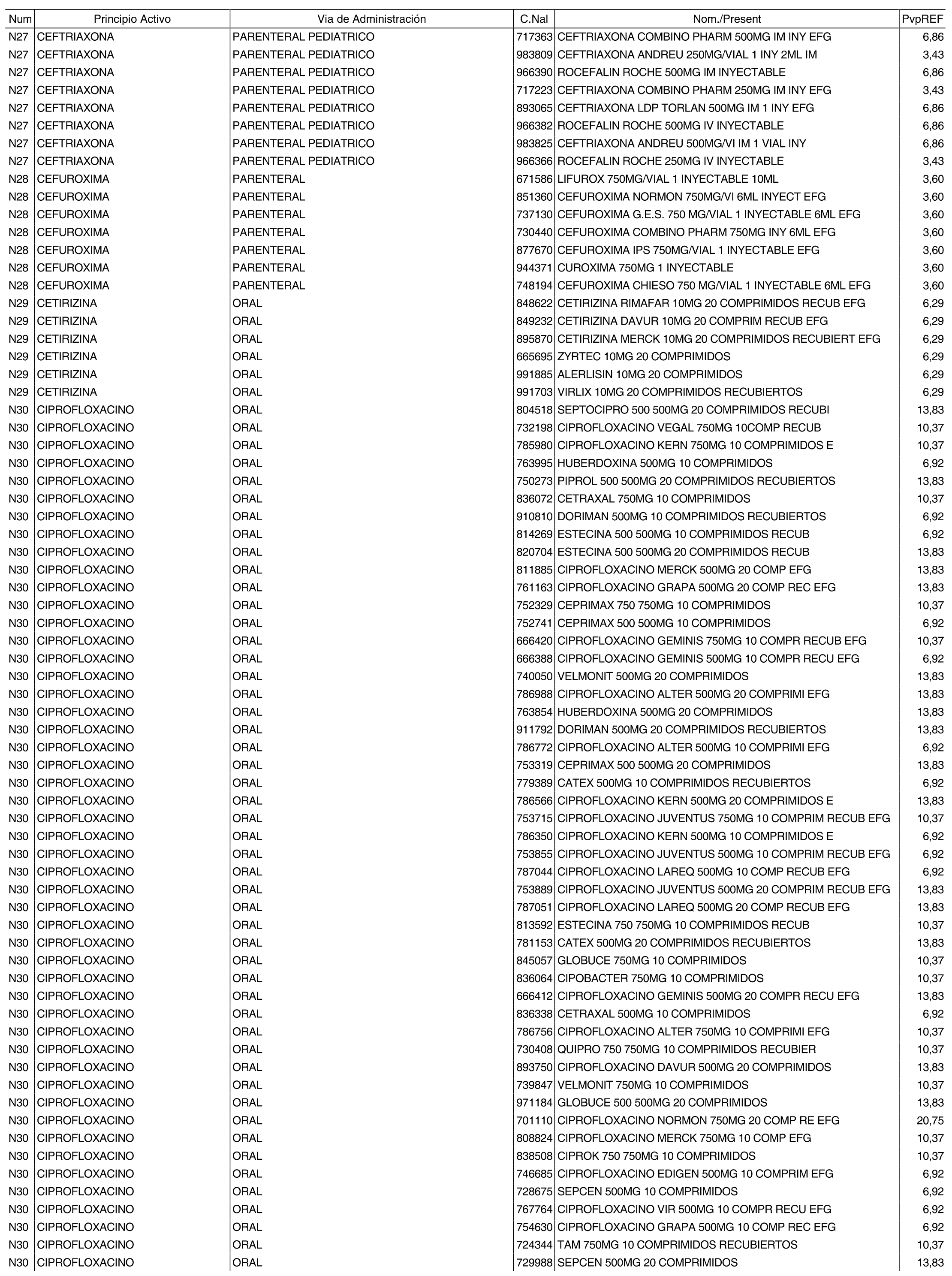
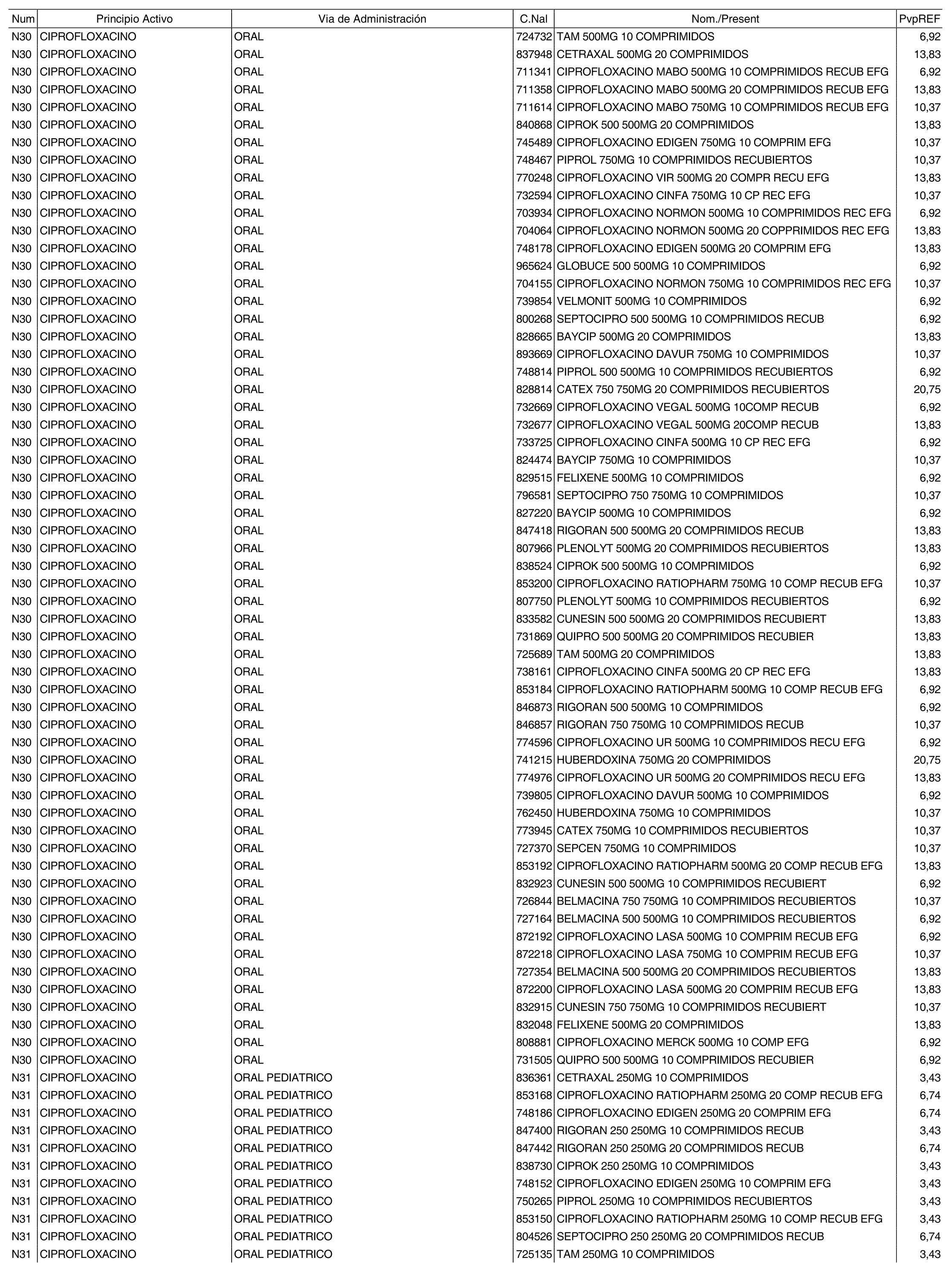
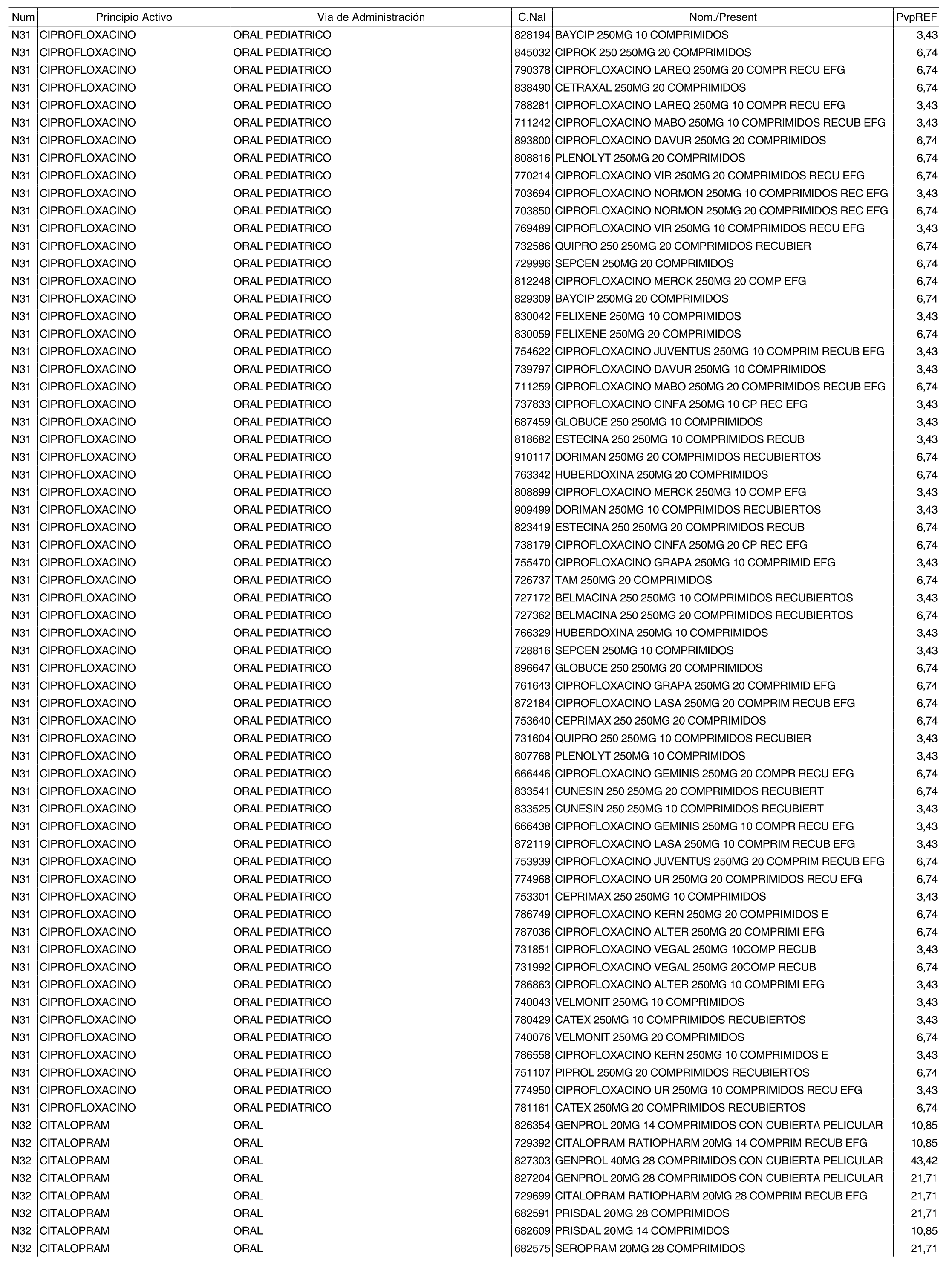
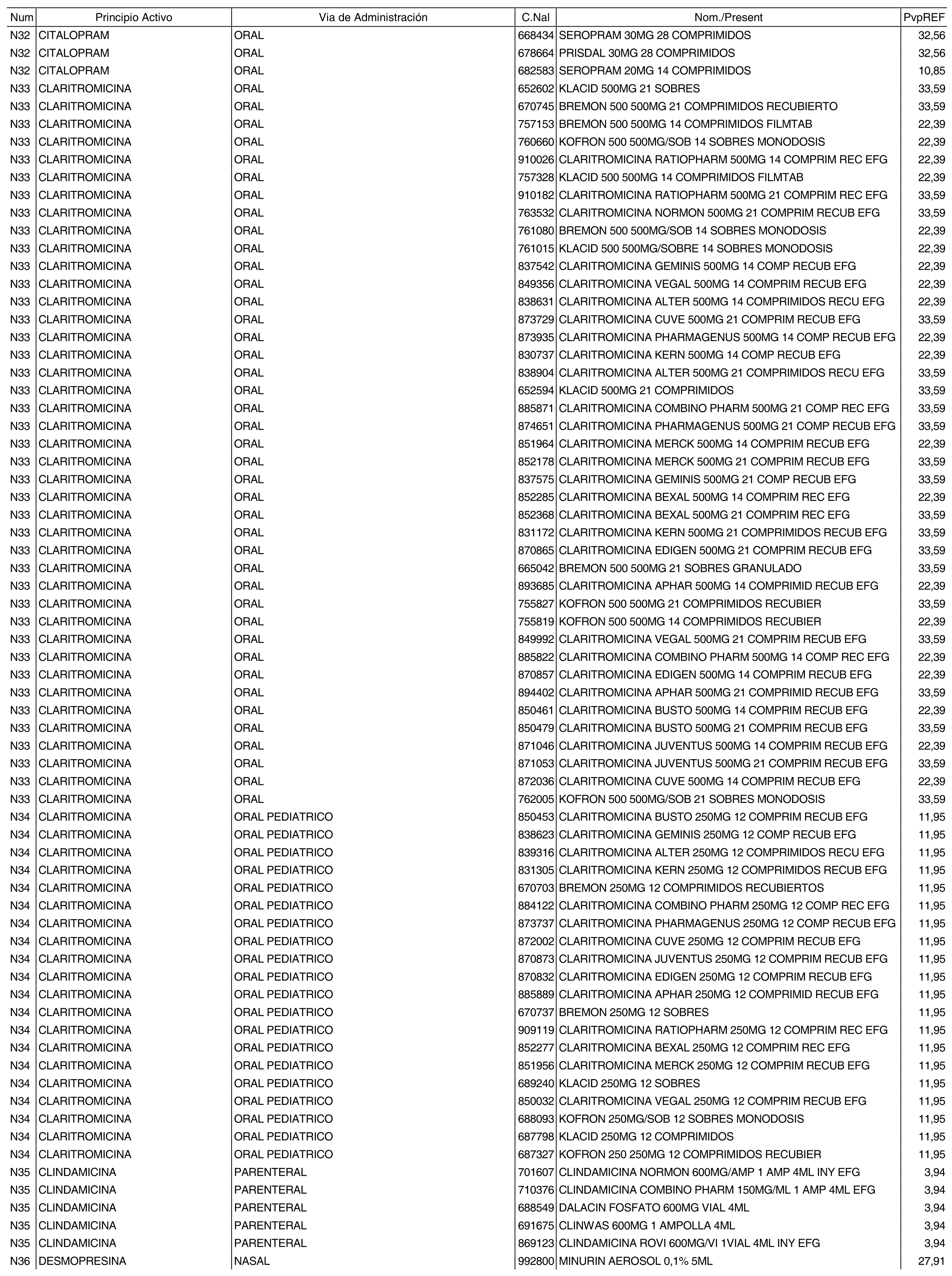
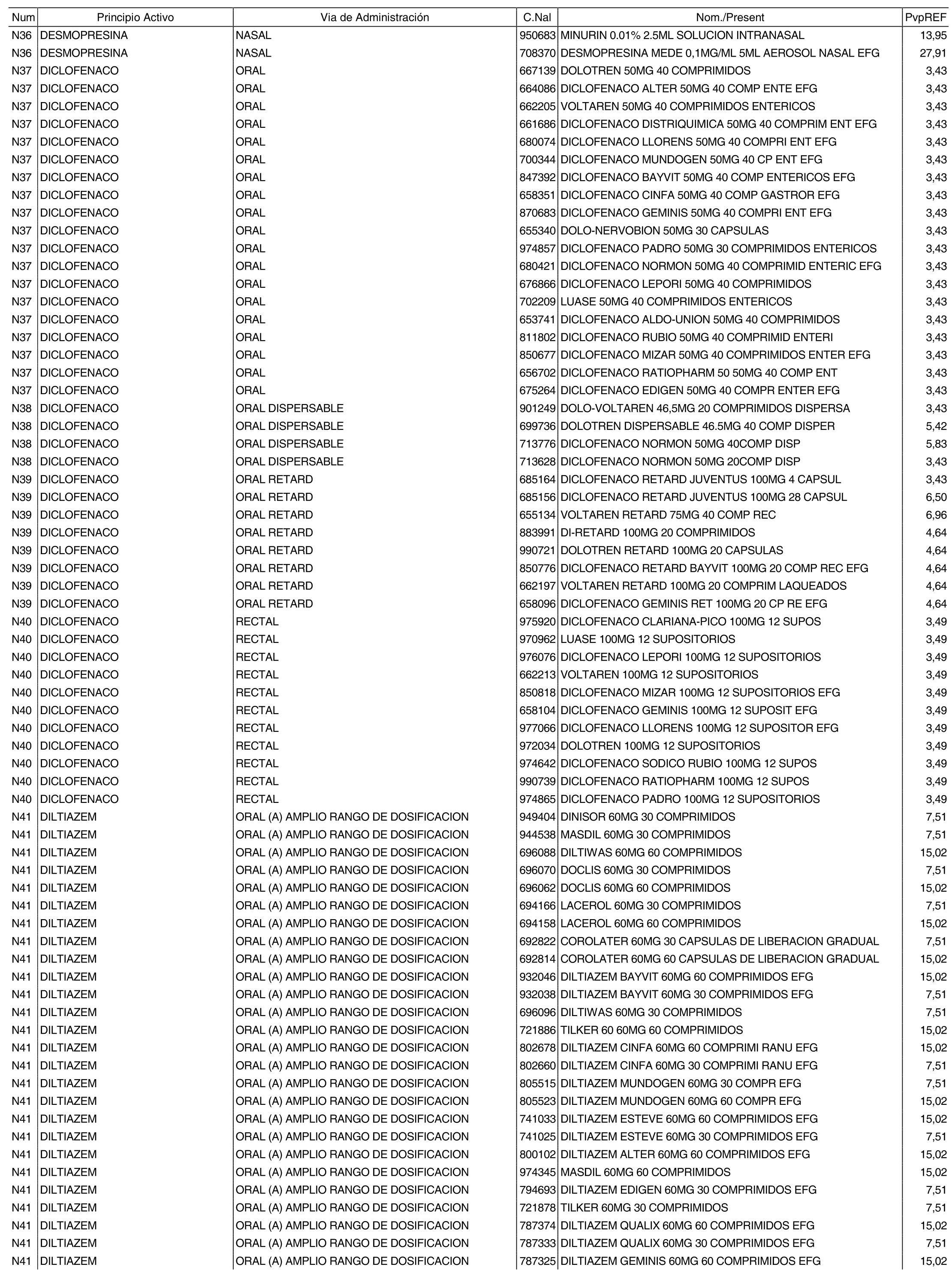
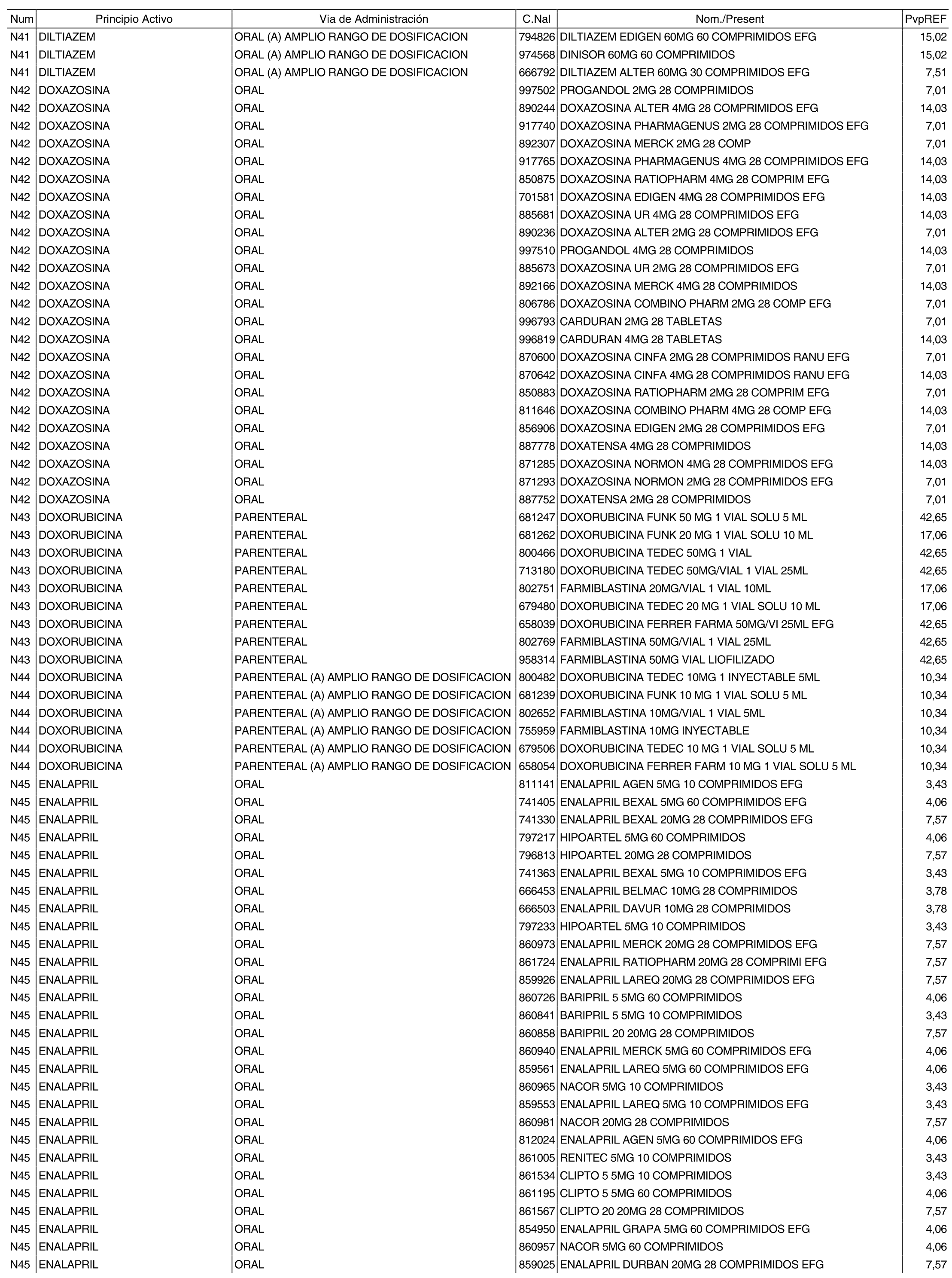
1. Los nuevos conjuntos, creados conforme a lo previsto por el artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, son los que se determinan por la presente Orden y se relacionan en el anexo I de la misma.
A efectos de determinación de los conjuntos a los que se refiere el párrafo anterior:
Se consideran formas farmacéuticas innovadoras las presentaciones calificadas como tales por el Director de la Agencia Española de Medicamentos y Productos Sanitarios, debiendo para ello tener en cuenta la evidencia clínica disponible orientada al incremento directo o indirecto de la eficacia terapéutica.
Las presentaciones indicadas para tratamientos en pediatría constituirán conjuntos independientes. A efectos de la determinación de dichos conjuntos será necesario que exista, al menos, una presentación de especialidad farmacéutica genérica pediátrica con la misma composición cualitativa en sustancias medicinales y vía de administración. Asimismo, constituirán conjuntos independientes, con idéntico requisito, aquellas presentaciones de especialidades farmacéuticas para las que exista una dosificación significativamente distinta para una determinada indicación.
2. Los precios de referencia aplicables a cada uno de los conjuntos a que se refiere el apartado anterior, son los que se aprueban por la presente Orden y se relacionan en el anexo I de la misma.
A efectos del cálculo de la cuantía del precio de referencia en cada conjunto:
Las tres presentaciones de especialidades farmacéuticas seleccionadas para fijar, conforme establece el párrafo quinto del apartado 6 del artículo 94 de la Ley 25/1990, de 20 de diciembre, del Medicamento, el correspondiente precio de referencia deben pertenecer, siempre que ello sea posible, a tres grupos empresariales diferentes. A los efectos del artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, y de lo dispuesto en la presente Orden, se considera que pertenecen a un mismo grupo las empresas que constituyan una unidad de decisión, en los términos del artículo 4 de la Ley 24/1988, de 28 de julio, del Mercado de Valores.
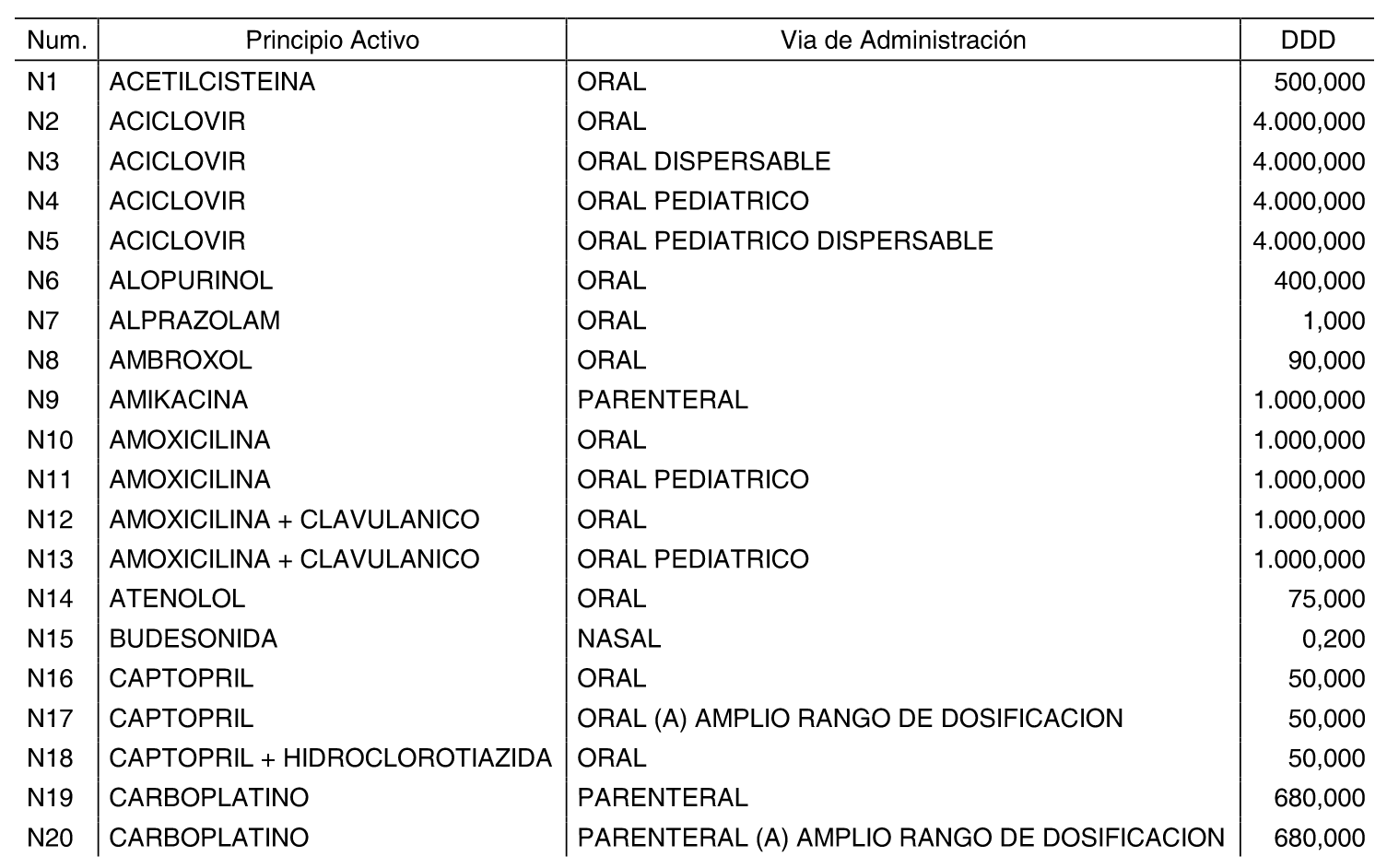
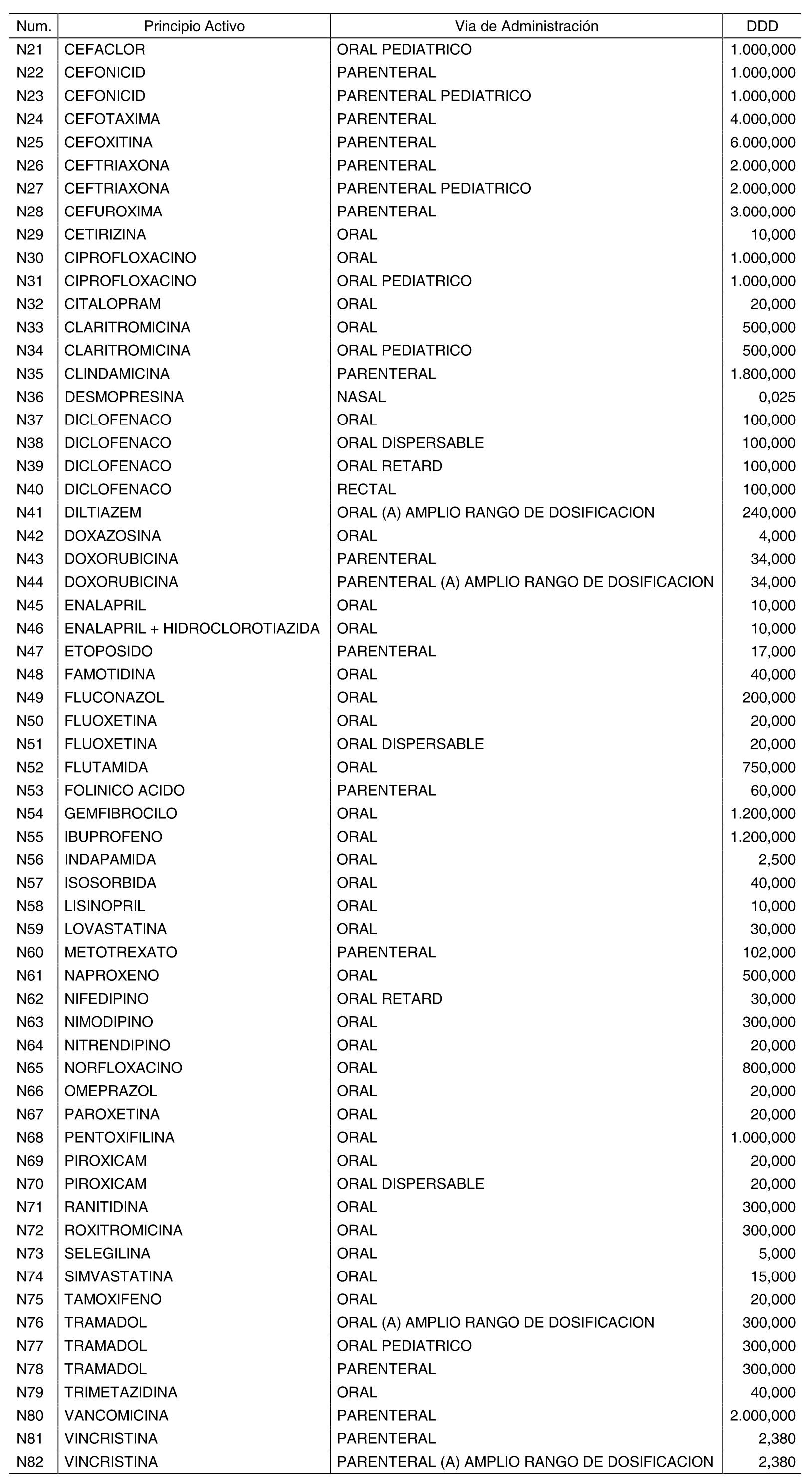
Las dosis diarias definidas son las relacionadas en el anexo II de la presente Orden. Dichas dosis diarias definidas se corresponden con las asignadas oficialmente por el Centro Colaborador de la Organización Mundial de la Salud en Metodología y Estadísticas sobre Medicamentos o, en su defecto, las calculadas por el Ministerio de Sanidad y Consumo conforme a la metodología utilizada por el citado centro.
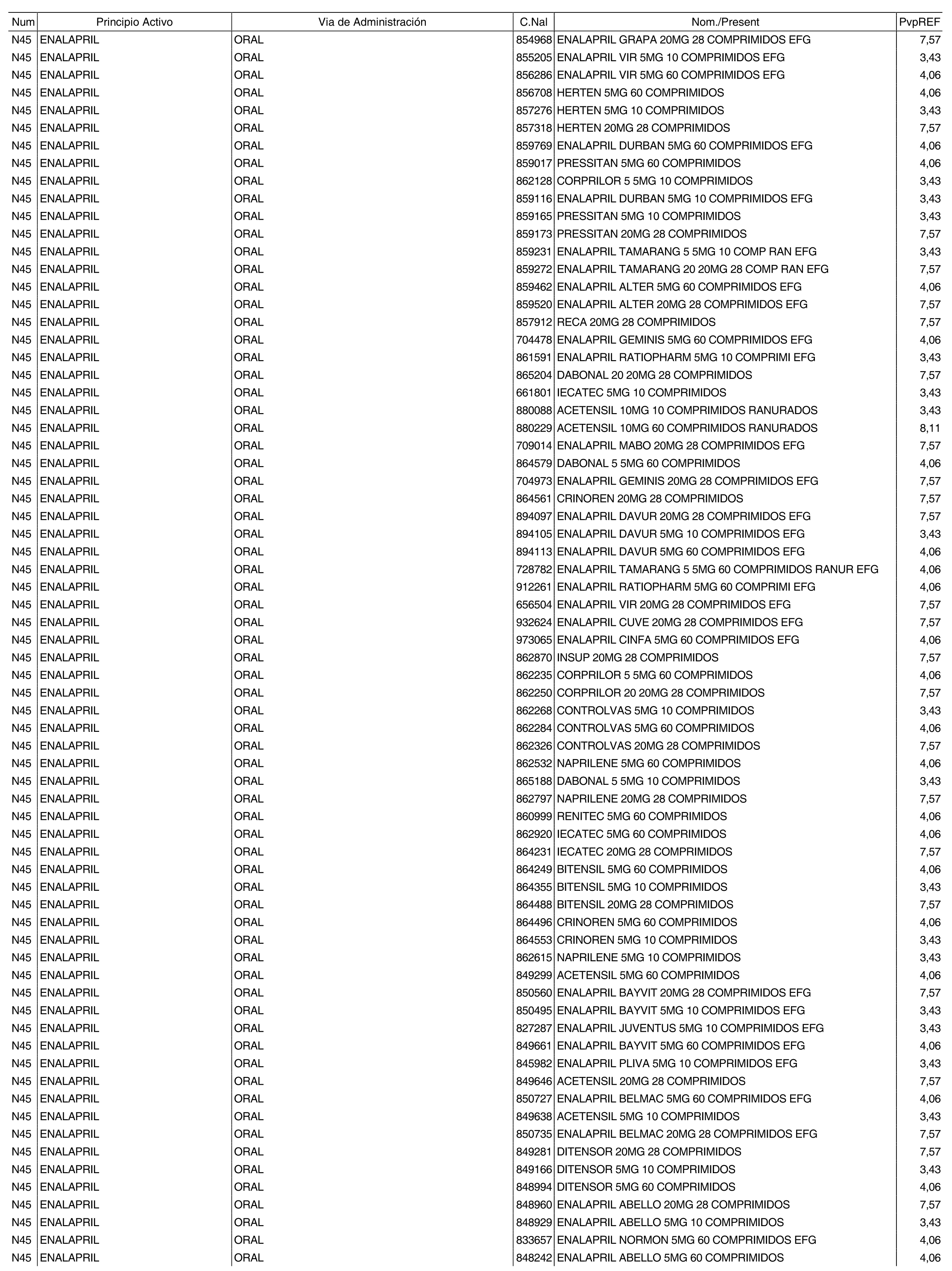
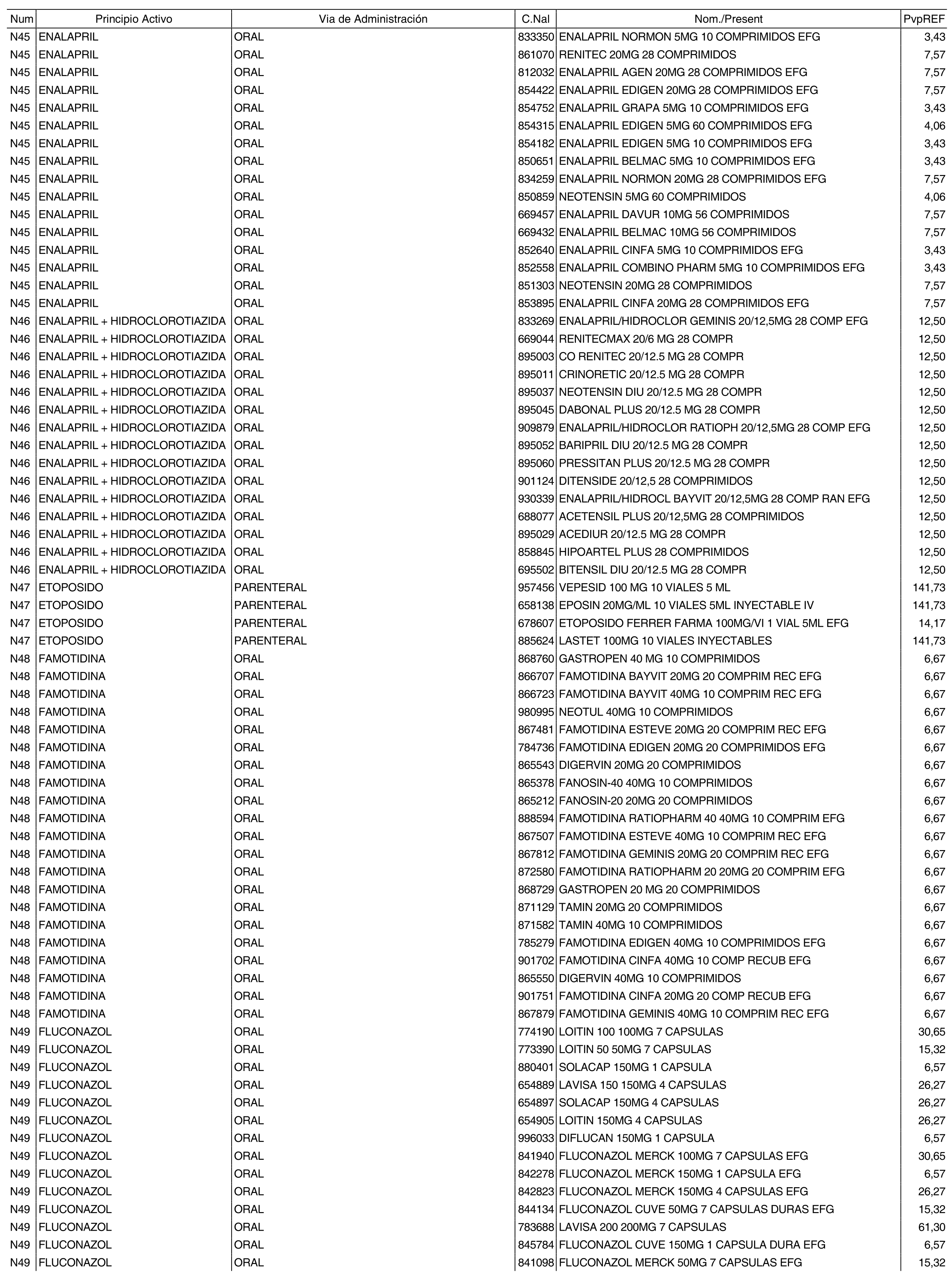
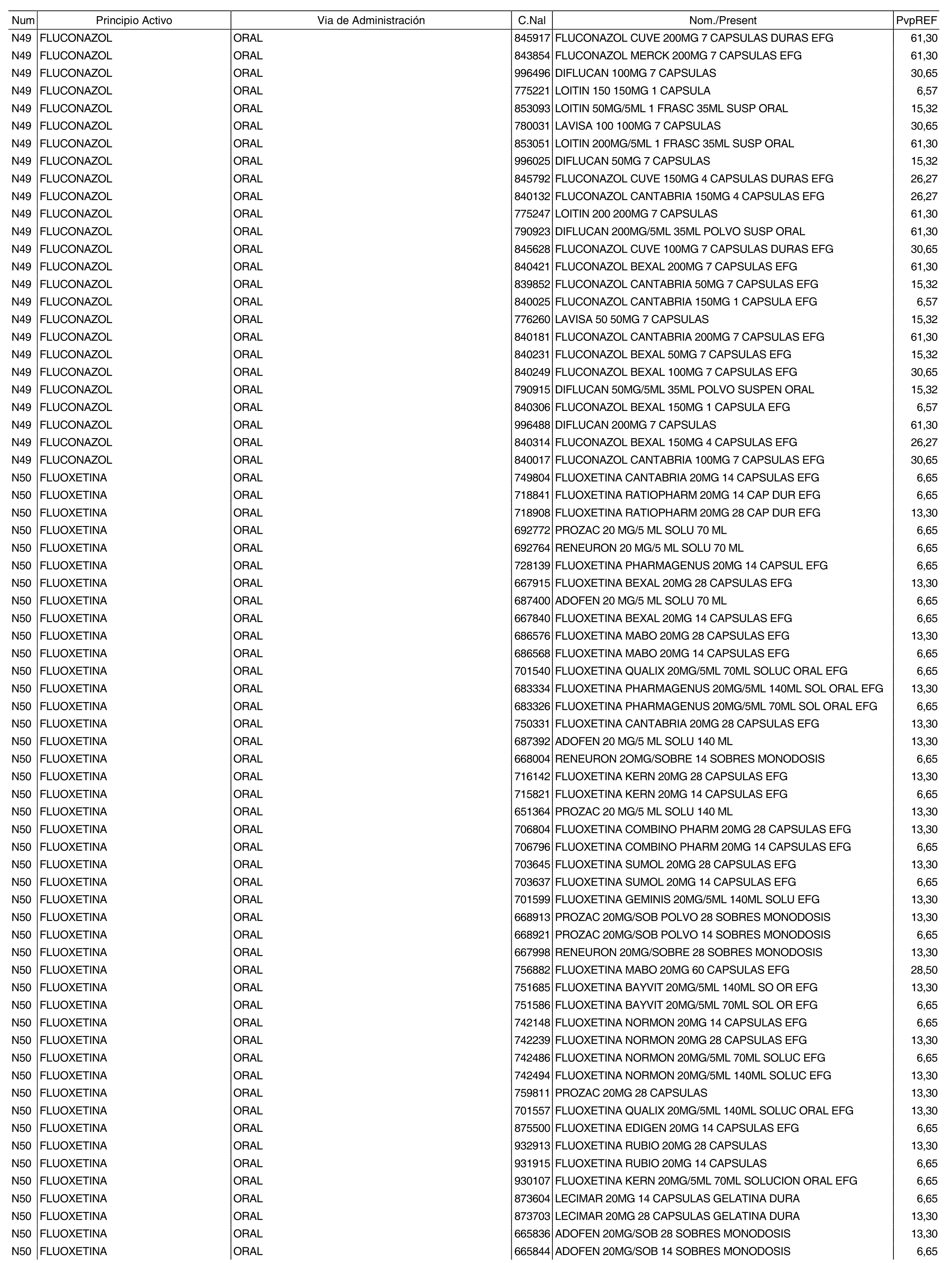
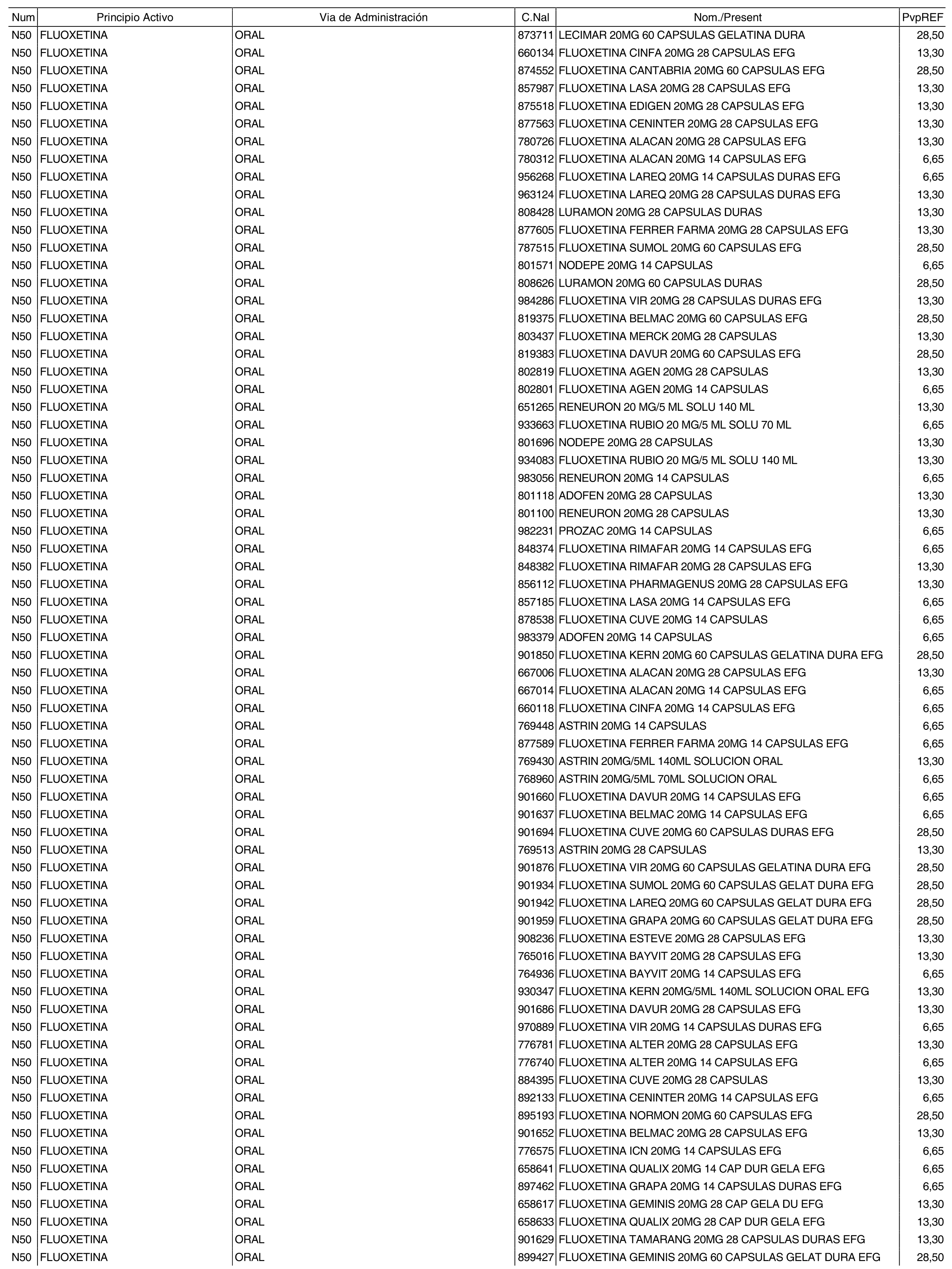
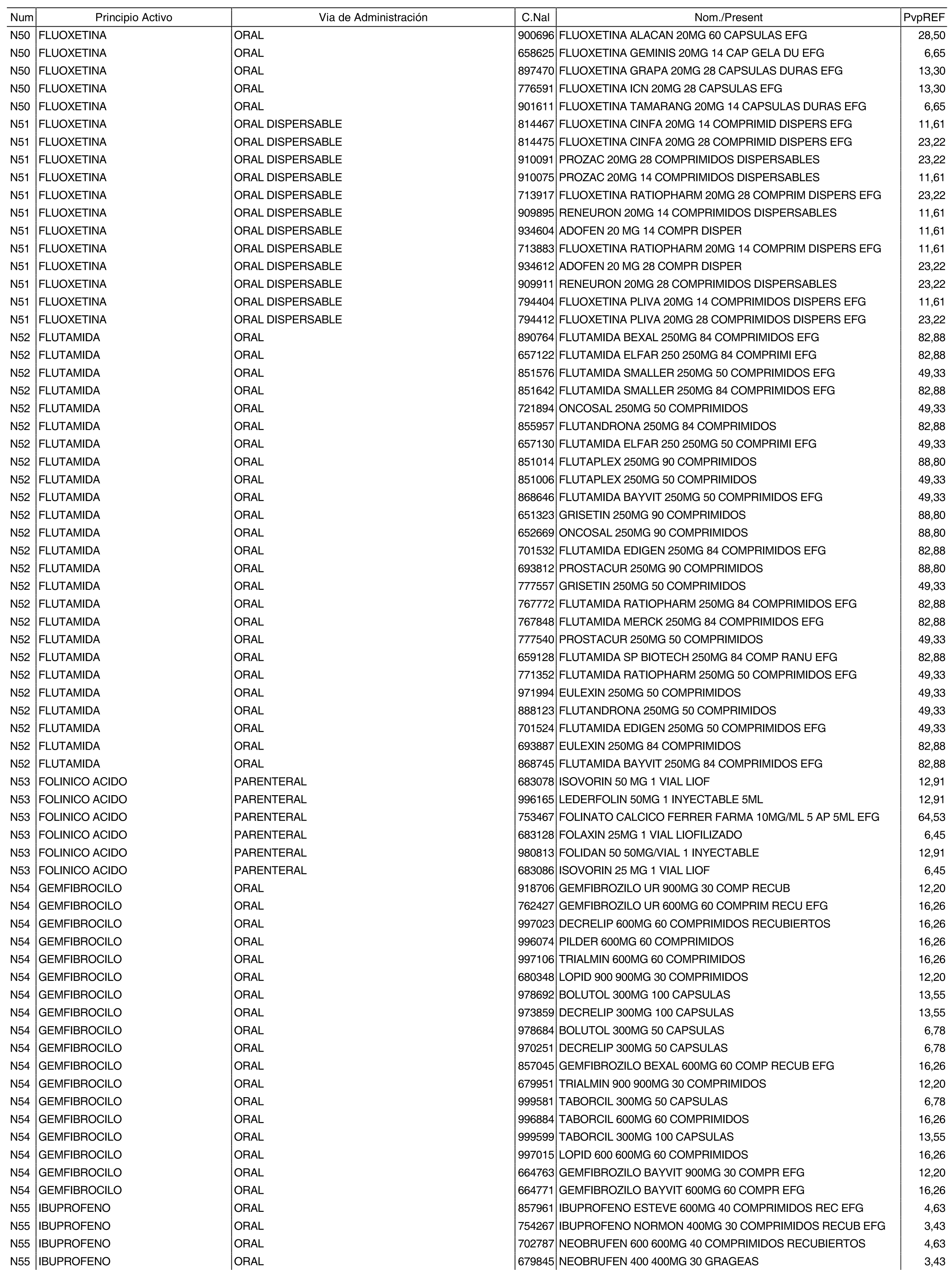
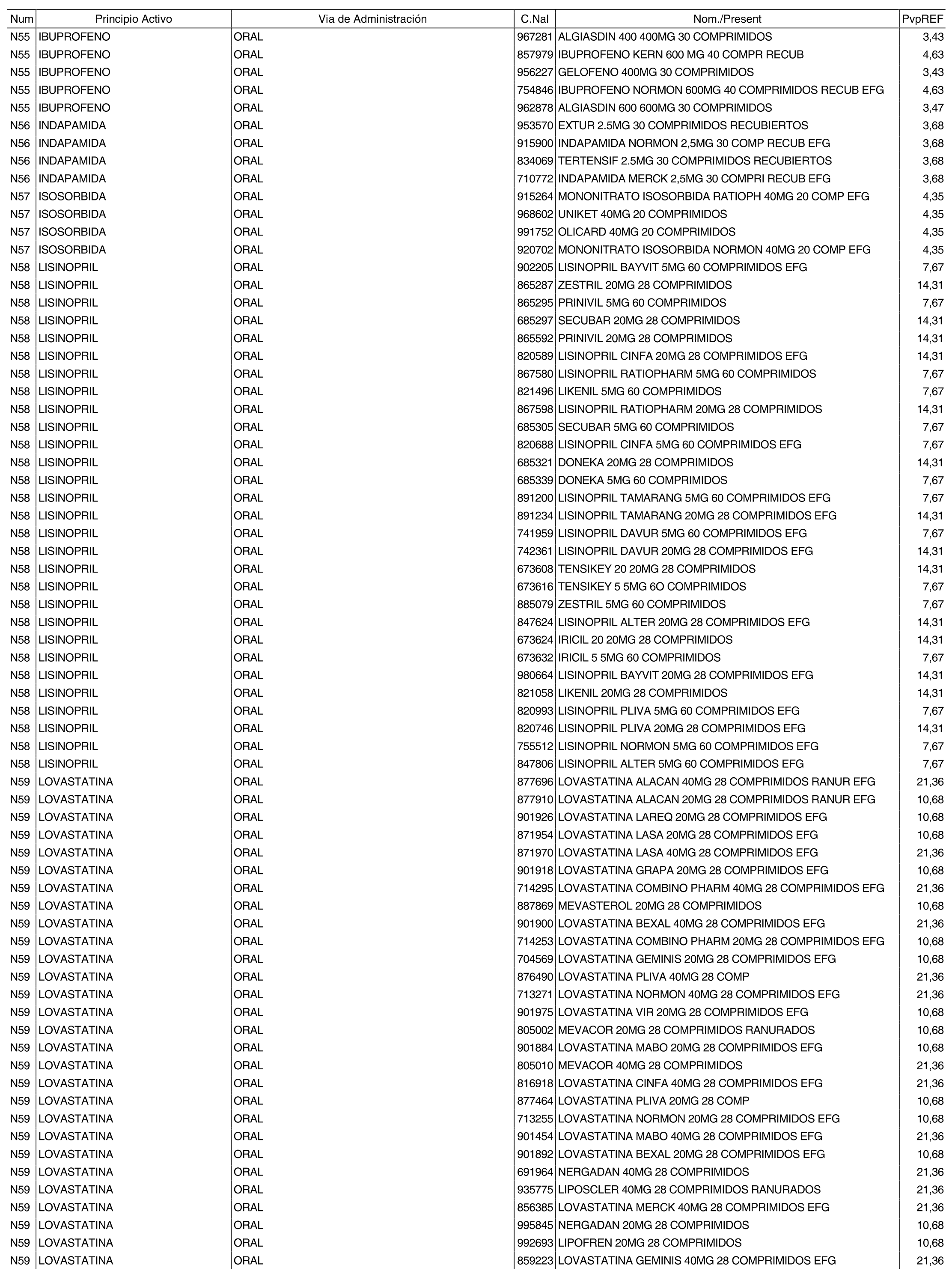
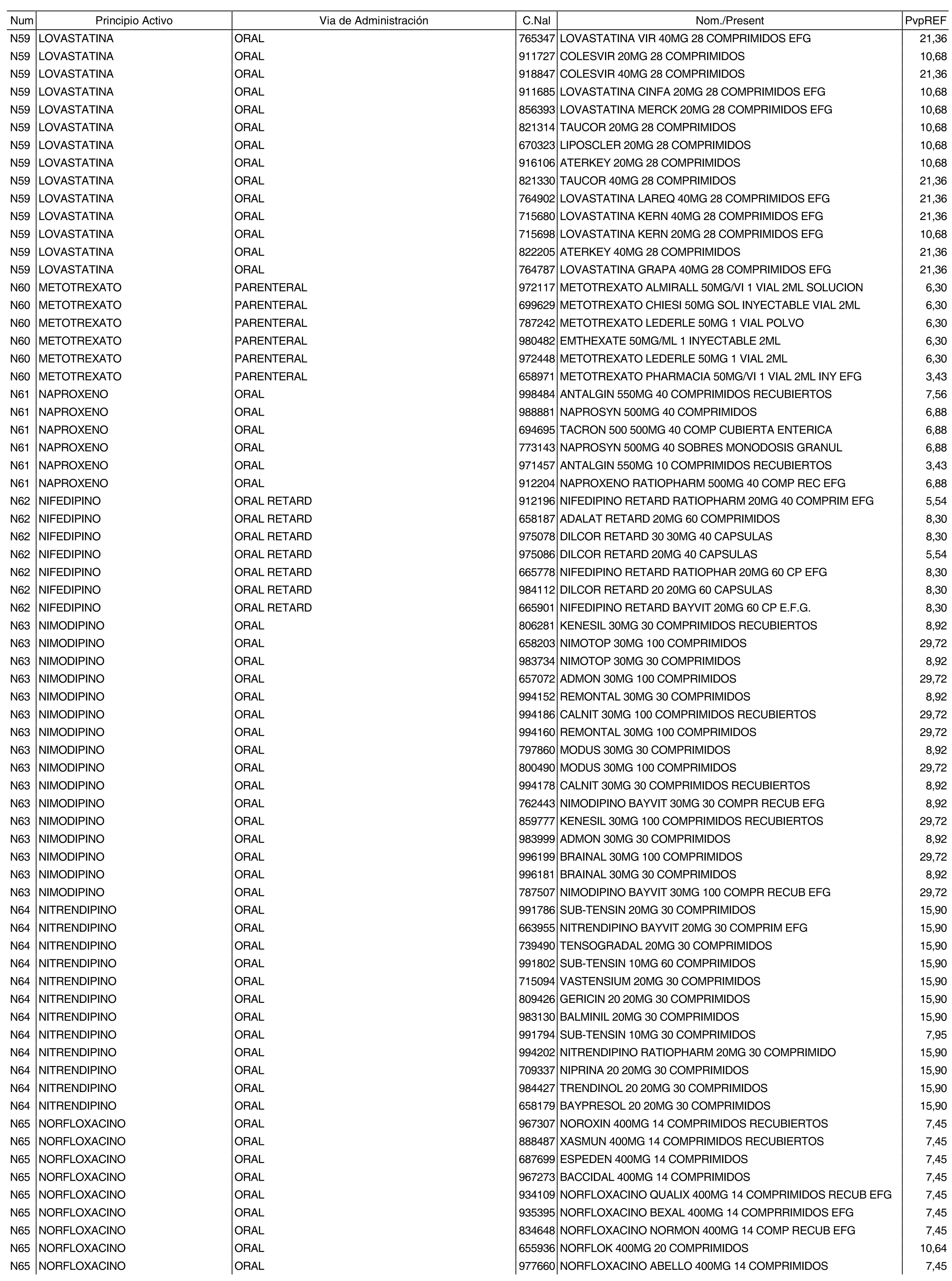
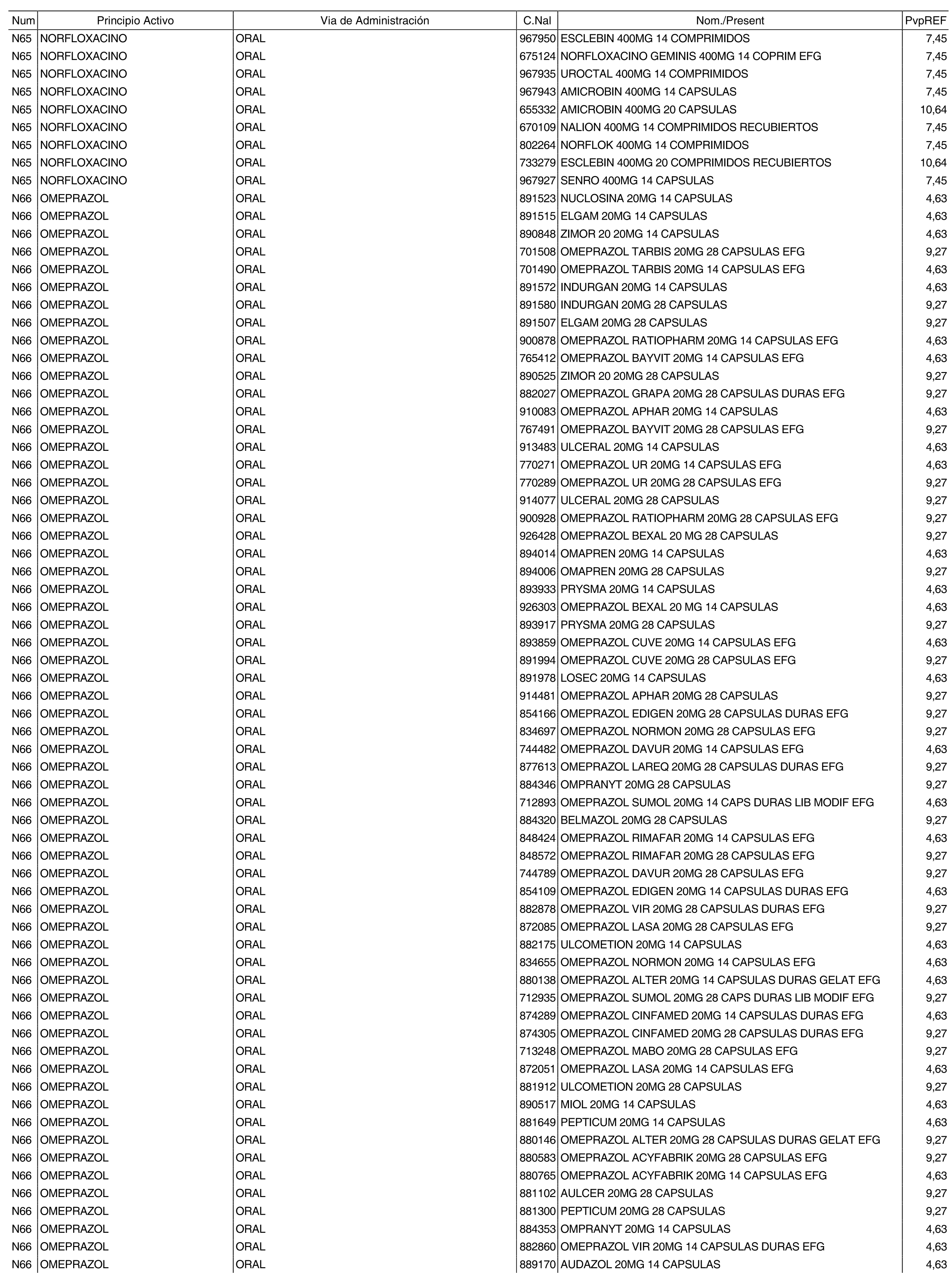
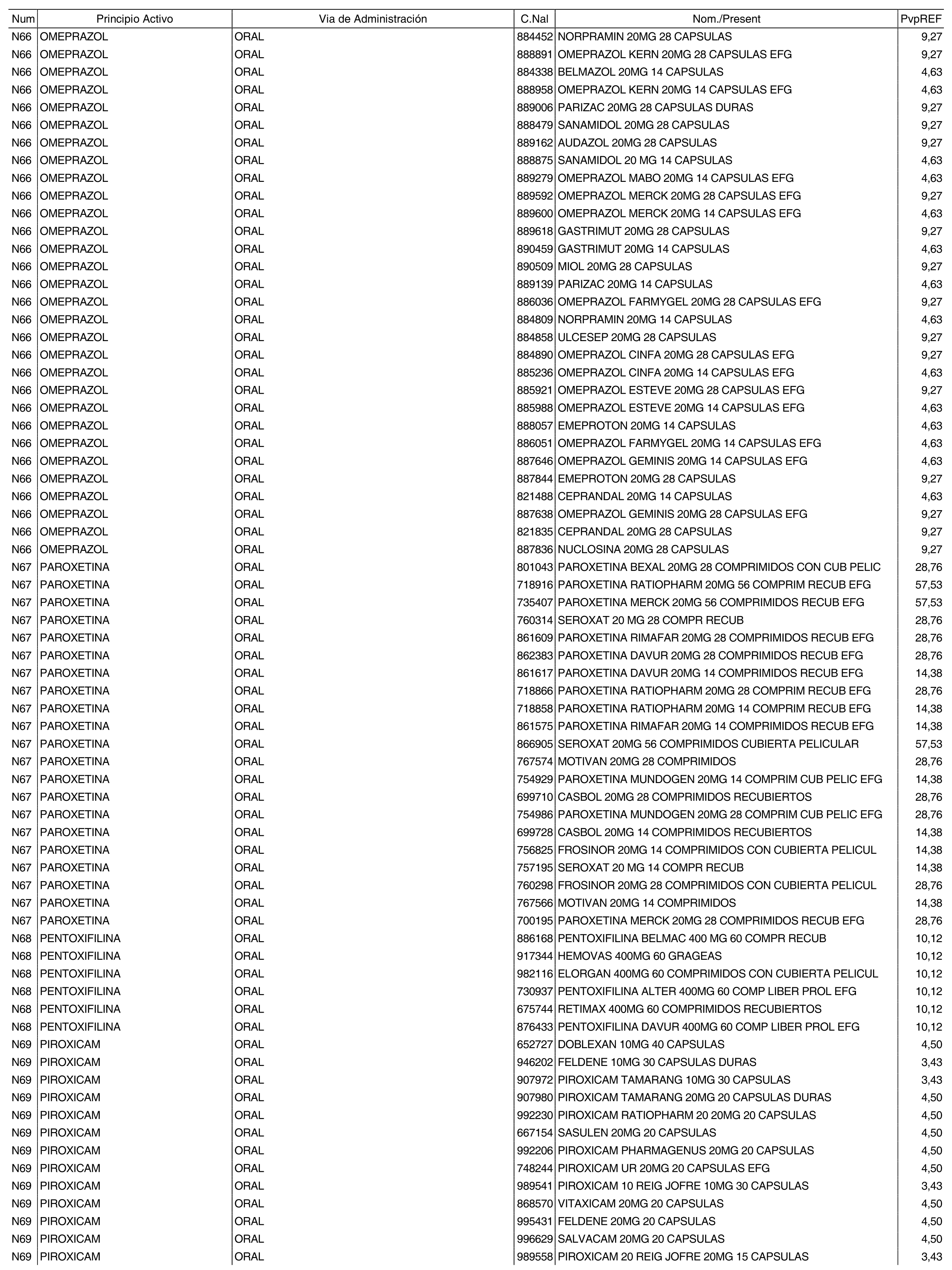
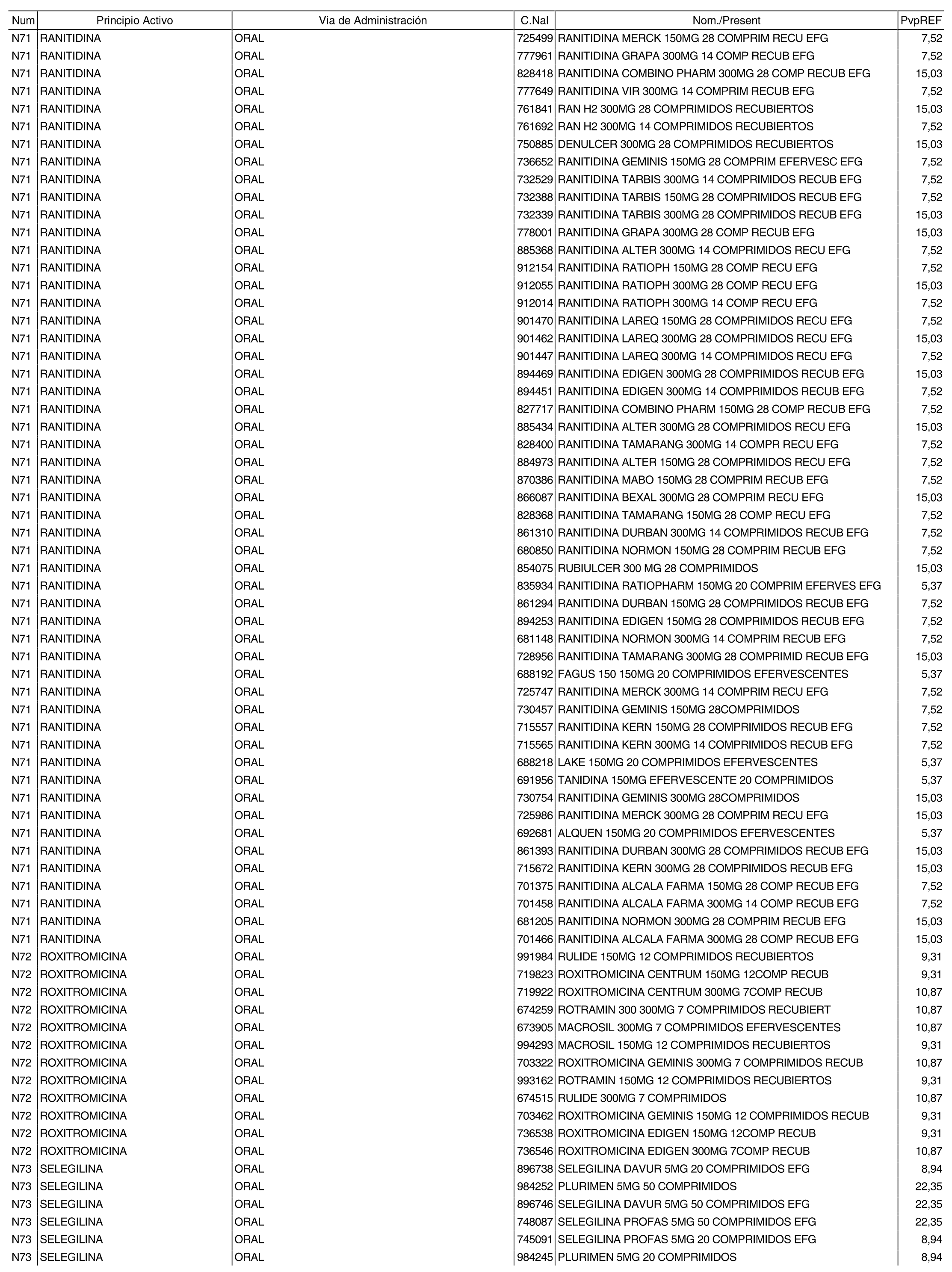
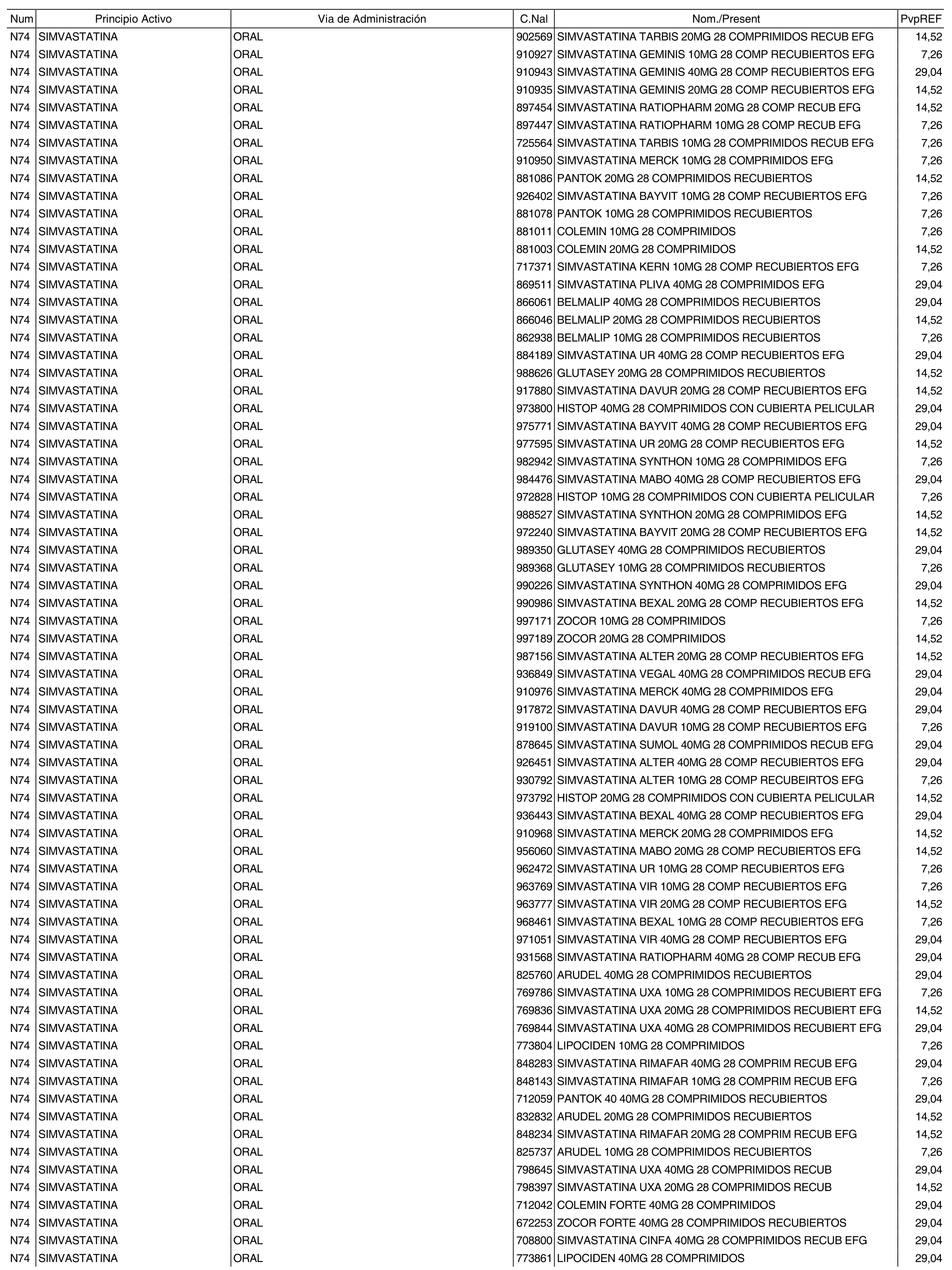
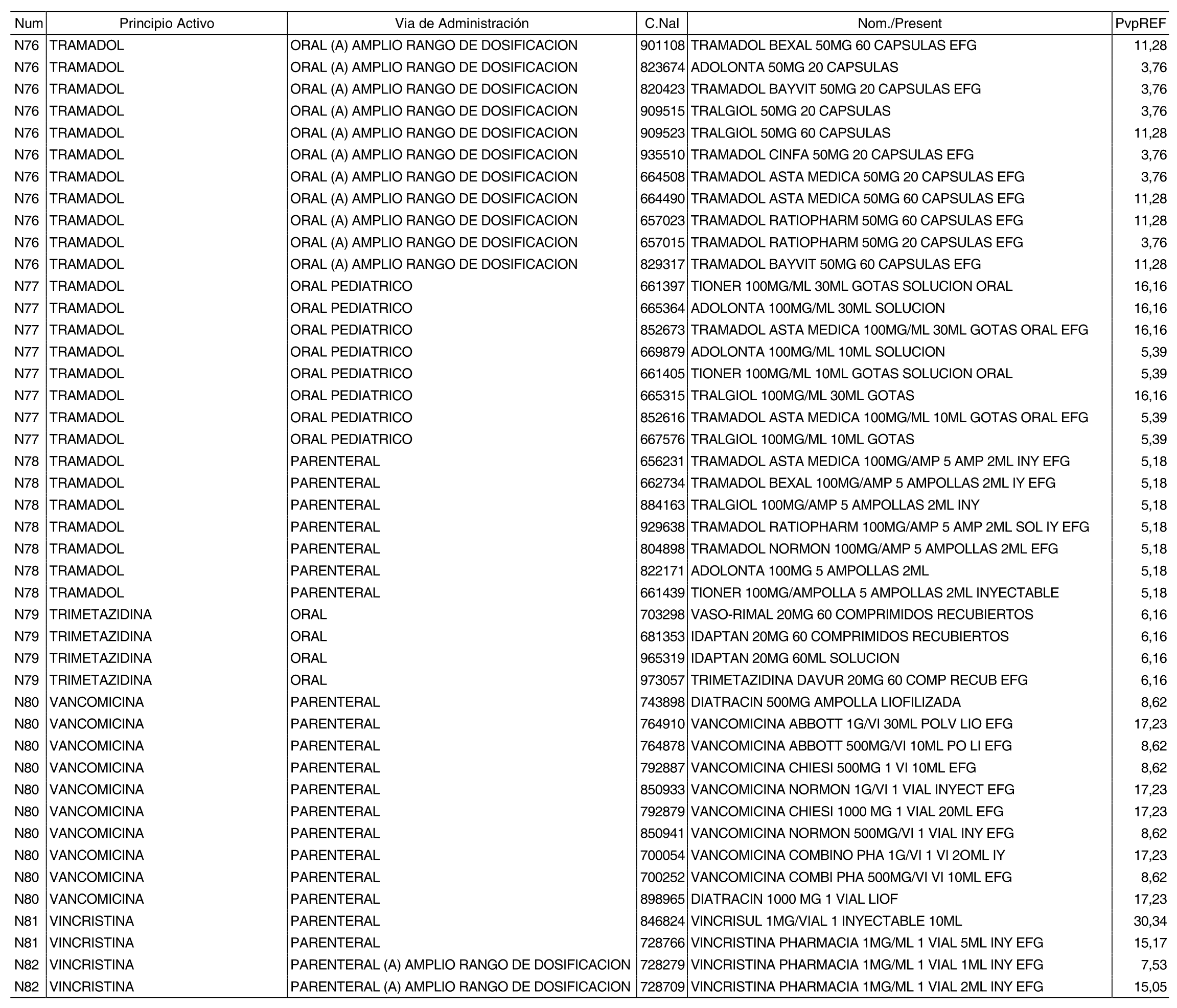
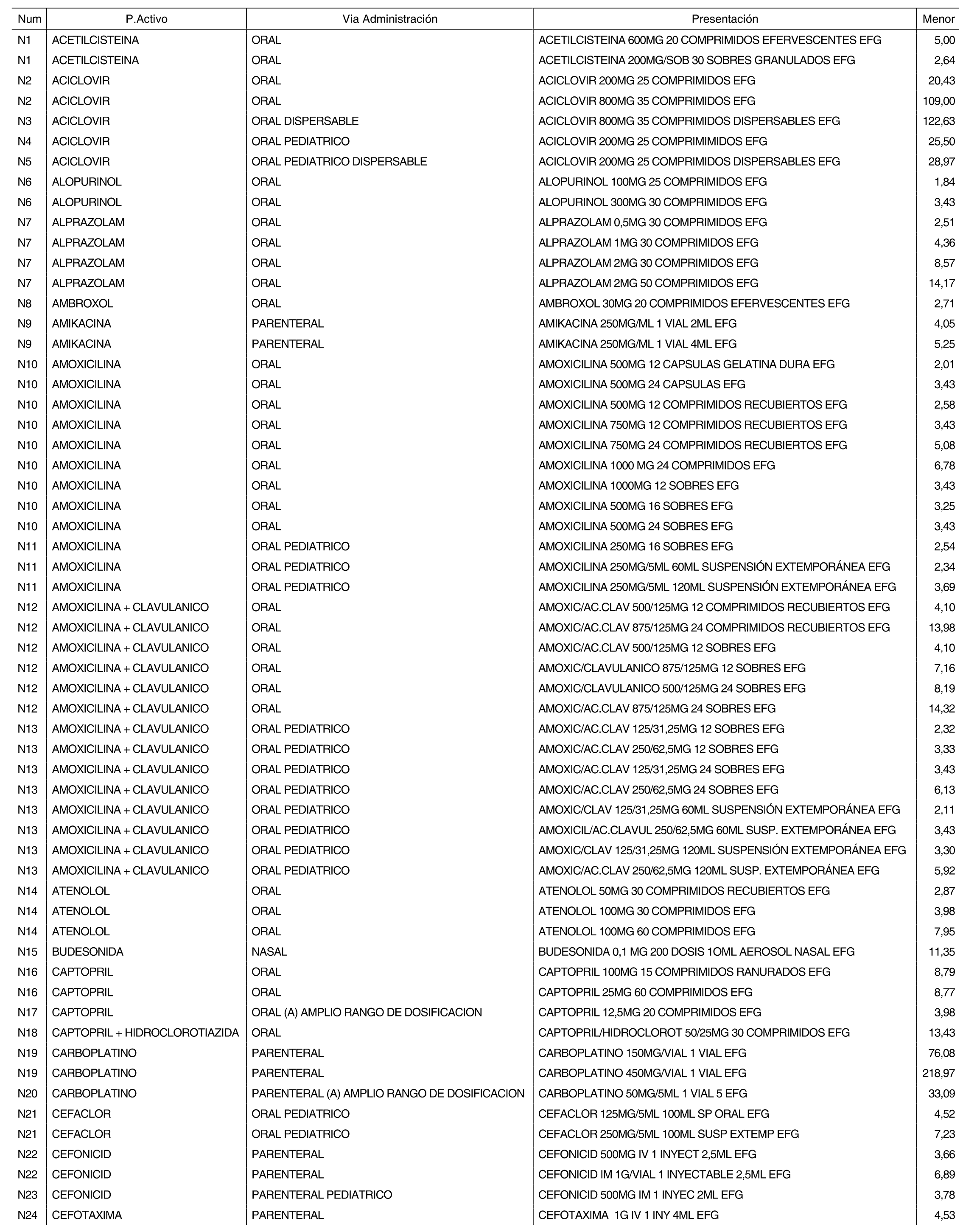
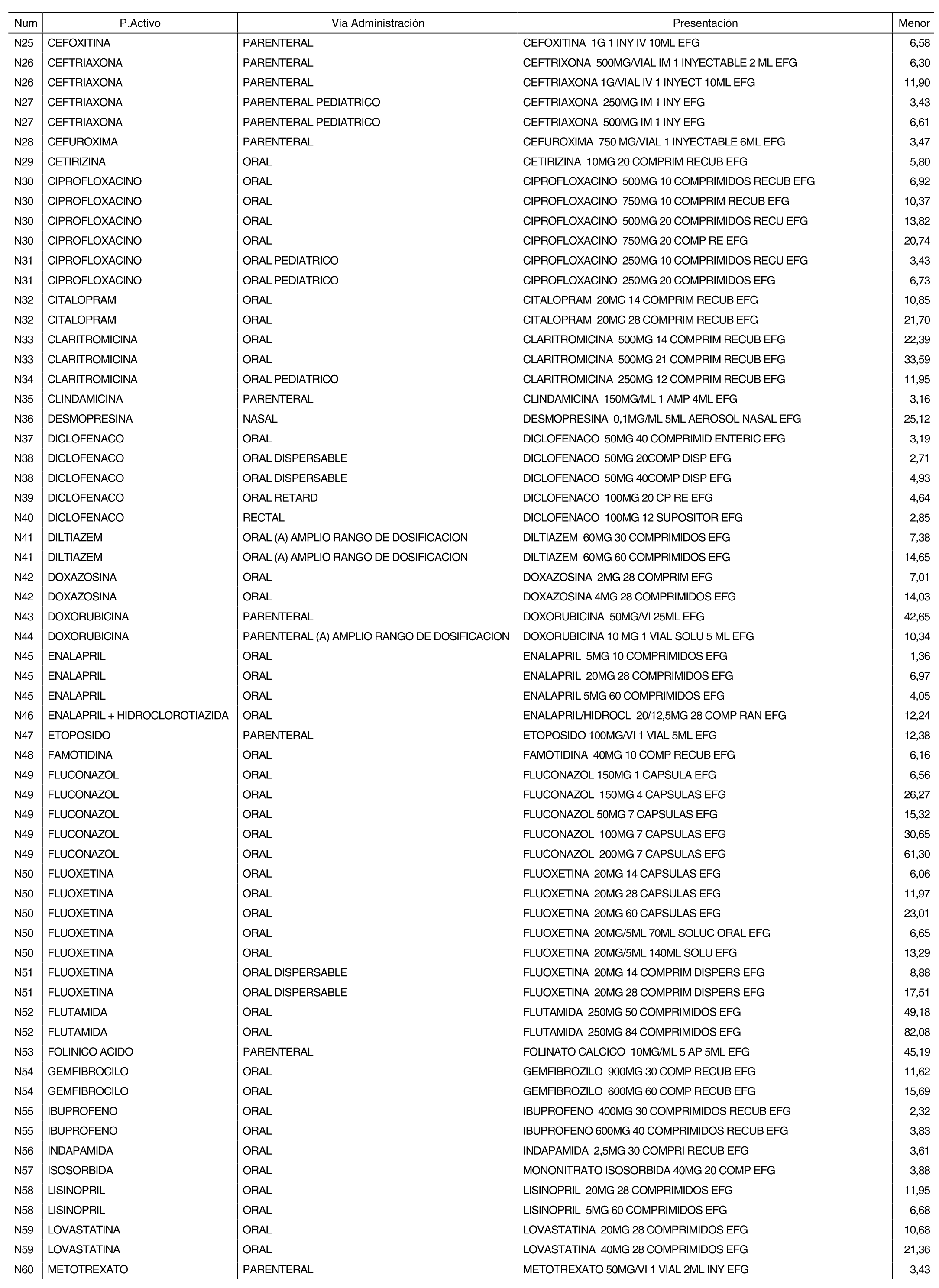
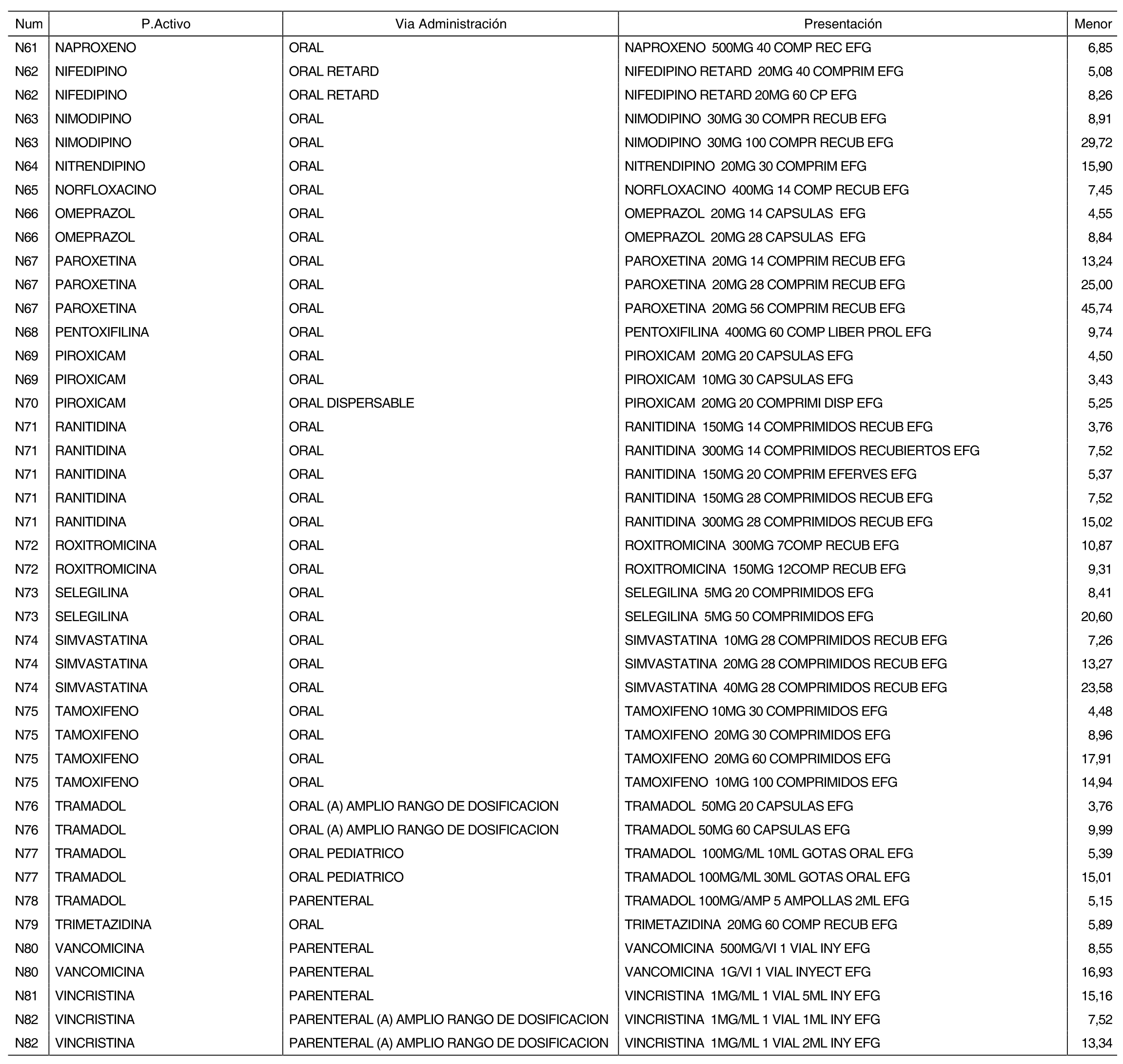
3. A efectos de lo previsto en los párrafos séptimo y octavo del artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, los precios menores correspondientes a distintas presentaciones de especialidades farmacéuticas genéricas, clasificadas por principio activo y vía de administración, son los que se relacionan en el anexo III de la presente Orden. La vigencia de dichos precios se mantendrá hasta la plena efectividad de la Orden que, en su día, revise los precios de referencia aprobados por esta norma.
1. Al objeto de cumplimentar lo dispuesto por el párrafo quinto del apartado 6 del artículo 94 de la Ley 25/1990, de 20 de diciembre, del Medicamento, y con el fin de facilitar el abastecimiento a las oficinas de farmacia, las presentaciones de especialidades farmacéuticas utilizadas para fijar el precio de referencia no deberán tener un precio de venta de laboratorio inferior a 2 euros.
2. Asimismo, a efectos de cumplimentar lo establecido por los apartados 1 y 2 del artículo 3, y en relación con lo dispuesto por el párrafo quinto del apartado 6 del artículo 94, de la Ley 25/1990, de 20 de diciembre, del Medicamento, se fijará un precio de referencia correspondiente a un precio de venta de laboratorio de 2 euros a aquellas presentaciones de especialidades farmacéuticas a las que, como consecuencia de lo establecido en la presente Orden, les corresponda un precio de referencia inferior.
1. En cumplimiento de lo establecido por el párrafo séptimo del artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, el farmacéutico cumplimentará la prescripción realizada por el médico conforme a lo siguiente:
Cuando el médico prescriba una especialidad farmacéutica cuyo precio sea igual o inferior al precio de referencia se dispensará la especialidad farmacéutica prescrita.
Cuando el médico prescriba una especialidad farmacéutica cuyo precio sea superior al precio de referencia y existan especialidades farmacéuticas genéricas de sustitución, se deberá sustituir la especialidad farmacéutica prescrita por la especialidad farmacéutica genérica de menor precio, conforme a los relacionados en el anexo III de la presente Orden.
Cuando el médico prescriba una especialidad farmacéutica cuyo precio sea superior al precio de referencia y no exista una especialidad farmacéutica genérica de sustitución, se dispensará a precio de referencia la especialidad farmacéutica prescrita.
2. Por otra parte, en cumplimiento de lo establecido por el párrafo octavo del artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, el farmacéutico cumplimentará la prescripción realizada por el médico conforme a lo siguiente:
Cuando el médico prescriba por principio activo sometido a precio de referencia, se deberá dispensar la especialidad farmacéutica genérica de menor precio, conforme a los relacionados en el anexo III de la presente Orden. De no existir especialidad farmacéutica genérica de menor precio, el farmacéutico dispensará a precio de referencia la especialidad farmacéutica de marca correspondiente a la prescripción efectuada.
3. En todos los supuestos a los que se refieren los apartados 1 y 2 del presente artículo, la especialidad farmacéutica genérica susceptible de dispensación deberá tener idéntica composición cualitativa y cuantitativa en sustancias medicinales, forma farmacéutica, vía de administración, dosificación y presentación que la especialidad farmacéutica prescrita o la correspondiente a la prescripción por principio activo efectuada.
4. A los efectos establecidos en el presente artículo, se entiende que no existe especialidad farmacéutica genérica de sustitución cuando dicha especialidad no se encuentre disponible en el mercado, o cuando concurriendo la circunstancia mencionada no esté incluida en la prestación farmacéutica de la Seguridad Social.
1. En el plazo de dos meses desde la fecha de entrada en vigor de la presente Orden, las presentaciones de especialidades farmacéuticas genéricas con precio superior al de referencia se suministrarán por los laboratorios al precio industrial que se corresponda con el de referencia.
2. Los laboratorios cumplimentarán, en sus instalaciones centrales, las modificaciones en el cartonaje que se deriven de la exigencia a la que se refiere el apartado anterior, bien utilizando nuevos cartonajes, bien reetiquetando los actuales con etiquetas adhesivas. No se modificará el Código nacional de la especialidad.
1. Los laboratorios que voluntariamente decidan comercializar las presentaciones de especialidades farmacéuticas a un precio inferior al autorizado para adecuarlo a un nivel igual o inferior al de referencia, sin modificar el Código nacional, deberán comunicarlo al Ministerio de Sanidad y Consumo, en el plazo de treinta días a partir de la fecha de entrada en vigor de la presente Orden.
2. Las presentaciones de especialidades farmacéuticas a que se refiere esta Disposición se suministrarán por los laboratorios con el nuevo precio en el plazo de dos meses desde la fecha de entrada en vigor de la presente Orden. Los laboratorios no modificarán el Código nacional de la especialidad farmacéutica y cumplimentarán los cambios del cartonaje en la forma indicada en el apartado 2 de la Disposición adicional primera.
1. Sin perjuicio de que las oficinas de farmacia dispongan de existencias con precios anteriores y posteriores a las reducciones establecidas en las Disposiciones adicionales primera y segunda de la presente Orden, las cantidades que en cada caso corresponda realizar al beneficiario serán satisfechas con base en el precio fijado en el embalaje exterior.
2. Transcurridos dos meses desde la entrada en vigor de la presente Orden, en el ámbito del Sistema Nacional de Salud, así como en los Regímenes Especiales de la Mutualidad General de Funcionarios Civiles del Estado (MUFACE), del Instituto Social de las Fuerzas Armadas (ISFAS) y de la Mutualidad General Judicial (MUGEJU), la aportación del beneficiario se calculará con base en los nuevos precios de facturación.
3. Lo previsto en la presente Disposición se entiende sin perjuicio de lo establecido, en lo relativo a dispensación de especialidades farmacéuticas de marca a precio de referencia, en el artículo 3 de esta Orden.
1. La formalización de la dispensación de presentaciones de especialidades farmacéuticas que se comercialicen a precio superior al de referencia correspondiente y para las que no existe genérico de menor precio y de idéntica composición cualitativa y cuantitativa en sustancias medicinales, forma farmacéutica, vía de administración y dosificación conforme a lo que establecen los párrafos séptimo y octavo del artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, deberá ajustarse, en defecto de acuerdo entre las partes, al procedimiento que se establece en los párrafos siguientes del presente apartado.
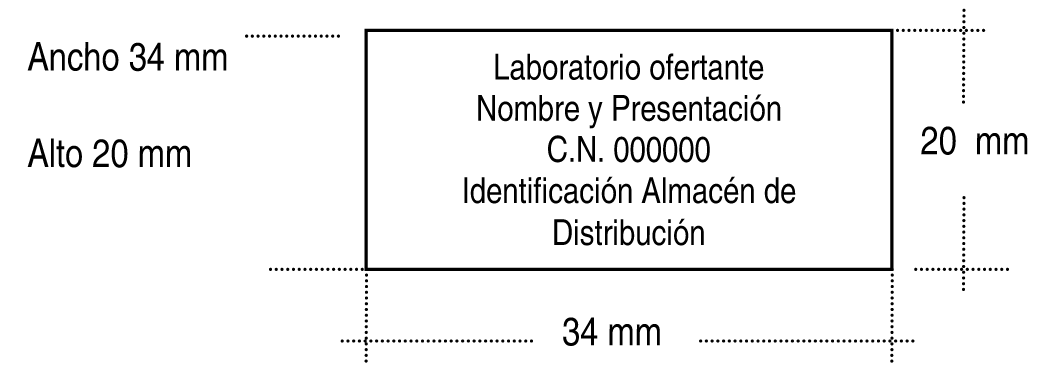
Las especialidades farmacéuticas a que se refiere el párrafo anterior deberán incorporar en su embalaje y en un espacio trepado contiguo al cupón precinto una etiqueta justificativa de la dispensación a precio de referencia, cuyas características se establecen en el anexo IV de la presente Orden, que contendrá información identificativa del Código nacional del formato de la especialidad farmacéutica, del laboratorio responsable de la oferta al Sistema Nacional de Salud, así como del almacén de distribución al que se suministre.
Las recetas oficiales del Sistema Nacional de Salud, así como las de los Regímenes Especiales de la Mutualidad General de Funcionarios Civiles del Estado (MUFACE), del Instituto Social de las Fuerzas Armadas (ISFAS) y de la Mutualidad General Judicial (MUGEJU), relativas a las citadas especialidades farmacéuticas se presentarán de forma separada, para su facturación, al correspondiente Colegio Oficial de Farmacéuticosoa la entidad que realice la facturación y se acompañarán de las mencionadas etiquetas justificativas de dispensación a precio de referencia.
Al objeto de hacer efectiva la devolución contemplada en el párrafo séptimo del artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, las oficinas de farmacia, a través de los respectivos colegios oficiales de farmacéuticos o de la entidad que realice la facturación, remitirán mensualmente las etiquetas justificativas, junto con la acreditación a la que se refiere el párrafo siguiente, a los almacenes de distribución o, en su caso, a los laboratorios. En el supuesto de remisión a los almacenes de distribución, éstos enviarán, en el plazo de diez días desde su recepción, las etiquetas justificativas y la acreditación correspondiente a los laboratorios que comercializan las especialidades farmacéuticas dispensadas. En el plazo de quince días, a contar desde la recepción de la mencionada documentación, los laboratorios abonarán a los almacenes de distribución o, en su caso, a las oficinas de farmacia la diferencia entre el precio de venta de laboratorio autorizado y el que se corresponde con el precio de referencia. En el supuesto de devolución a los almacenes de distribución, éstos, en el plazo de quince días desde la recepción de la diferencia señalada, abonarán a las respectivas oficinas de farmacia la diferencia entre el precio de venta del almacén y el que se corresponde con el precio de referencia.
Los colegios oficiales de farmacéuticos o la entidad que realice la facturación deberán acreditar que el número de etiquetas justificativas enviadas se corresponde con el número de recetas que, de las mismas presentaciones de especialidades farmacéuticas, han sido presentadas para su facturación al Sistema Nacional de Salud así como a los Regímenes Especiales de la Mutualidad General de Funcionarios Civiles del Estado (MUFACE), del Instituto Social de las Fuerzas Armadas (ISFAS) y de la Mutualidad General Judicial (MUGEJU).
Las obligaciones a las que se refieren la disposición adicional primera y el apartado 2 de la disposición adicional octava de la Orden de 13 de julio de 2000, continúan vigentes a todos los efectos.
1. El Sistema Nacional de Salud, así como MUFACE, ISFAS Y MUGEJU, mantendrán, hasta el día 31 de enero de 2004, el precio anterior de las especialidades afectadas por lo establecido en las Disposiciones adicionales primera y segunda, a efectos de facturación y en lo que se refiere, exclusivamente, a la parte del gasto satisfecho directamente por dicho Sistema y por los Regímenes Especiales mencionados.
2. Las facturaciones cerradas a partir del día 1 de febrero de 2004 se liquidarán con los nuevos precios. A partir de esa misma fecha, las facturaciones referidas a especialidades farmacéuticas incluidas en un conjunto y con precio superior al de referencia, y para las que no exista, a efectos de sustitución o dispensación cuando se prescriba por principio activo sometido a precio de referencia, una especialidad farmacéutica genérica de idéntica composición cualitativa y cuantitativa en sustancias medicinales, forma farmacéutica, vía de administración y dosificación a la prescrita, se liquidarán con base en los precios de referencia correspondientes.
3. En el supuesto al que se refieren los apartados 1 y 2 del artículo 3 de la presente Orden, el Sistema Nacional de Salud, así como MUFACE, ISFAS Y MUGEJU, se hará cargo hasta el día 31 de enero de 2004 del pago de la diferencia entre el precio de la especialidad y la aportación que al beneficiario le corresponda satisfacer sobre el precio de referencia.
La presente Orden se dicta al amparo de la competencia estatal en materia de legislación sobre los productos farmacéuticos, de acuerdo con lo dispuesto en el artículo 149.1.1.a y 17.a de la Constitución.
La presente Orden entrará en vigor el día siguiente al de su publicación en el Boletín Oficial del Estado.
Madrid, 23 de octubre de 2003.
PASTOR JULIÁN


Estatuko Aldizkari Ofiziala Estatu Agentzia
Manoteras Etorb., 54 - 28050 Madril