Suscrito el 25 de marzo de 2024 Convenio entre la Agencia Española de Medicamentos y Productos Sanitarios y la Plataforma de Organizaciones de Pacientes, en relación con el fomento del uso seguro y racional de los medicamentos y la confianza en la red reguladora de medicamentos de la Unión Europea, en cumplimiento de lo dispuesto en el artículo 48.8 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, procede la publicación en el «Boletín Oficial del Estado» de dicho convenio, que figura como anexo de esta resolución.
Madrid, 8 de abril de 2024.–El Secretario de Estado de Sanidad, Javier Padilla Bernáldez.
REUNIDOS
De una parte, doña María Jesús Lamas Díaz, Directora de la Agencia Española de Medicamentos y Productos Sanitarios, actuando en nombre y representación de la Agencia Española de Medicamentos y Productos Sanitarios, en virtud de su nombramiento por el Consejo Rector el 19 de julio de 2018 (BOE de 21 de julio de 2018) y del artículo 14.2 f) del Estatuto de la Agencia estatal «Agencia Española de Medicamentos y Productos Sanitarios» aprobado por Real Decreto 1275/2011, de 16 de septiembre.
Y de otra, doña Carina Escobar Manero, Presidenta de la Plataforma de Organizaciones de Pacientes por nombramiento de la Asamblea General Extraordinaria celebrada el 30 de septiembre de 2022.
Ambas partes, que actúan en razón de sus respectivos cargos, se reconocen, mutuamente, la capacidad legal necesaria para la formalización del presente convenio y, a tal efecto,
EXPONEN
Que la Agencia Española de Medicamentos y Productos Sanitarios (en adelante, AEMPS) tiene por objeto «garantizar que tanto los medicamentos de uso humano, como los de uso veterinario y los productos sanitarios, cosméticos y productos de higiene personal cumplan con estrictos criterios de calidad, seguridad, eficacia y correcta información con arreglo a la normativa vigente sobre estas materias en el ámbito estatal y de la Unión Europea», en virtud del artículo 6 del Estatuto de la AEMPS, aprobado por el Real Decreto 1275/2011, de 16 de septiembre.
Que el citado Real Decreto 1275/2011, de 16 de septiembre, establece en su artículo 7 las competencias de la AEMPS, entre las que se encuentran:
Evaluar, autorizar, modificar, renovar, restringir, suspender o revocar la autorización de comercialización de los medicamentos de uso humano y veterinario elaborados industrialmente.
Organizar, coordinar e impartir docencia, promover y realizar proyectos de investigación y proporcionar asesoría científica y técnica, en todos los campos que le son propios.
Promover la información sobre los medicamentos de uso humano destinada a los profesionales sanitarios y al público en general así como autorizar la elaboración y distribución de muestras gratuitas.
Que, además, la AEMPS tiene el interés de establecer formas de colaboración y participación con la ciudadanía y las personas usuarias de sus servicios.
Que, en virtud de lo establecido en el Reglamento (CE) n.º 726/2004 del Parlamento Europeo y del Consejo de 31 de marzo de 2004 por el que se establecen procedimientos comunitarios para la autorización y el control de los medicamentos de uso humano y veterinario y por el que se crea la Agencia Europea de Medicamentos, es necesario establecer una línea de colaboración con los pacientes y consumidores para generar una opinión formada, relevante y útil, como partes interesadas, sobre el procedimiento regulatorio durante todo el ciclo de vida de los medicamentos.
Que, asimismo, es preciso contribuir a una comunicación eficiente y dirigida a los pacientes y consumidores, para apoyar su papel en el uso seguro y racional de los medicamentos y fomentar la confianza en la Red Reguladora de Medicamentos de la Unión Europea, la cual se basa en una red reguladora estrechamente coordinada de autoridades nacionales competentes de los Estados miembros del Espacio Económico Europeo (EEE) que colaboran con la Agencia Europea de Medicamentos (EMA) y la Comisión Europea. Uno de los beneficios que aporta es seguridad a los pacientes, los profesionales sanitarios, la industria y los gobiernos al garantizar normas coherentes y el uso de los mejores conocimientos disponibles.
Que es imprescindible la inclusión del punto de vista de los pacientes y consumidores para lograr una regulación de los medicamentos sostenible y accesible para toda la ciudadanía de la Unión Europea, siendo uno de los pilares de la Estrategia farmacéutica para Europa.
Que dicha estrategia fue adoptada el 25 de noviembre de 2020, la cual pretende crear un marco regulador orientado al futuro y apoyar a la industria en la promoción de la investigación y las tecnologías que llegan a los pacientes para satisfacer sus necesidades terapéuticas, al mismo tiempo que se tratan las deficiencias del mercado. También tendrá en cuenta las deficiencias que la pandemia de coronavirus ha puesto de manifiesto y adoptará las medidas oportunas para reforzar el sistema.
Que los ciudadanos de toda la Unión Europea esperan beneficiarse de igualdad de acceso a terapias seguras, modernas y asequibles. En este sentido, los medicamentos desempeñan un papel importante, puesto que proporcionan opciones terapéuticas para el diagnóstico, el tratamiento y la prevención de enfermedades.
Que la Plataforma de Organizaciones de Pacientes (en adelante, POP) se constituyó en octubre de 2014 en Madrid y, aglutina a las principales entidades que representan a los pacientes, personas con enfermedades crónicas o síntomas cronificados en España.
Que la POP tiene como misión y visión la de promover la participación de los pacientes y defender sus derechos en todos los ámbitos, políticas y actuaciones que afecta a sus vidas y, lograr que la voz y la implicación de los pacientes sean la fuerza para conseguir que los sistemas de salud y sociales, ofrezcan una atención integral y personalizada en condiciones de acceso universal, equidad, transparencia y sostenibilidad.
Que algunas de las líneas estratégicas de acción de la POP son:
Conocimiento e información para la acción: crear condiciones que permitan conocer la situación de los pacientes y sus necesidades a efectos de poder definir las actuaciones necesarias para la mejora de los servicios que se les destinan y disponer de información que permita a los pacientes hacer efectivos sus derechos y gestionar su asistencia.
Fomento del empoderamiento de los pacientes: diseñar actuaciones que permitan que los pacientes gestionen y, en su caso, controlen, su propia salud, mediante acciones que les permitan disponer de los conocimientos y de las capacidades necesarias para convertirlos en pacientes activos corresponsables de su salud y partícipes, en el ejercicio de la autonomía adquirida, en las decisiones compartidas respecto a su asistencia.
Cooperación, colaboración y alianzas: aprovechar las posibilidades de colaboración (y, en su caso, de establecer alianzas), con otras organizaciones (administraciones públicas, empresas, entidades sociales, sociedades científicas, otras organizaciones de pacientes y cuidadores, etc.), nacionales e internacionales, buscando una mayor efectividad en el cumplimiento de su misión y en el desarrollo de sus estrategias, en beneficio de los pacientes.
Que surge la necesidad de establecer fórmulas de cooperación que vinculen a la AEMPS y a la POP, dada la idoneidad de esta organización por su representatividad y por la afinidad de sus misiones u objetivos con los que pretende promover la AEMPS en su relación con la ciudadanía para conseguir fomentar el uso racional de los medicamentos y la confianza en la Red Reguladora de Medicamentos de la Unión Europea, a través de sesiones informativas.
Y en atención a lo expuesto, ambas partes suscriben el mismo en los términos que figuran seguidamente.
CLÁUSULAS
El presente convenio tiene por objeto establecer la colaboración entre la Agencia española de medicamentos y productos sanitarios (AEMPS) y la Plataforma de Organizaciones de Pacientes (POP), en relación al fomento del uso seguro y racional de los medicamentos y la confianza en la Red Reguladora de Medicamentos de la Unión Europea.
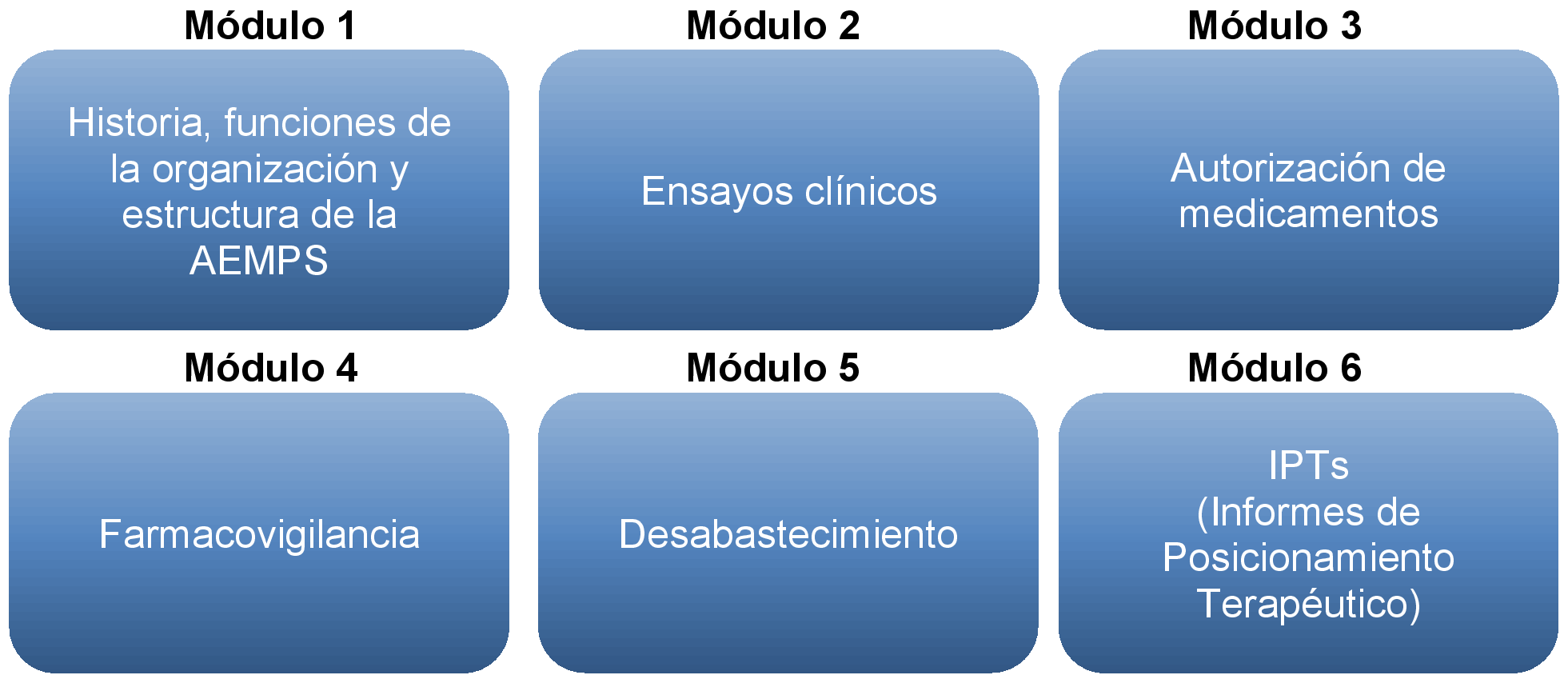
El objetivo es la realización de sesiones informativas con la organización y temática indicadas en el anexo al presente documento. Se ha estimado la celebración de un total de seis sesiones informativas, tres sesiones por año de duración del convenio.
La POP asume los siguientes compromisos:
Colaborar con la AEMPS en el diseño y estructura de los contenidos de las sesiones informativas en línea con lo expuesto en el anexo.
Convocar de las organizaciones interesadas, relacionadas o que sean miembros de POP, informándoles acerca de la fecha y el contenido de cada módulo de la sesión informativa.
Encargarse de facilitar y gestionar la asistencia de los convocados a las sesiones informativas.
Difundir la actividad realizada mediante los oportunos medios de difusión.
Colaborar en todo momento con la AEMPS, de acuerdo con los principios de buena fe y eficacia, realizando los trabajos de forma coordinada y con responsabilidad, para asegurar la correcta ejecución de lo convenido.
Intercambiar la información y los documentos que se consideren necesarios a través de los canales de comunicación que faciliten el desarrollo de los compromisos adquiridos por cada uno de los firmantes.
La cuantificación de los compromisos no dinerarios que asume la POP para la correcta y eficaz ejecución del objeto del convenio, aportando las gestiones y los recursos que sean precisos (Gestión de asistencias, documentación, desplazamientos, difusión, etc…) y, con carácter estimativo, es de una cantidad máxima de 6.150,00 euros, IVA exento al no tratarse de entrega de bienes ni prestación de servicios.
La AEMPS asume los siguientes compromisos:
Compartir con la POP sus conocimientos y experiencia en materia de regulación de medicamentos para preparar las sesiones informativas en este campo.
Realizar el diseño y estructura de los contenidos de las sesiones informativas en línea con lo expuesto en el anexo.
Facilitar un índice de contenidos y los materiales de apoyo necesarios para el desarrollo de la sesión informativa, cuando así fuera necesario.
Difundir las sesiones informativas mediante los oportunos medios de difusión.
Identificar a los ponentes para cada módulo de la sesión informativa.
Poner a disposición el espacio físico y los medios materiales precisos para que la actividad pueda realizarse.
Colaborar en todo momento con la POP para asegurar la correcta ejecución del convenio.
La cuantificación de los compromisos no dinerarios que asume la AEMPS para la correcta y eficaz ejecución del objeto del convenio, aportando las gestiones y los recursos que sean precisos (reserva de espacios de salas, número de personas/hora, material, etc.) y, con carácter estimativo, es de una cantidad máxima de 8.550,00 euros, IVA exento al no tratarse de entrega de bienes ni prestación de servicios.
Se crea una comisión de seguimiento del presente convenio que, además de resolver las posibles dudas que sobre interpretación puedan surgir durante el desarrollo del convenio, vigilará y controlará las actuaciones descritas.
Se someterán a la comisión de seguimiento las discrepancias que pudieran surgir en la interpretación y cumplimiento del presente convenio.
El régimen de funcionamiento de esta comisión, seguirá lo previsto para los órganos colegiados en la sección tercera del capítulo II del título preliminar de la Ley 40/2015, de 1 de octubre.
La comisión de seguimiento se reunirá siempre que lo estime conveniente cualquiera de las partes firmantes. Estas reuniones se podrán realizar por medios electrónicos.
La comisión de seguimiento estará formada por los siguientes miembros:
Por parte de la AEMPS:
– La persona titular del puesto de Jefe del Departamento de medicamentos de uso humano o persona en quien delegue, que ejercerá la presidencia de la comisión.
– La persona titular del puesto de Jefe de la División de evaluación y farmacología clínica del Departamento de medicamentos de uso humano o persona en quien delegue, que ejercerá la secretaría de la comisión.
Por parte de la POP:
– La persona titular del puesto de Presidenta o persona en quien delegue.
– La persona titular del puesto de Director General o persona en quien delegue.
La firma del presente convenio no conlleva compromisos económicos para las partes.
El presente convenio se perfeccionará por la prestación del consentimiento de las partes y resultará eficaz una vez inscrito en el Registro Electrónico Estatal de Órganos e Instrumentos de Cooperación del sector público estatal, en el plazo de cinco días hábiles desde su formalización, y será objeto de publicación en el «Boletín Oficial del Estado» (BOE), en el plazo de diez días hábiles desde su formalización. Tendrá una duración de dos años desde su inscripción.
Podrá prorrogarse mediante acuerdo expreso por un máximo de dos años.
Como norma general, la propiedad intelectual e industrial derivada de los resultados obtenidos de este convenio, serán de titularidad exclusiva de cada firmante que haya intervenido en su resultado. Ambas partes firmantes serán coautores en el caso en el que, dicho resultado, hayan intervenido conjuntamente.
Los firmantes del convenio podrán proponer la revisión de las condiciones establecidas en el mismo, en cualquier momento de su duración, a efectos de incluir las modificaciones que resulten pertinentes, con la firma de una adenda de modificación al convenio.
El incumplimiento de las obligaciones y compromisos asumidos por parte de alguno de los firmantes dará lugar a la resolución del presente convenio de conformidad con el apartado segundo, letra c), de la cláusula décima, además de la correspondiente indemnización por los daños y perjuicios causados.
Para determinar la cuantía de la indemnización por daños y perjuicios se tendrán en cuenta los gastos en los que hayan incurrido las partes no incumplidoras en la elaboración, ejecución y resolución de este convenio debidamente justificados con los documentos pertinentes.
El convenio se extingue por el cumplimiento de las actuaciones que constituyen su objeto o por incurrir en causa de resolución.
Son causas de resolución:
a) El transcurso del plazo de vigencia del convenio sin haberse acordado la prórroga del mismo.
b) El acuerdo unánime de todos los firmantes.
c) El incumplimiento de las obligaciones y compromisos asumidos por parte de alguno de los firmantes.
En este caso, cualquiera de las partes podrá notificar a la parte incumplidora un requerimiento para que en el plazo de siete días, cumpla con las obligaciones o compromisos que se consideran incumplidos. Este requerimiento será comunicado a la otra parte firmante.
Si trascurrido el plazo indicado en el requerimiento persistiera el incumplimiento, la parte que lo dirigió notificará a la otra parte firmante la concurrencia de la causa de resolución y se entenderá resuelto el convenio. La resolución del convenio por esta causa conllevará la indemnización de los perjuicios causados en base al incumplimiento ocasionado conforme las normas establecidas en la cláusula octava de este documento.
d) Por decisión judicial declaratoria de la nulidad del convenio.
e) Por fuerza mayor o la imposibilidad sobrevenida del cumplimiento de su objeto.
f) Por cualquier otra causa distinta de las anteriores prevista en otras leyes.
En cualquier caso y, a tenor del apartado 3, del artículo 52 de la Ley 40/2015, si cuando concurra cualquiera de las causas de resolución del convenio existen actuaciones en curso de ejecución, las partes, a propuesta de la comisión de seguimiento del convenio, podrán acordar la continuación y finalización de las actuaciones en curso que consideren oportunas, estableciendo un plazo improrrogable para su finalización, transcurrido el cual deberá realizarse la liquidación de las mismas.
El presente convenio tiene naturaleza administrativa, y es uno de los definidos en el artículo 47 de la Ley 40/2015, de 1 de octubre, y se encuentra, por consiguiente, sometido al régimen jurídico que dicha norma establece para los convenios.
Las partes se comprometen a resolver pacíficamente cualquier conflicto que pudiera surgir en la interpretación y ejecución del presente convenio. Las posibles controversias que pudieran suscitarse entre las partes, serán sometidas a la comisión de seguimiento prevista en el presente convenio, siendo la jurisdicción contencioso-administrativa la competente para resolver las controversias que pudieran surgir en la interpretación y aplicación del convenio, en último extremo.
Y en prueba de conformidad de cuanto antecede, firman el presente convenio en un único original electrónico en la última fecha de la firma electrónica. Por la Agencia Española de Medicamentos y Productos Sanitarios, la Directora, María Jesús Lamas Díaz.–Por la Plataforma de Organizaciones de Pacientes, la Presidenta, Carina Escobar Manero.
| Actividad | POP | AEMPS |
|---|---|---|
| Descripción del programa. | √ | √ |
| Ponentes. | √ | |
| Convocatoria a organizaciones. | √ | |
| Desplazamiento organizaciones. | √ | |
| Comunicación de la actividad. | √ | √ |
| Sala para la formación. | √ |
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid