El artículo 93 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, establece el sistema de precios de referencia en la financiación pública de medicamentos. Sistema que, como elemento esencial de control del gasto farmacéutico, aparece reforzado a raíz de las modificaciones introducidas por el Real Decreto-ley 9/2011, de 19 de agosto, de medidas para la mejora de la calidad y cohesión del Sistema Nacional de Salud, de contribución a la consolidación fiscal, y de elevación del importe máximo de los avales del Estado para 2011, constituyéndose como medida de control económico sobre los medicamentos sujetos a la financiación pública, necesaria para la sostenibilidad del sistema sanitario.
El precepto legal encomienda al titular de la Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad, Política Social e Igualdad a que, mediante resolución motivada y previo informe favorable de la Comisión Interministerial de Precios de los Medicamentos, determine los nuevos conjuntos y sus precios de referencia, así como revise los que ya estuvieran creados.
Según el apartado 2.º del artículo 93 citado, se entiende por conjunto la totalidad de las presentaciones de medicamentos financiadas que tengan el mismo principio activo e idéntica vía de administración entre las que existirá incluida en la prestación farmacéutica del Sistema Nacional de Salud, al menos una presentación de medicamento genérico o de medicamento biosimilar. Asimismo, las presentaciones indicadas para tratamientos en pediatría, así como las correspondientes a medicamentos de ámbito hospitalario, constituirán conjuntos independientes. Con ello, y a efectos de controlar el gasto farmacéutico producido en la prestación farmacéutica del Sistema Nacional de Salud, la Ley permite la creación de nuevos conjuntos de medicamentos, sean o no sustituibles entre sí, encontrándose las garantías de la dispensación de medicamentos en el artículo 85, en relación con la disposición adicional decimocuarta.
Ese mismo apartado 2.º del artículo 93 prevé que el precio de referencia, entendido como precio máximo de financiación pública, será, para cada conjunto, el coste/tratamiento/día menor de las presentaciones de medicamentos en él agrupadas por cada vía de administración, calculados según la dosis diaria definida, razón por la que se hace necesario fijar los conjuntos y sus respectivos precios de referencia.
Igualmente, el artículo 93 precisa en su apartado 3.º que la determinación de nuevos conjuntos y sus precios de referencia, así como la revisión de los precios de referencia de los conjuntos ya determinados, se realizará a la mayor brevedad posible, y como mínimo una vez al año, por lo que se concluye que resulta pertinente hacer uso de la facultad otorgada por el citado artículo.
Por otra parte, y de acuerdo con el último inciso del párrafo primero del apartado 2 del artículo 93, podrán crearse conjuntos desde el momento en que hayan transcurrido diez años desde la fecha de la autorización inicial de comercialización del medicamento de referencia en España, u once en el caso de haber sido autorizada una nueva indicación.
En consecuencia, mediante esta Resolución se procede, a efectos de dar cumplimiento a lo dispuesto por el citado artículo 93 de la Ley 29/2006, de 26 de julio, en lo referente a medicamentos no considerados de ámbito hospitalario, a la determinación de los conjuntos de medicamentos que vayan a ser dispensados en las oficinas de farmacia mediante receta médica oficial u orden de dispensación y sus precios de referencia, así como a la revisión de los precios de referencia determinados en la Orden SPI/3052/2010, de 26 de noviembre.
En otro aspecto, en el punto 2 de la presente resolución se hace referencia a aquellas nuevas presentaciones de medicamentos que, por haber sido declaradas innovaciones galénicas, quedarán excluidas del sistema de precios de referencia, en aplicación de lo dispuesto en el artículo 93.5 de la Ley 29/2006, de 26 de julio, en relación con el artículo 5 de la Orden SPI/3052/2010, de 26 de noviembre.
Igualmente, y conforme a esos mismos artículos, teniendo en cuenta que existen determinadas presentaciones de medicamentos cuya declaración como innovación galénica expirará en el plazo de los doce meses siguientes desde que la presente Resolución tenga efectos, en el punto 3 se facilita su incorporación al sistema de precios de referencia.
Esta Resolución incorpora, además, a efectos de la formación de determinados conjuntos, cuatro presentaciones de medicamentos genéricos sometidas a medida cautelar de inmovilización como consecuencia de resolución judicial dictada en procedimiento relativo a la protección de derechos de propiedad industrial. Estos conjuntos no producirán efectos hasta que se incluya en los mismos una presentación de medicamento genérico comercializada no afectada por medida cautelar de inmovilización, o se notifique, por parte del Tribunal o Juzgado al Ministerio de Sanidad, Servicios Sociales e Igualdad, la sentencia firme que desestime las pretensiones del titular de la patente del medicamento o el auto por el que se dejen sin efecto las medidas cautelares de inmovilización del medicamento genérico, para lo cual se ha consignado la correspondiente anotación en el Nomenclátor oficial de productos farmacéuticos del Sistema Nacional de Salud. Si la resolución judicial es favorable a los intereses del titular del medicamento genérico, o se produce la incorporación de una presentación de medicamento genérico comercializada no sometida a medidas cautelares de inmovilización, las anotaciones serán suprimidas. En caso contrario, los conjuntos permanecerán inactivos hasta que sean suprimidos, en su caso, por la resolución de revisión correspondiente.
La presente Resolución ha obtenido el previo informe favorable de la Comisión Interministerial de Precios de los Medicamentos.
Por lo expuesto, en desarrollo de la previsión contenida en el artículo 93 de la Ley 29/2006, de 26 de julio, y de acuerdo con las atribuciones dadas a esta Dirección General en virtud del artículo 10 del Real Decreto 263/2011, de 28 de febrero, por el que se desarrolla la estructura orgánica básica del Ministerio de Sanidad Política Social e Igualdad, resuelvo:
1. Conjuntos y precios de referencia
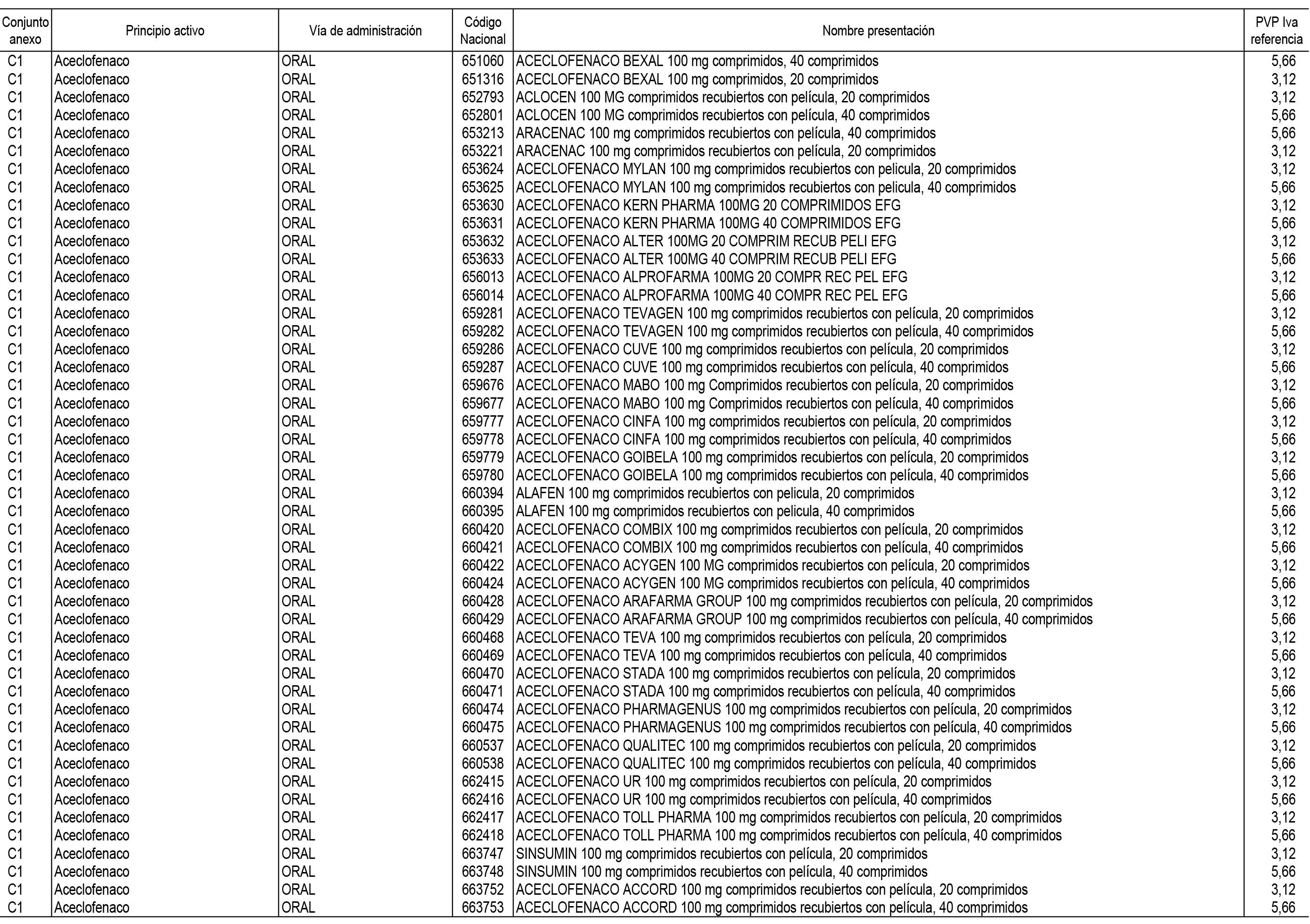
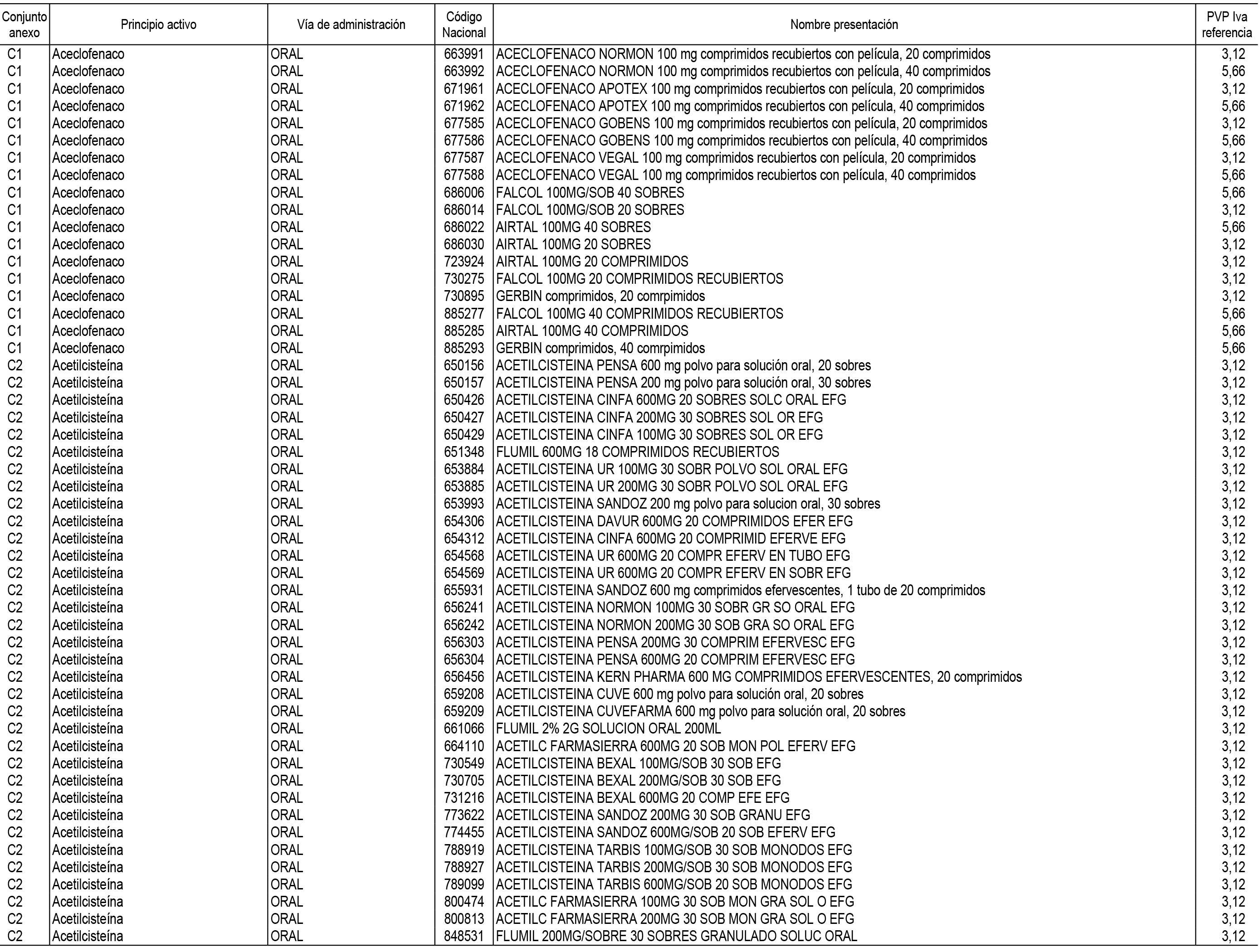
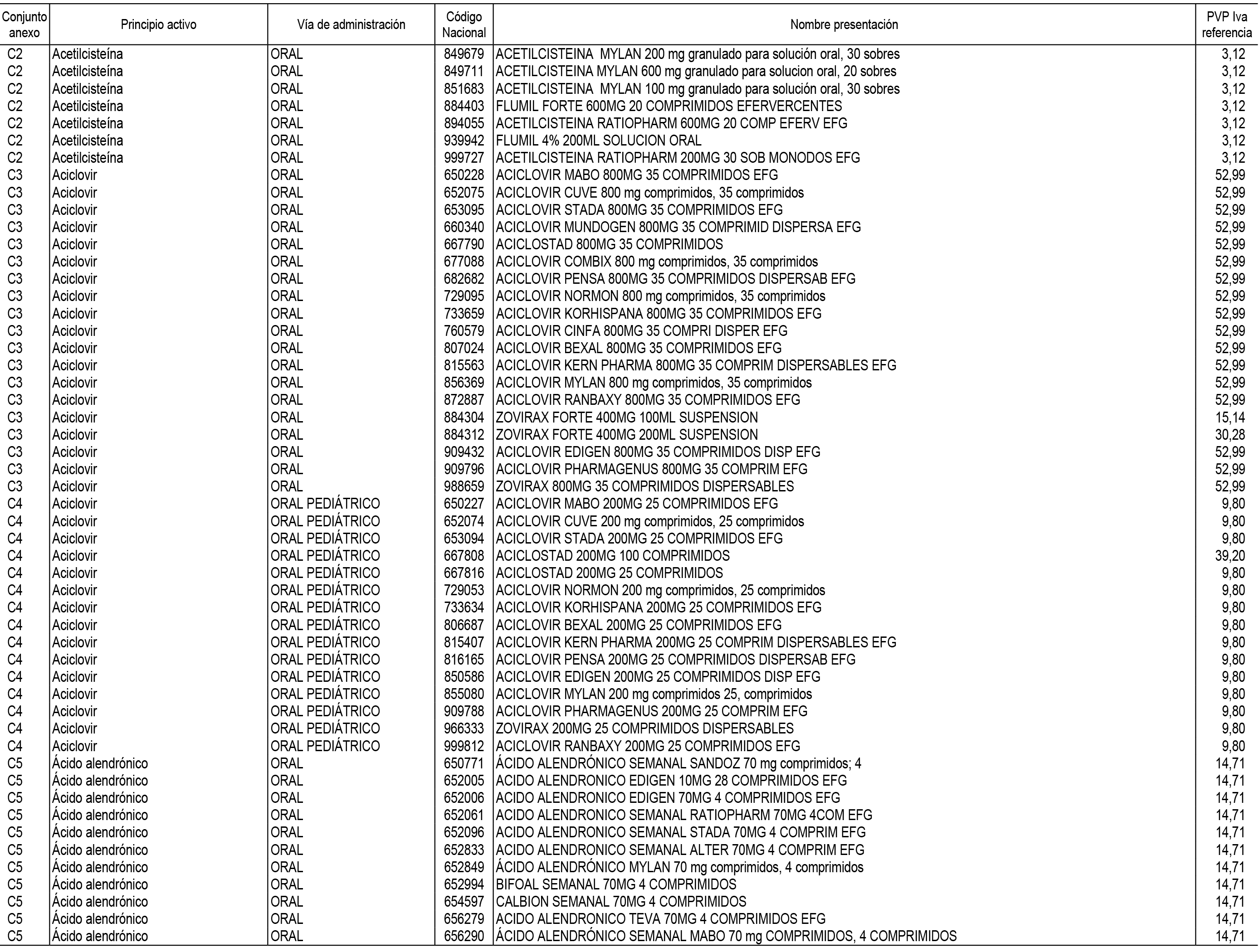
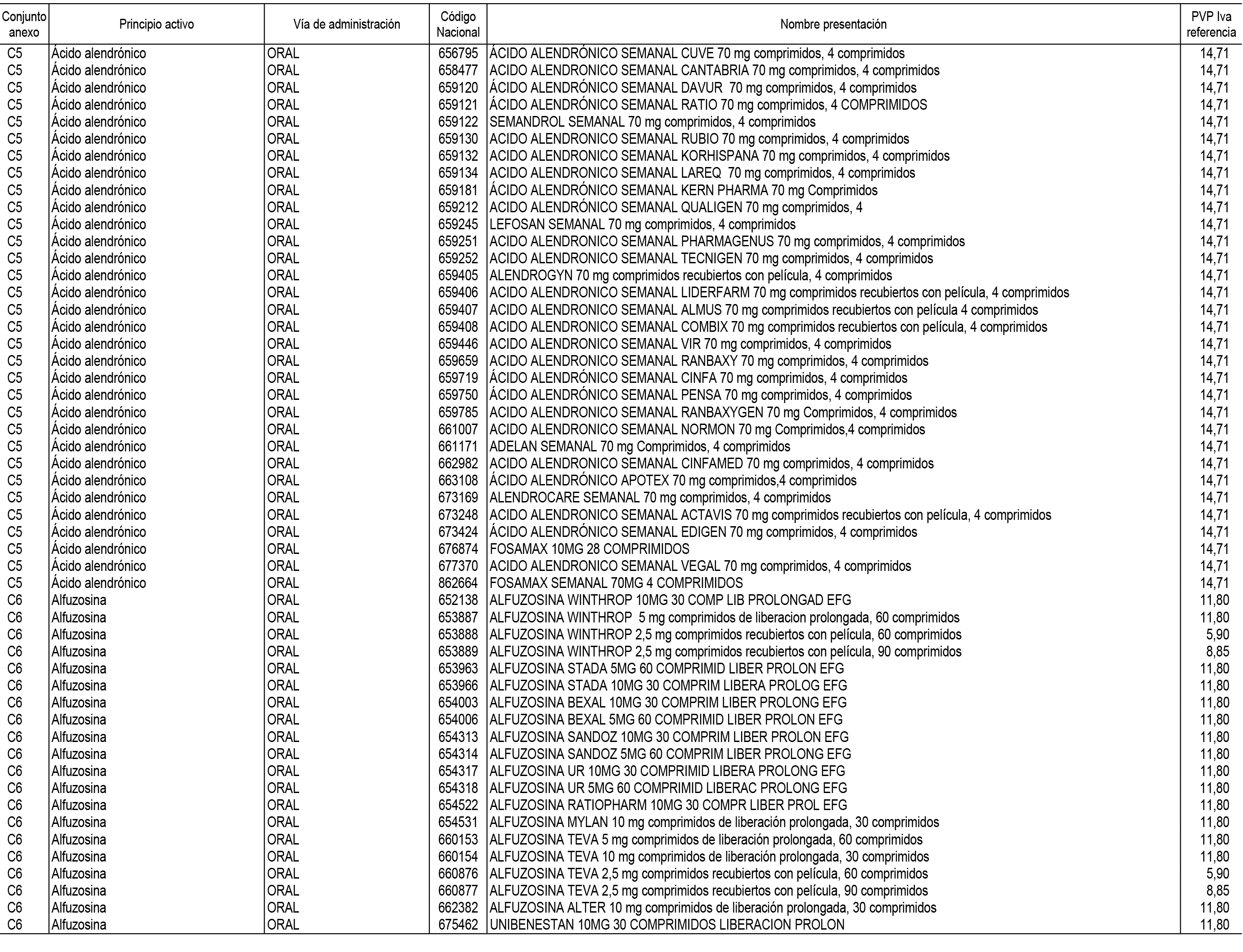
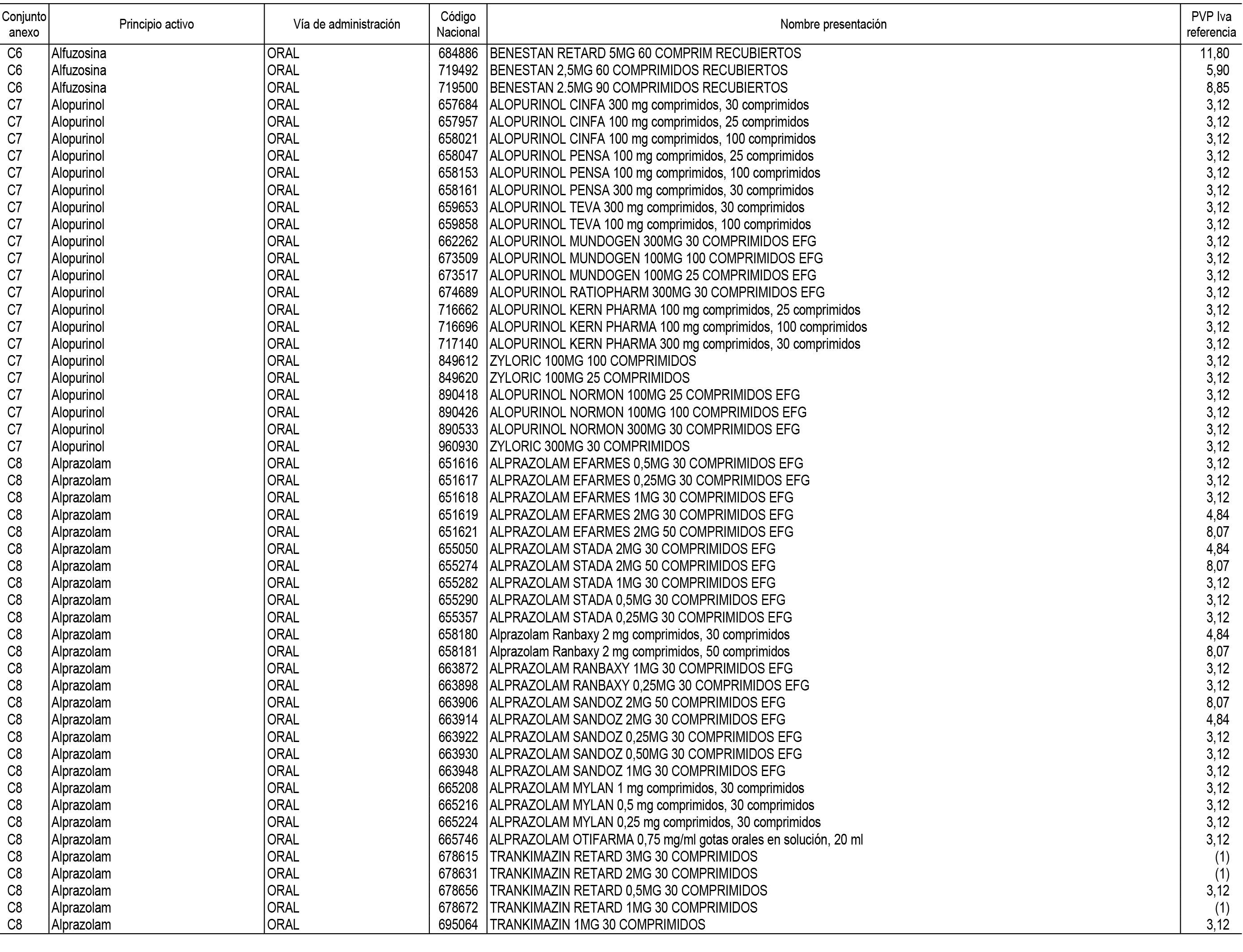
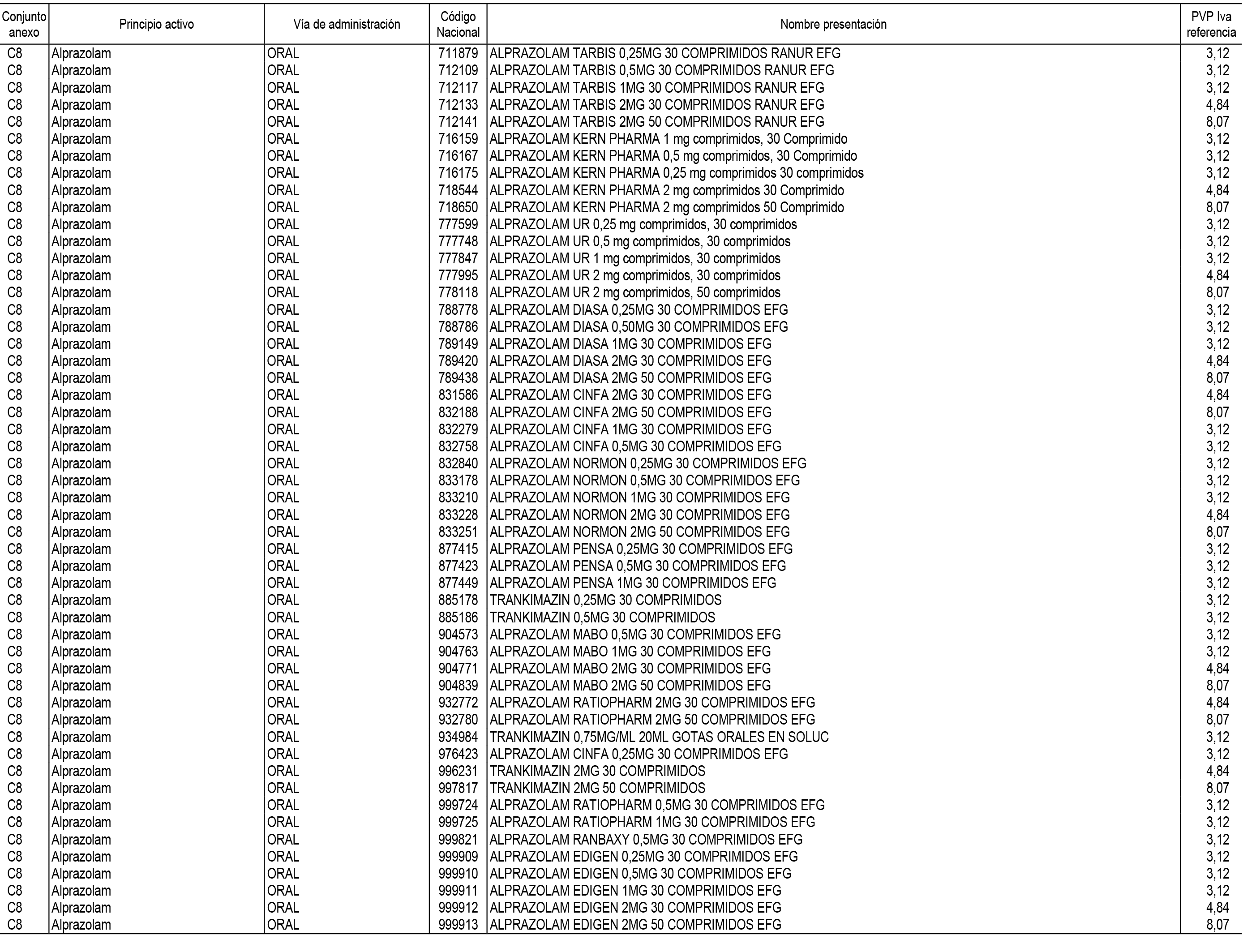
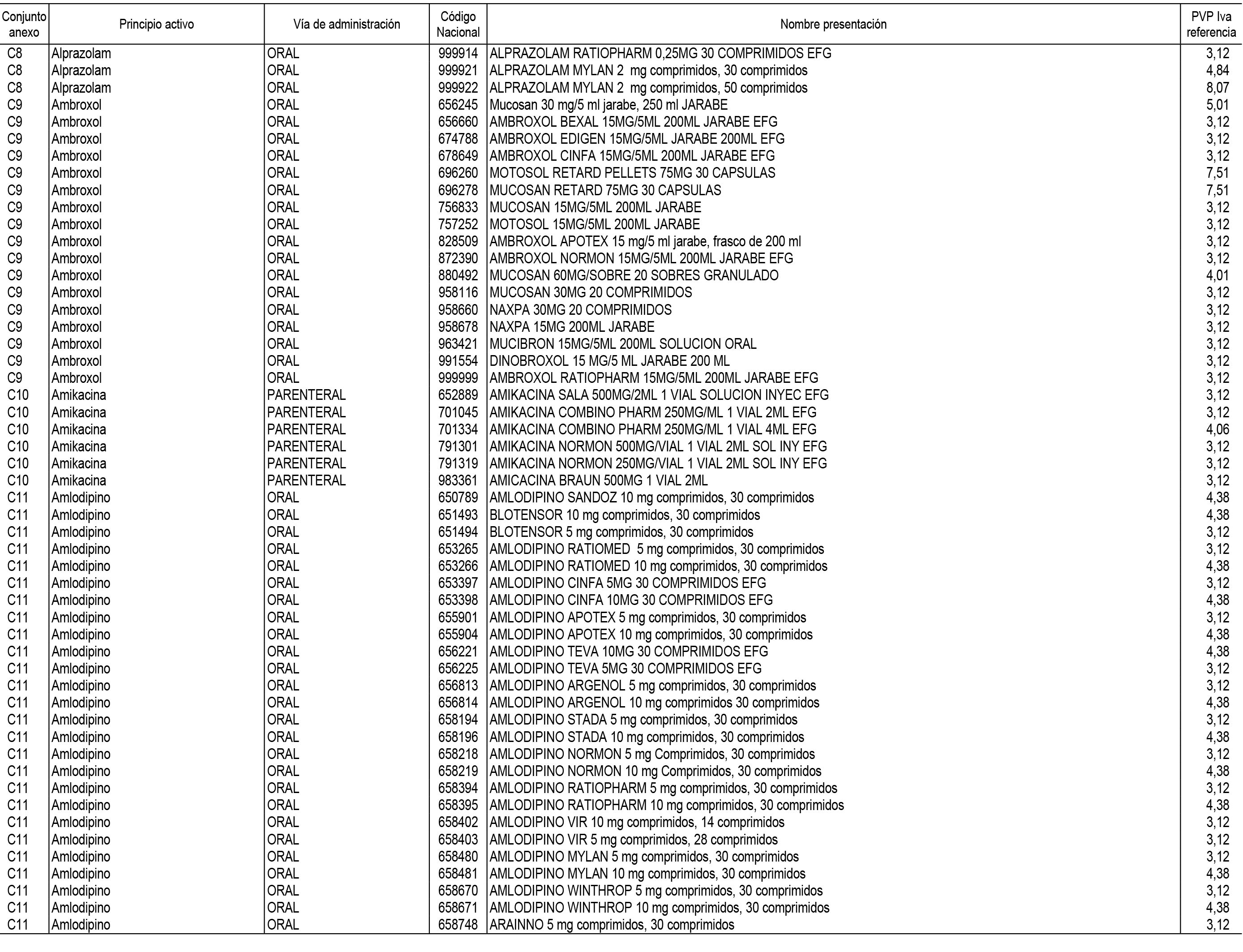
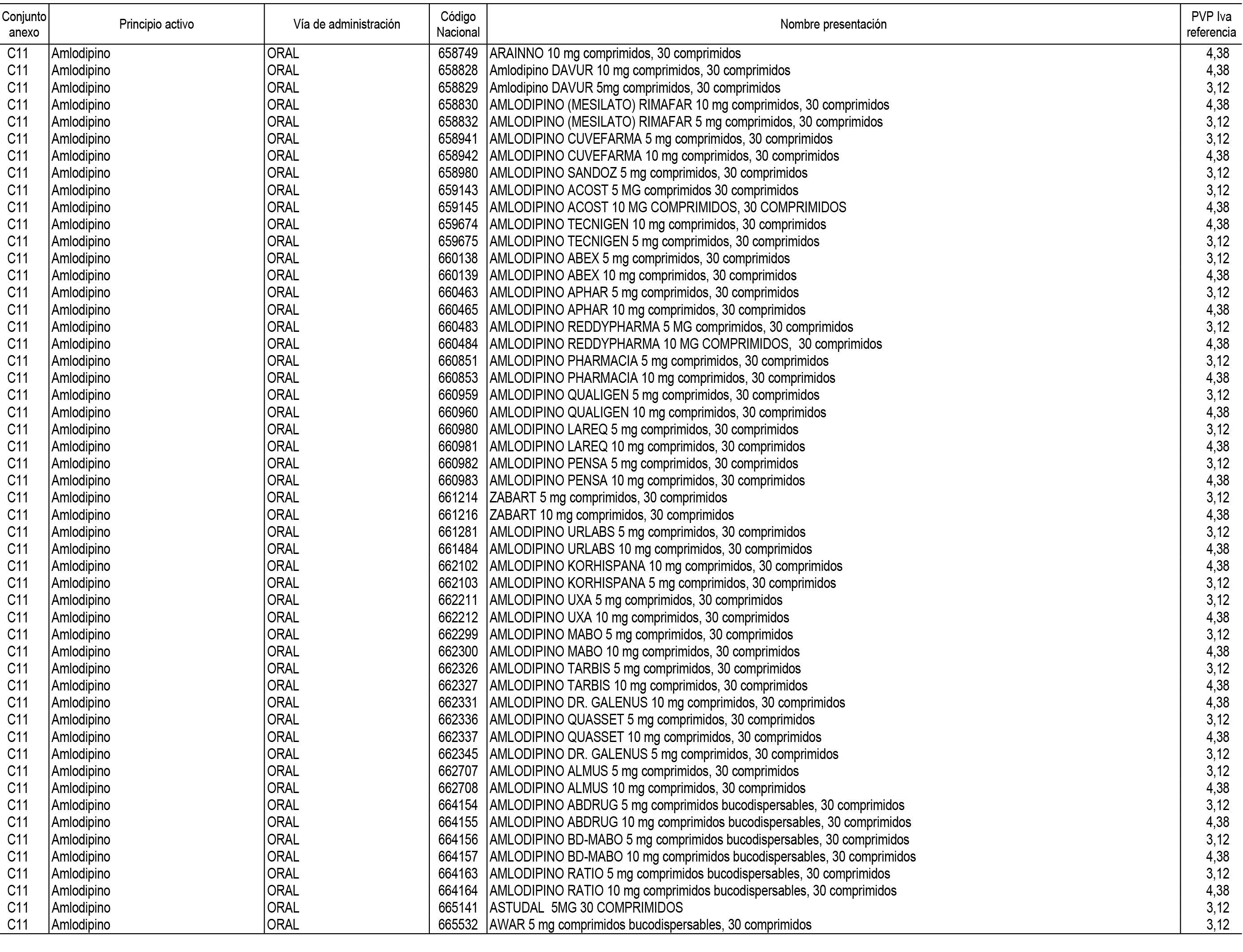
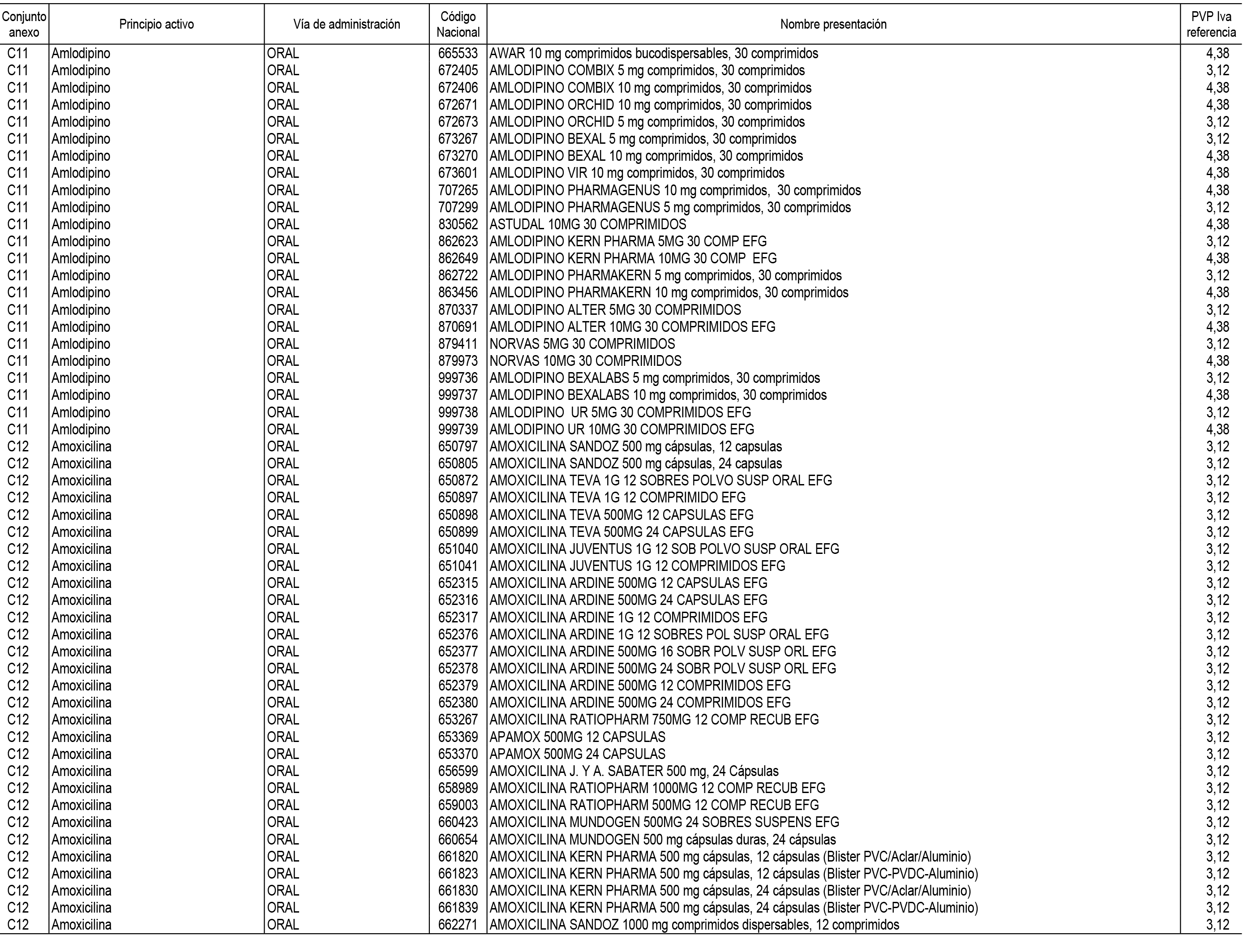
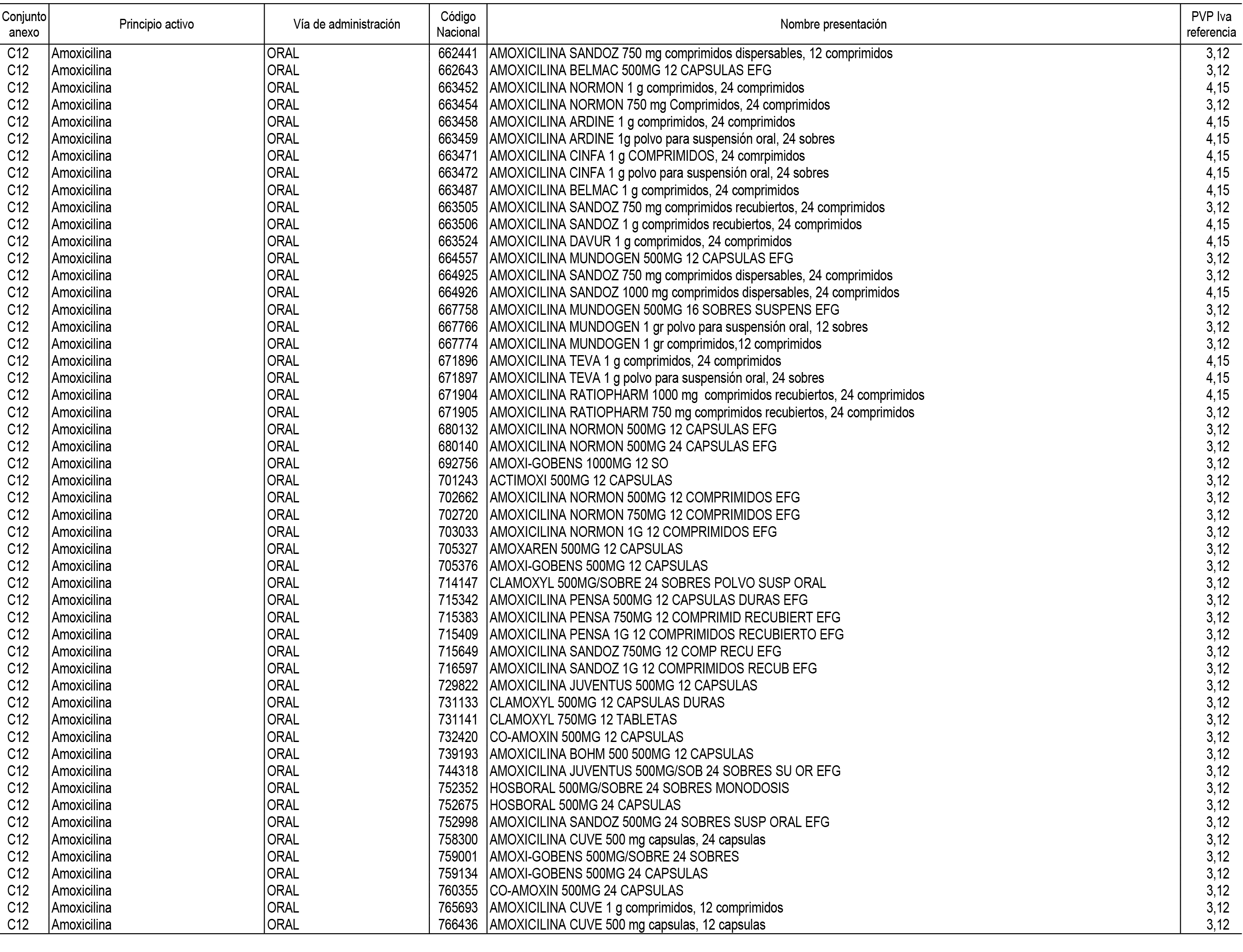
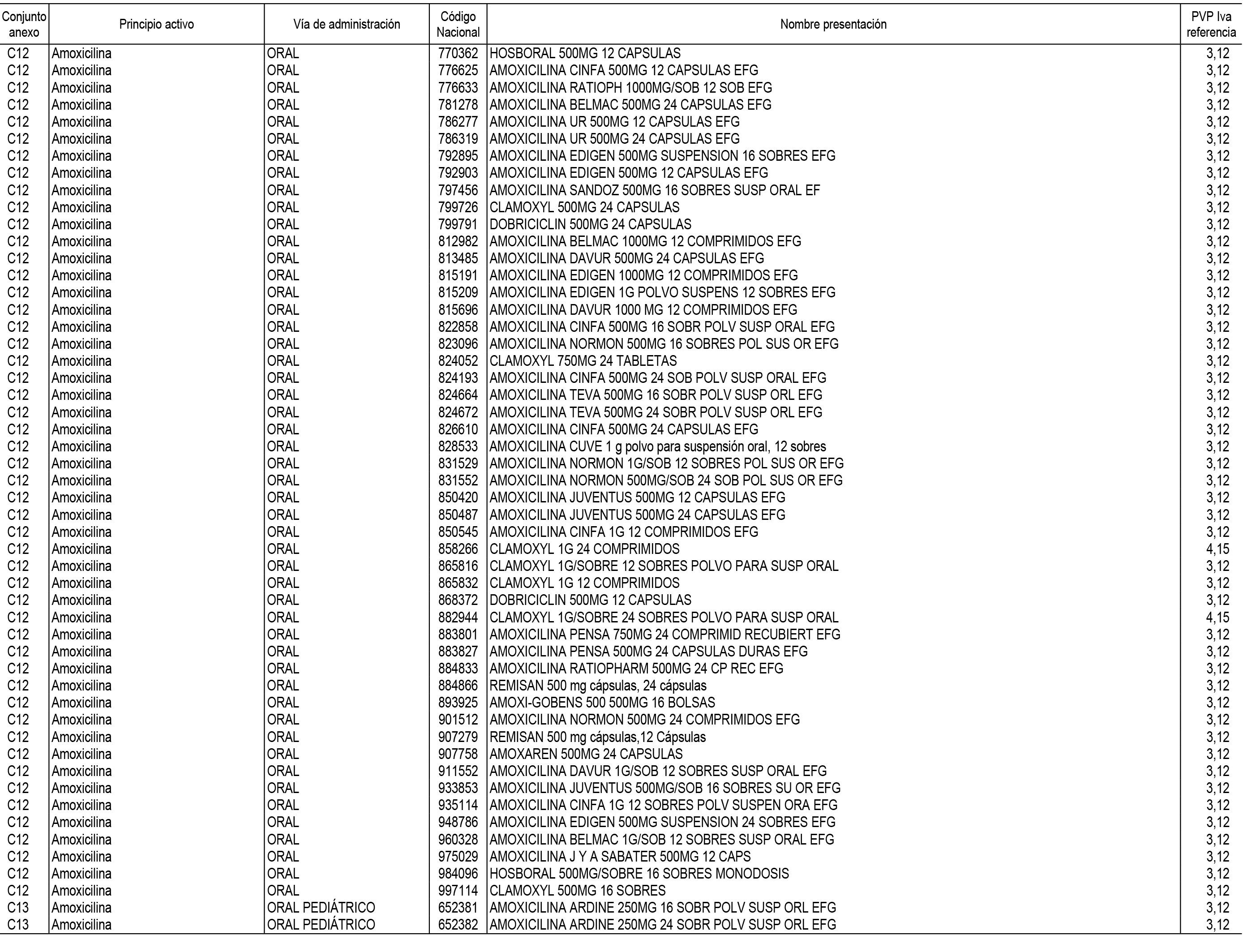
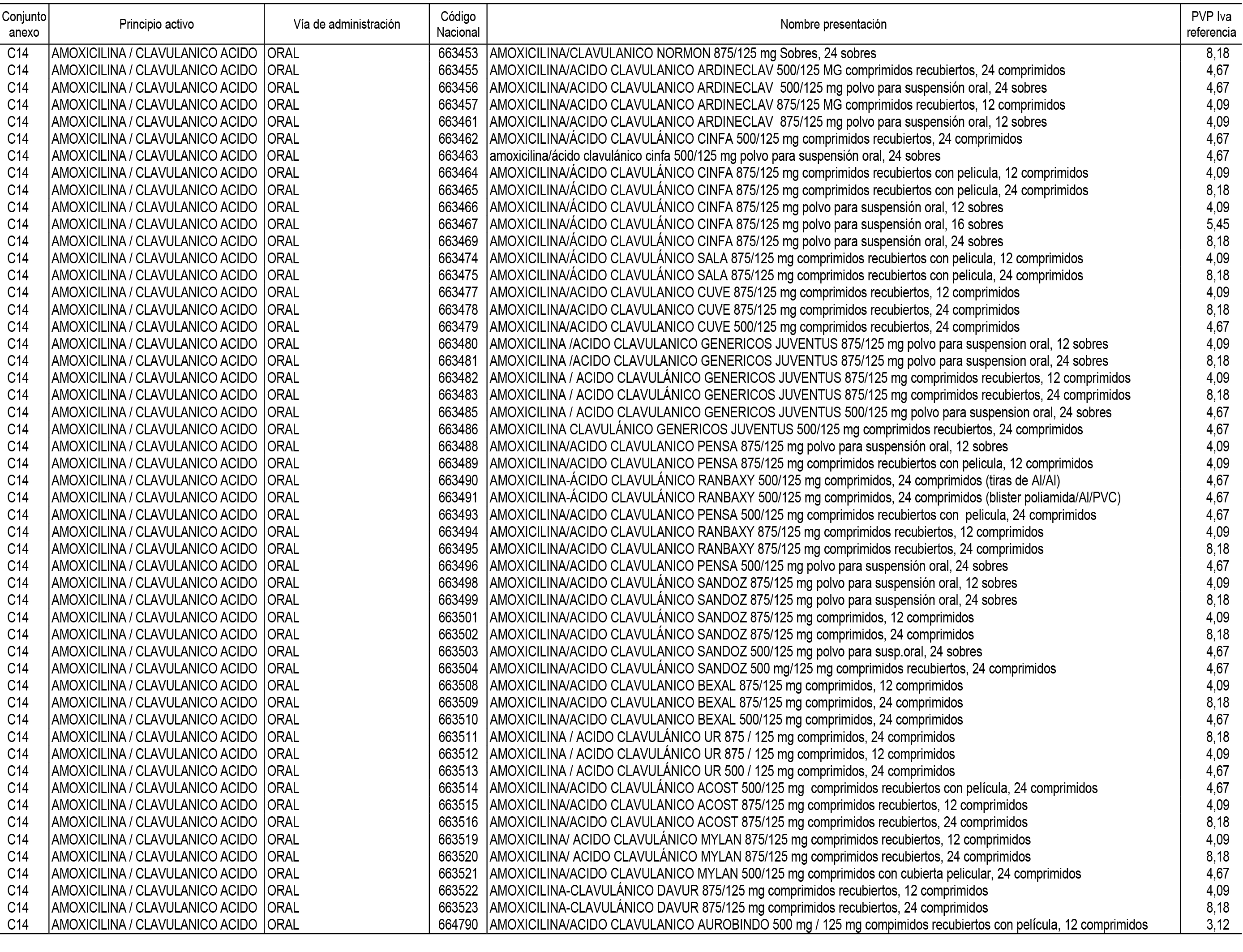
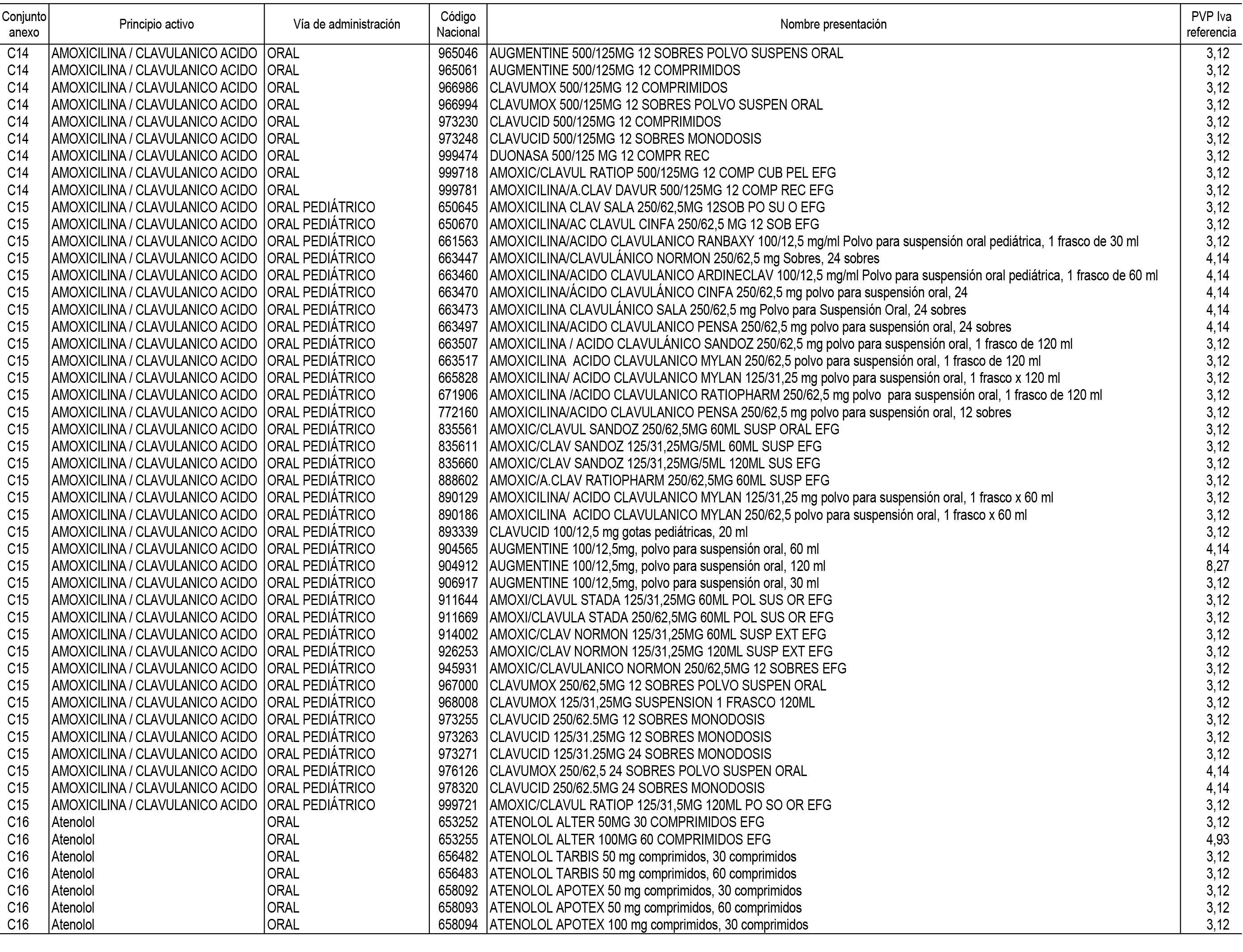
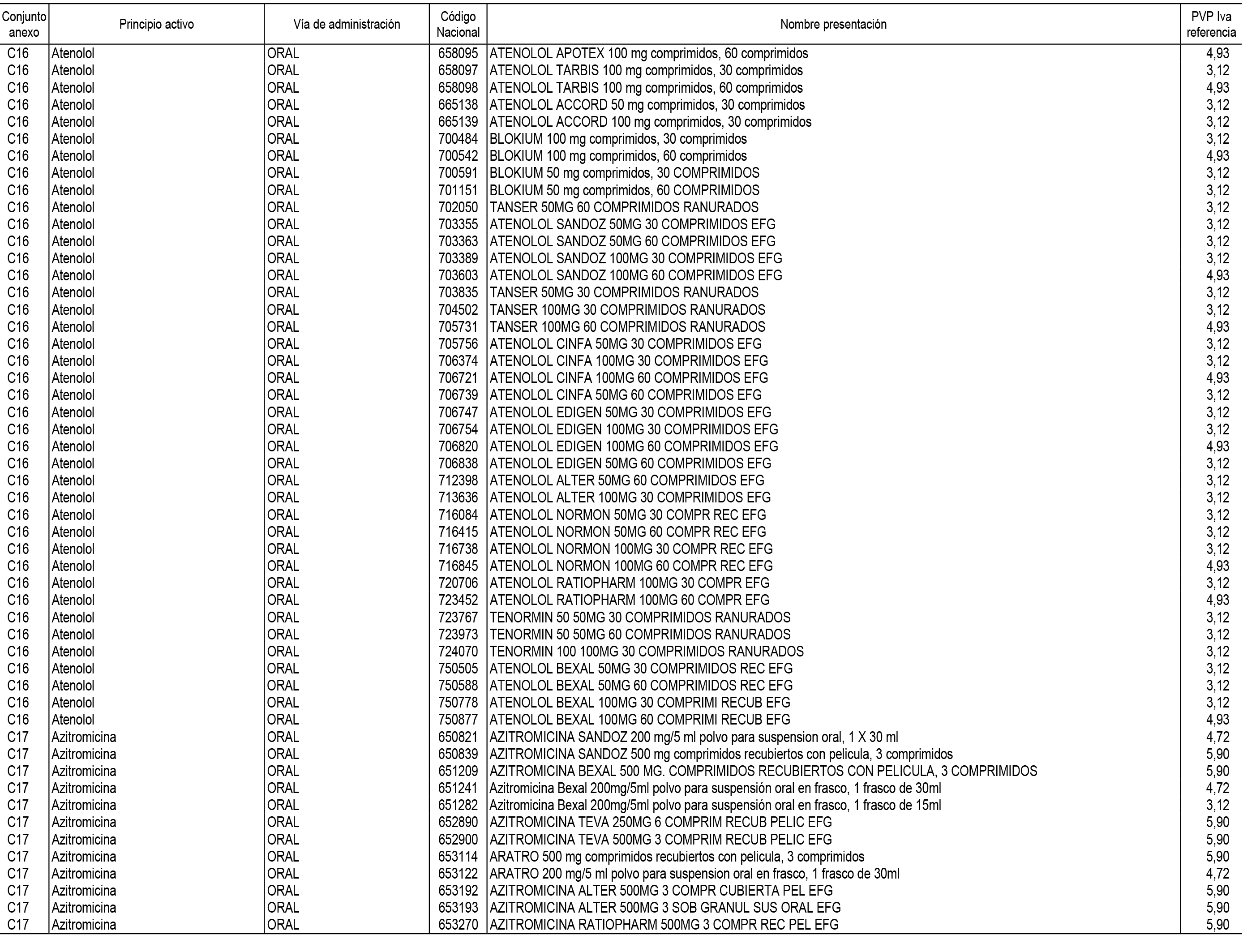
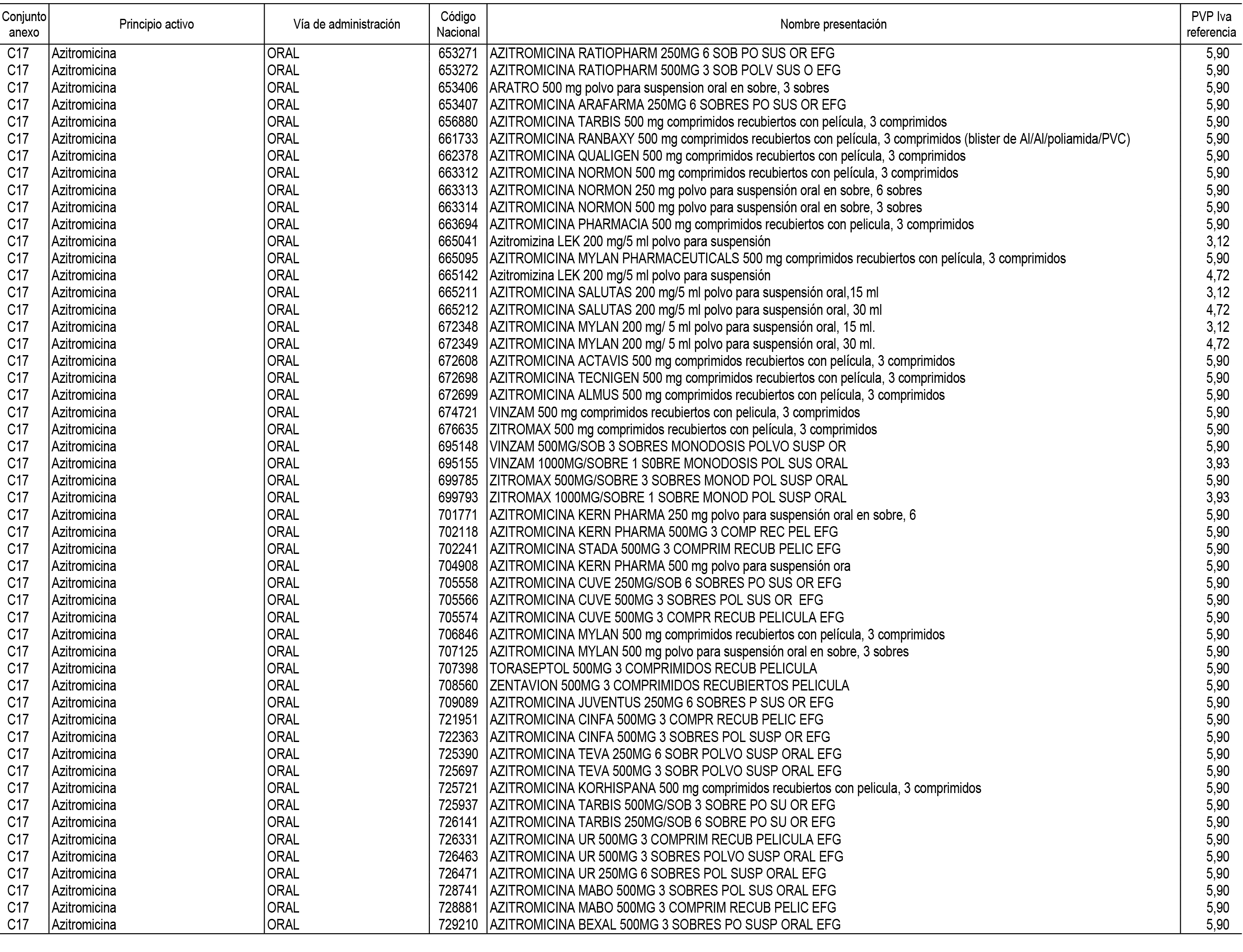
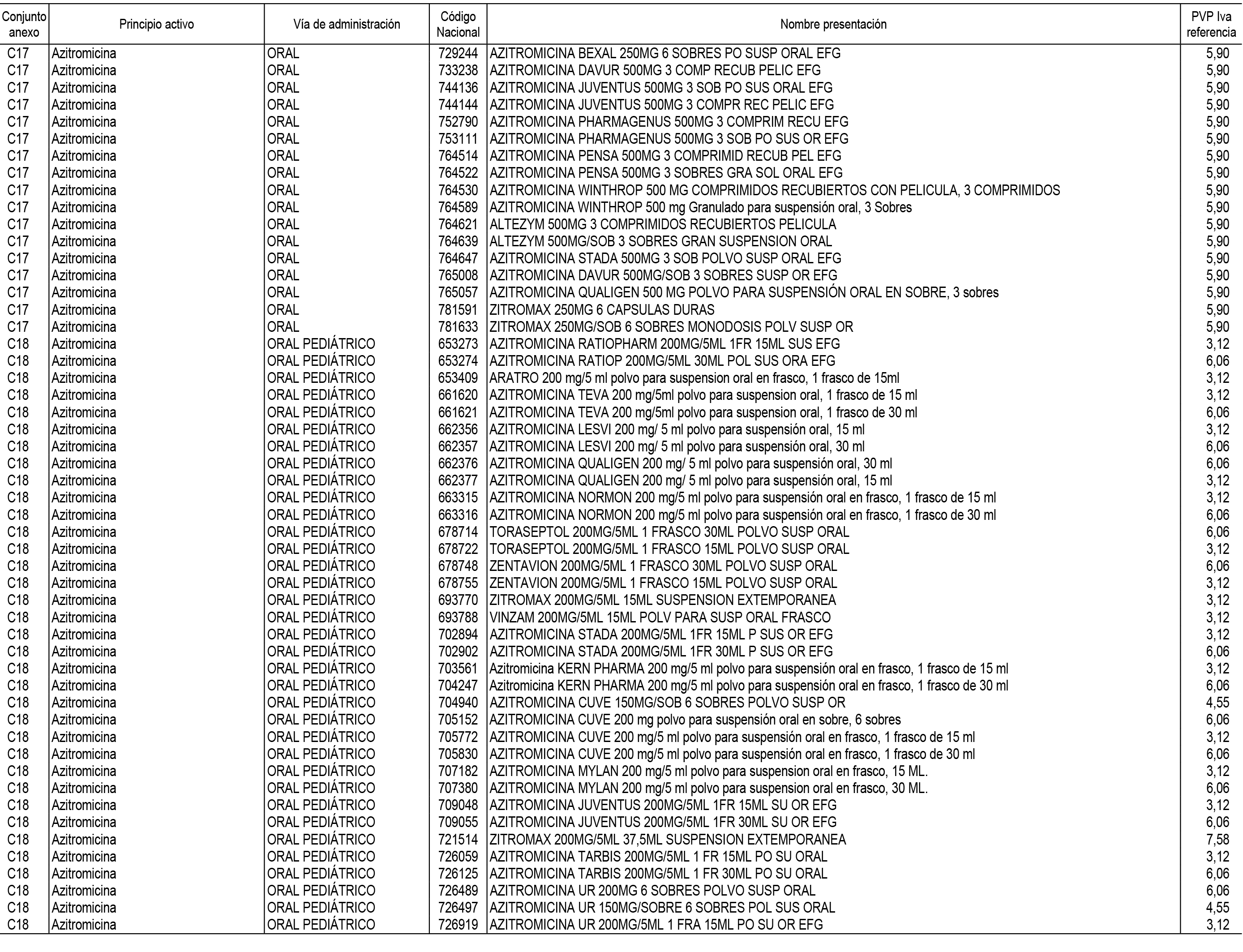
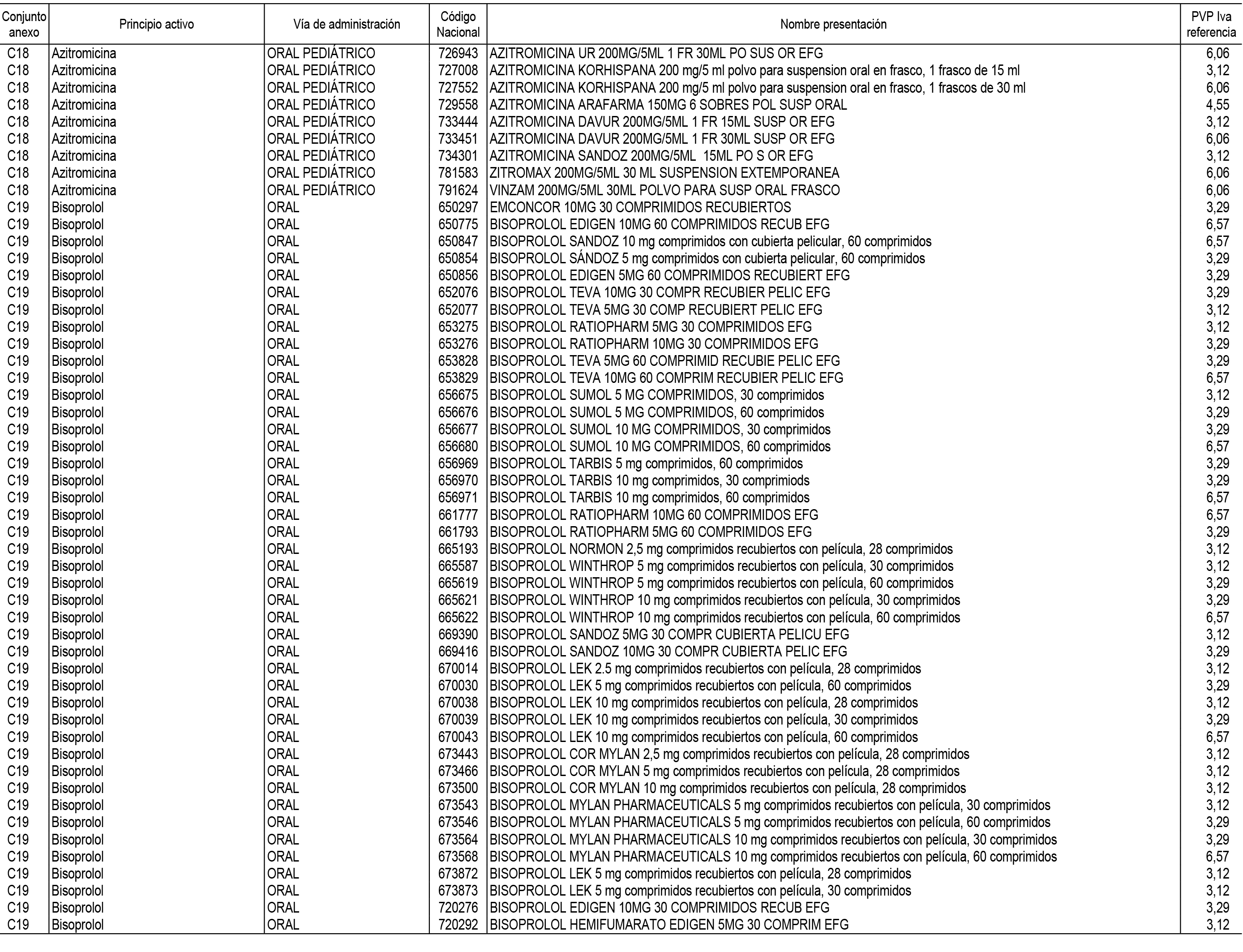
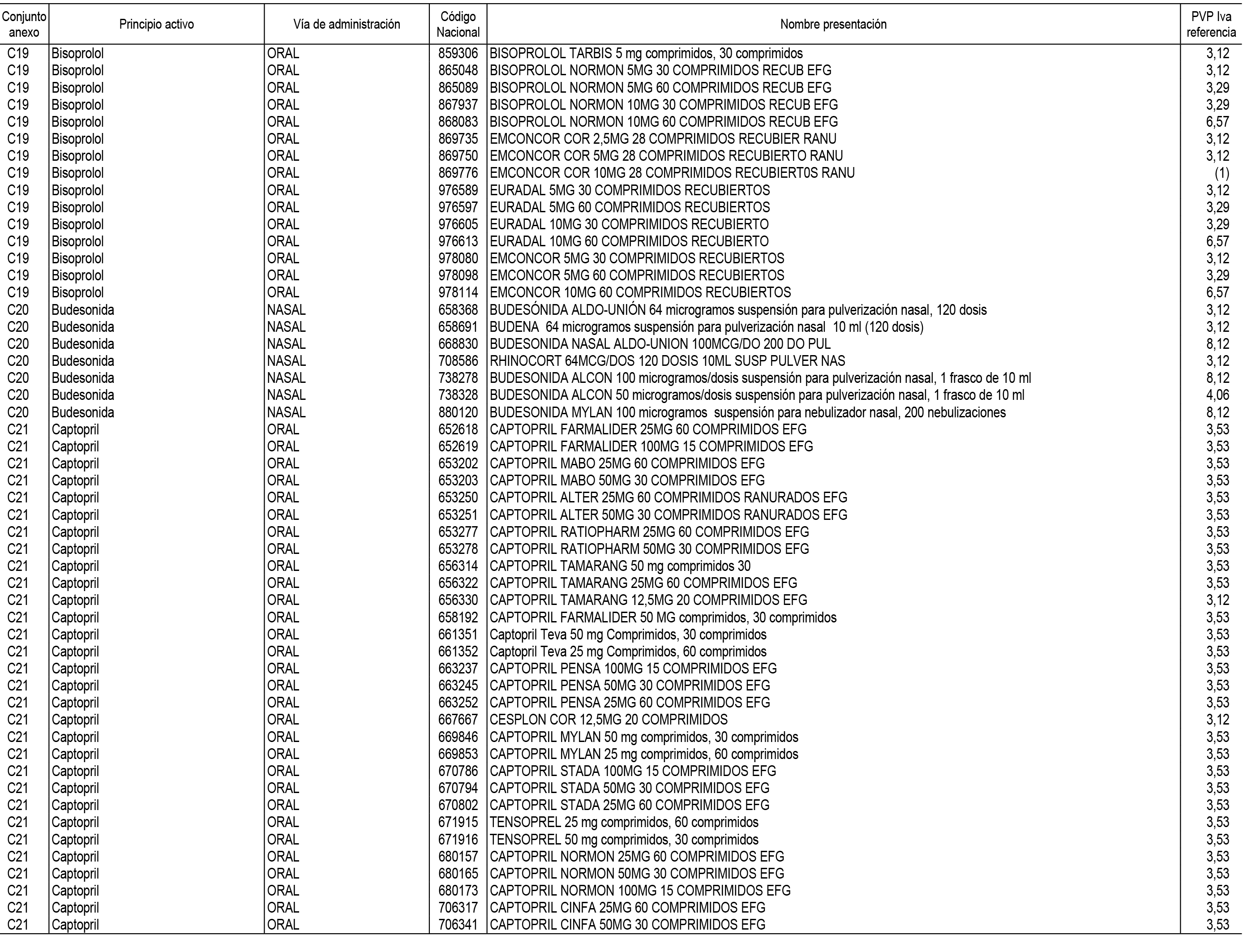
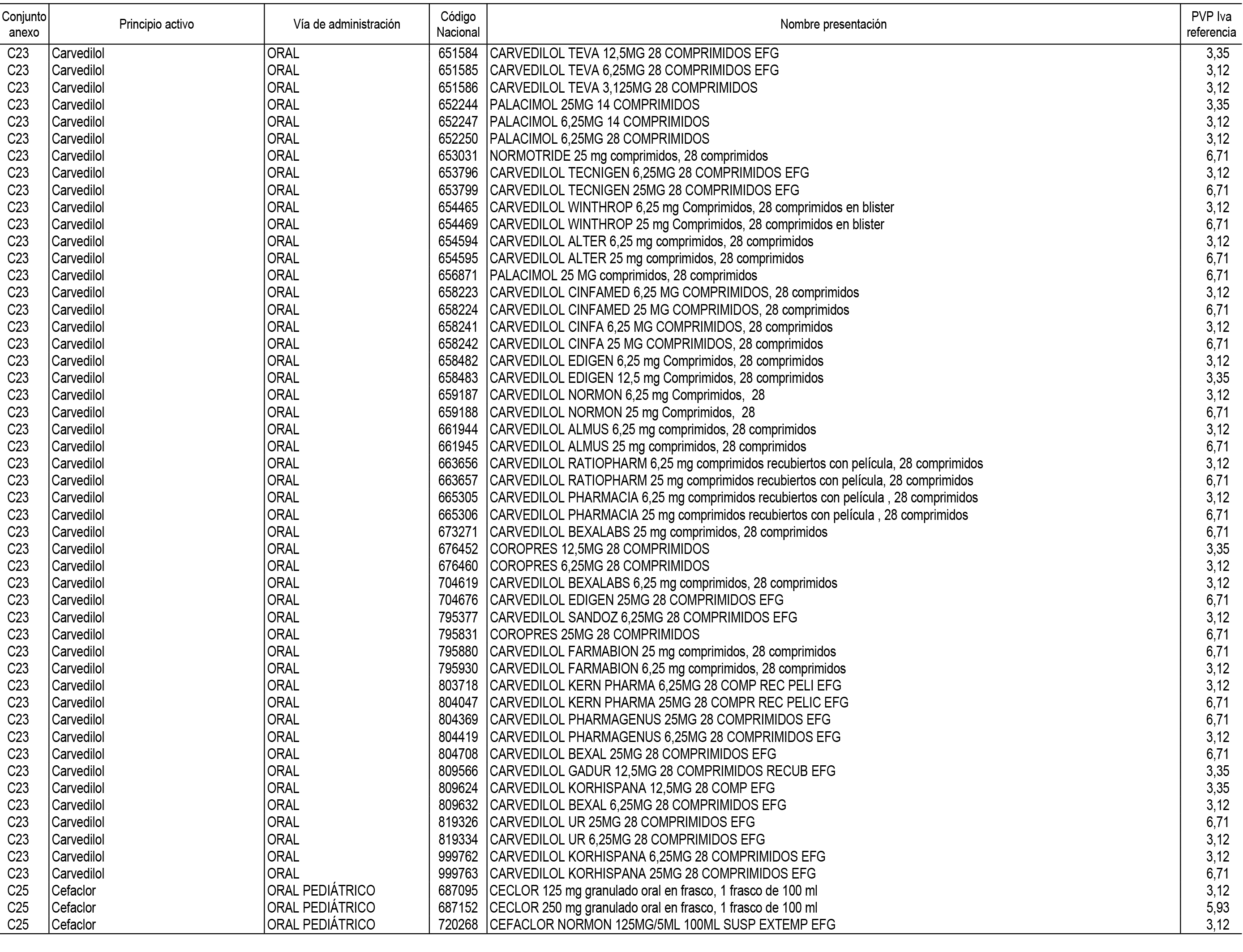
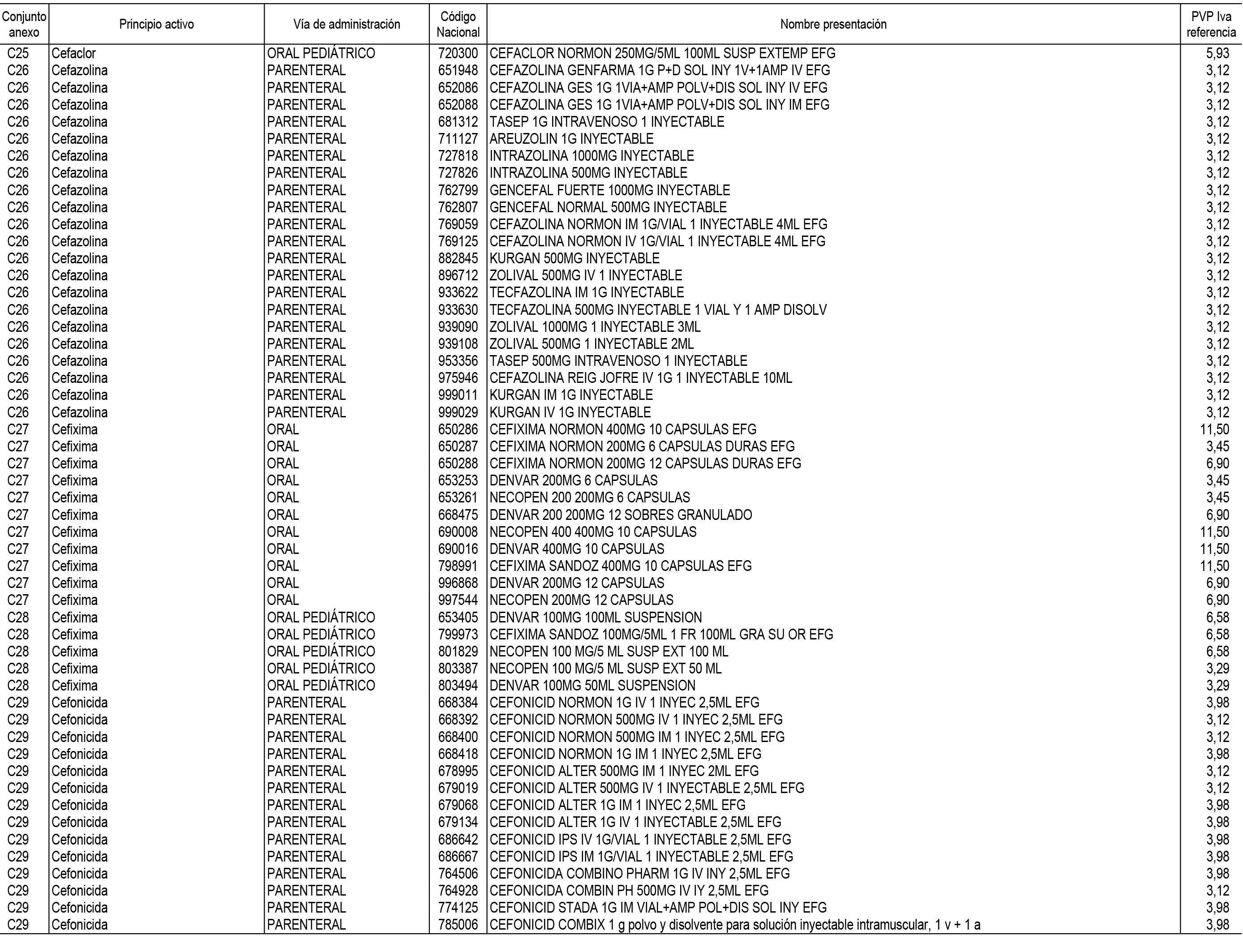
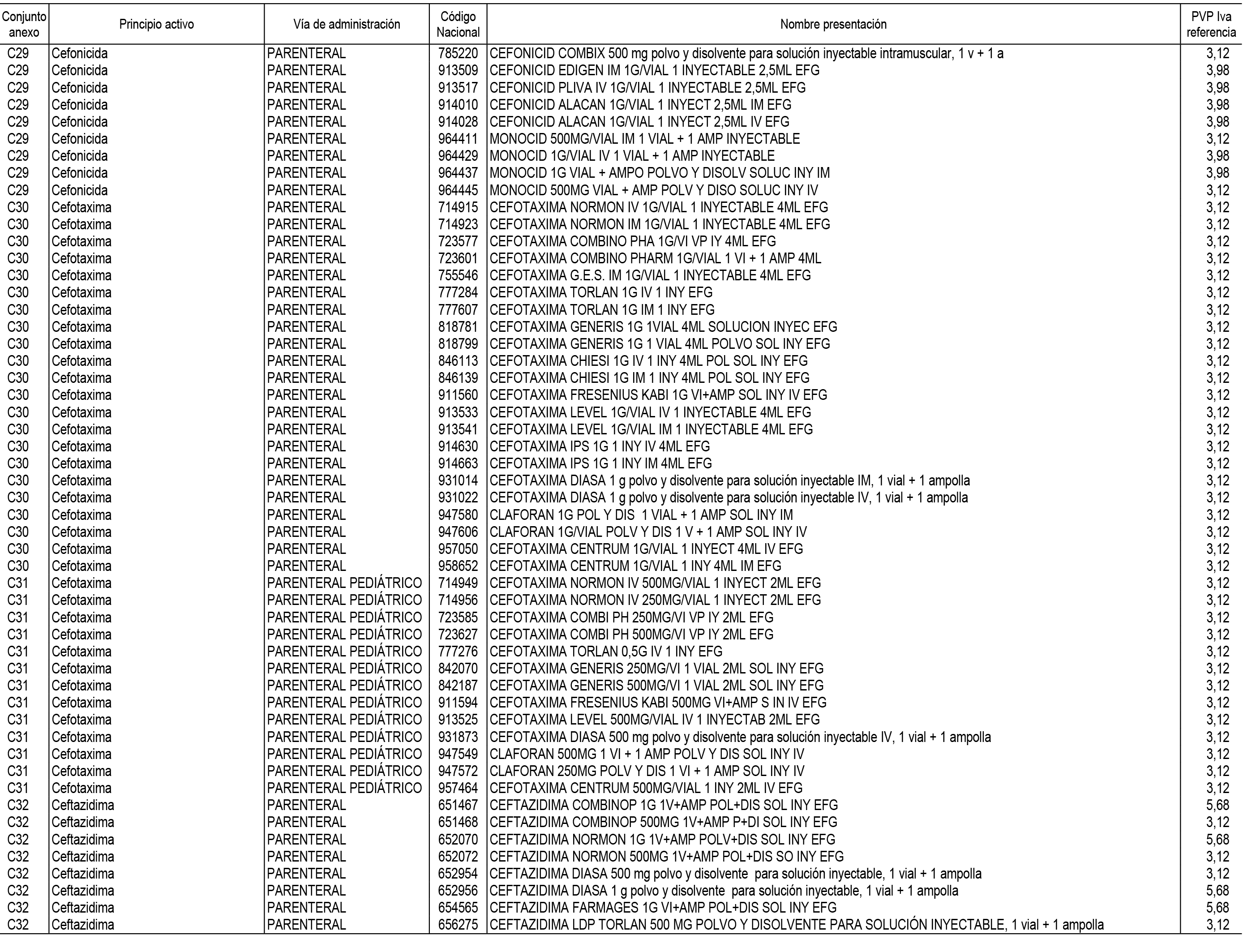
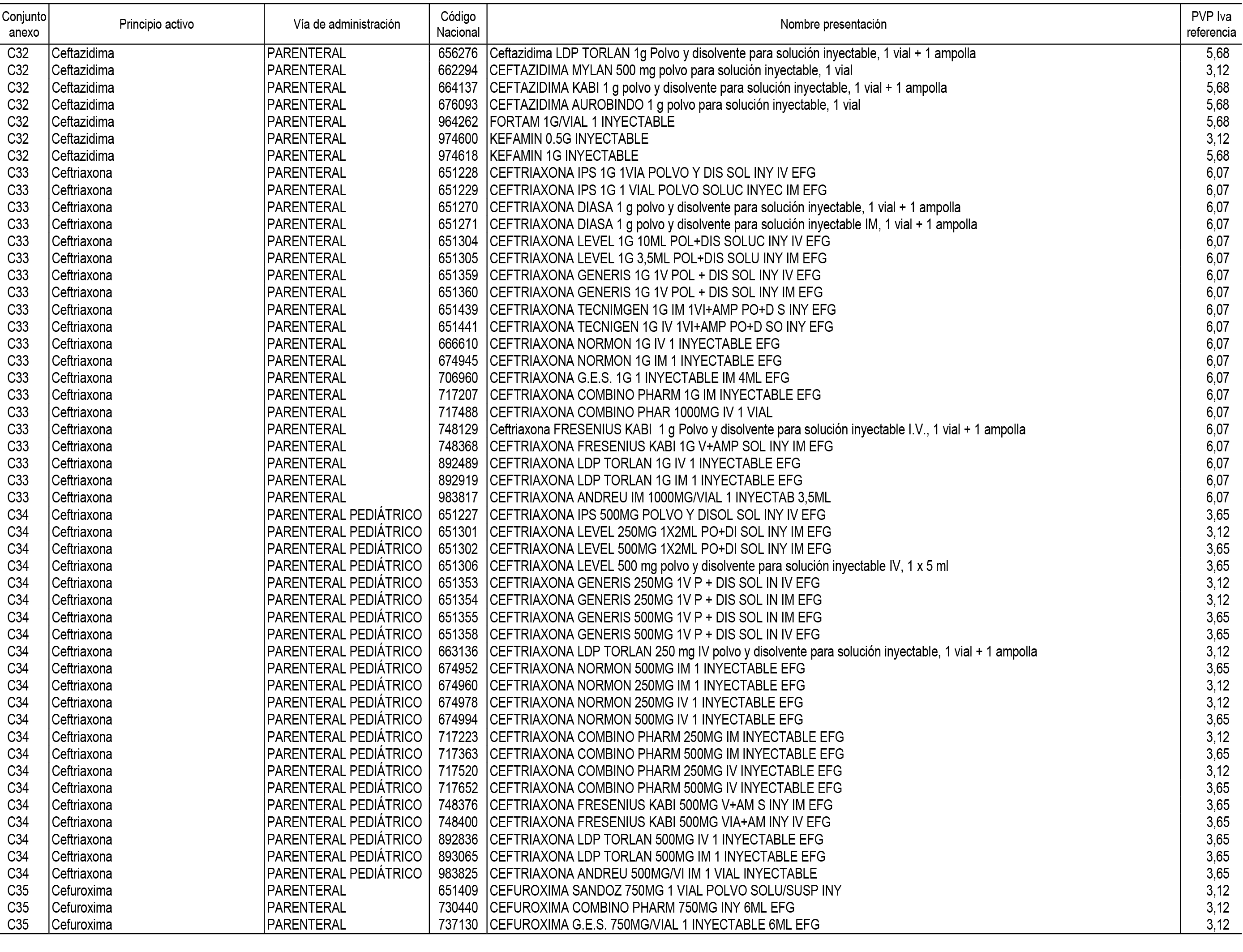
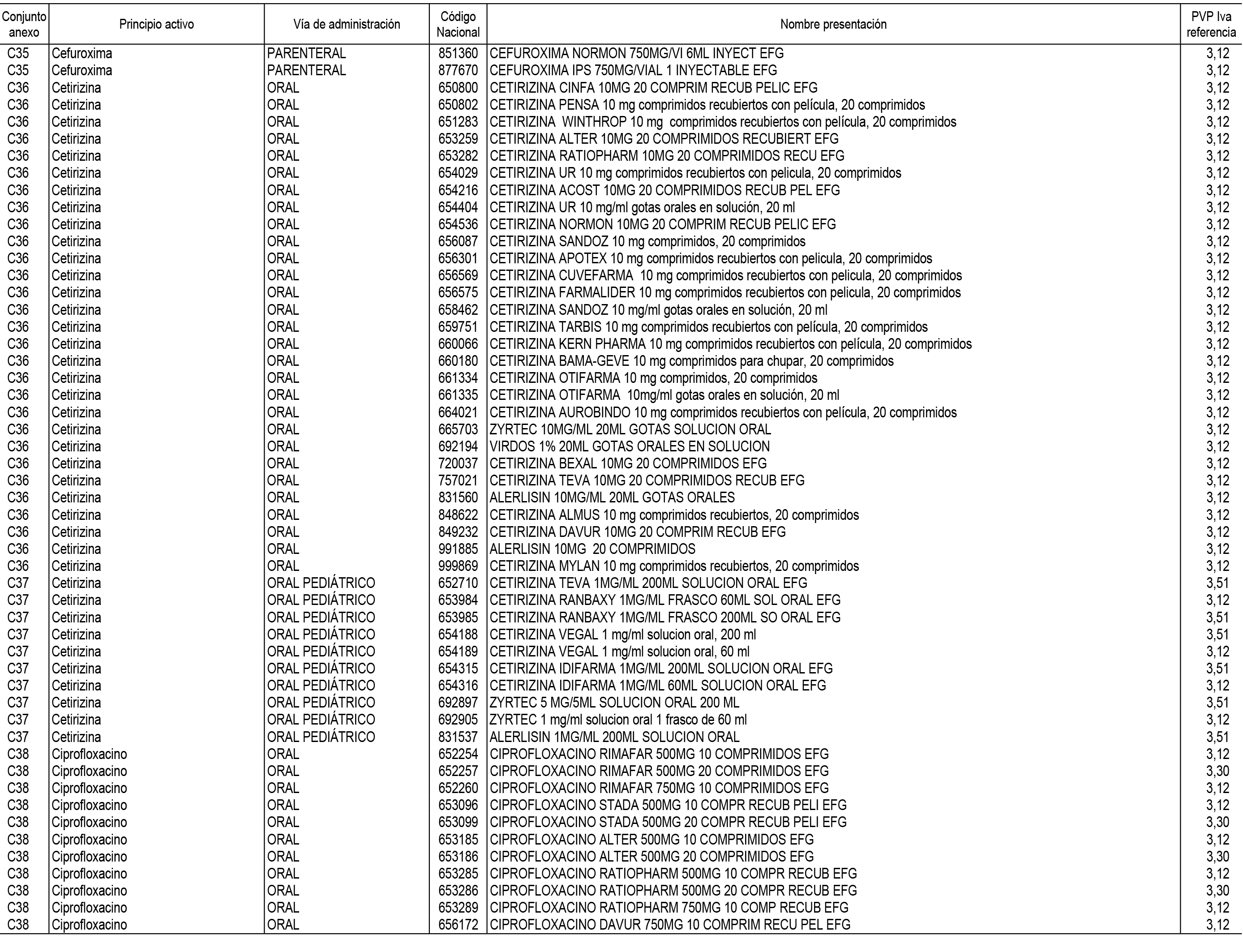
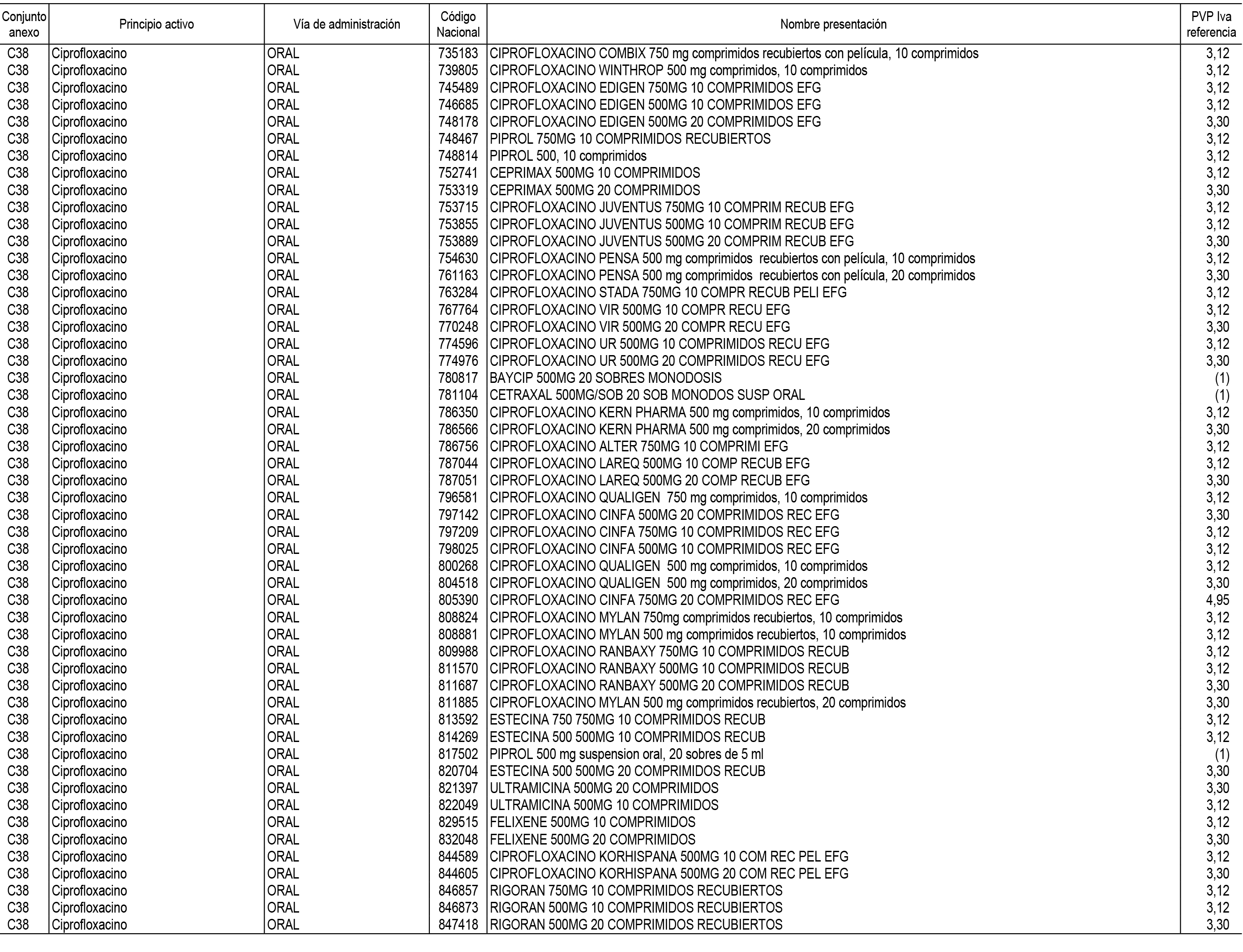
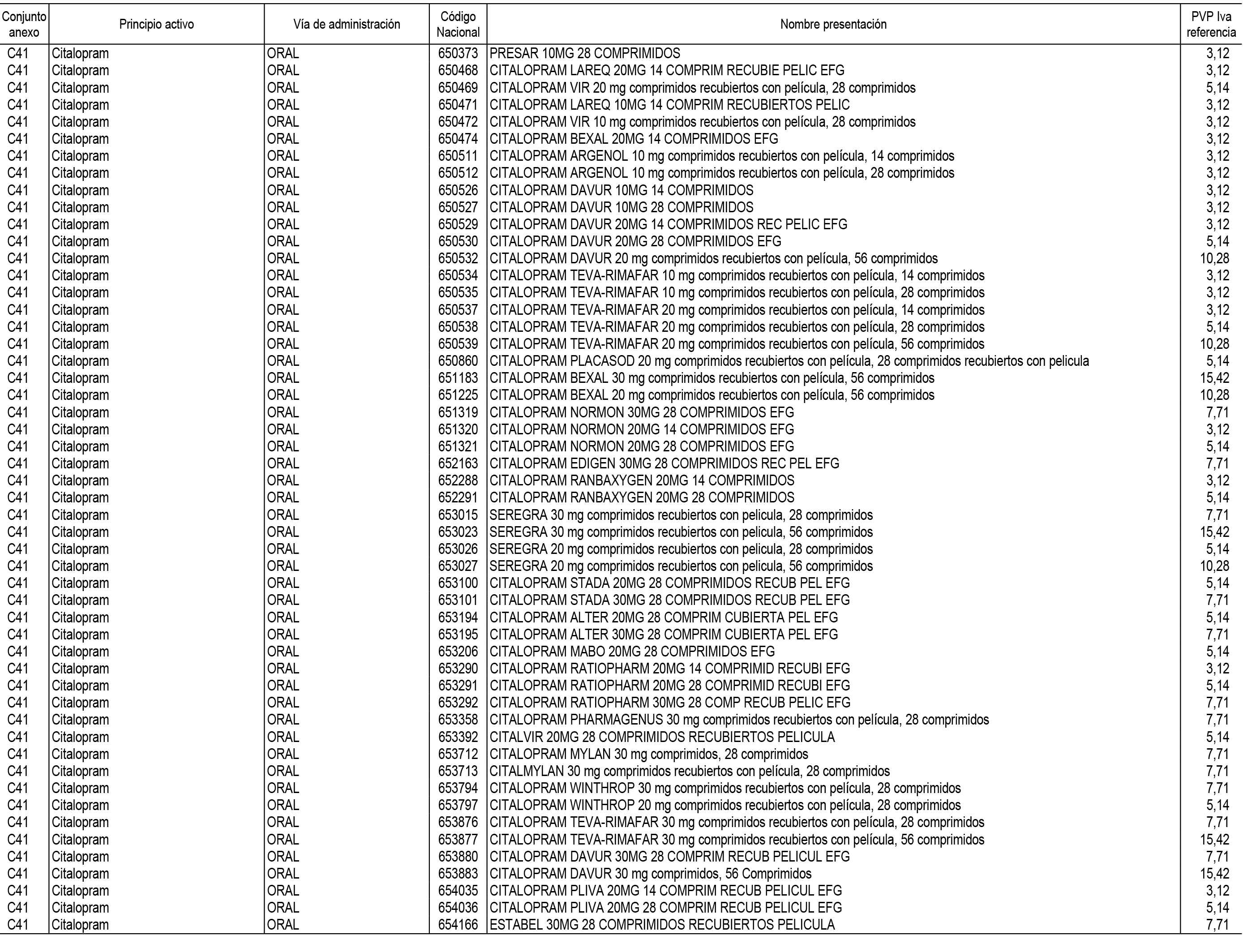
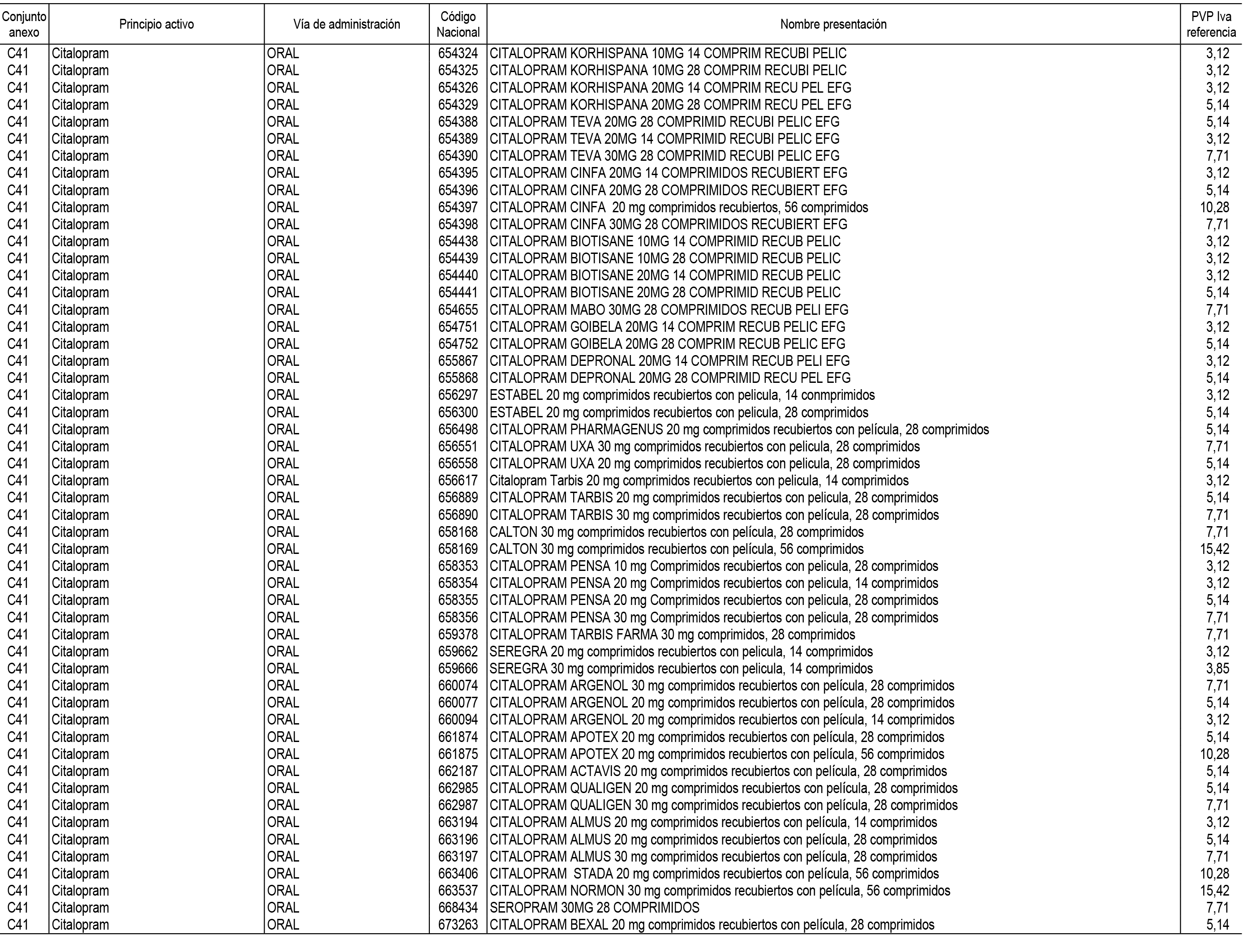
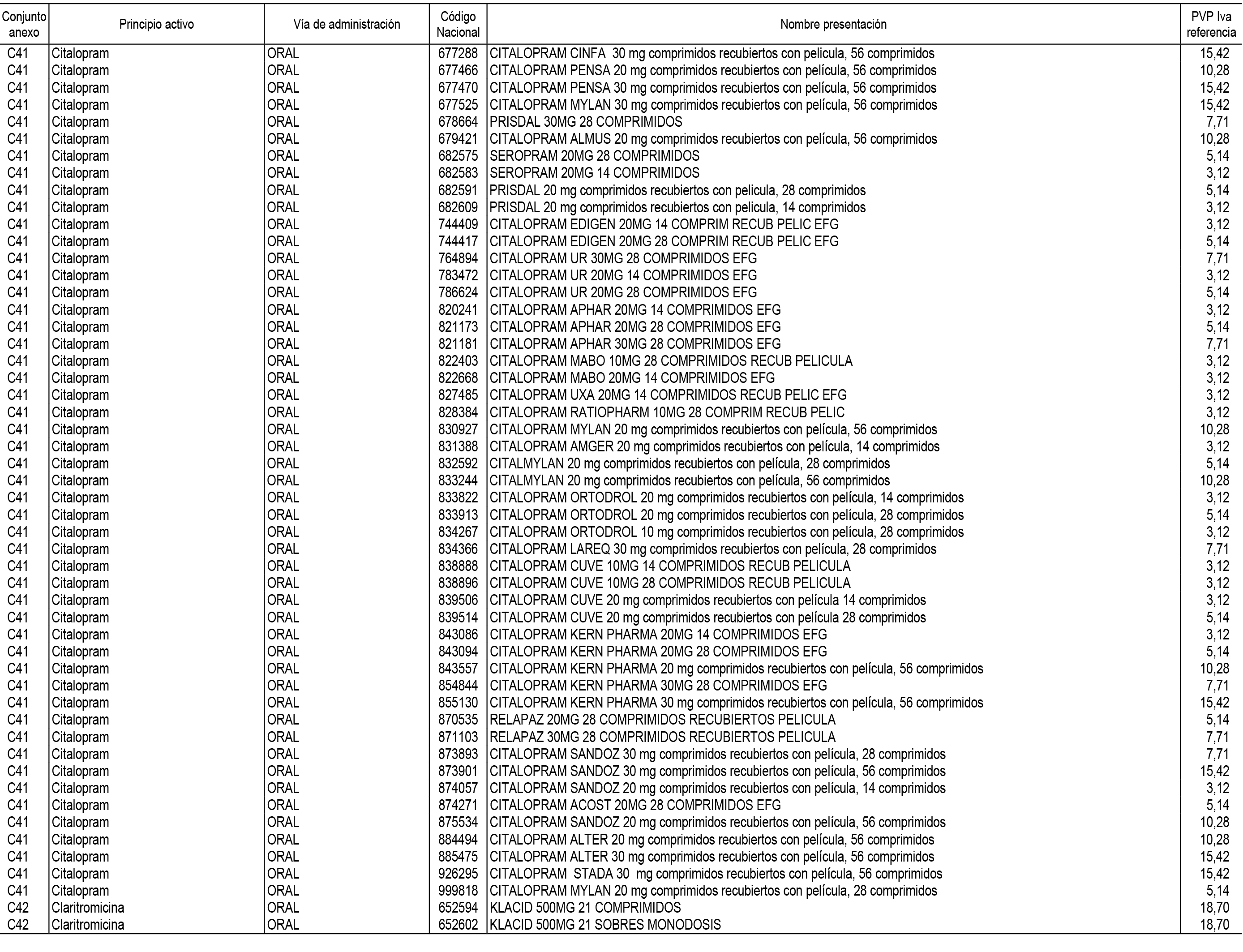
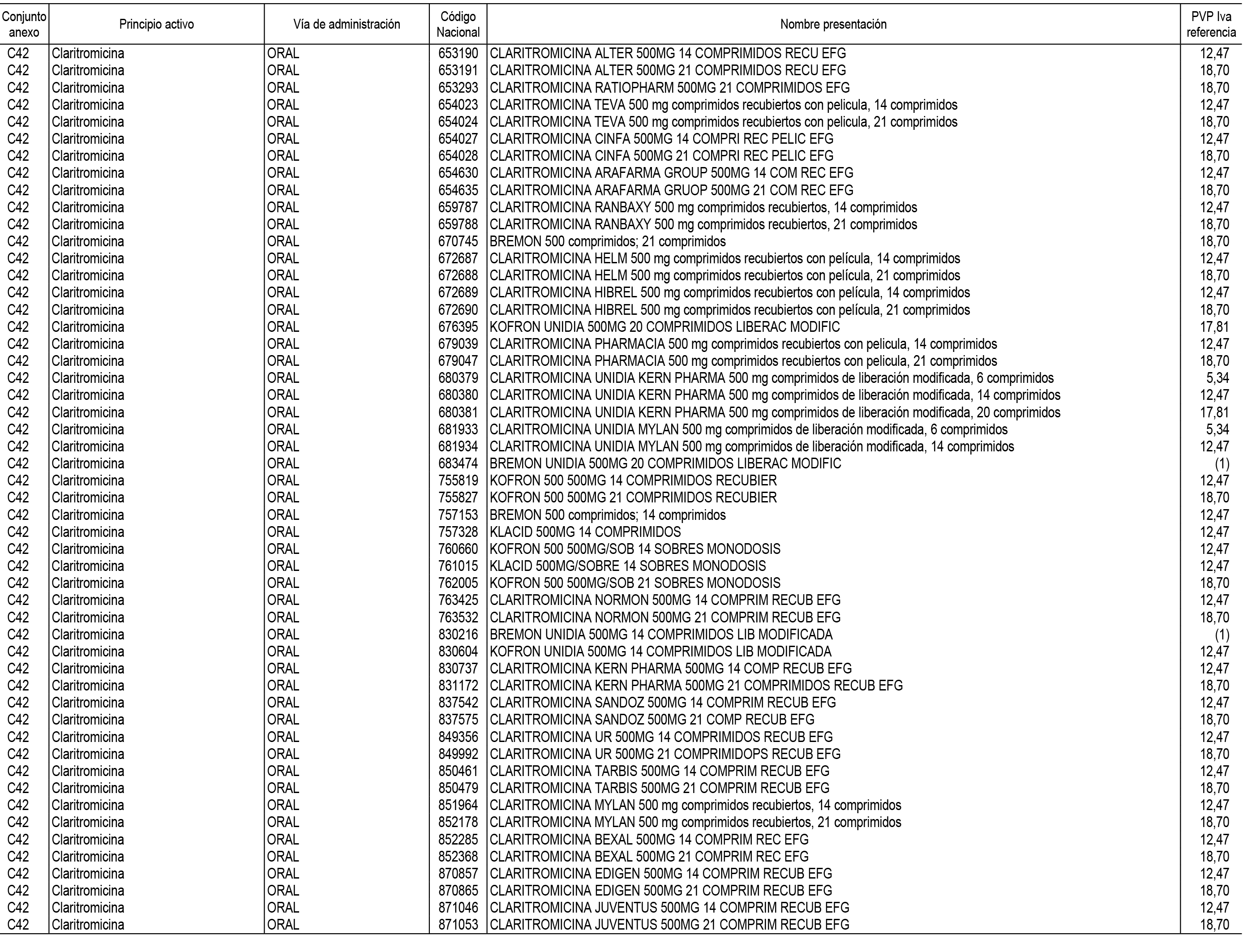
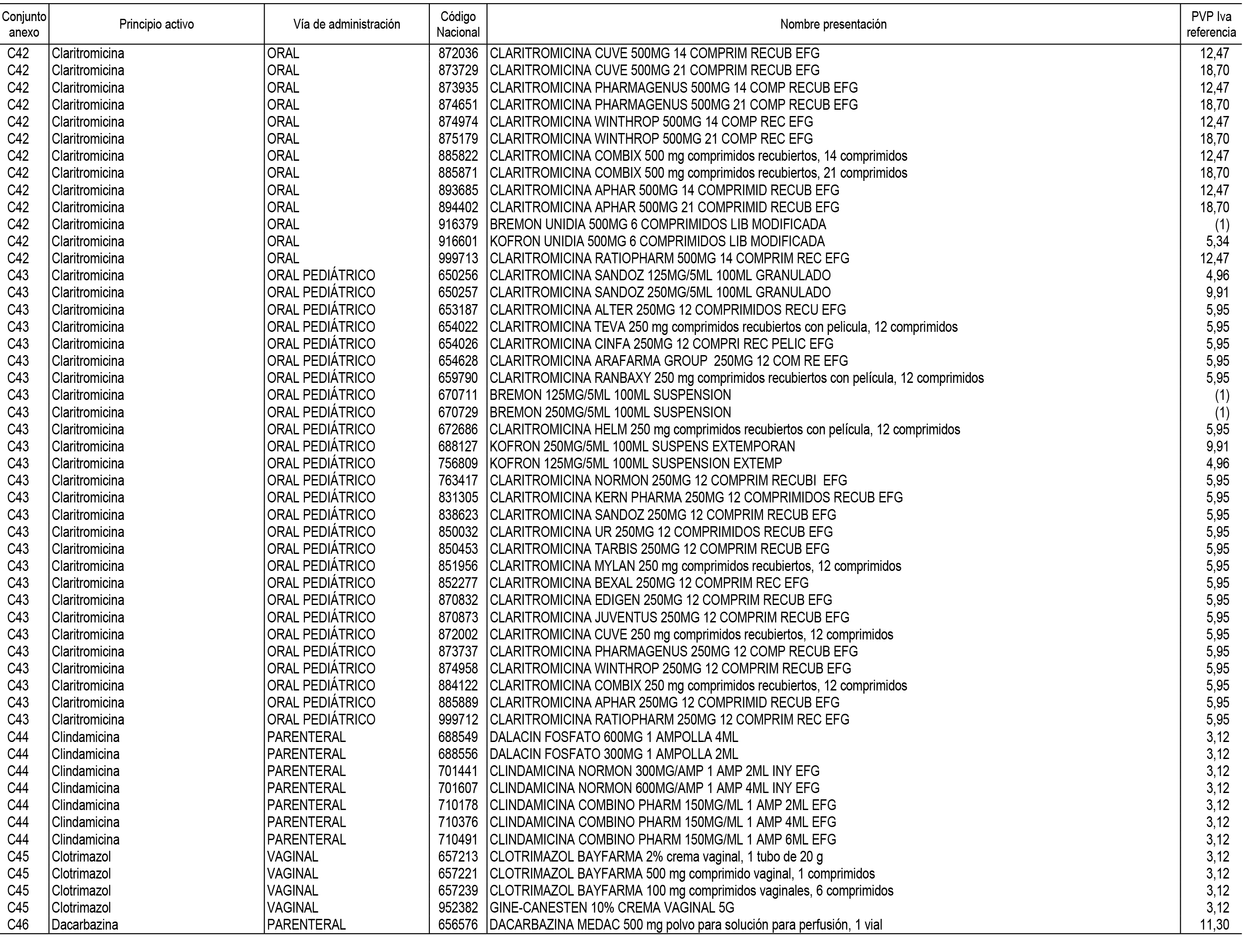
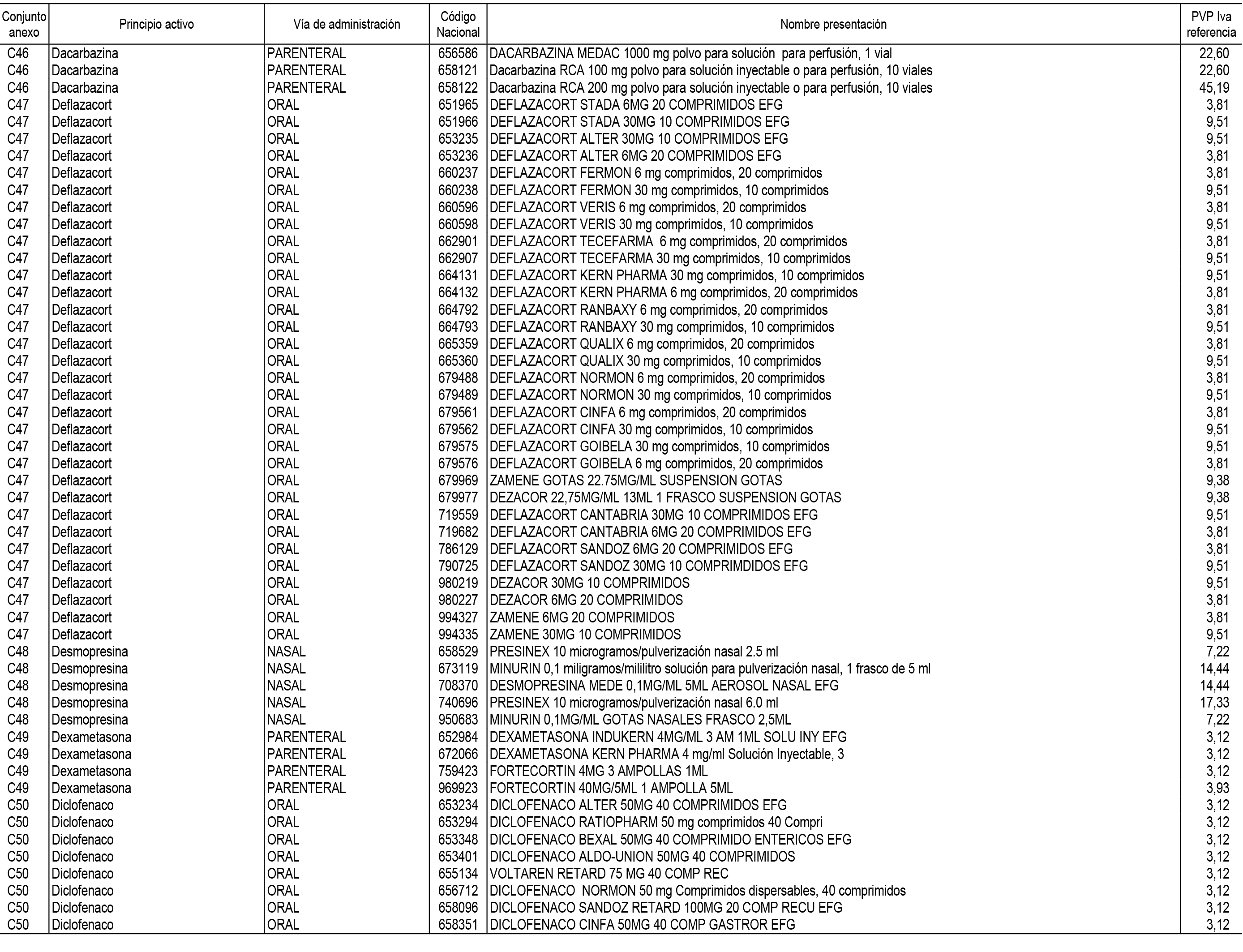
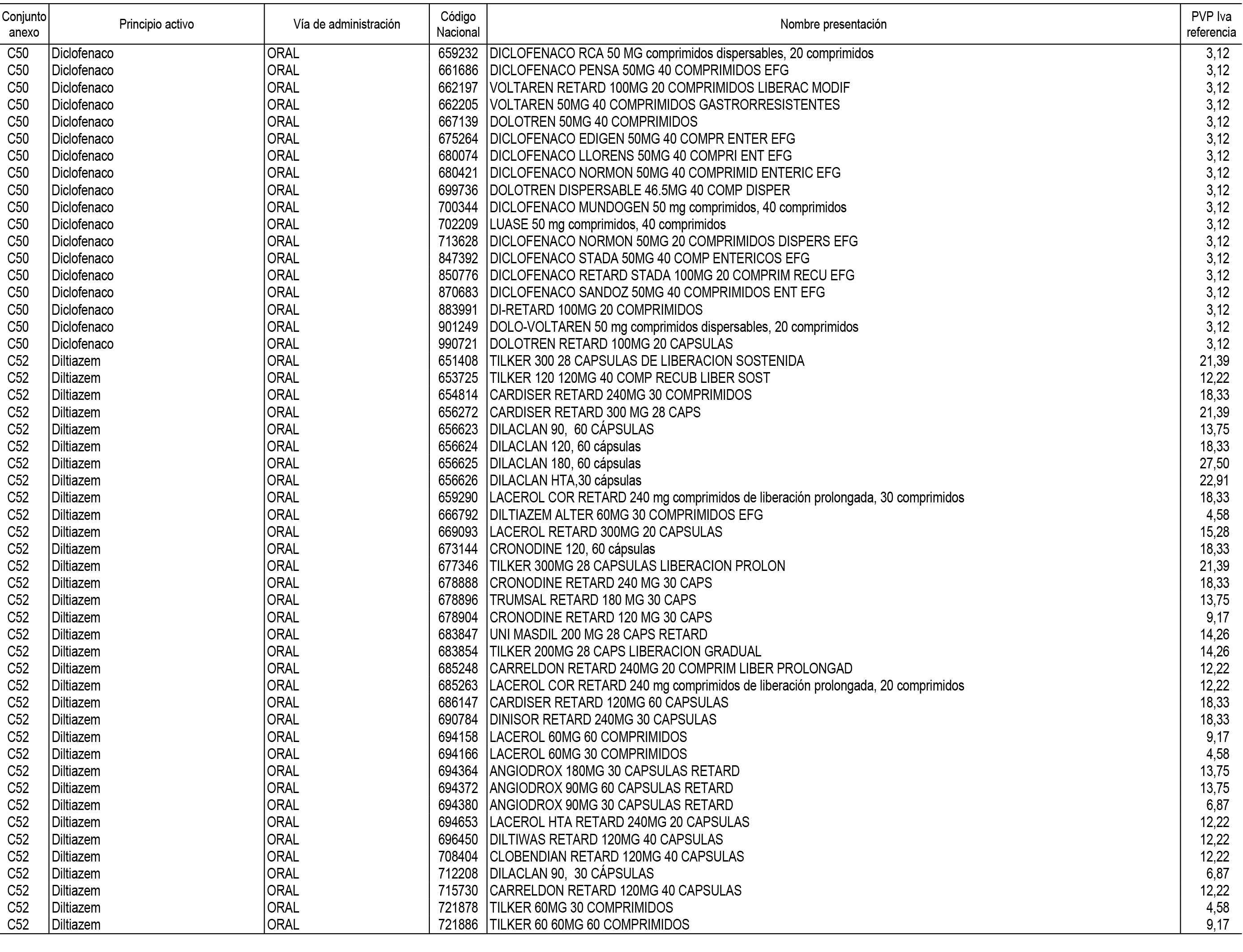
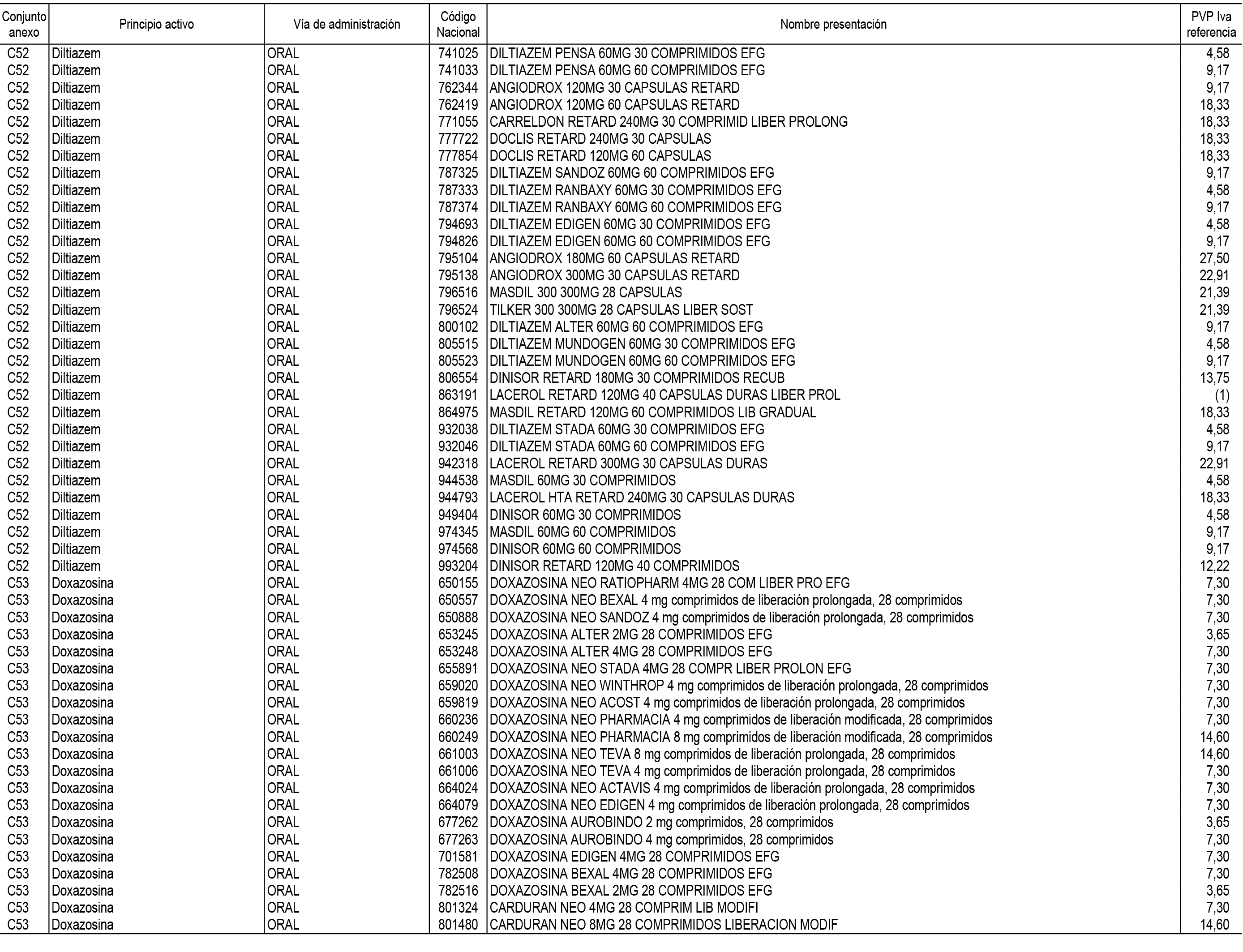
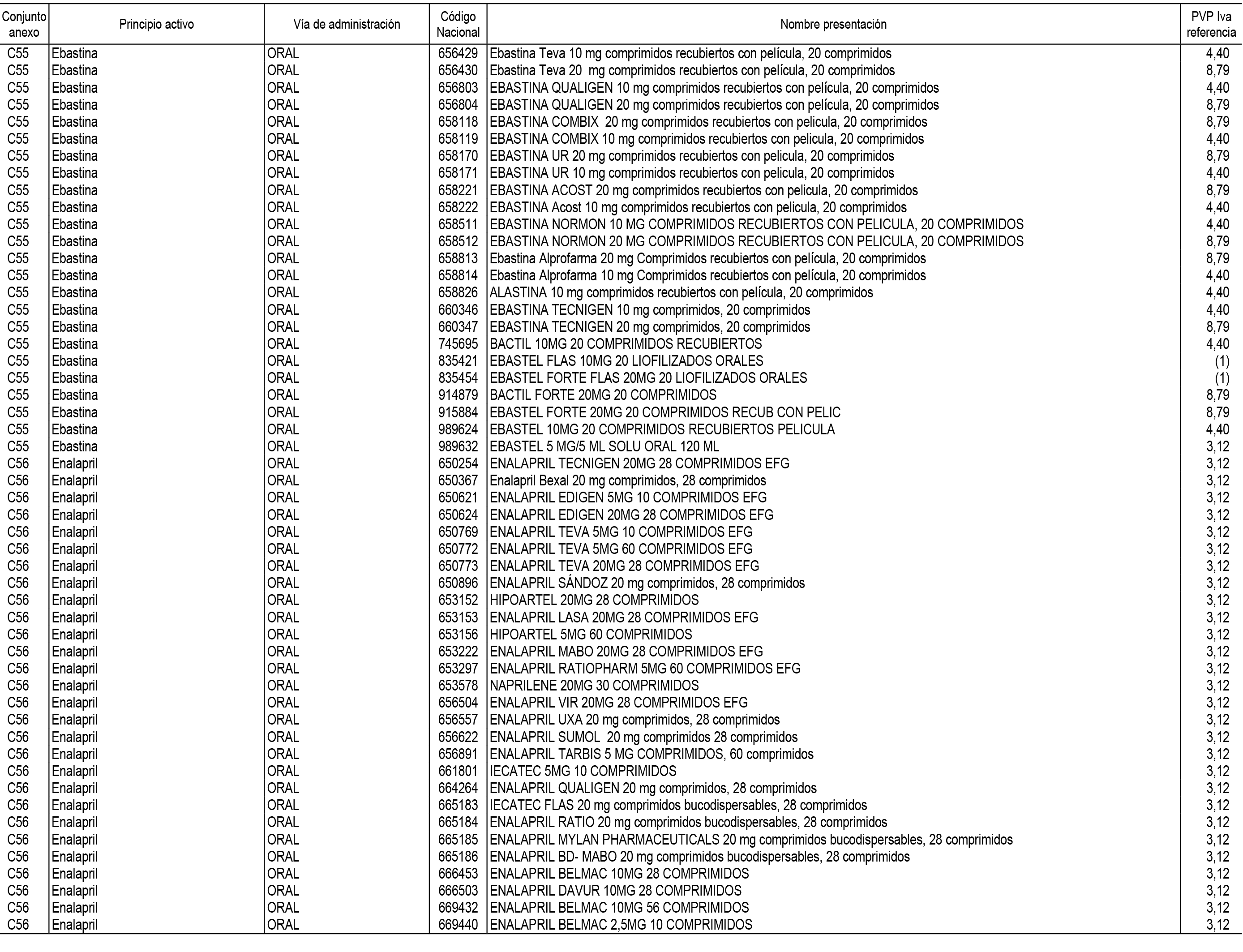
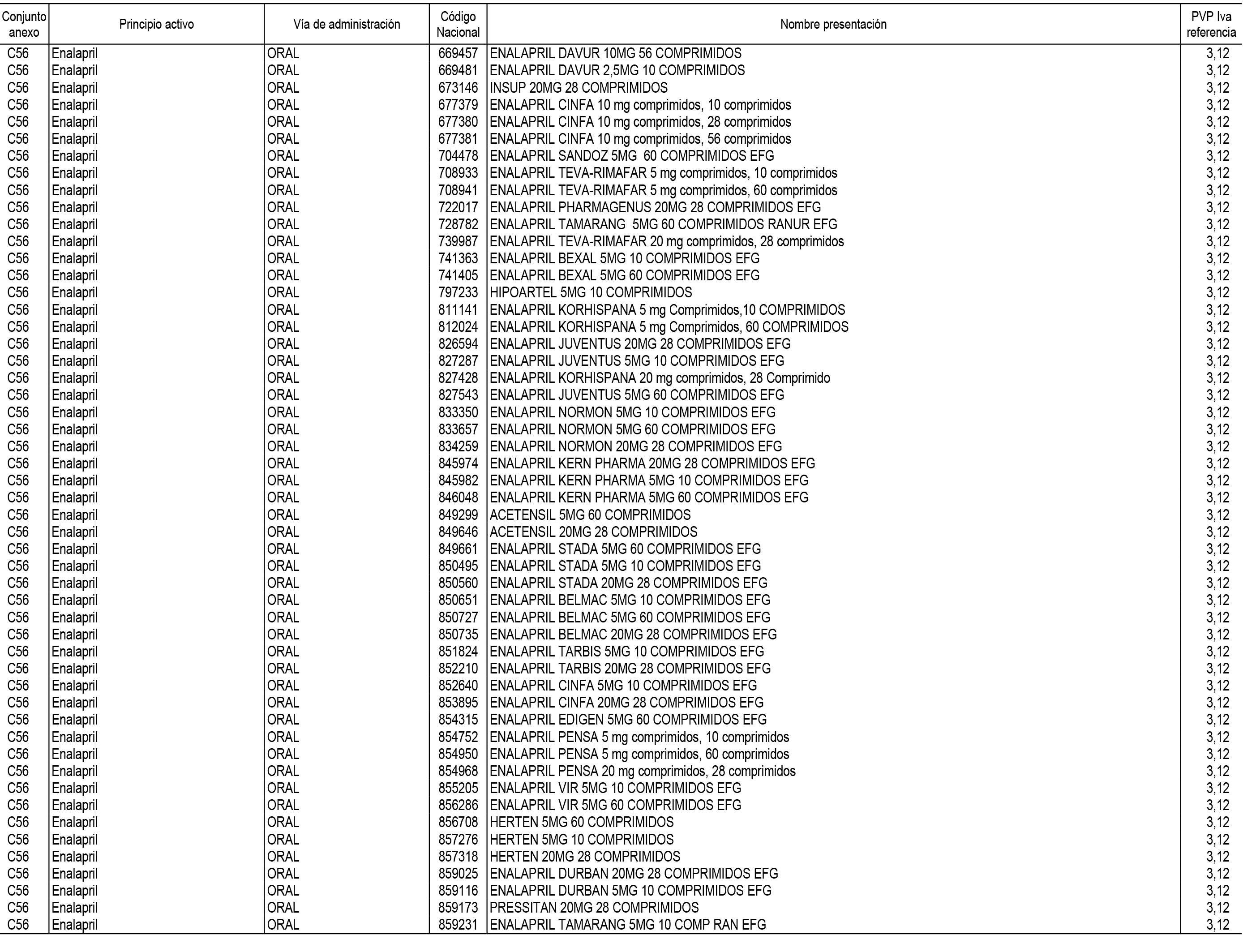
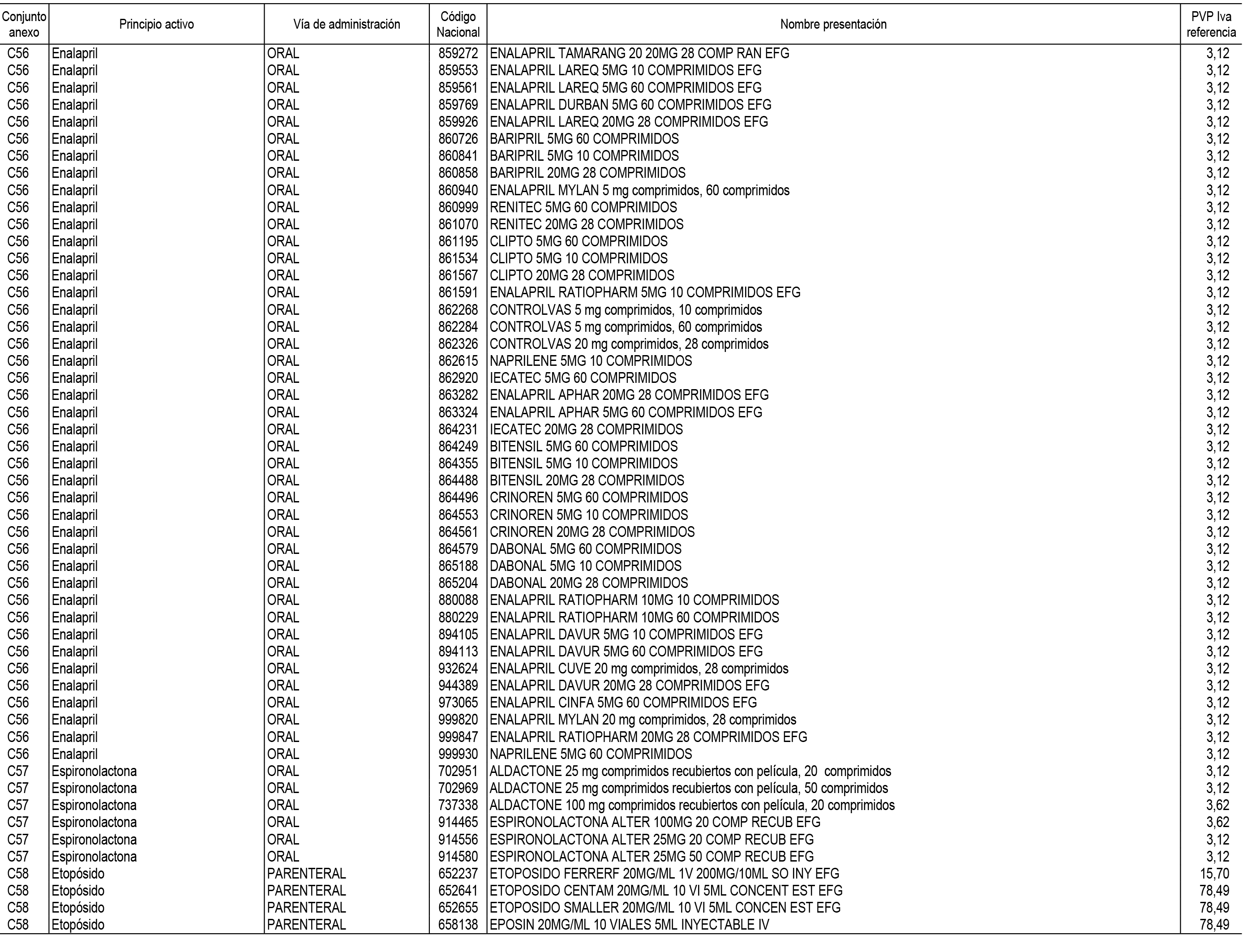
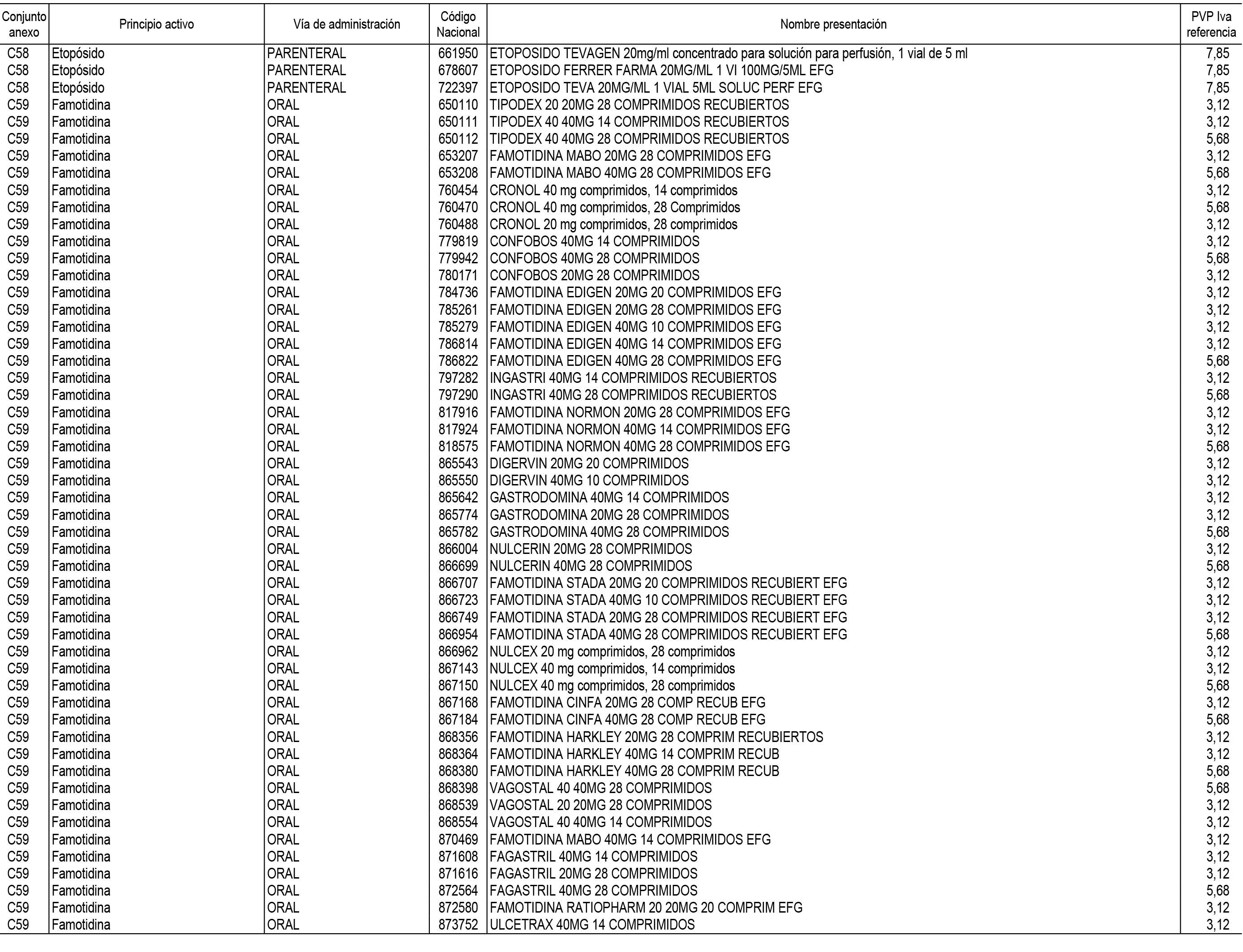
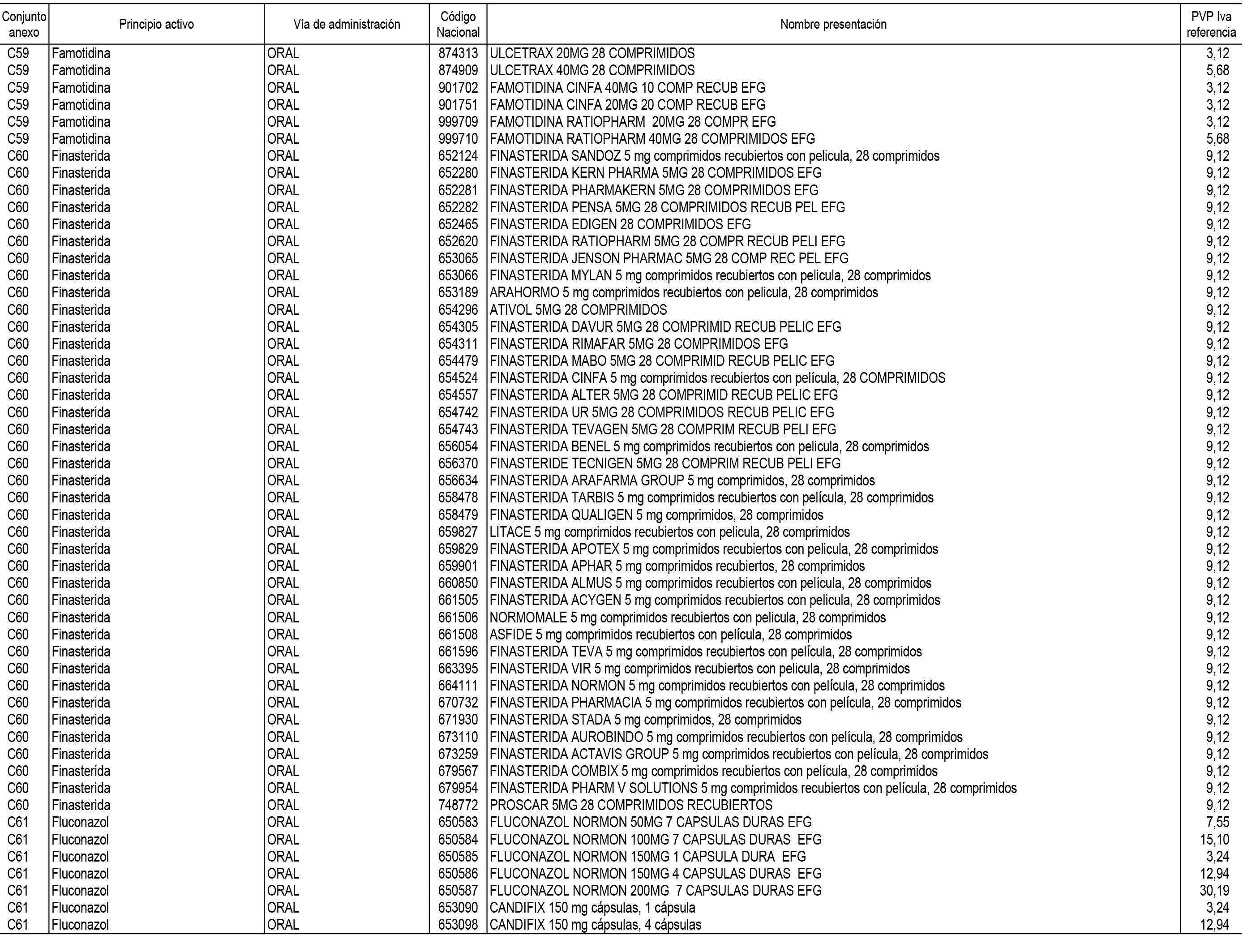
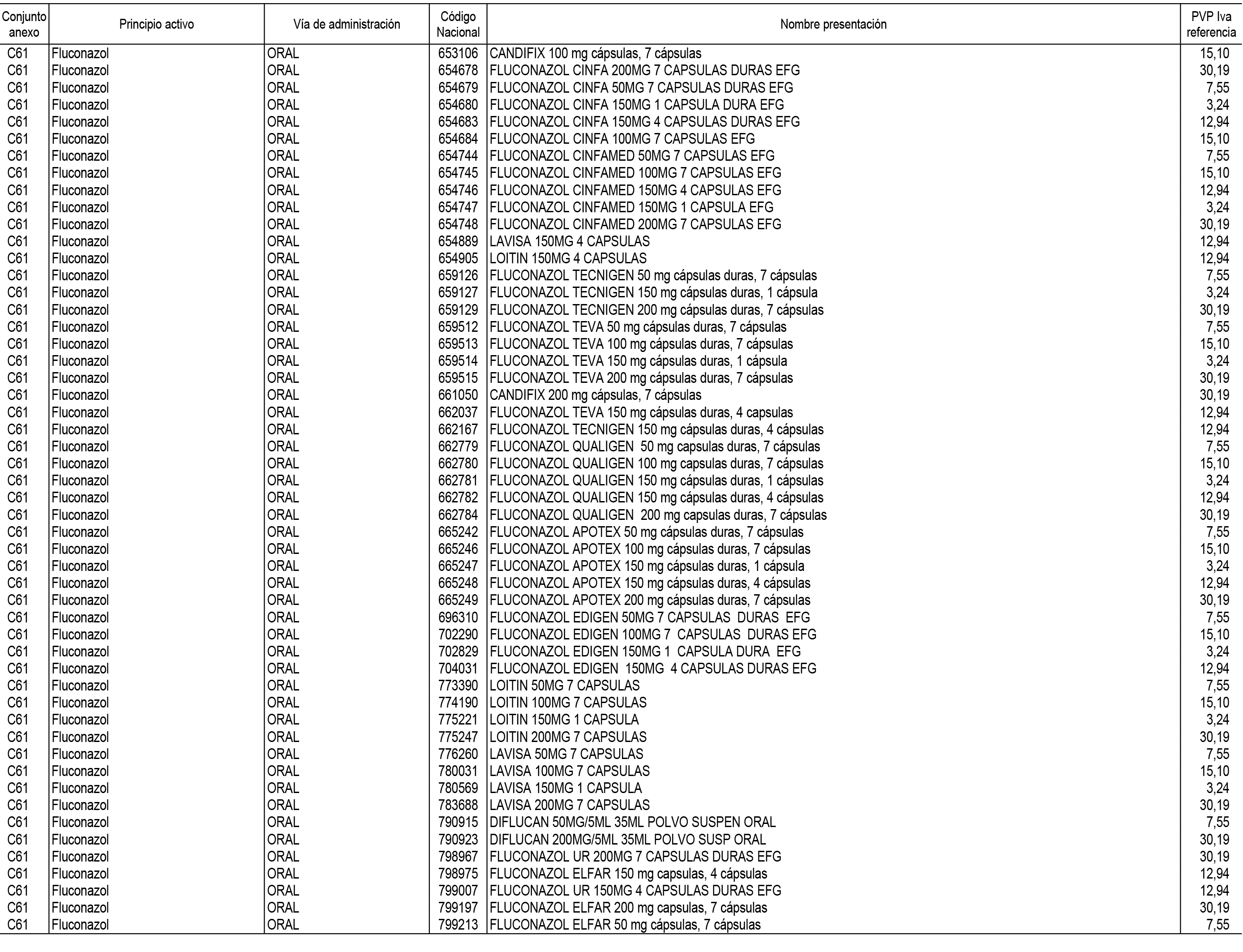
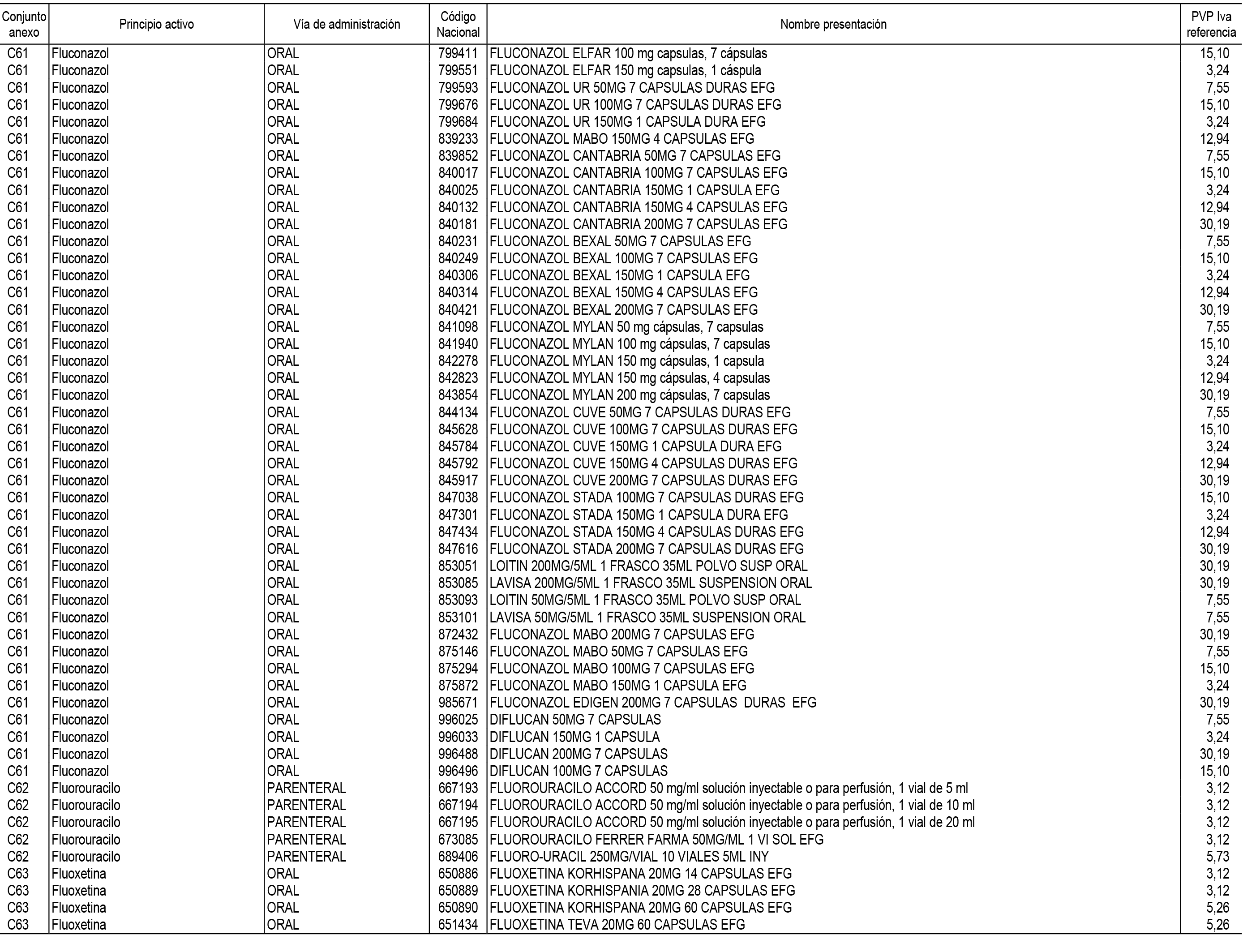
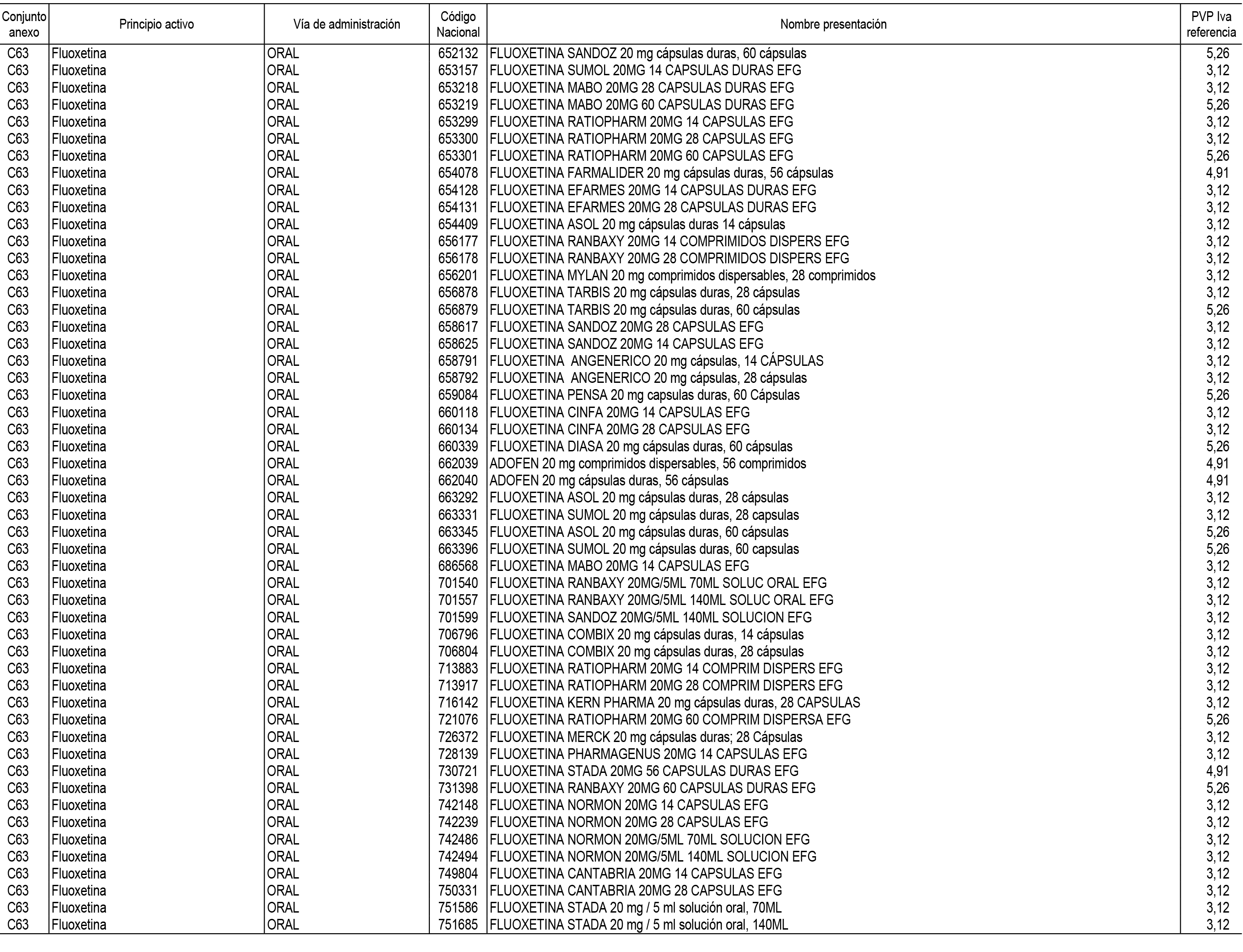
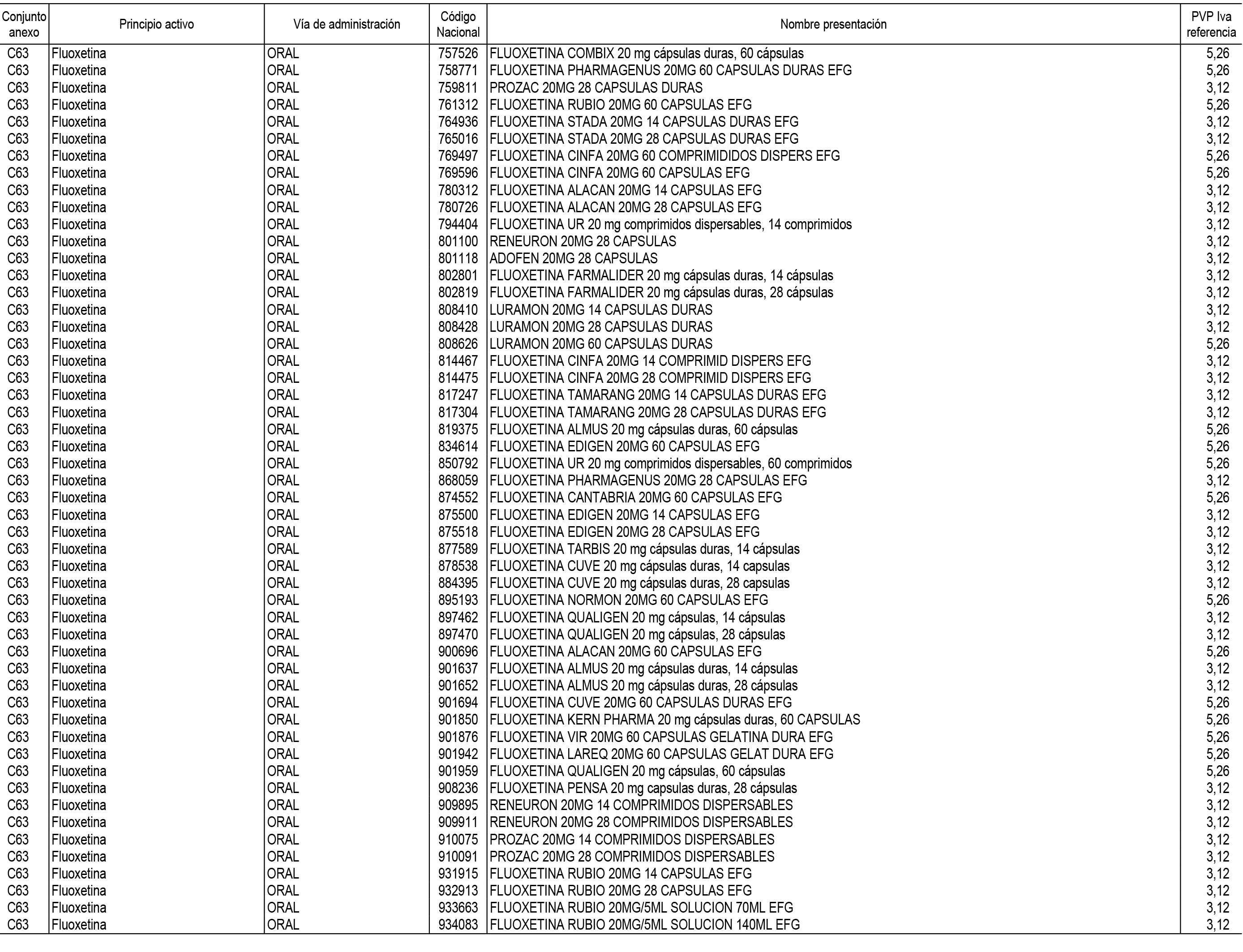
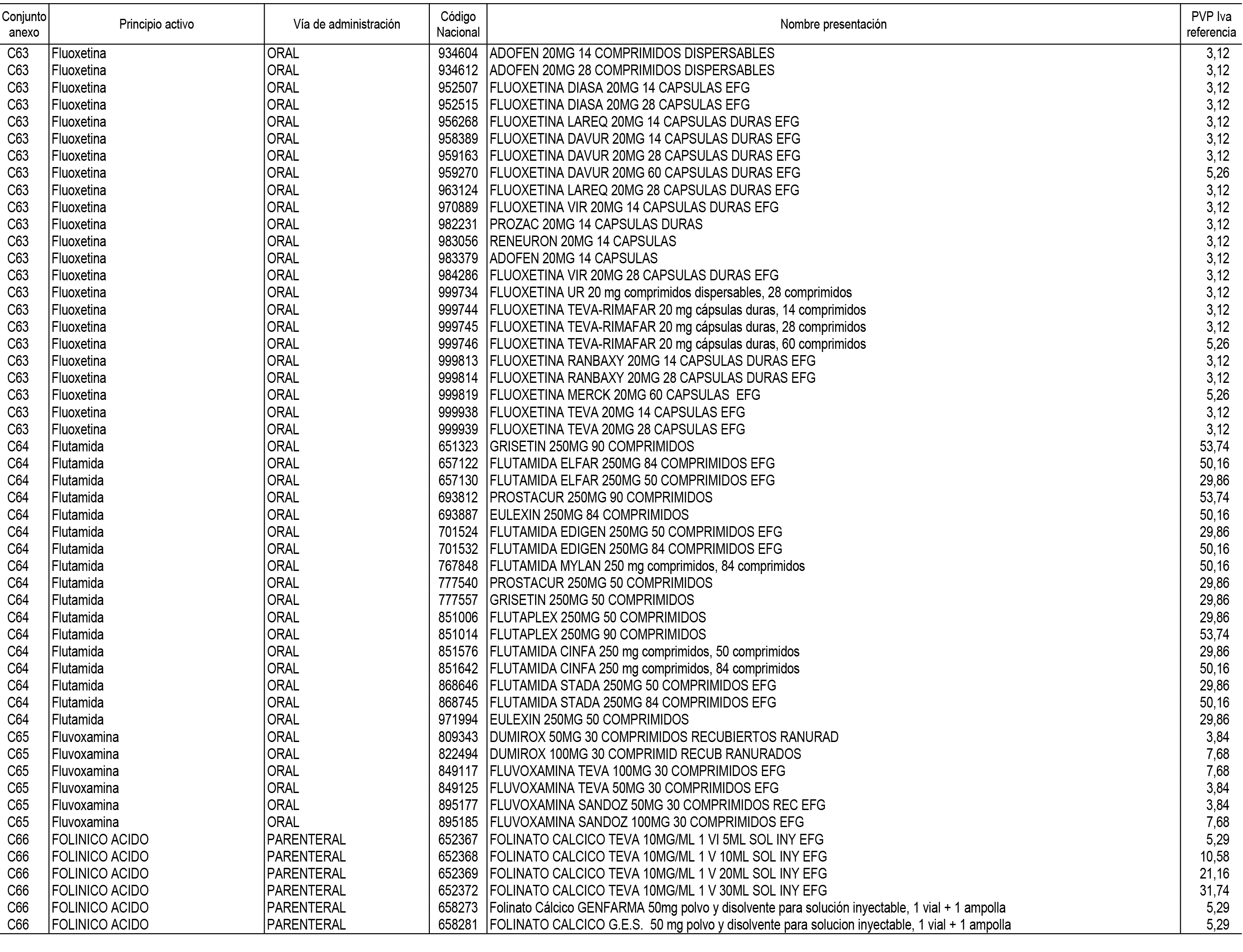
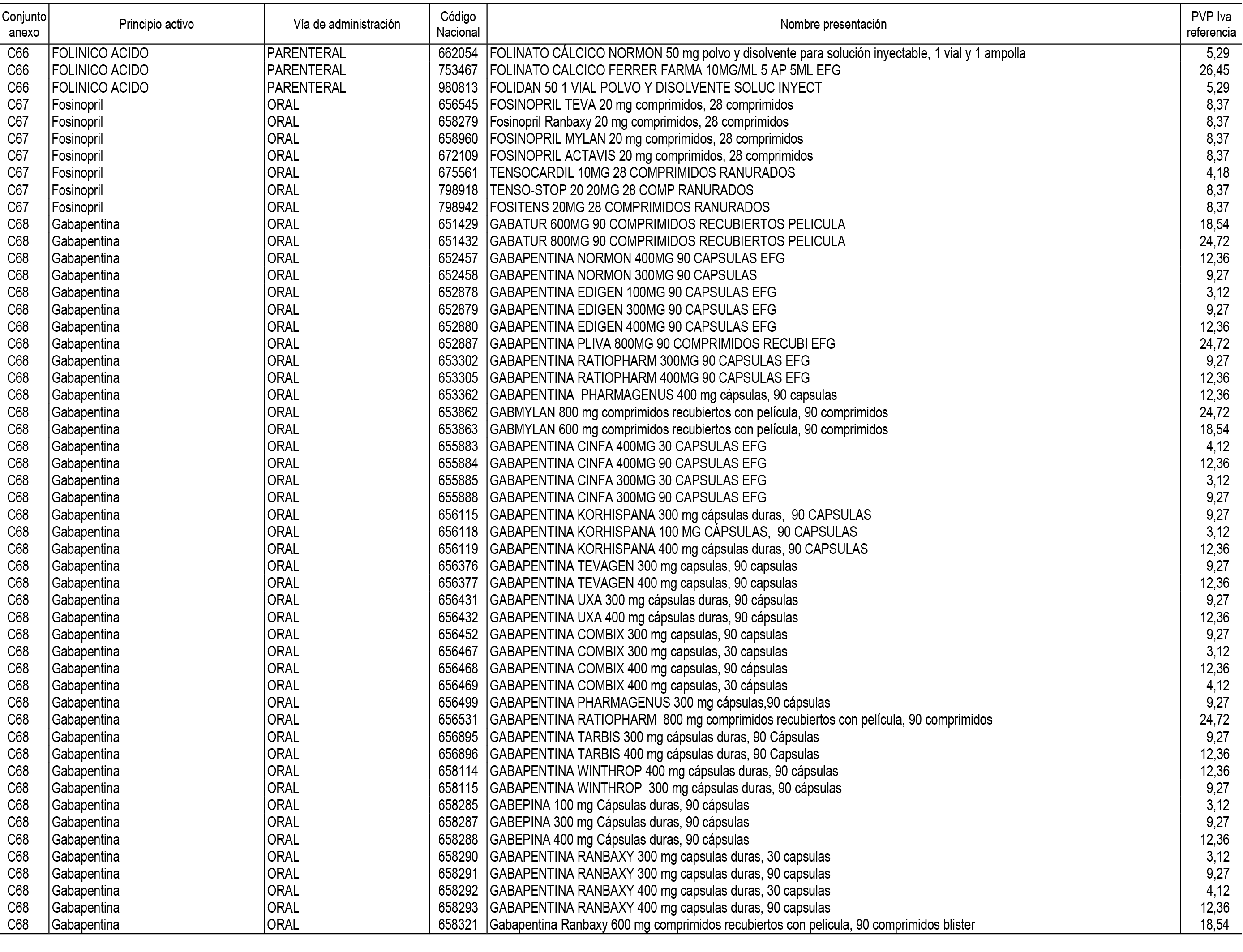
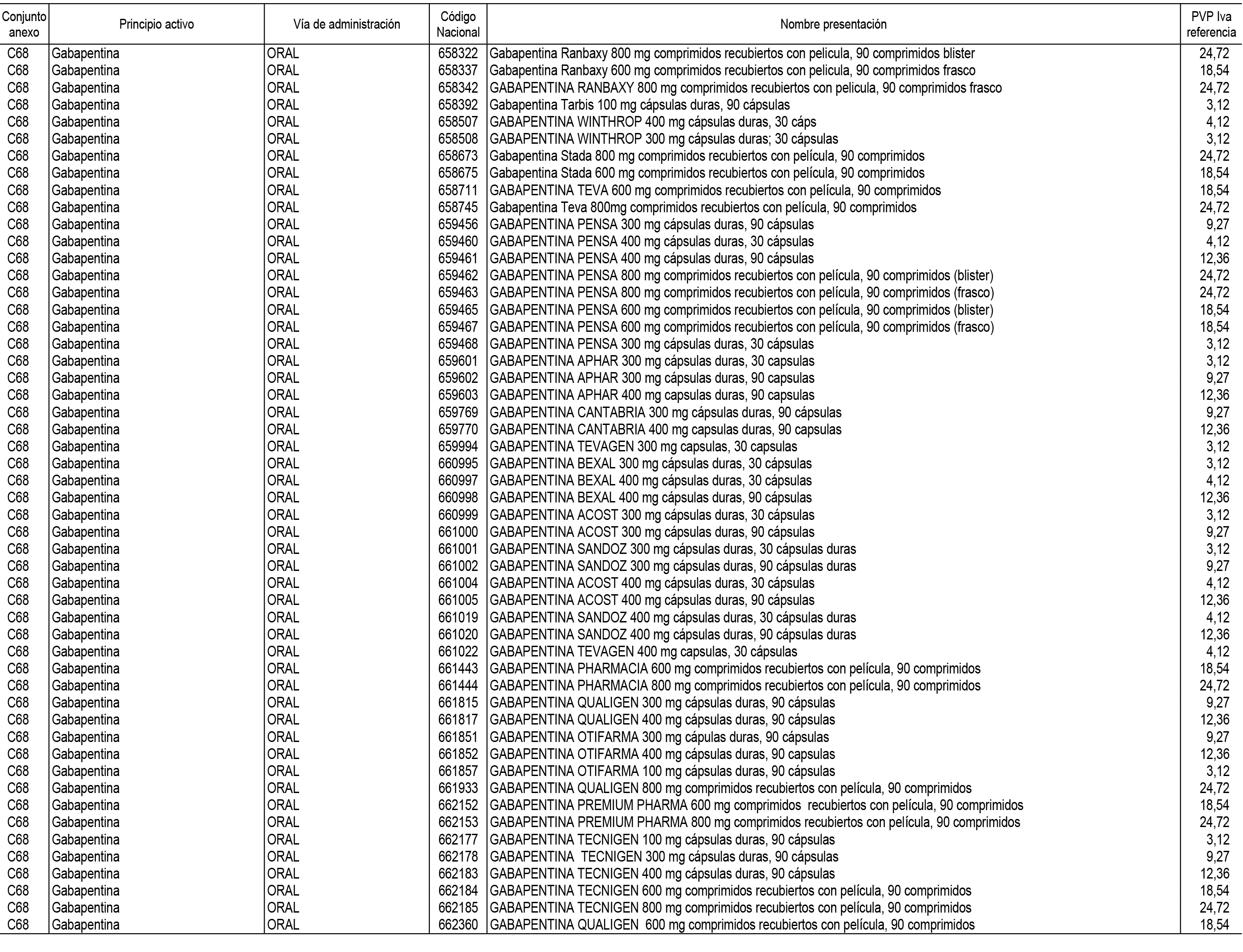
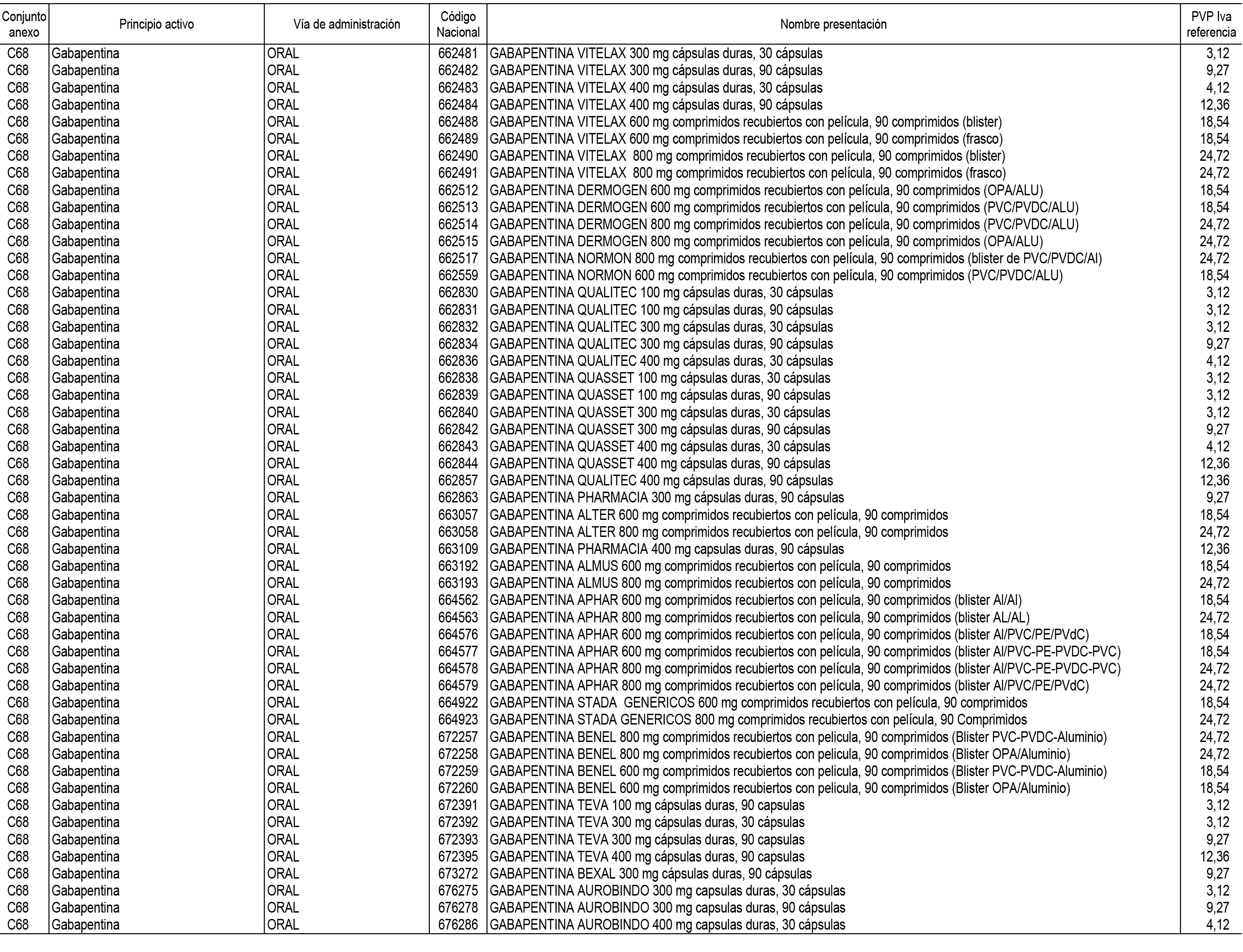
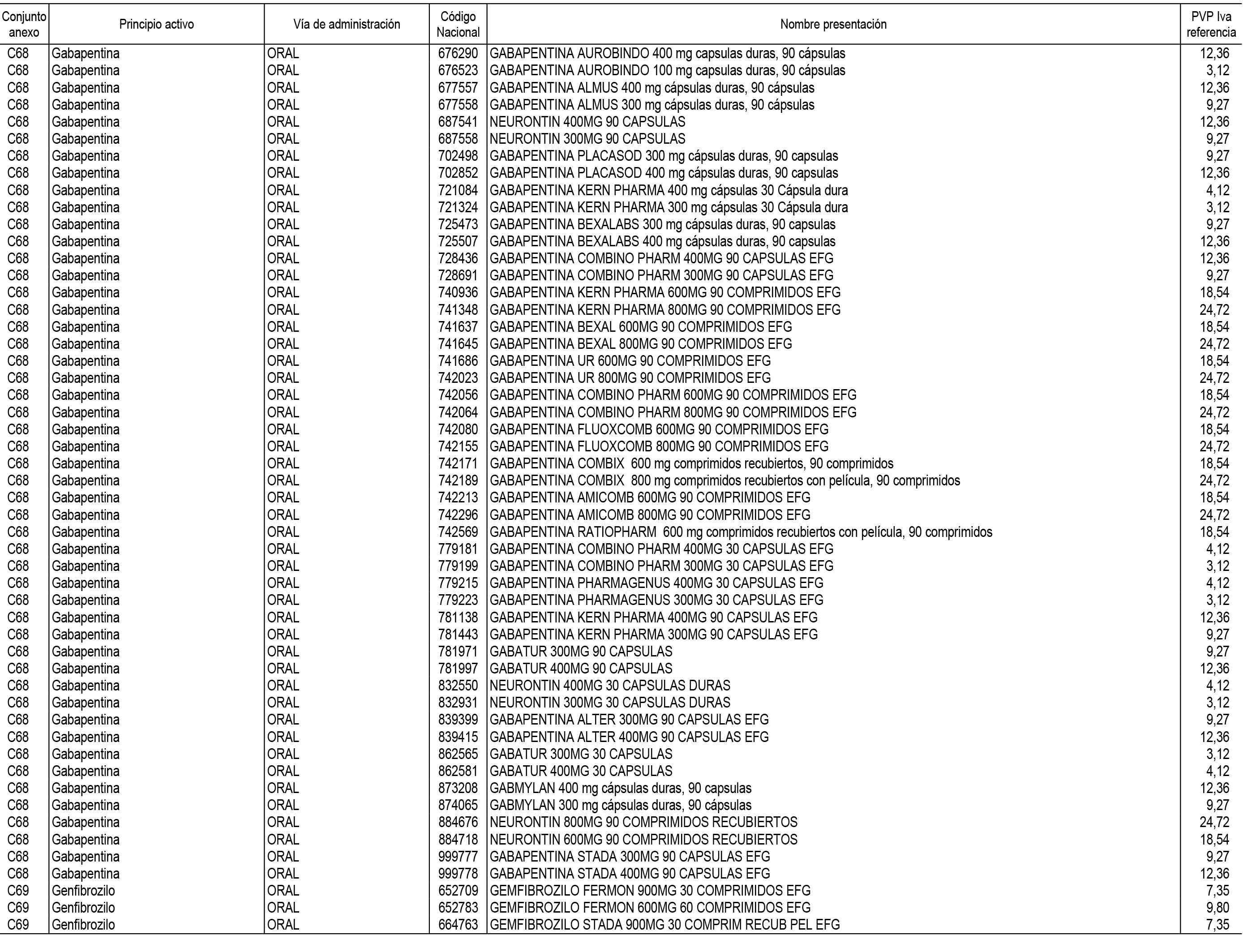
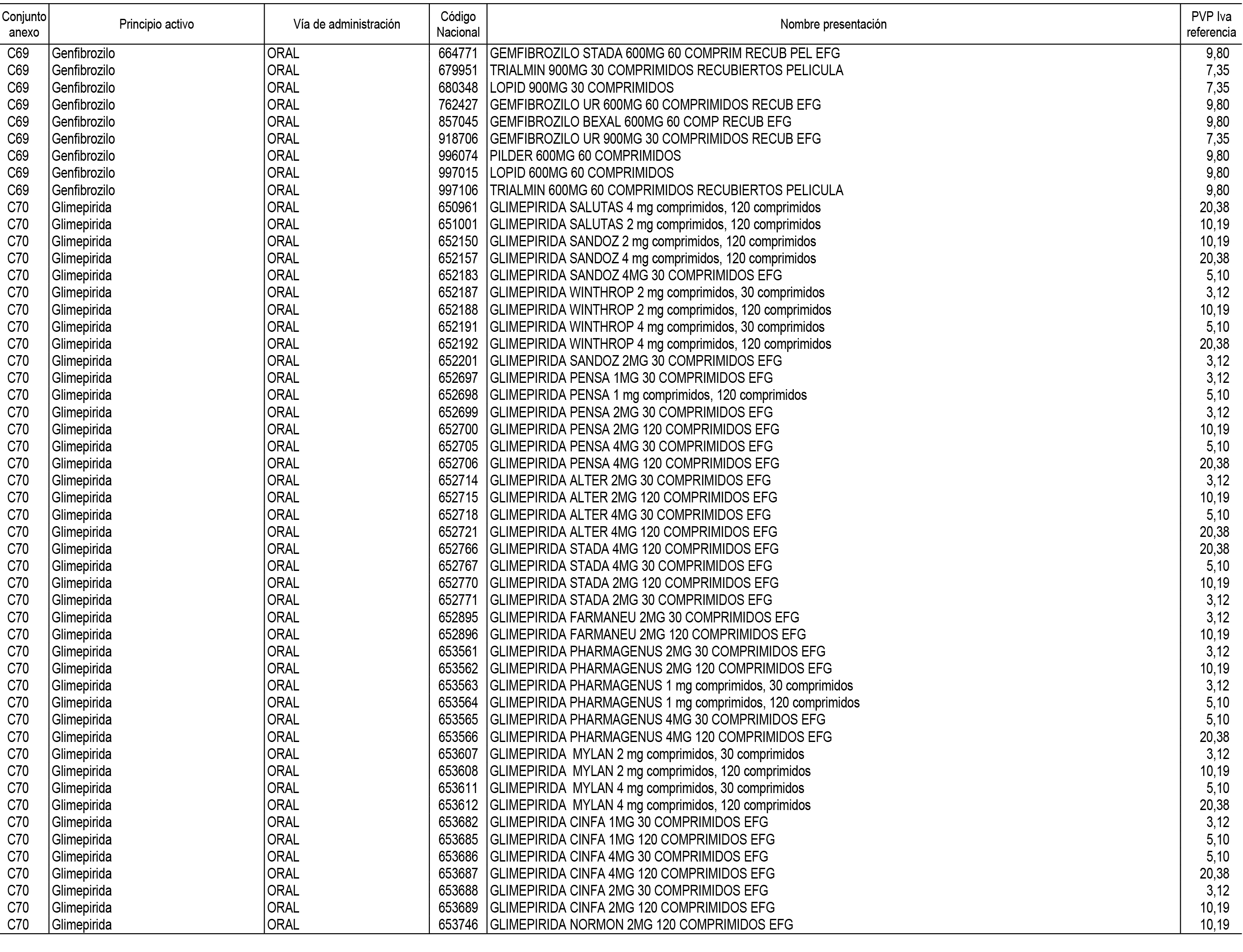
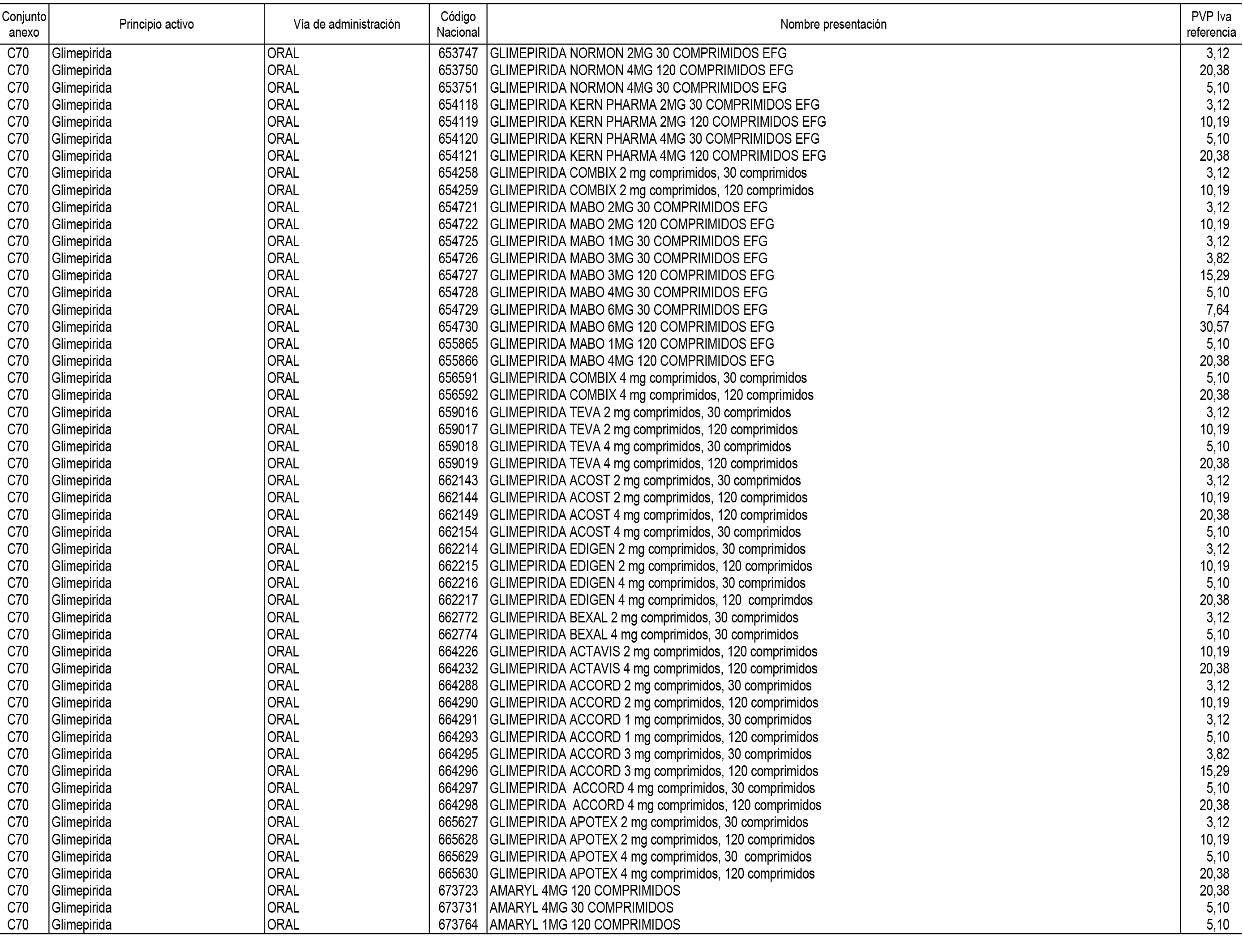
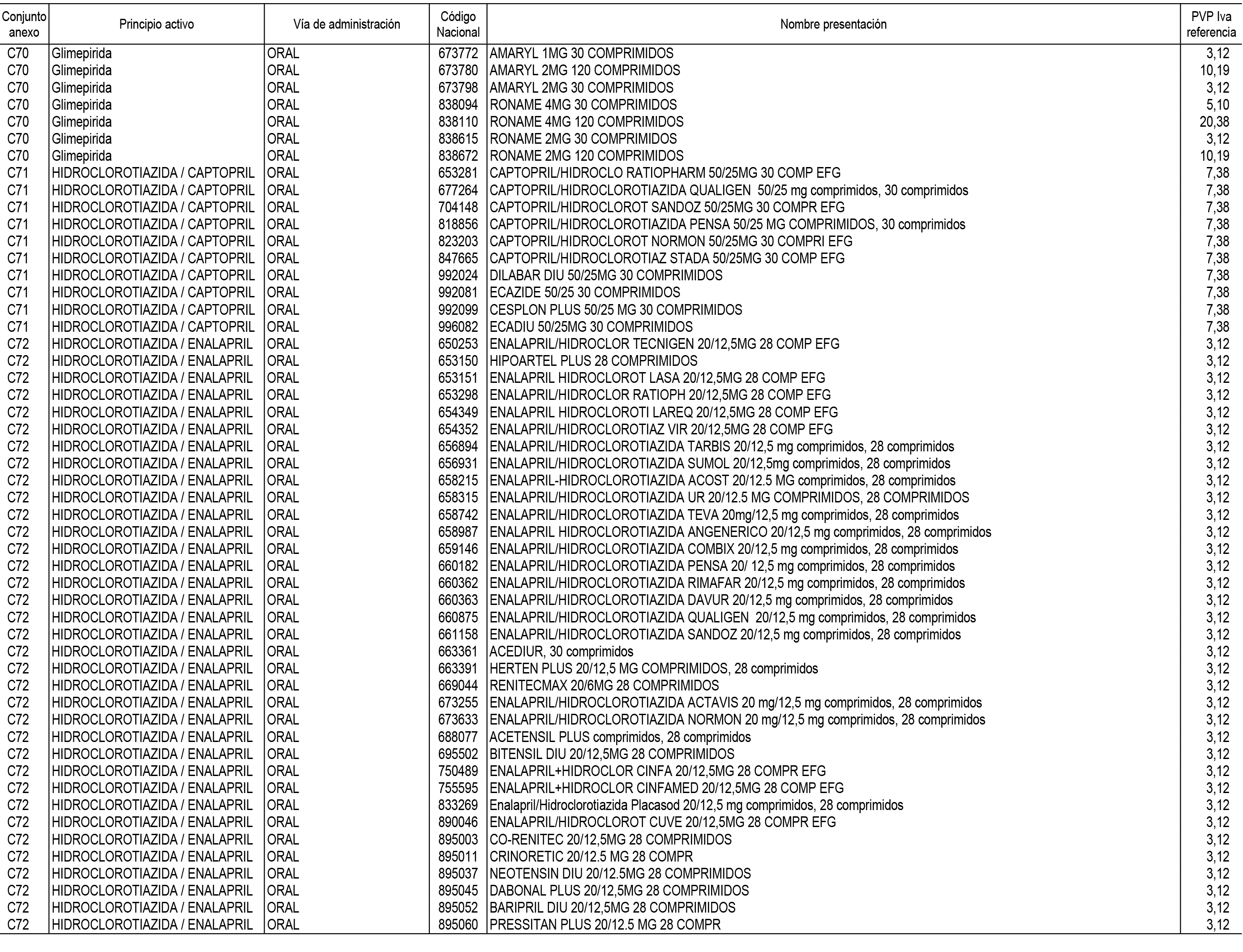
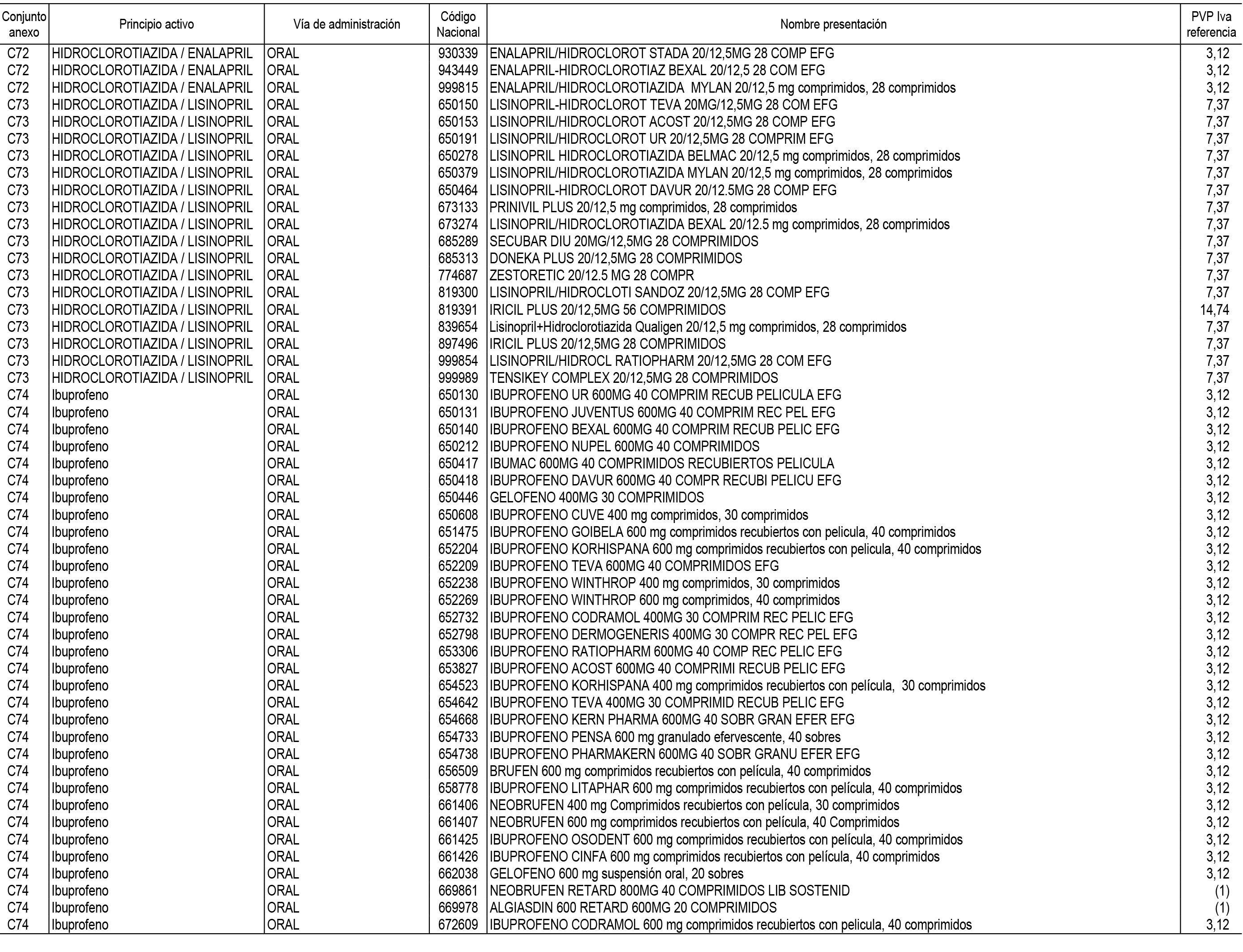
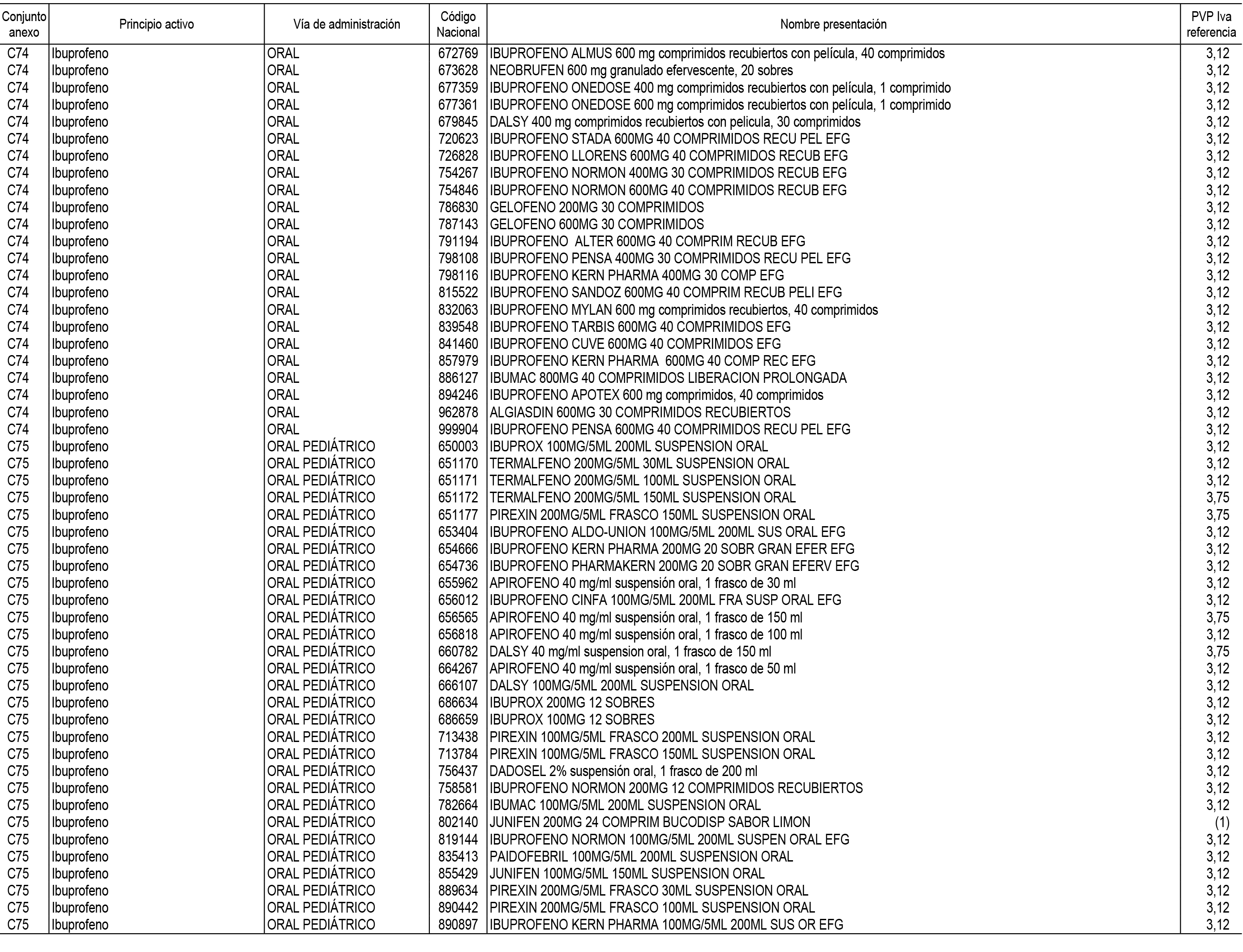
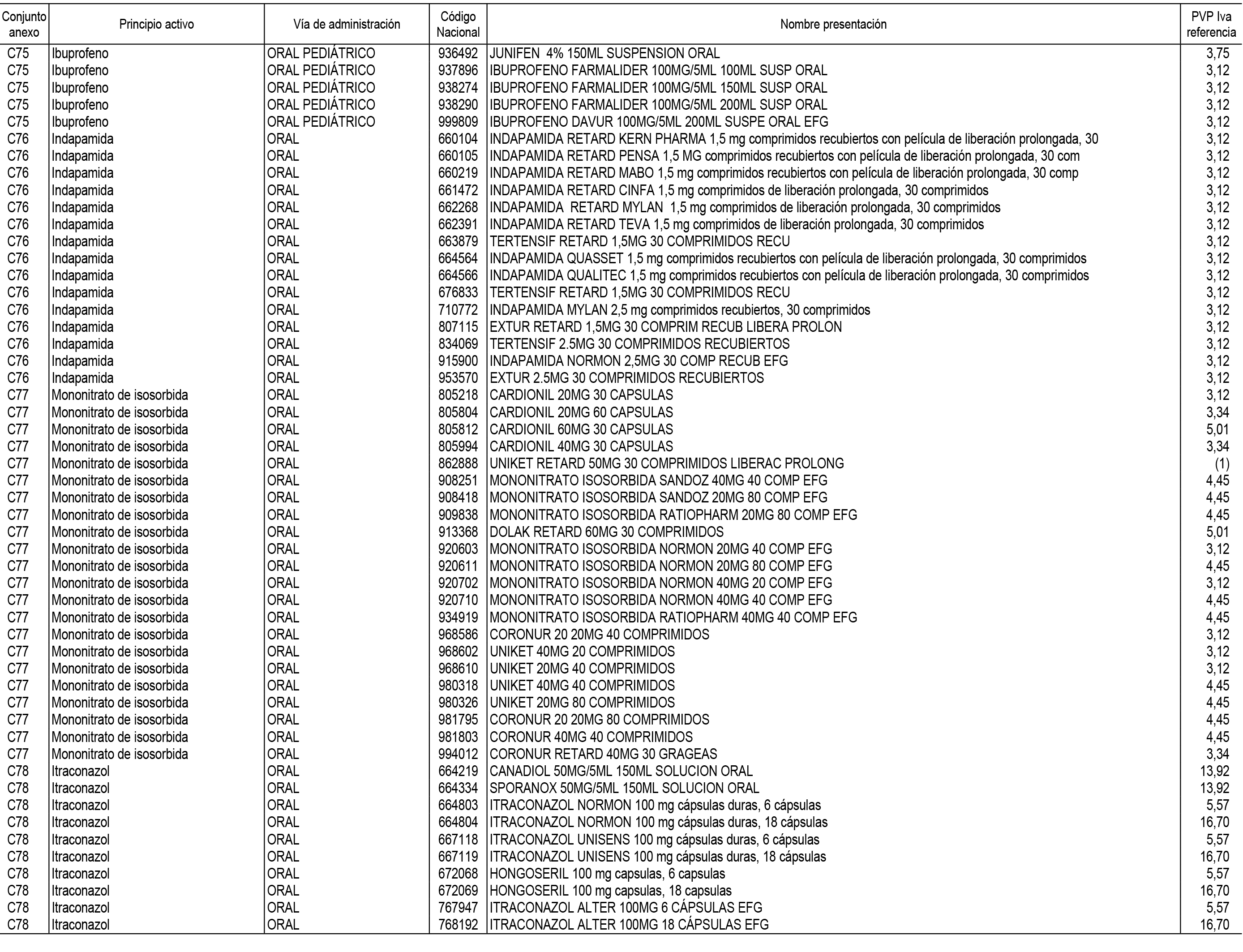
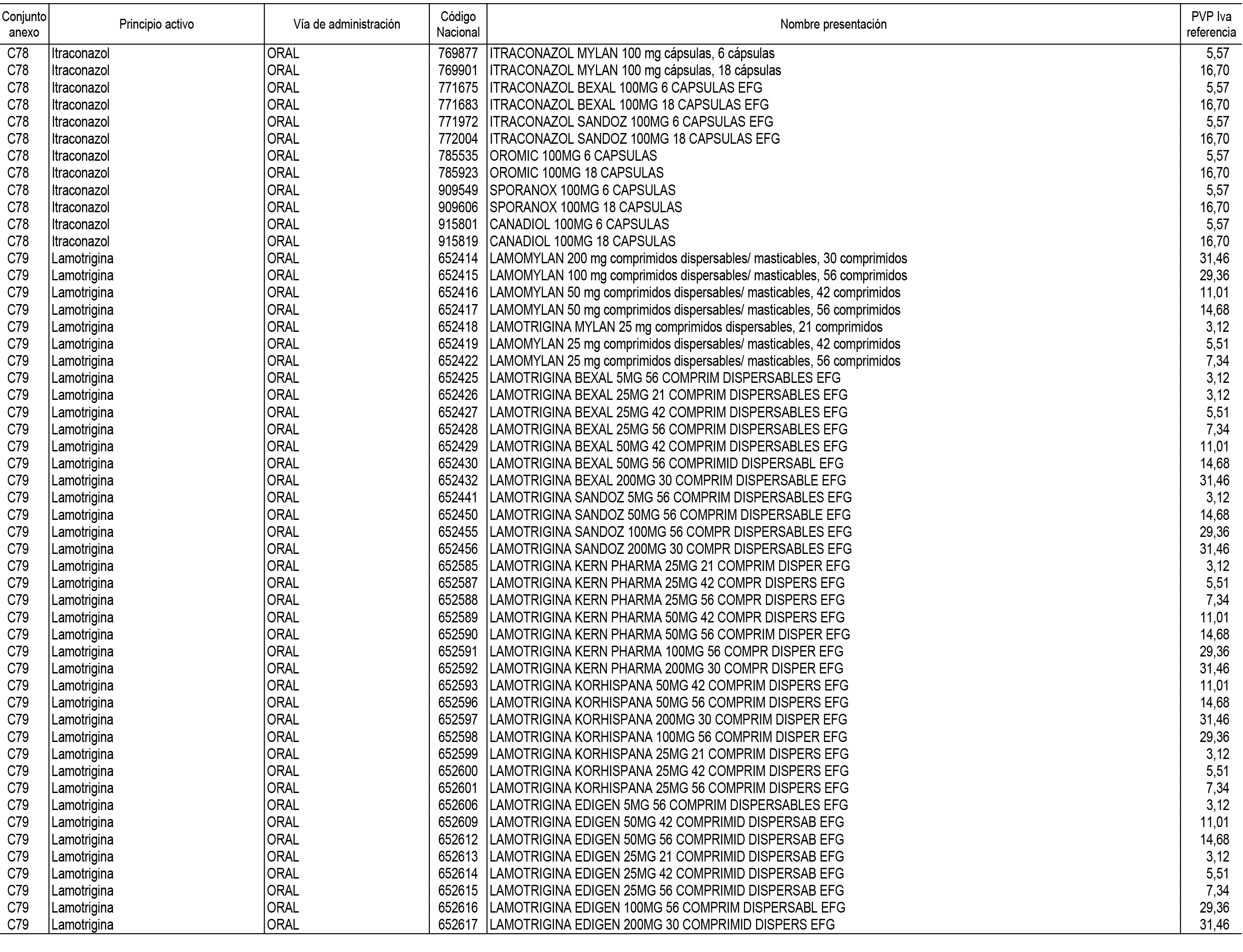
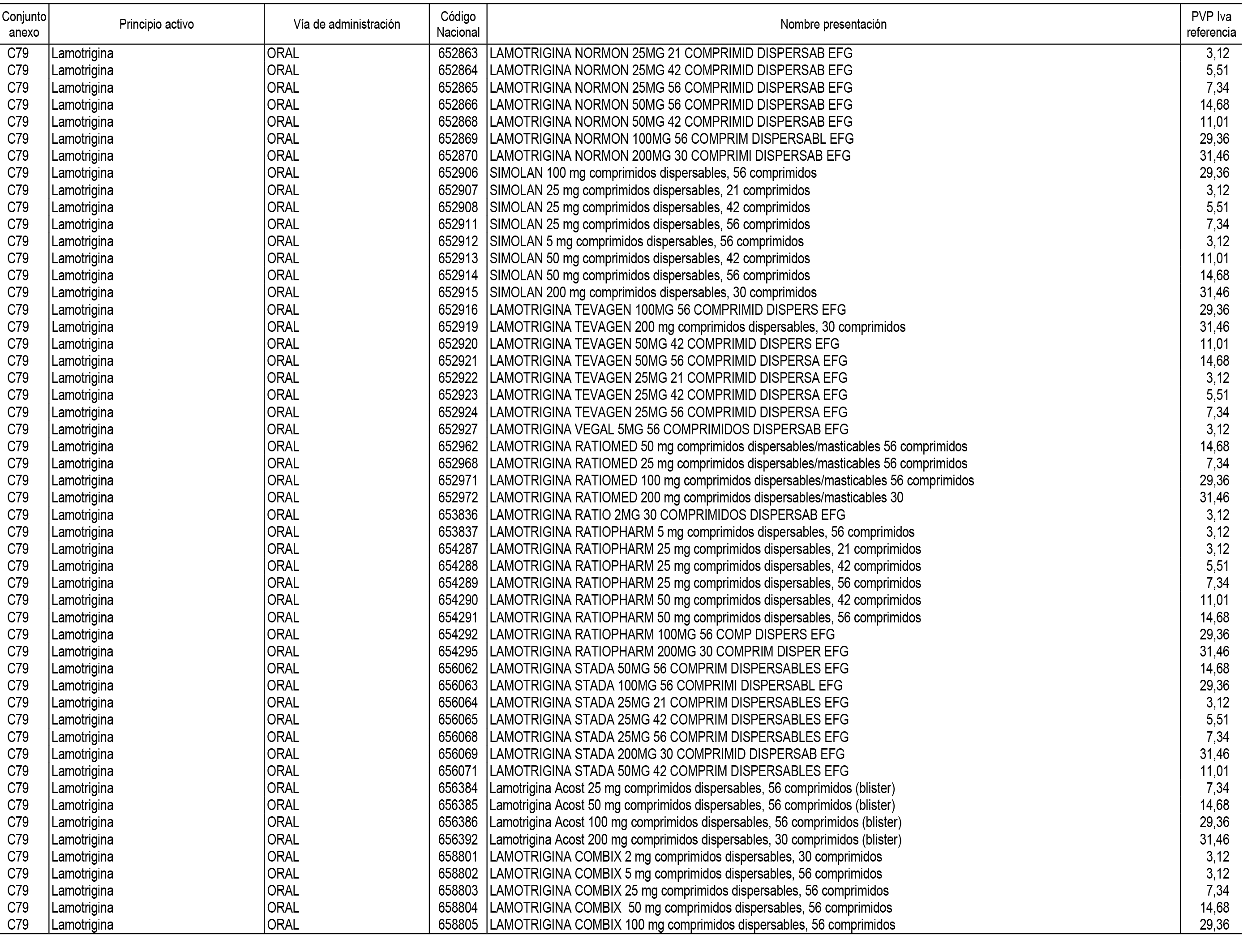
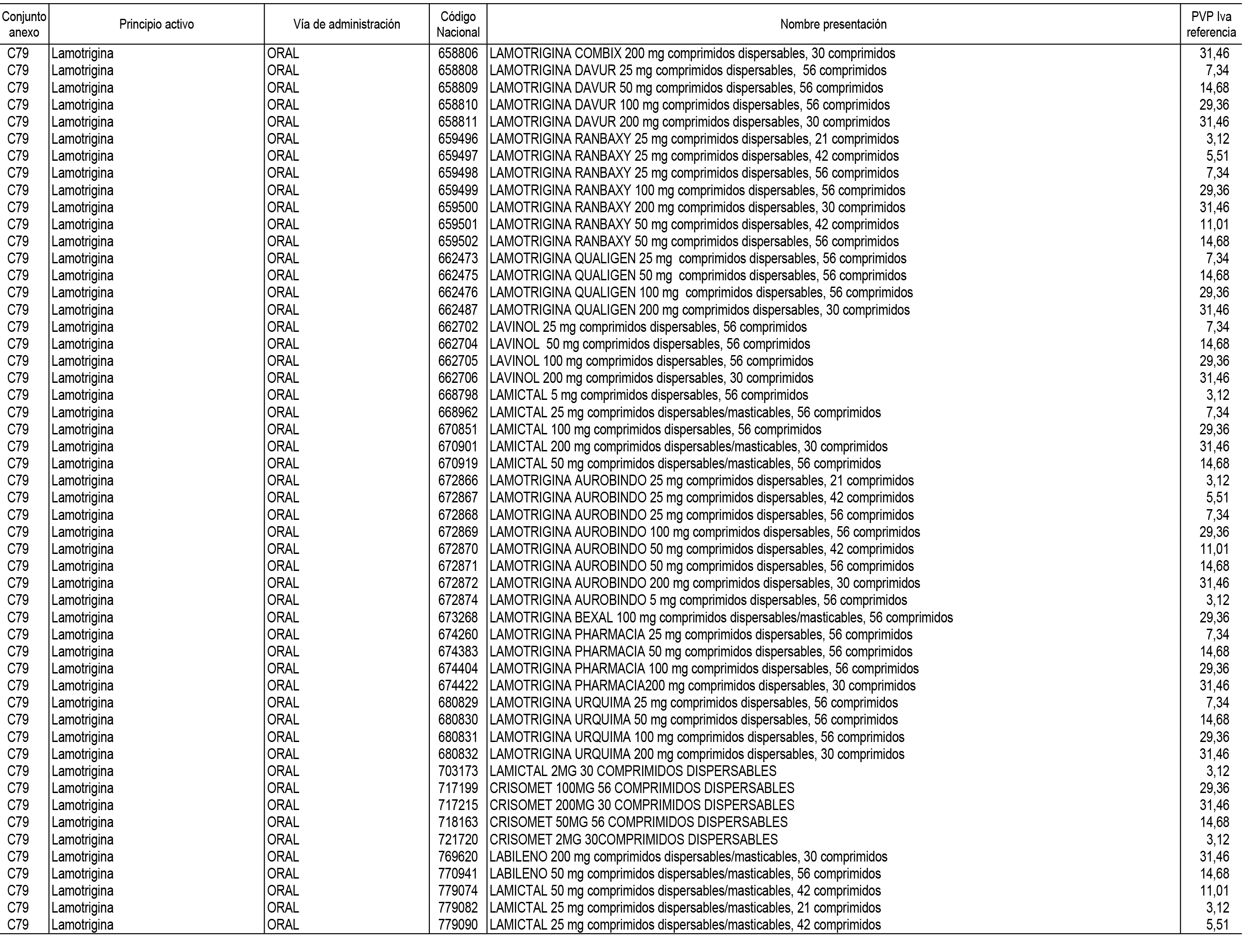
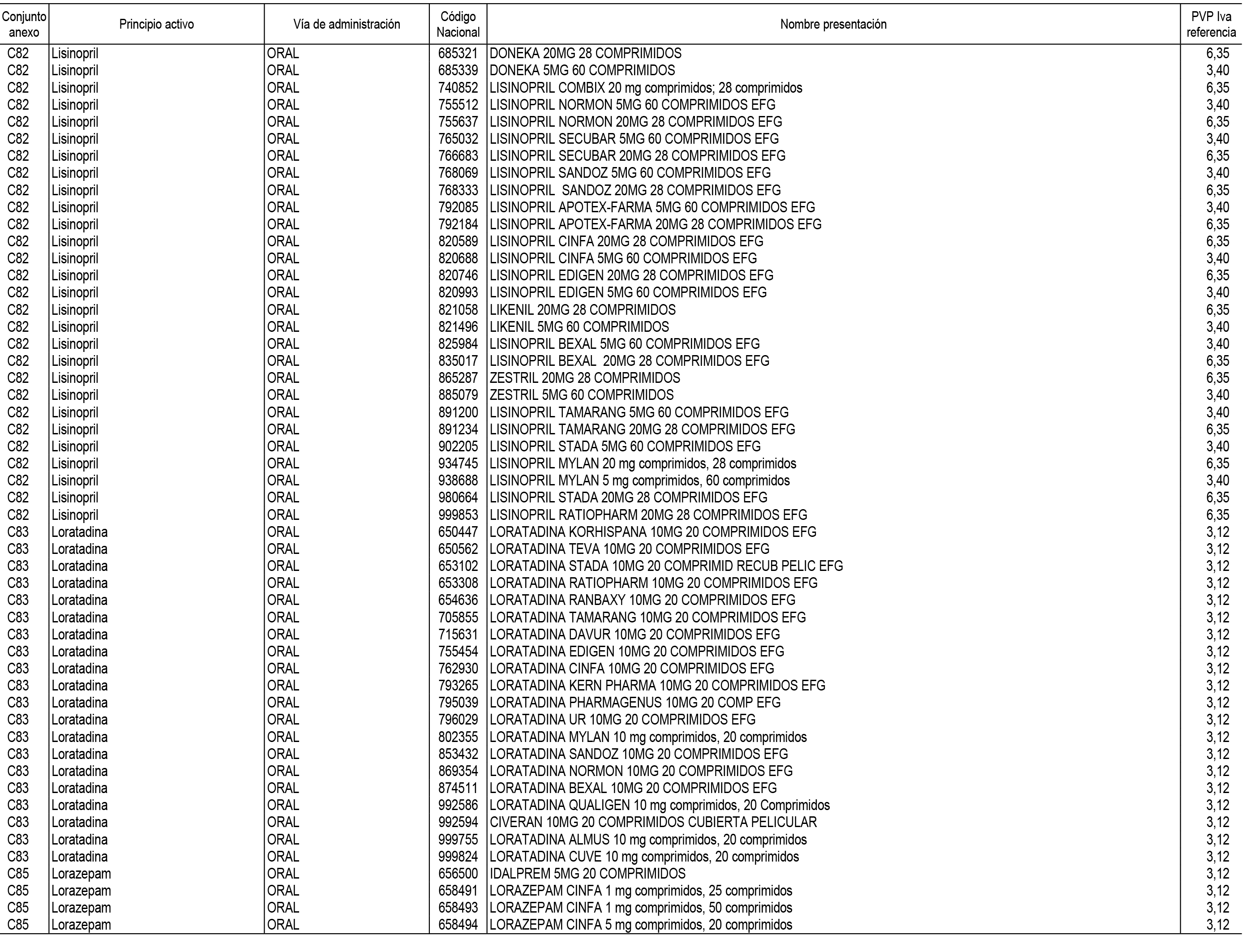
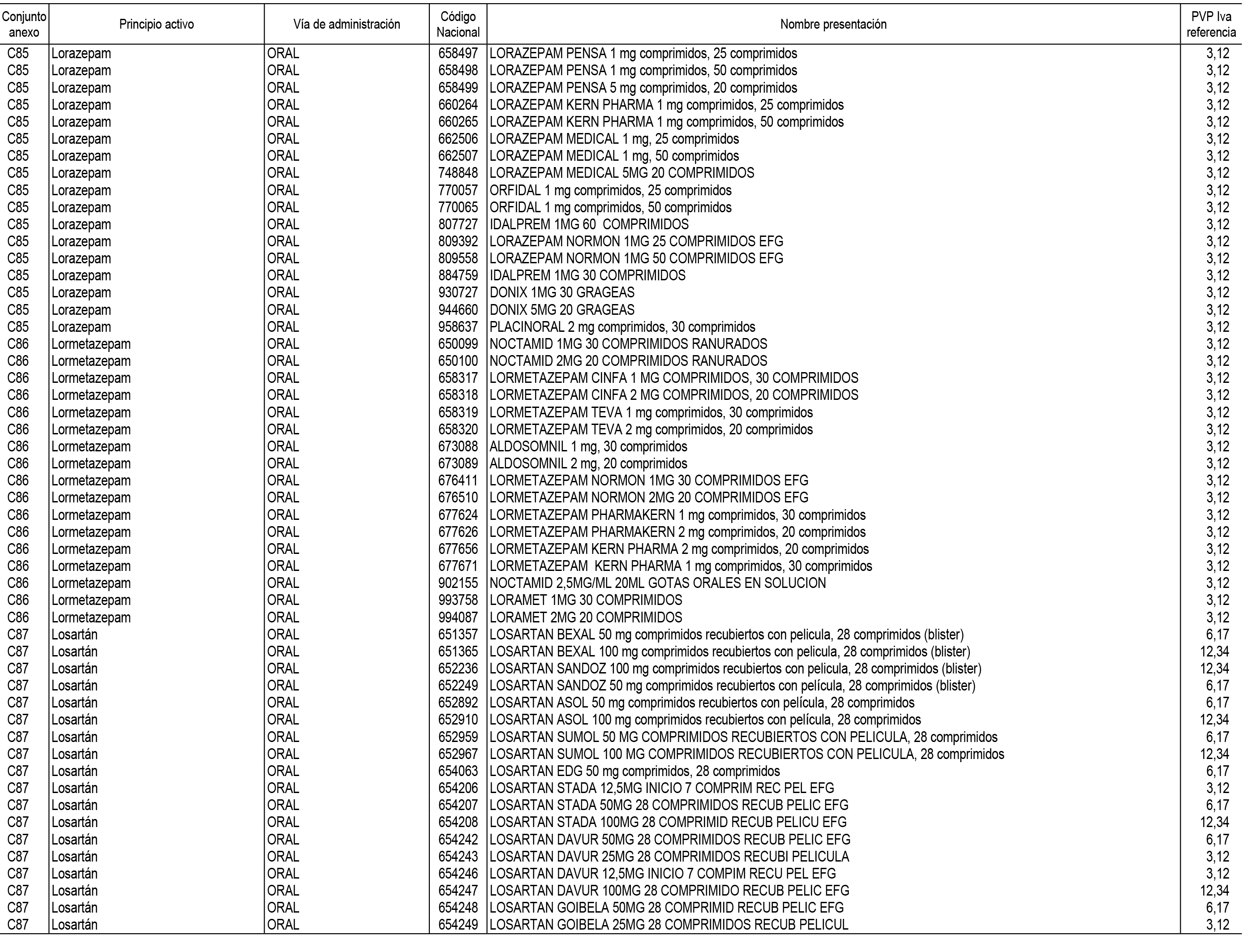
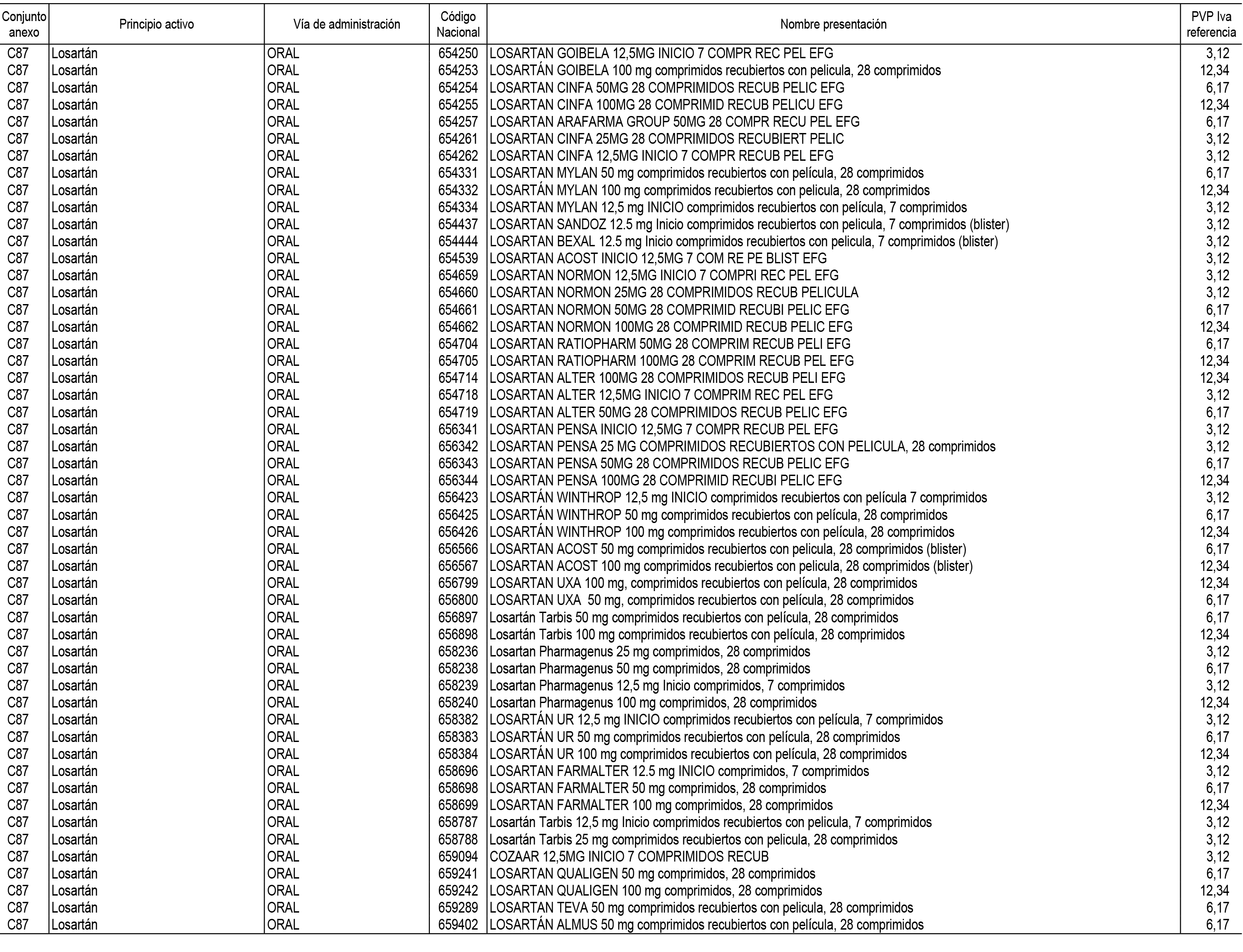
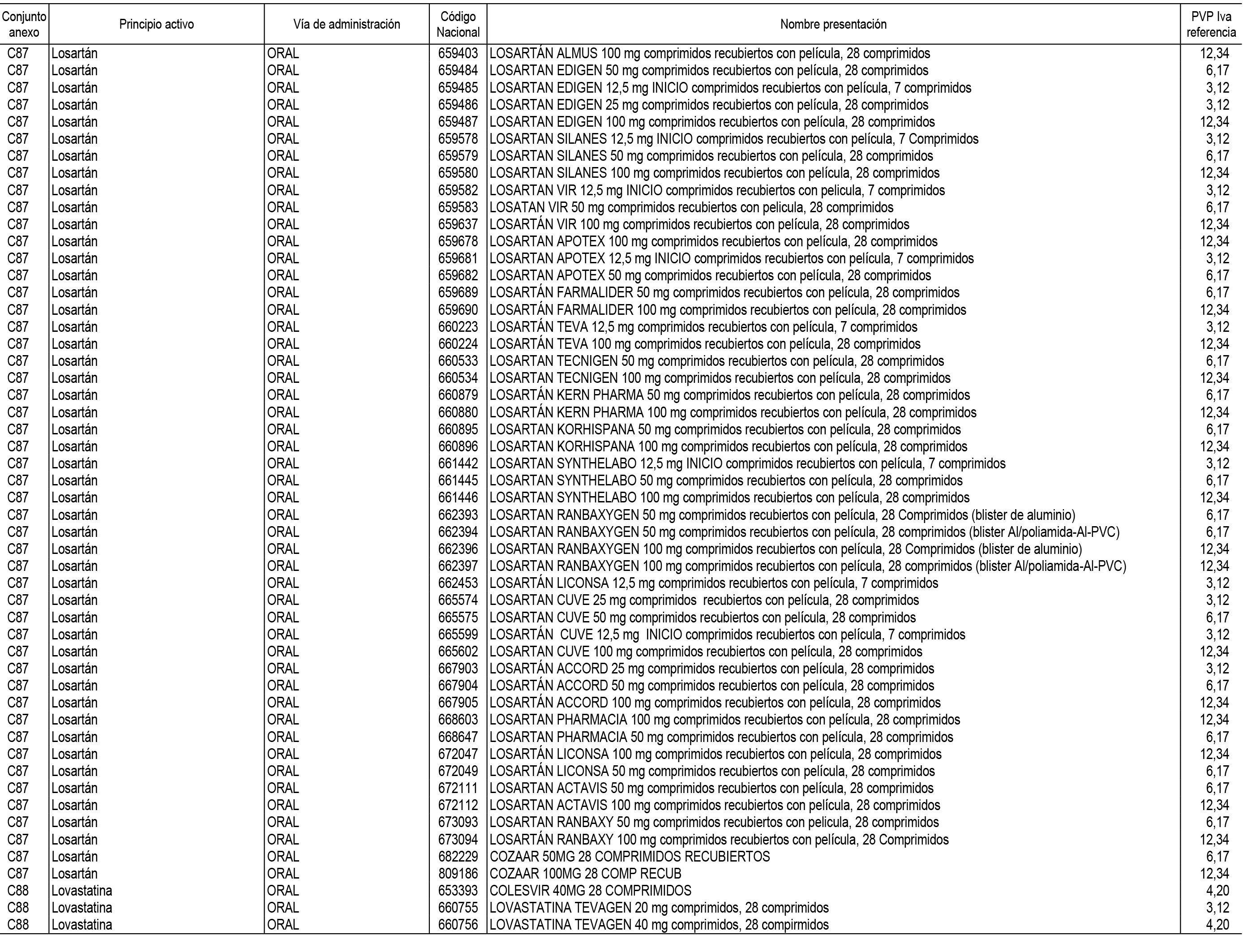
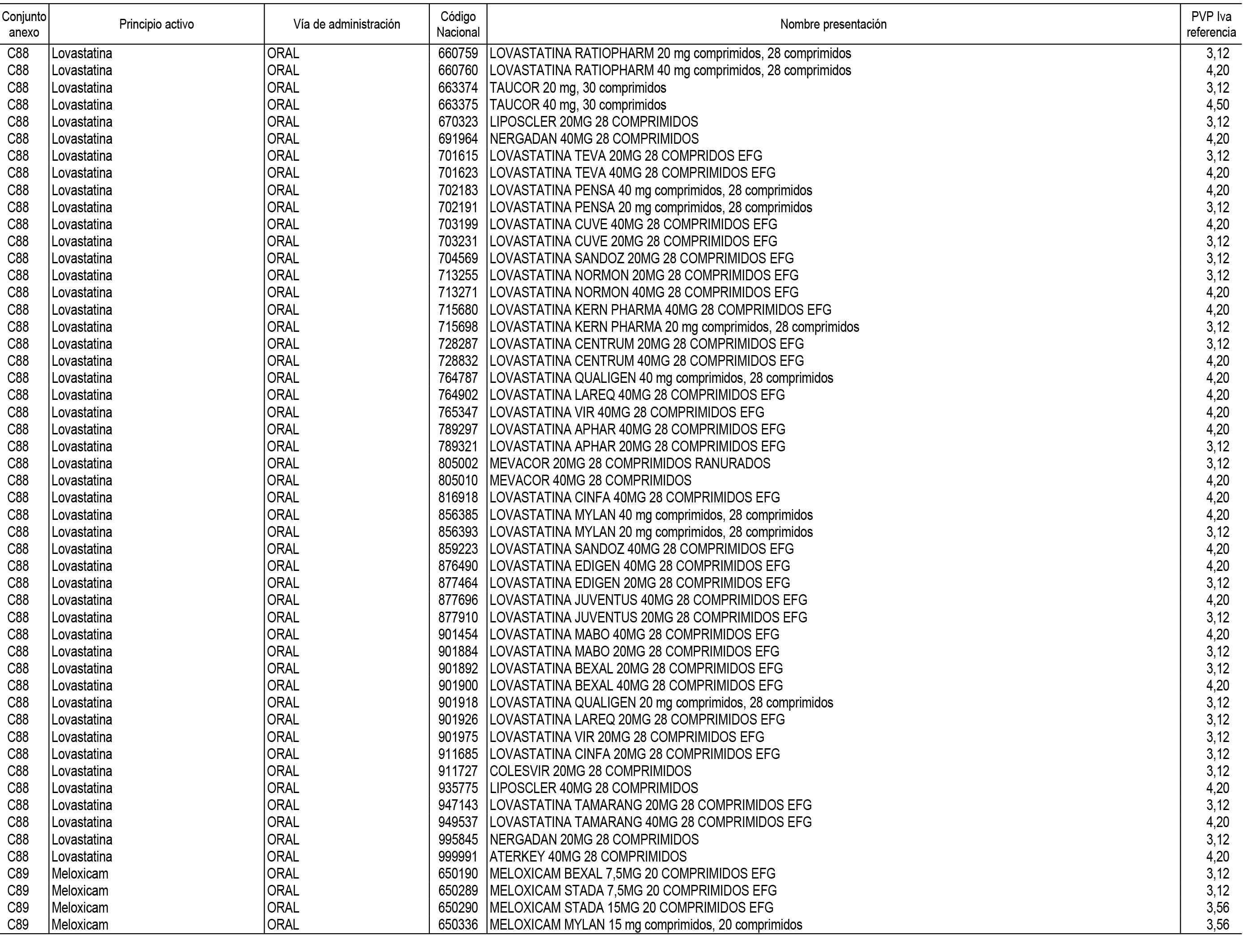
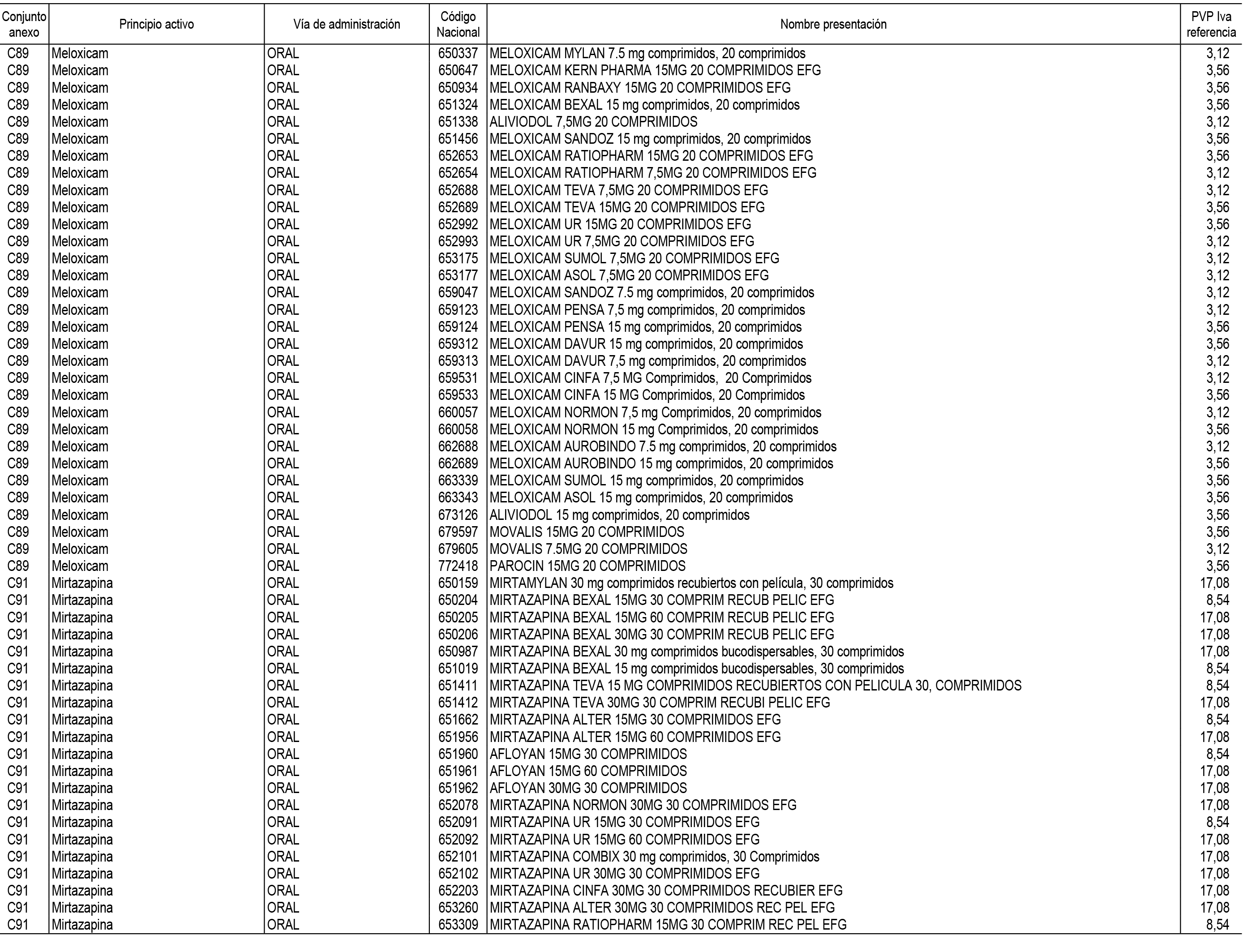
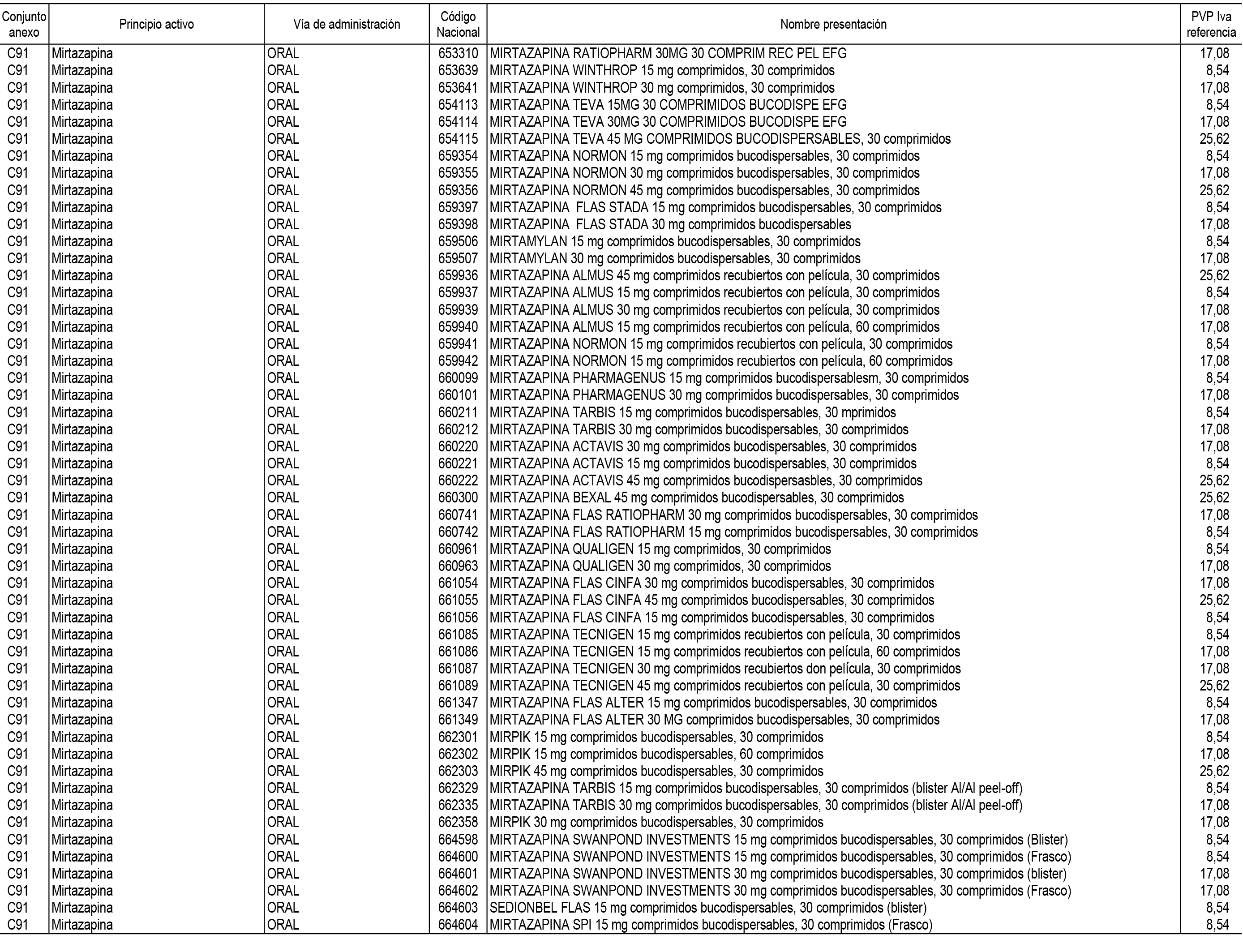
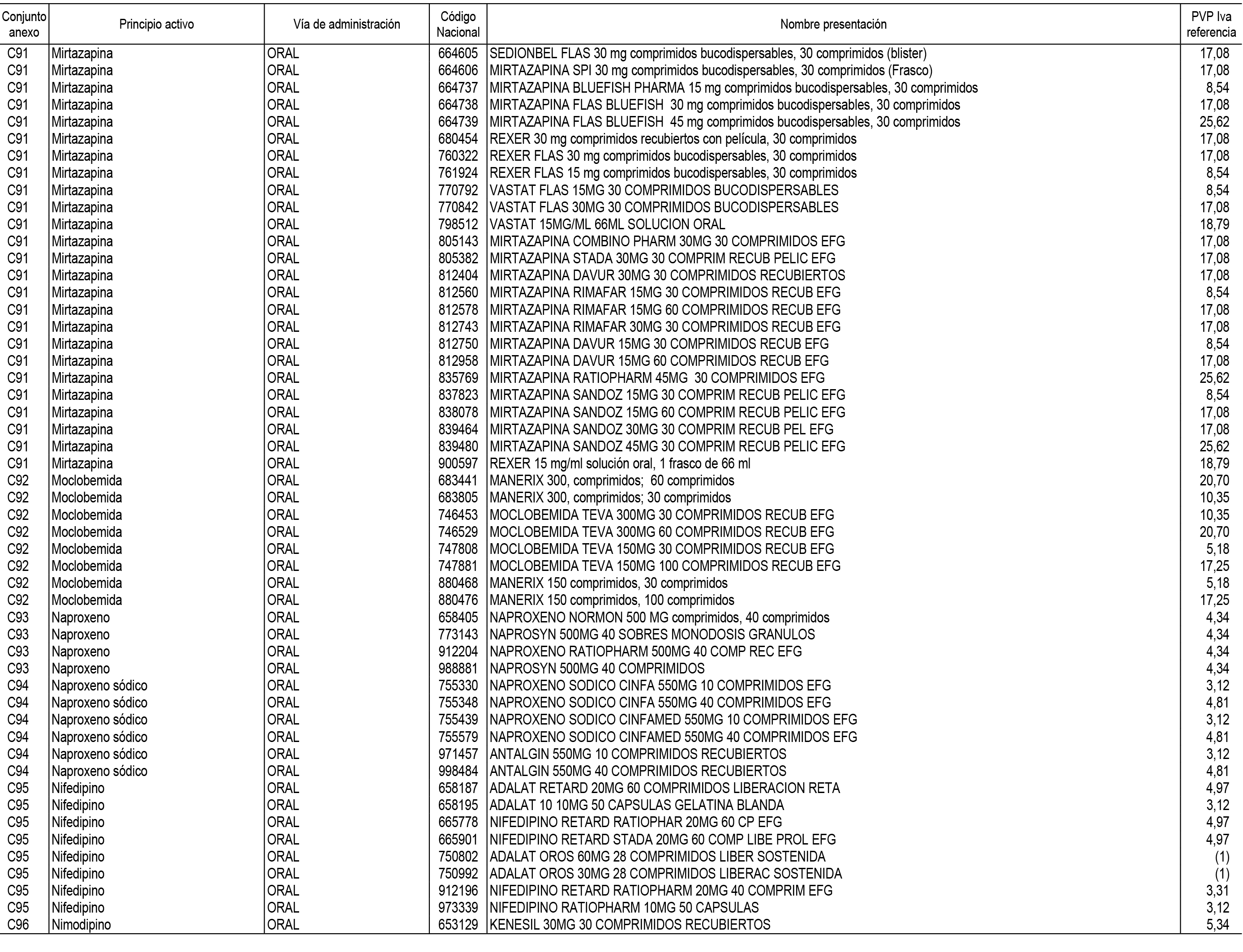
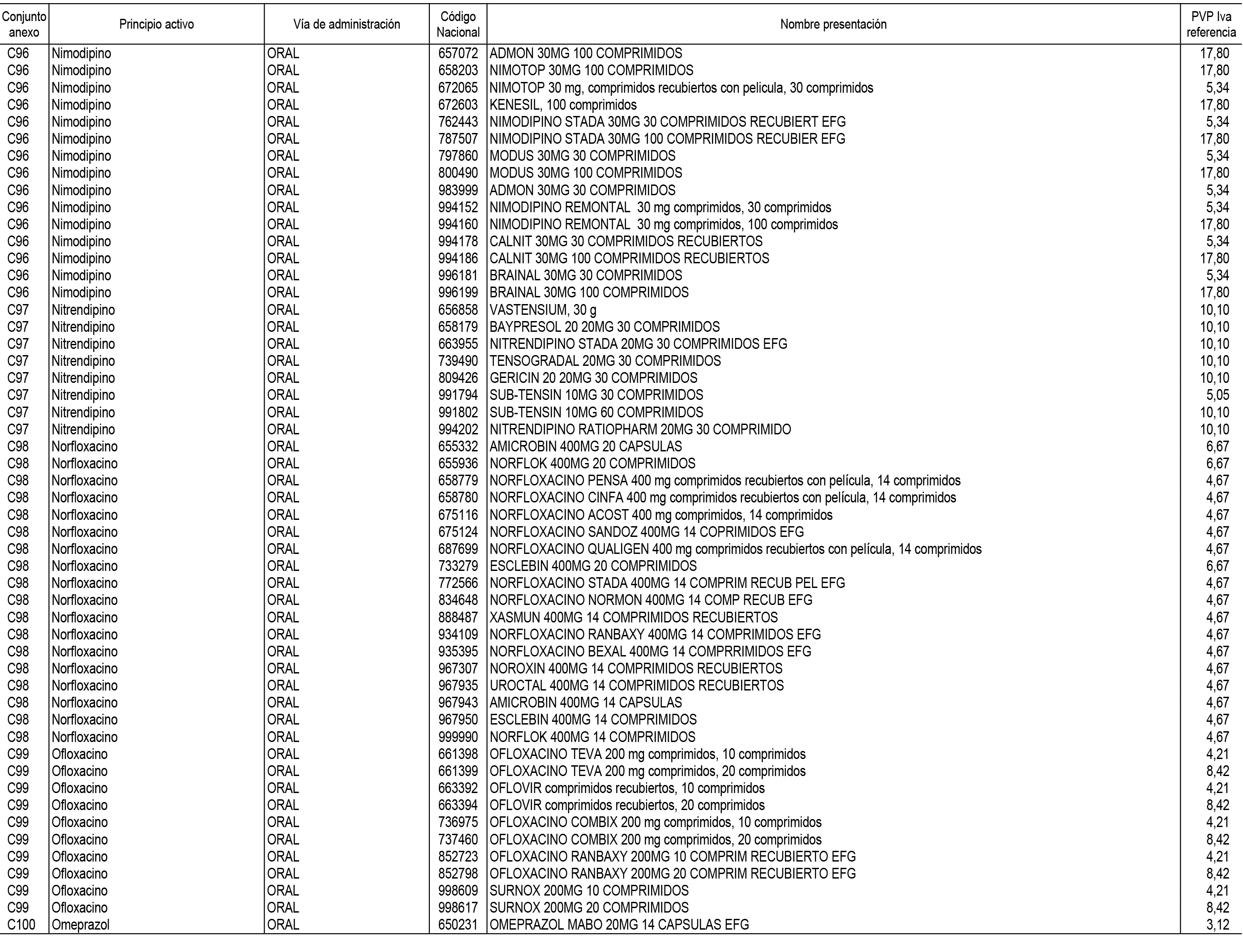
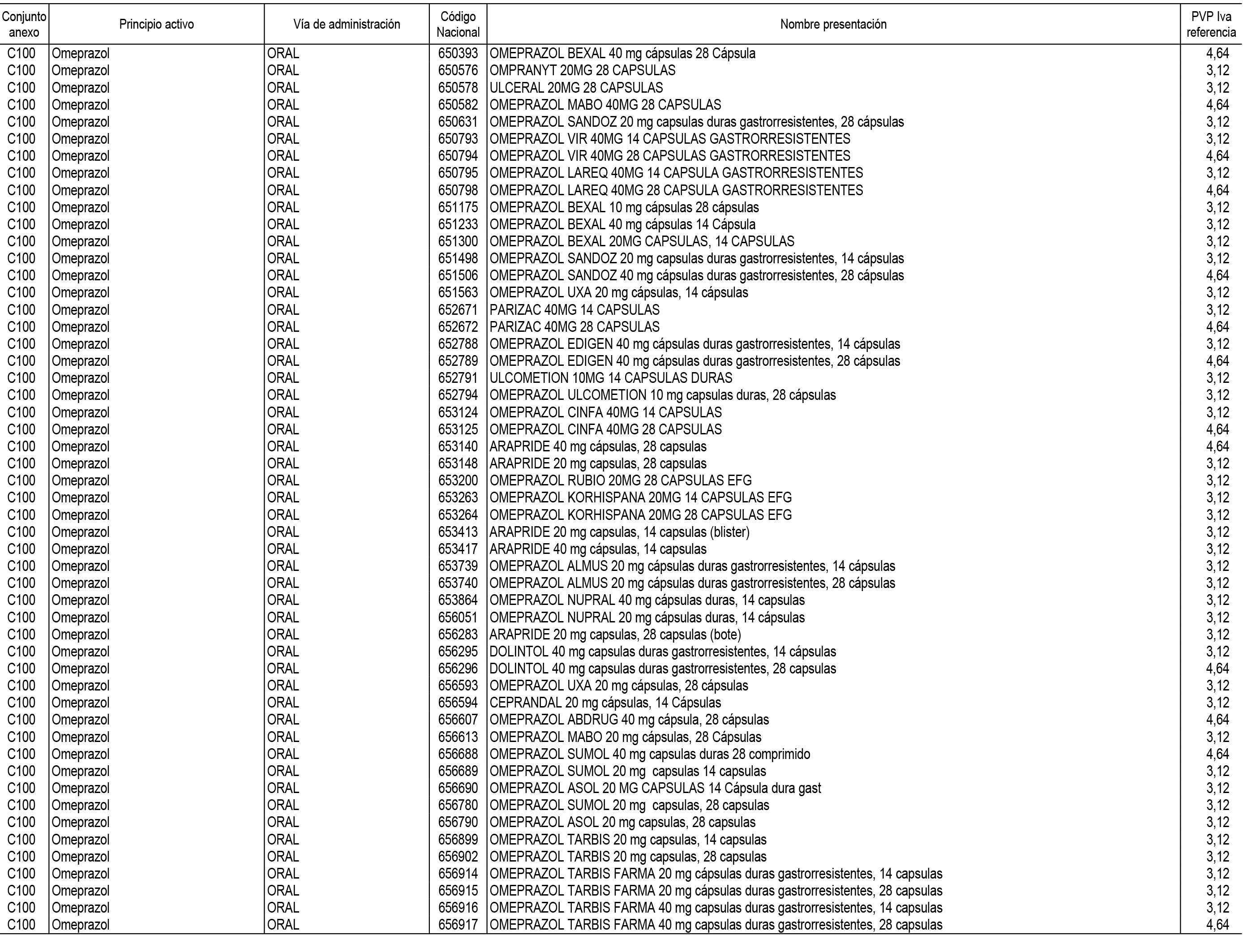
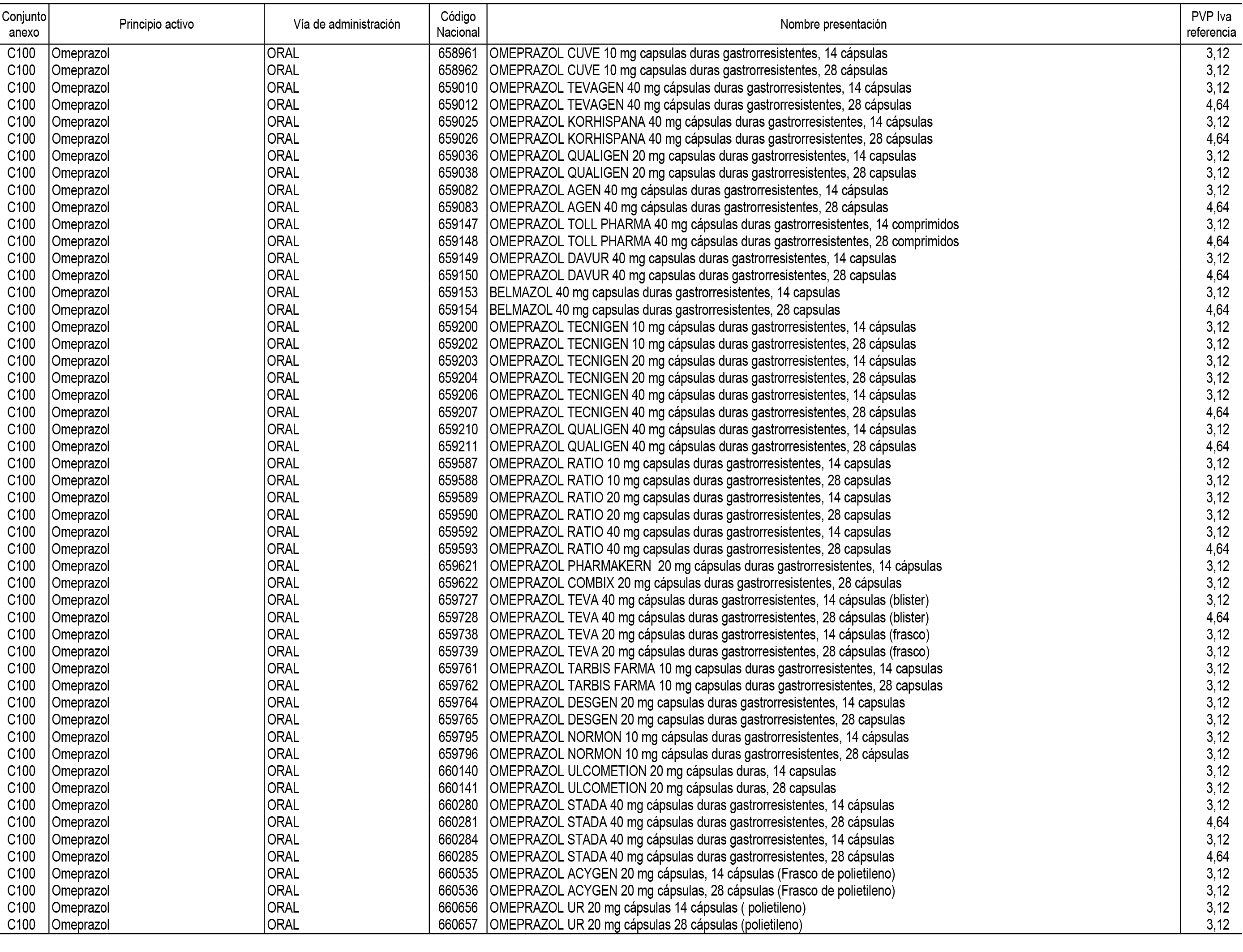
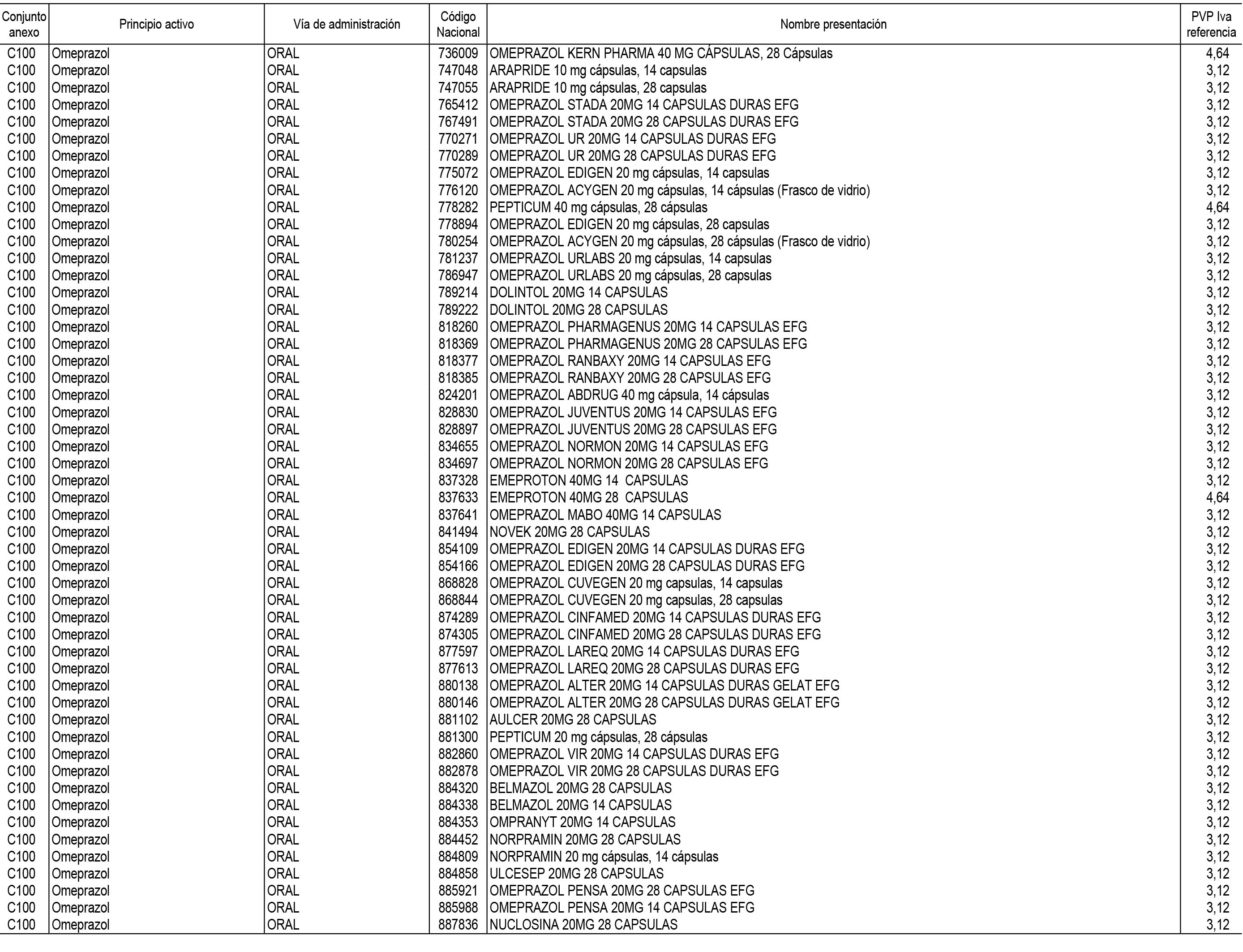
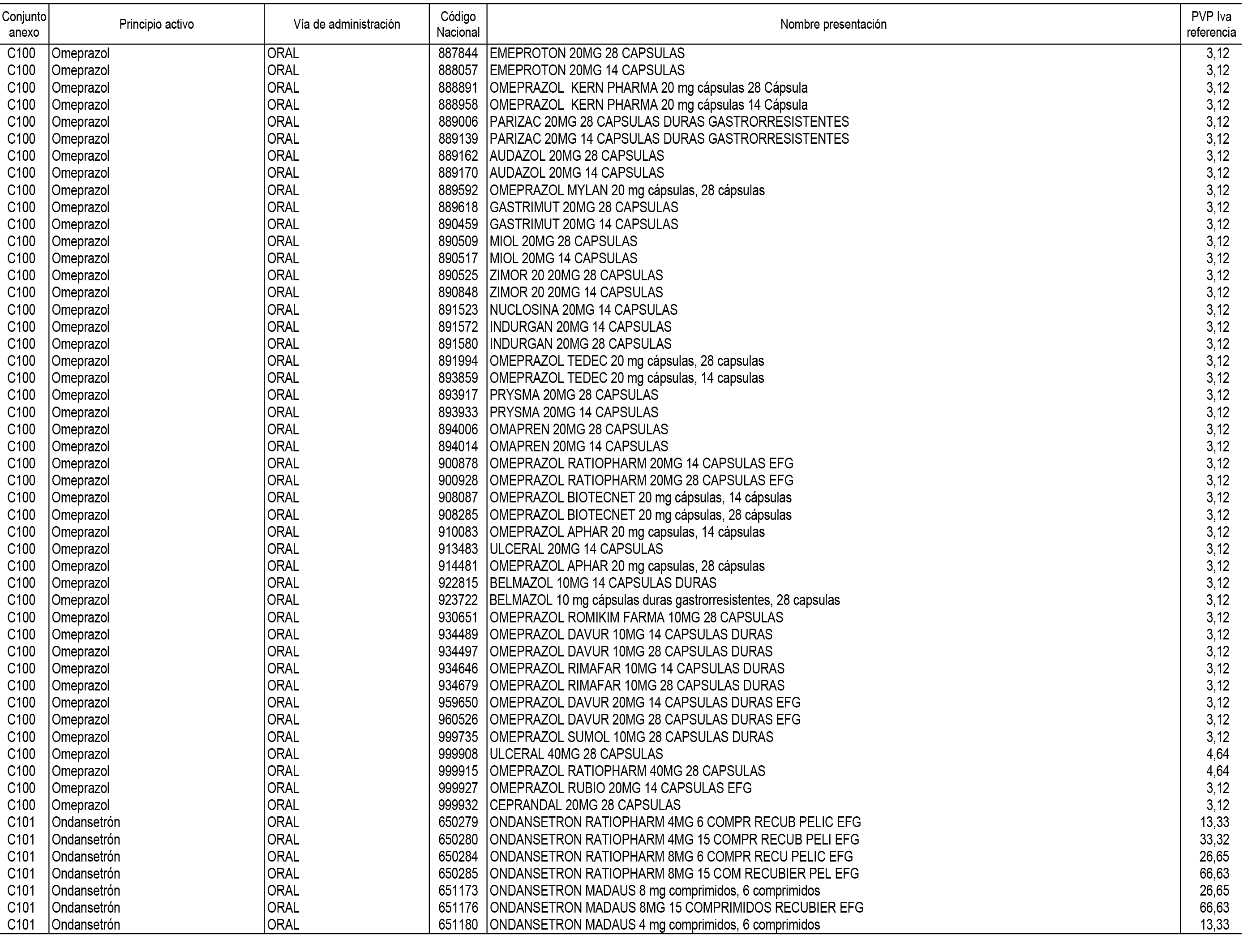
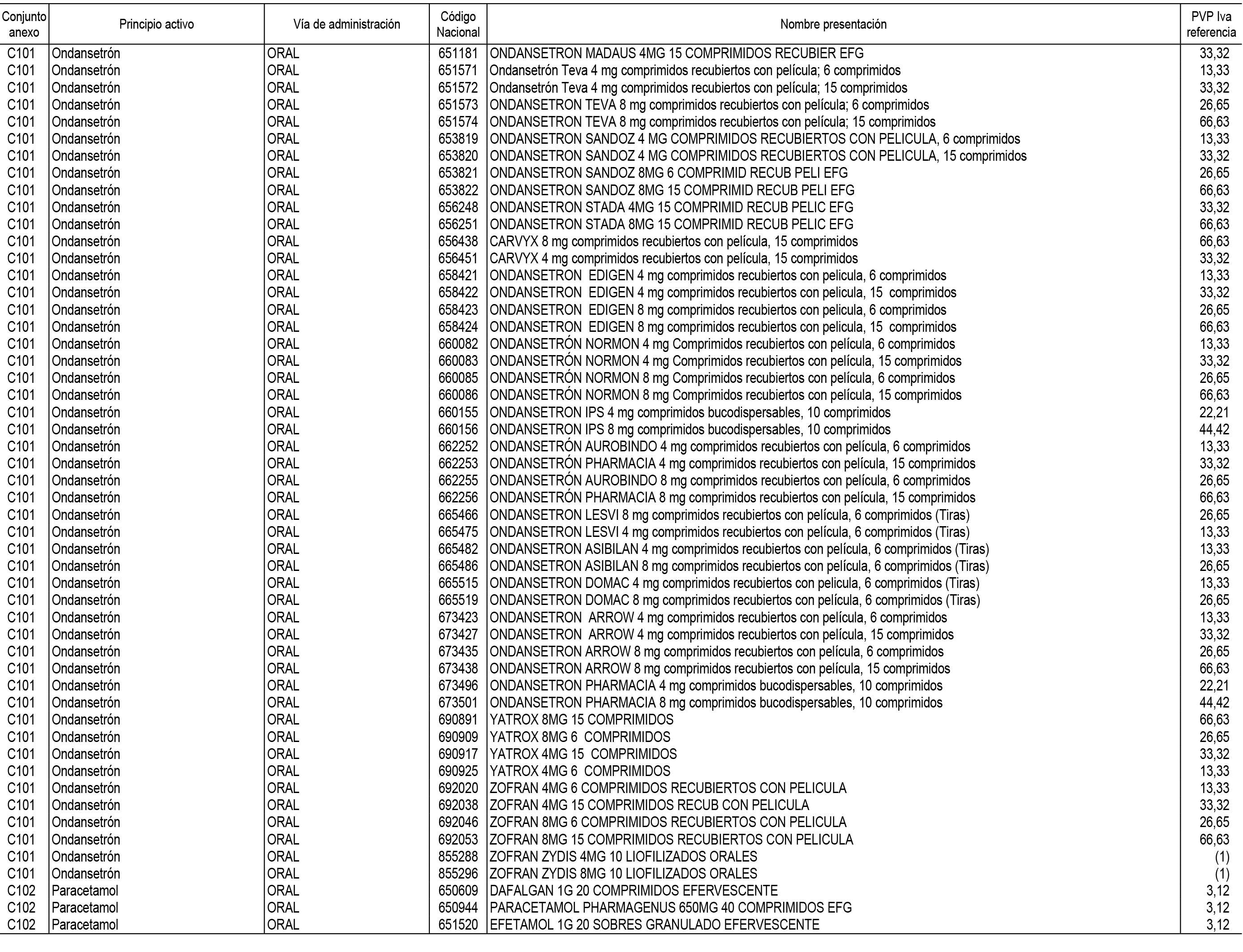
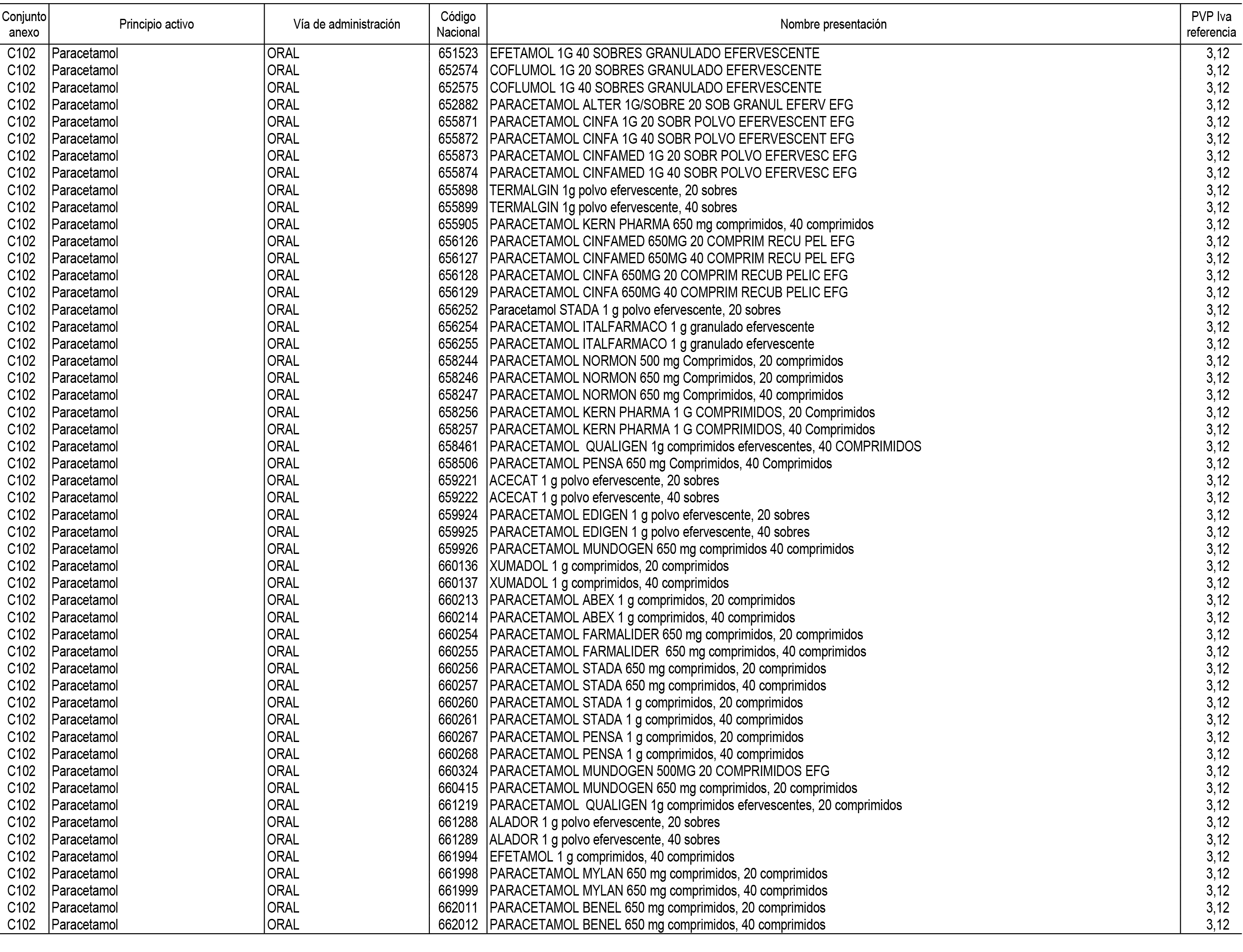
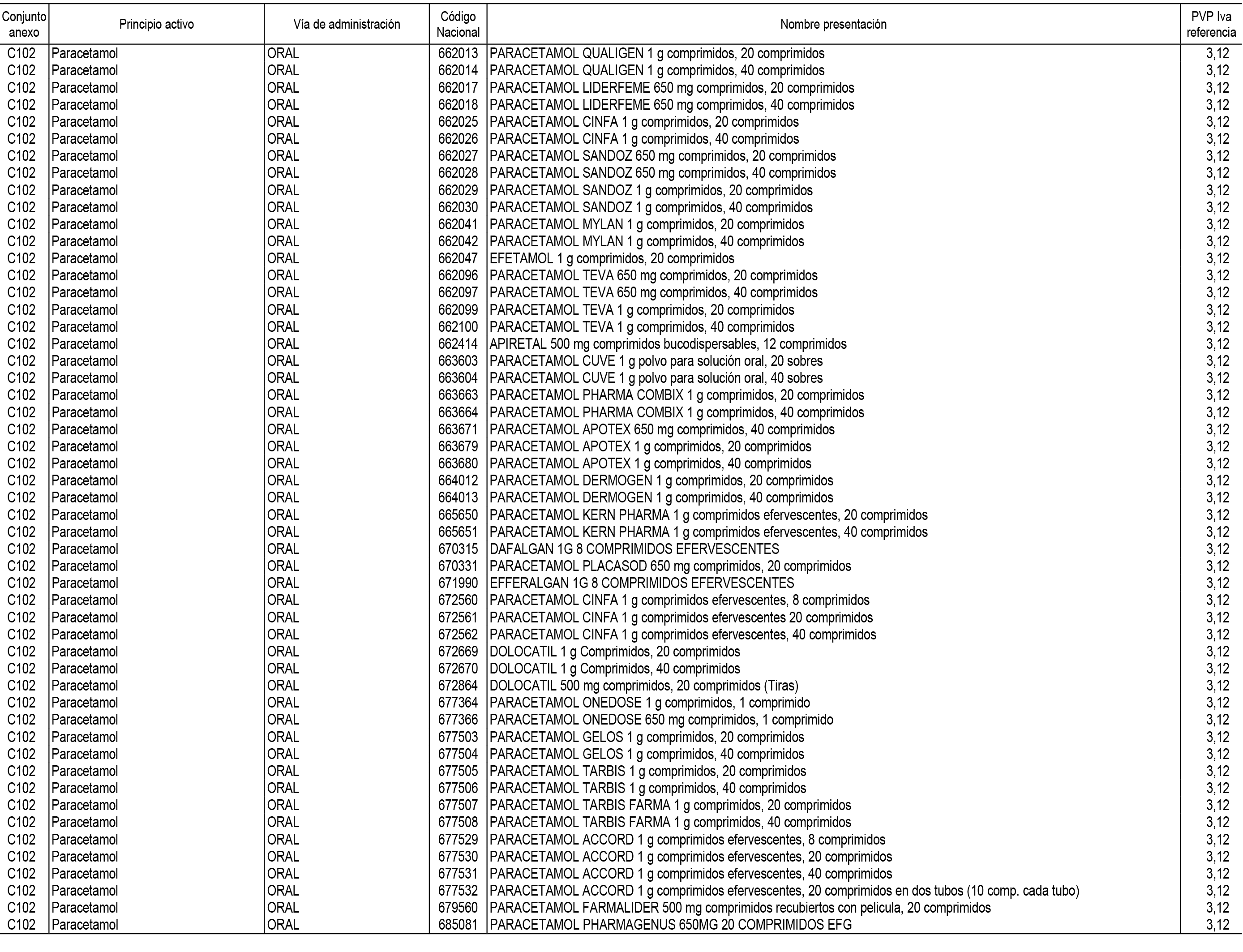
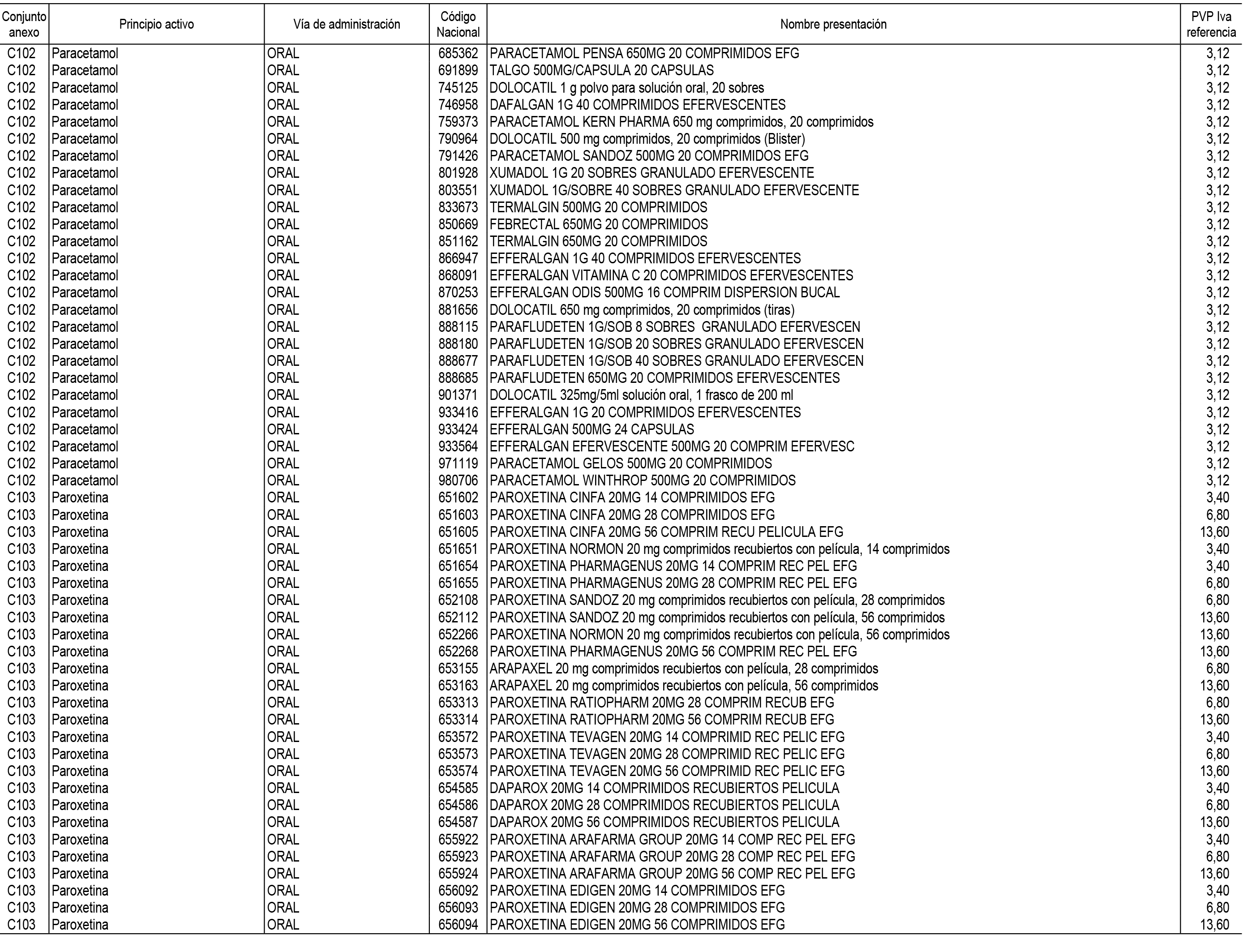
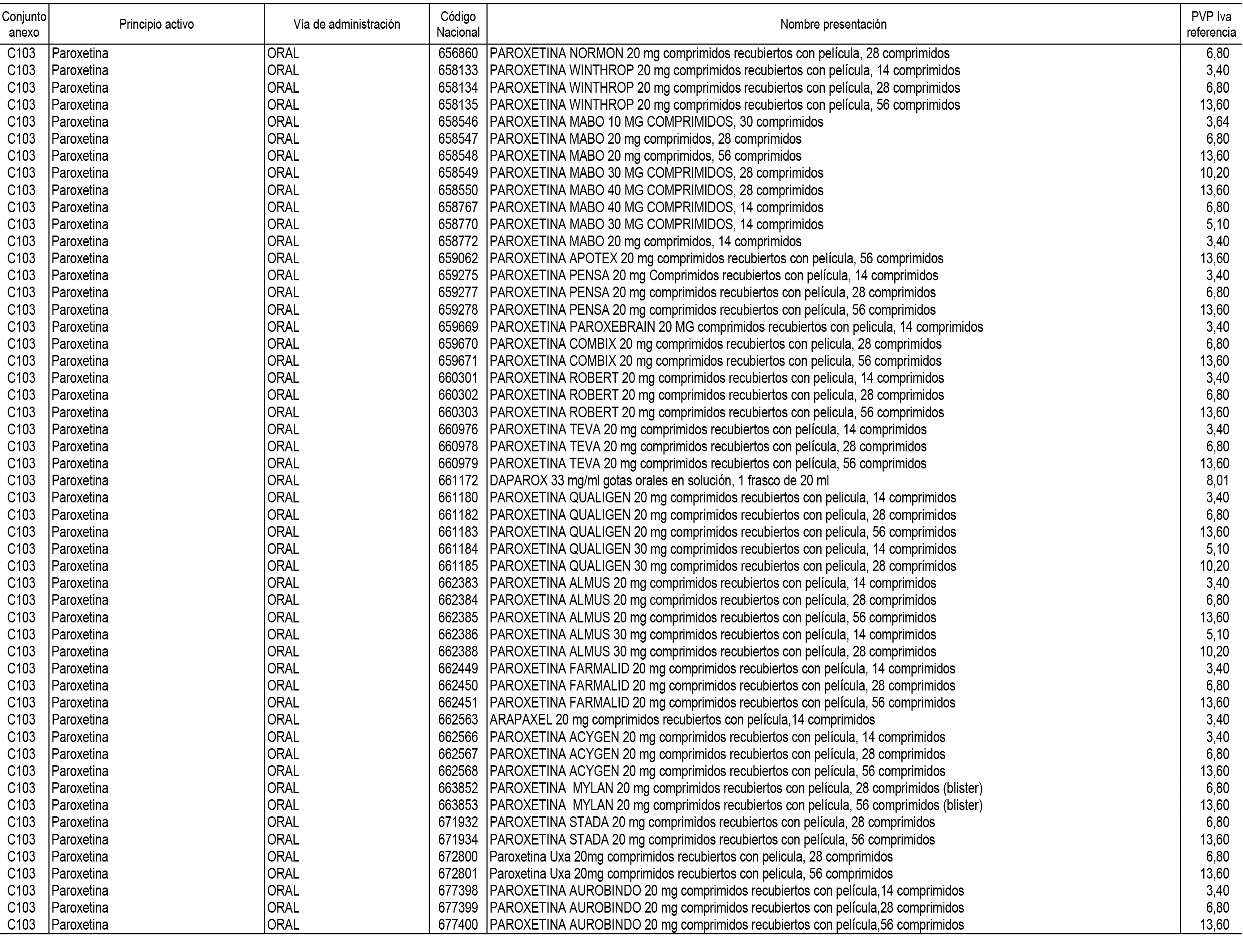
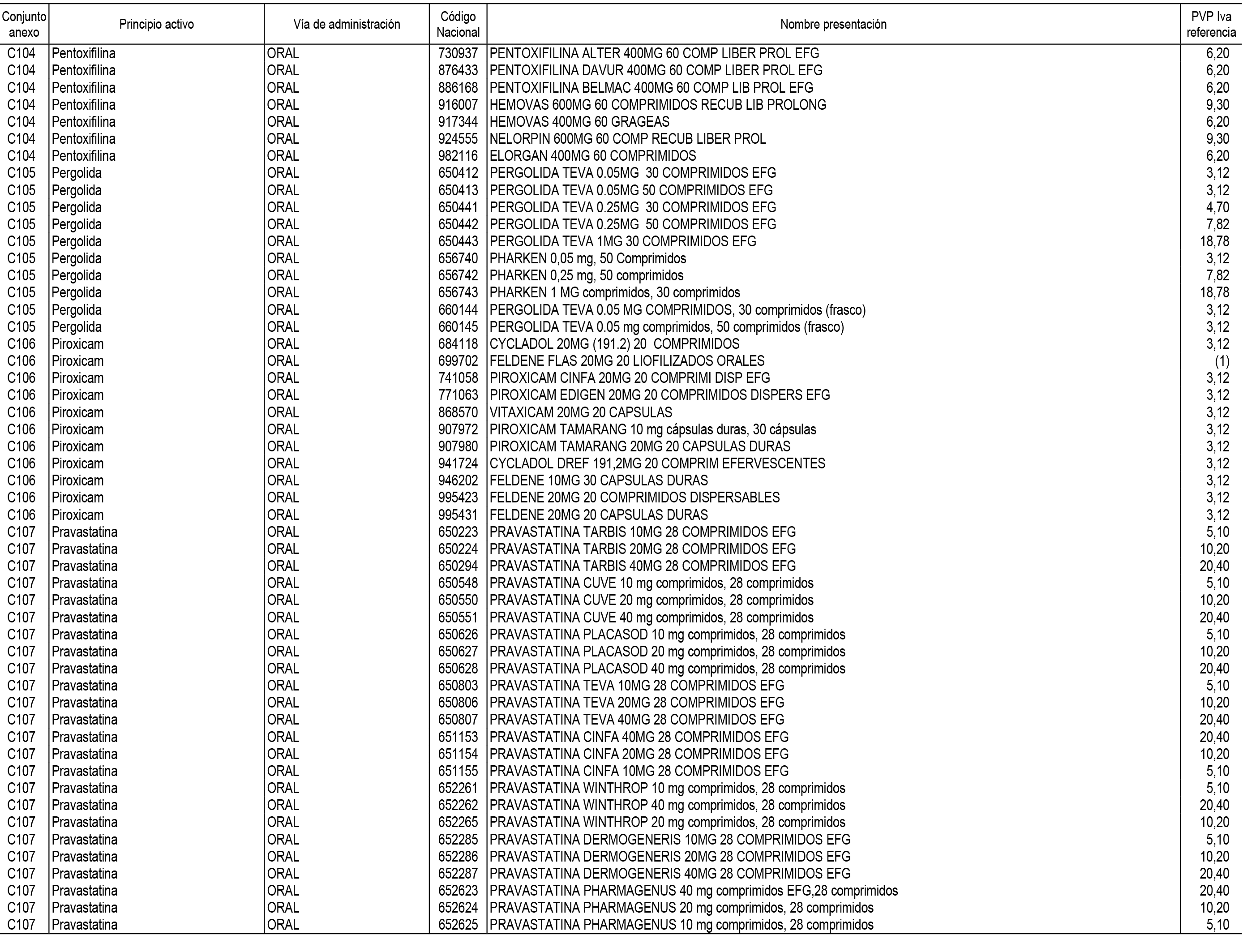
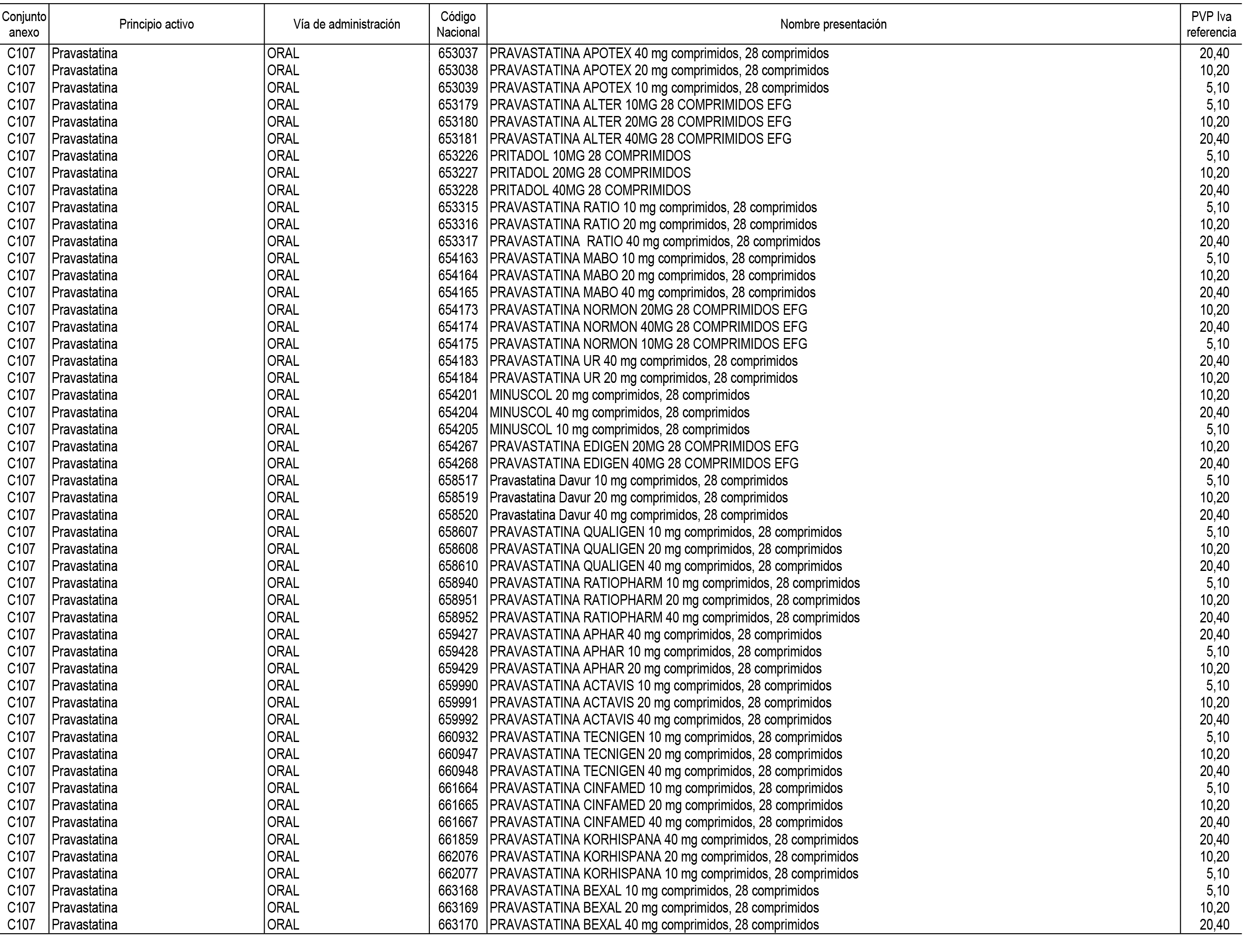
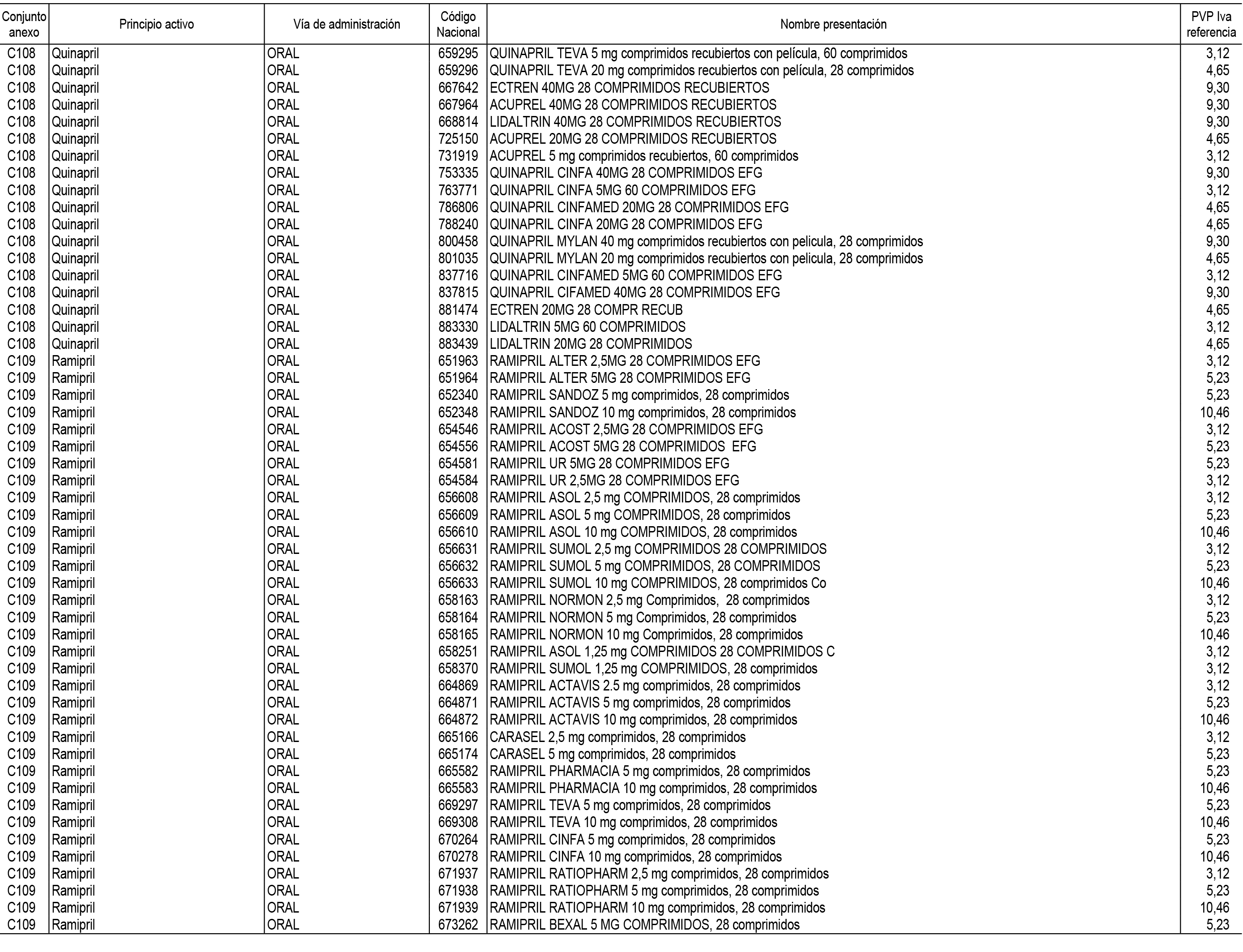
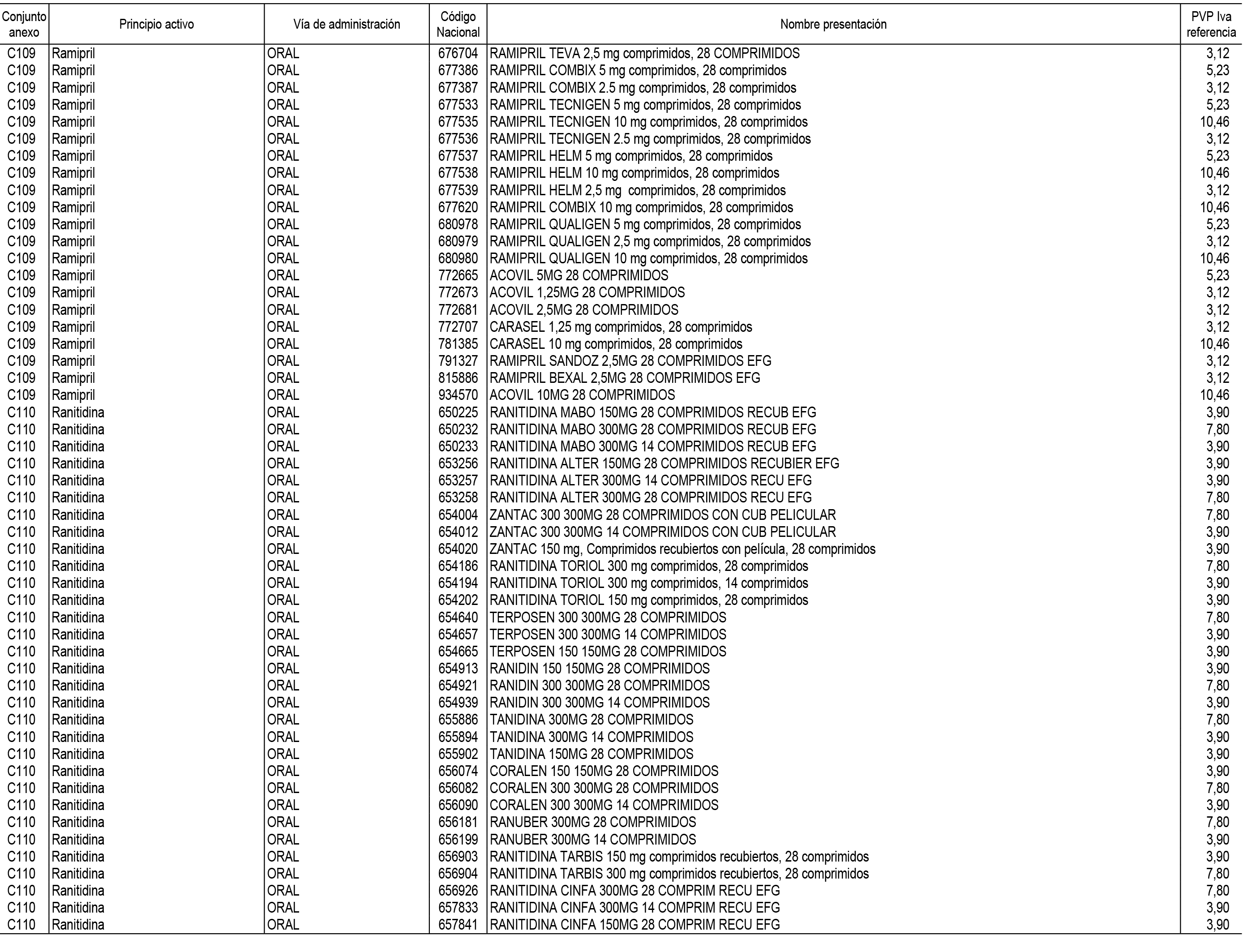
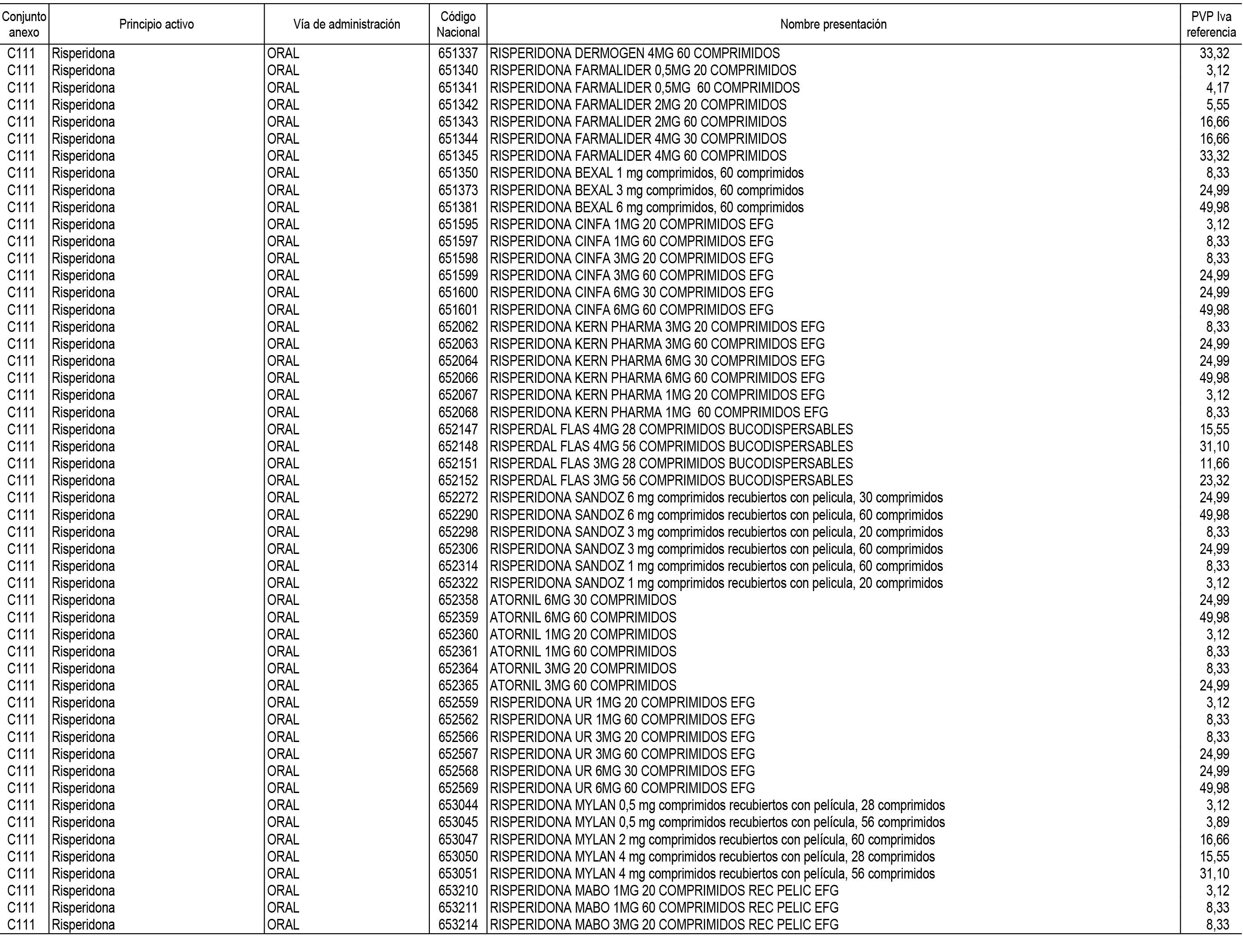
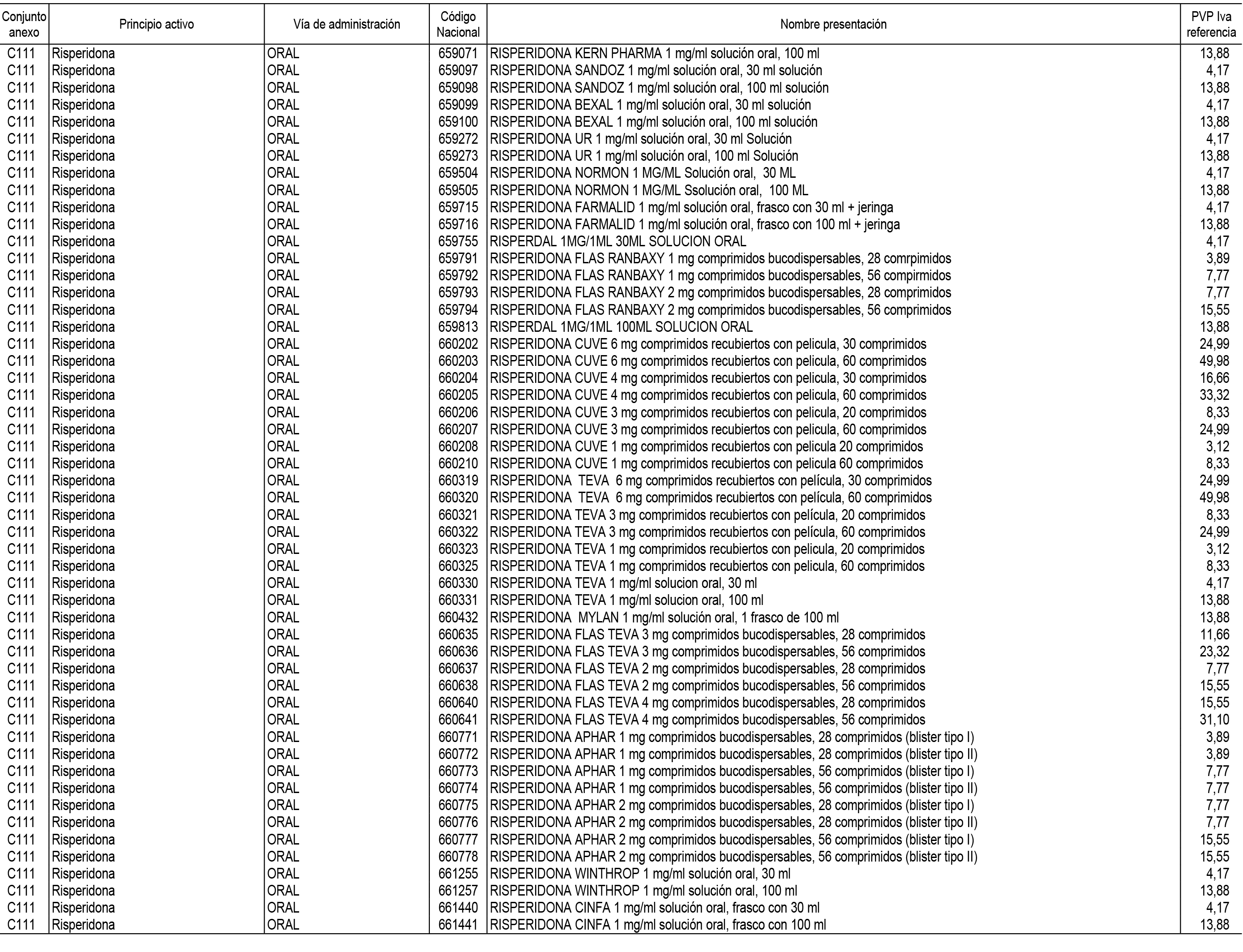
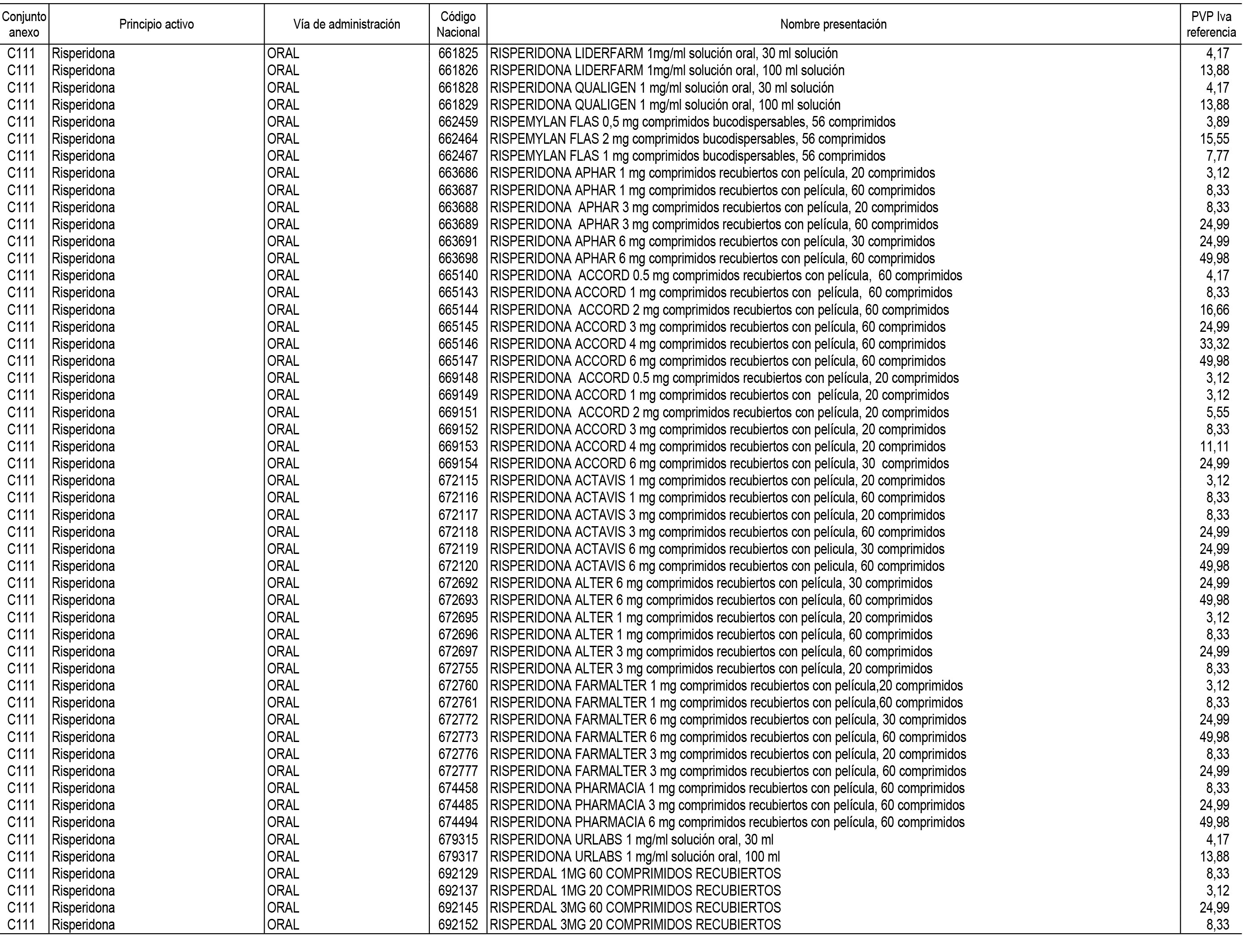
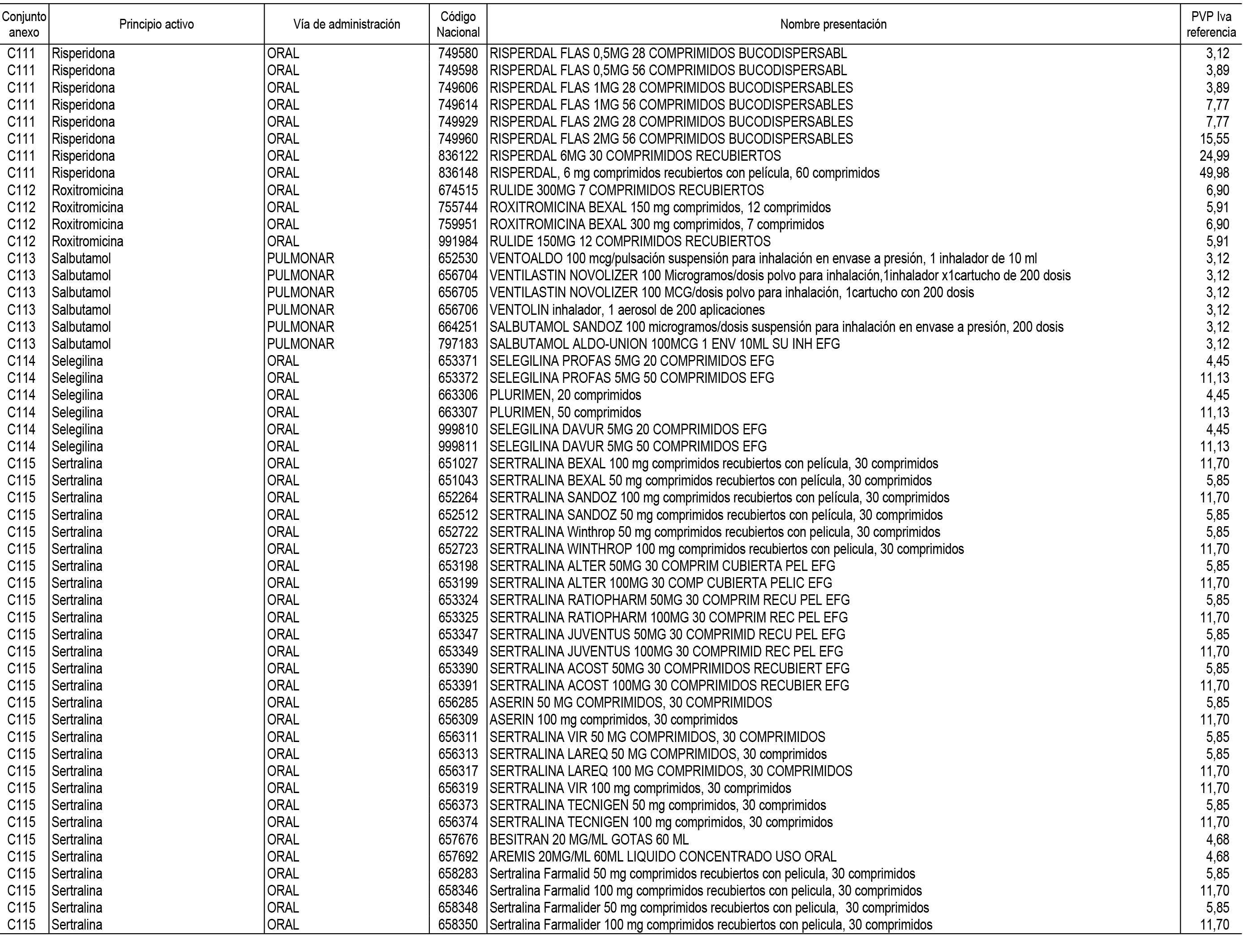
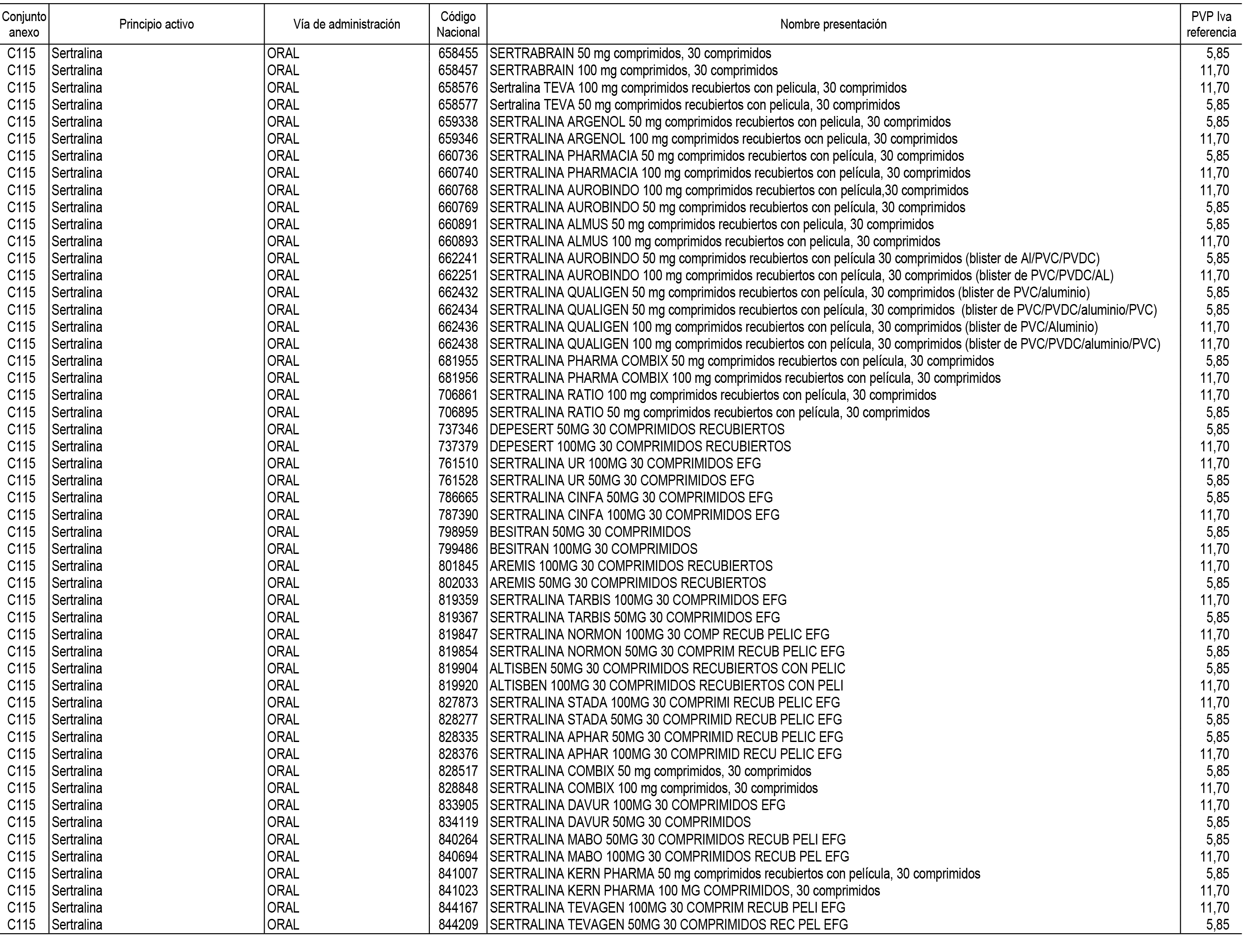
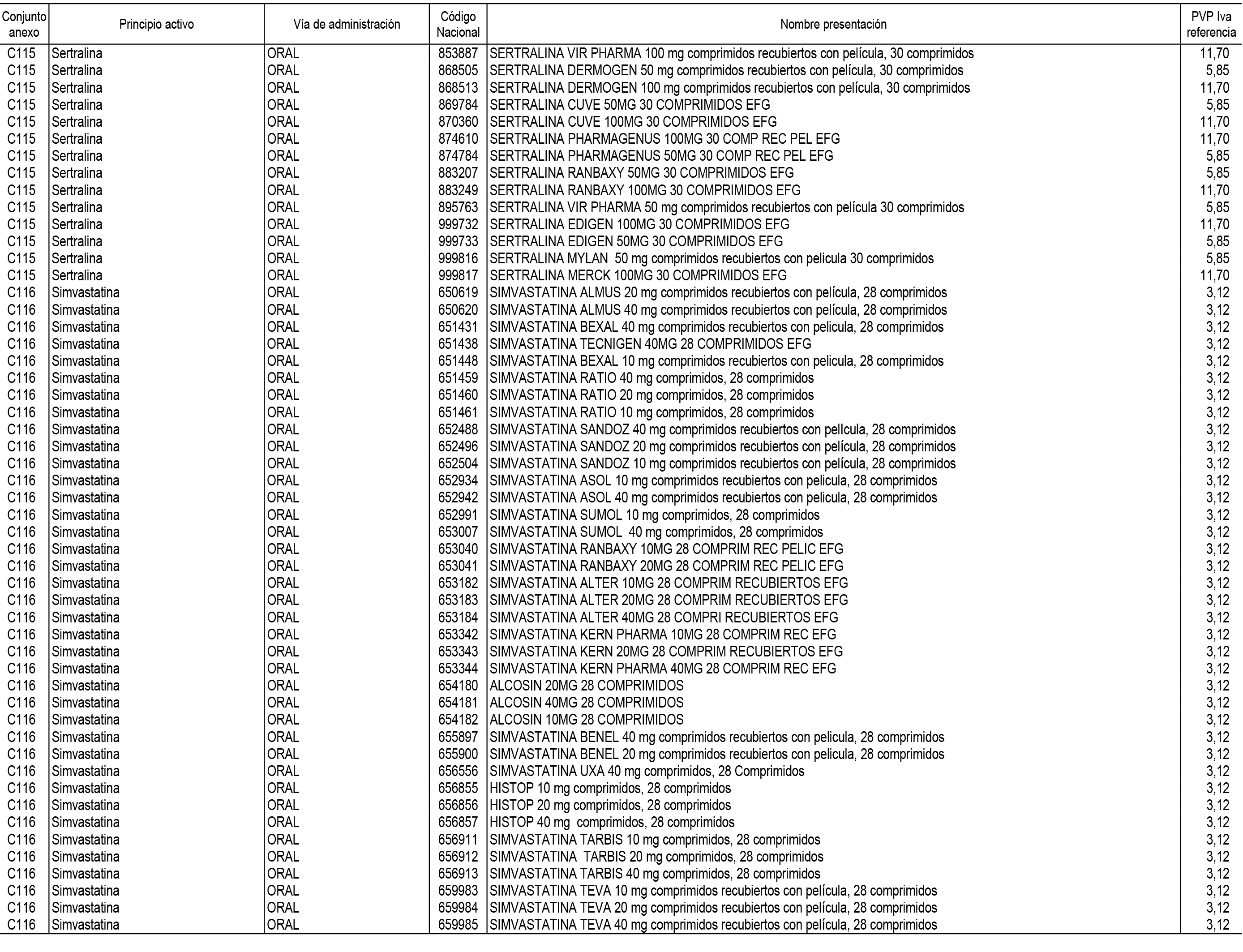
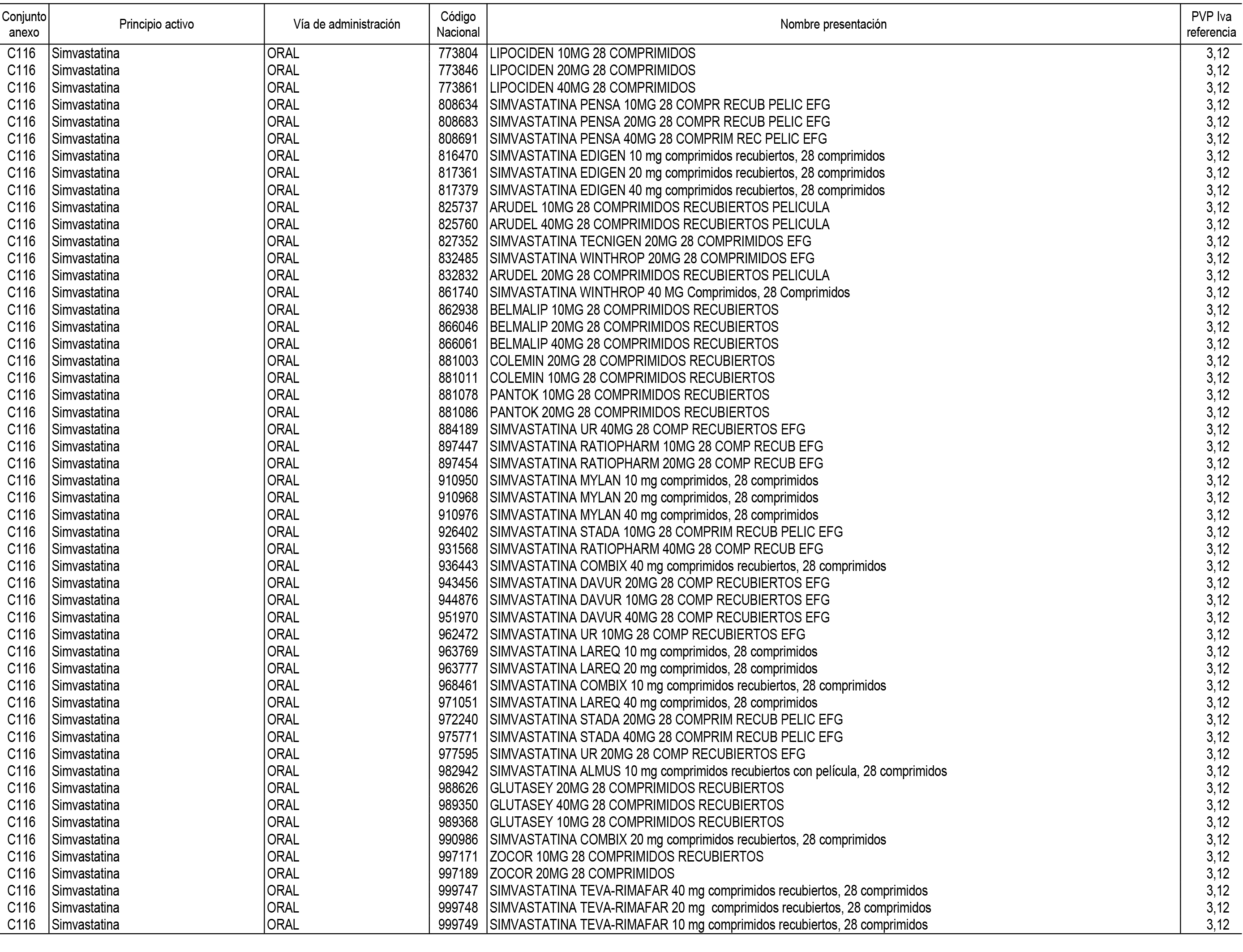
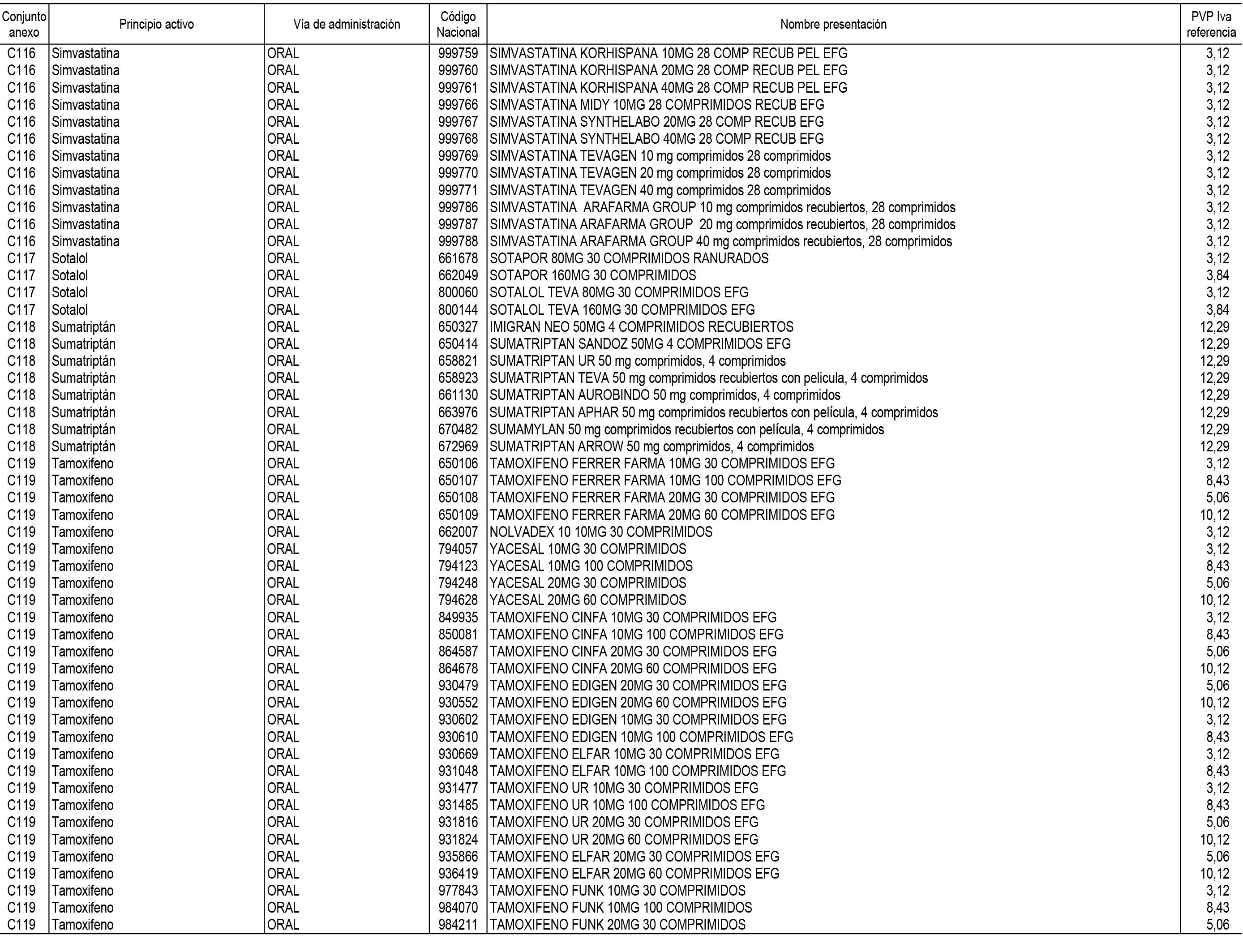
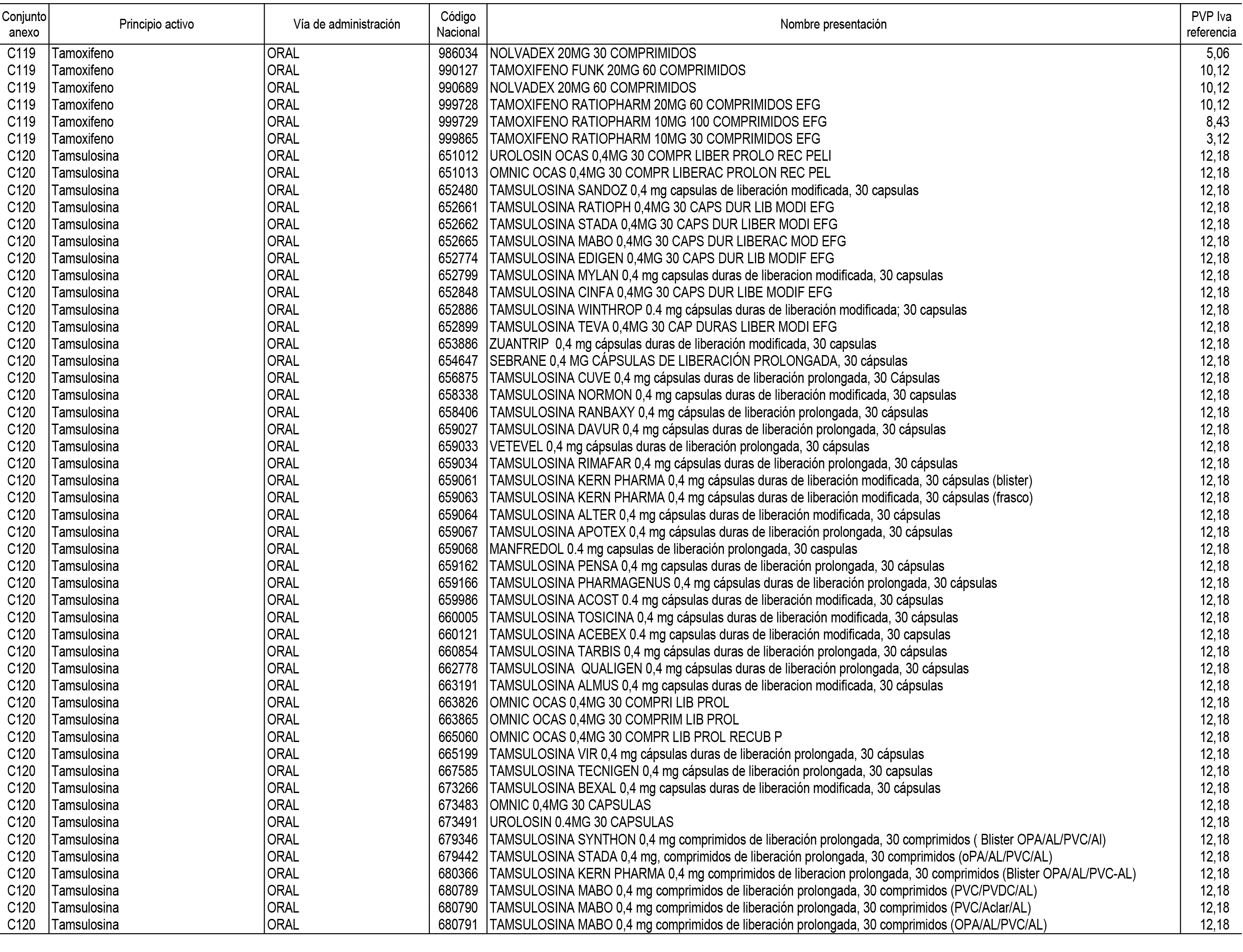
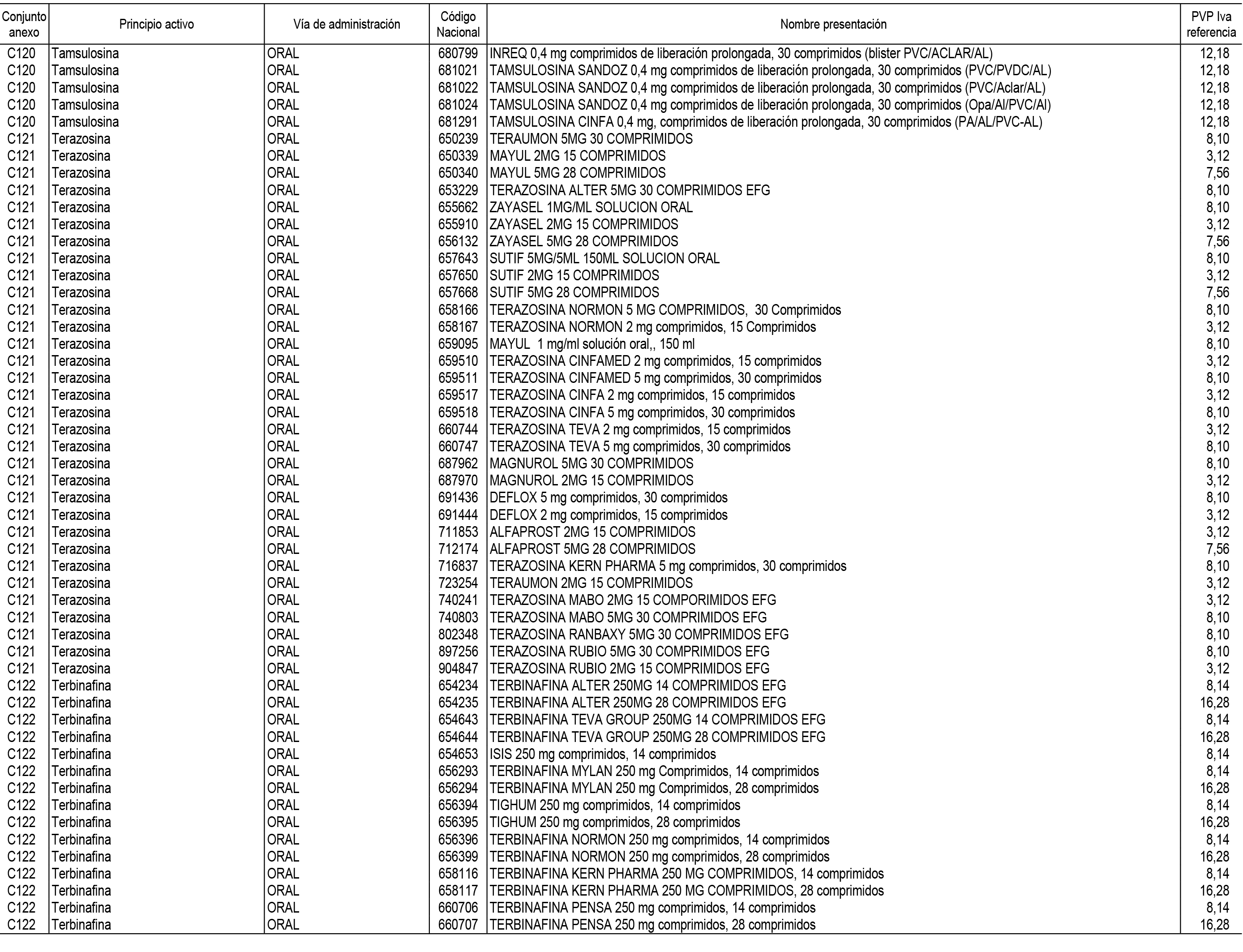
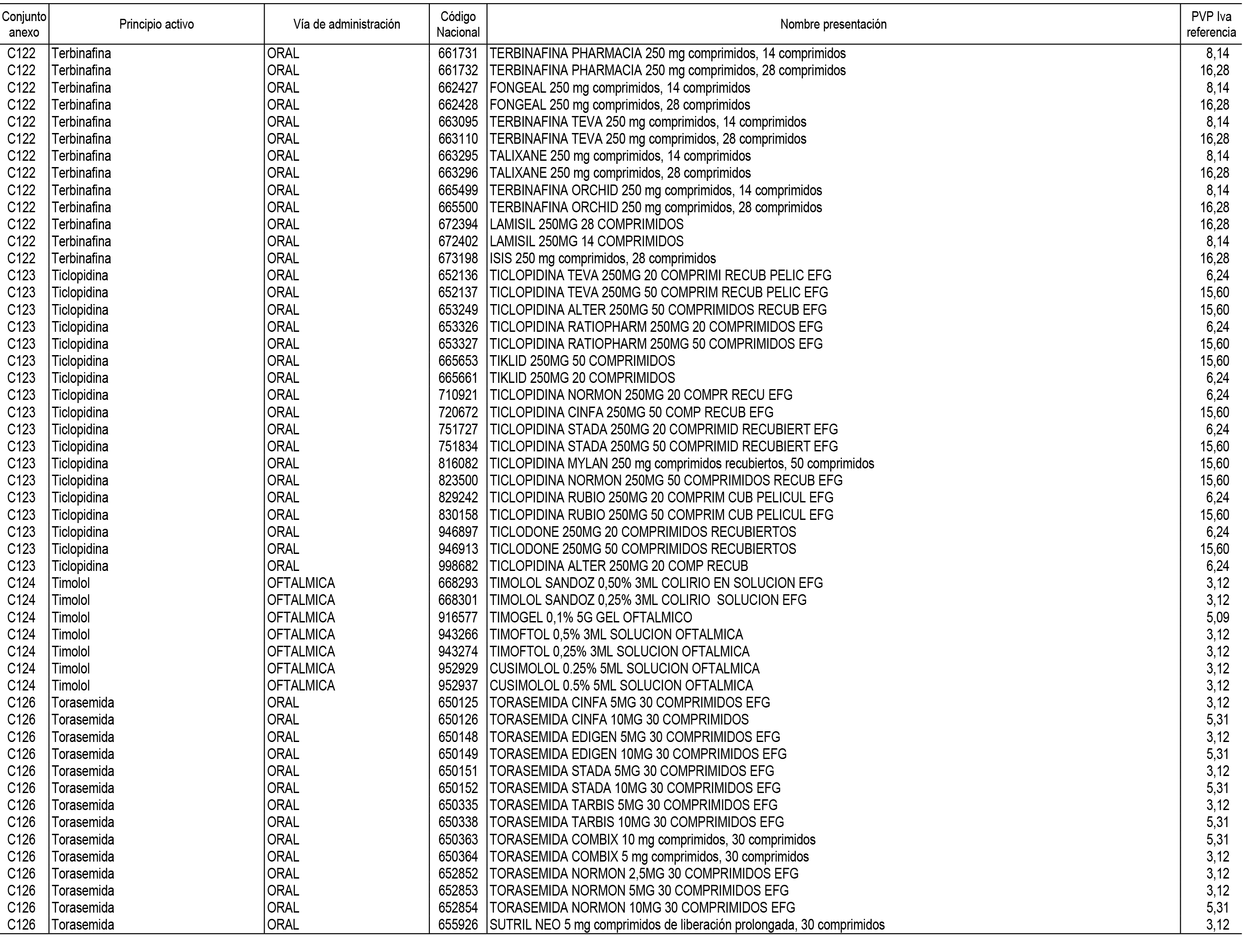
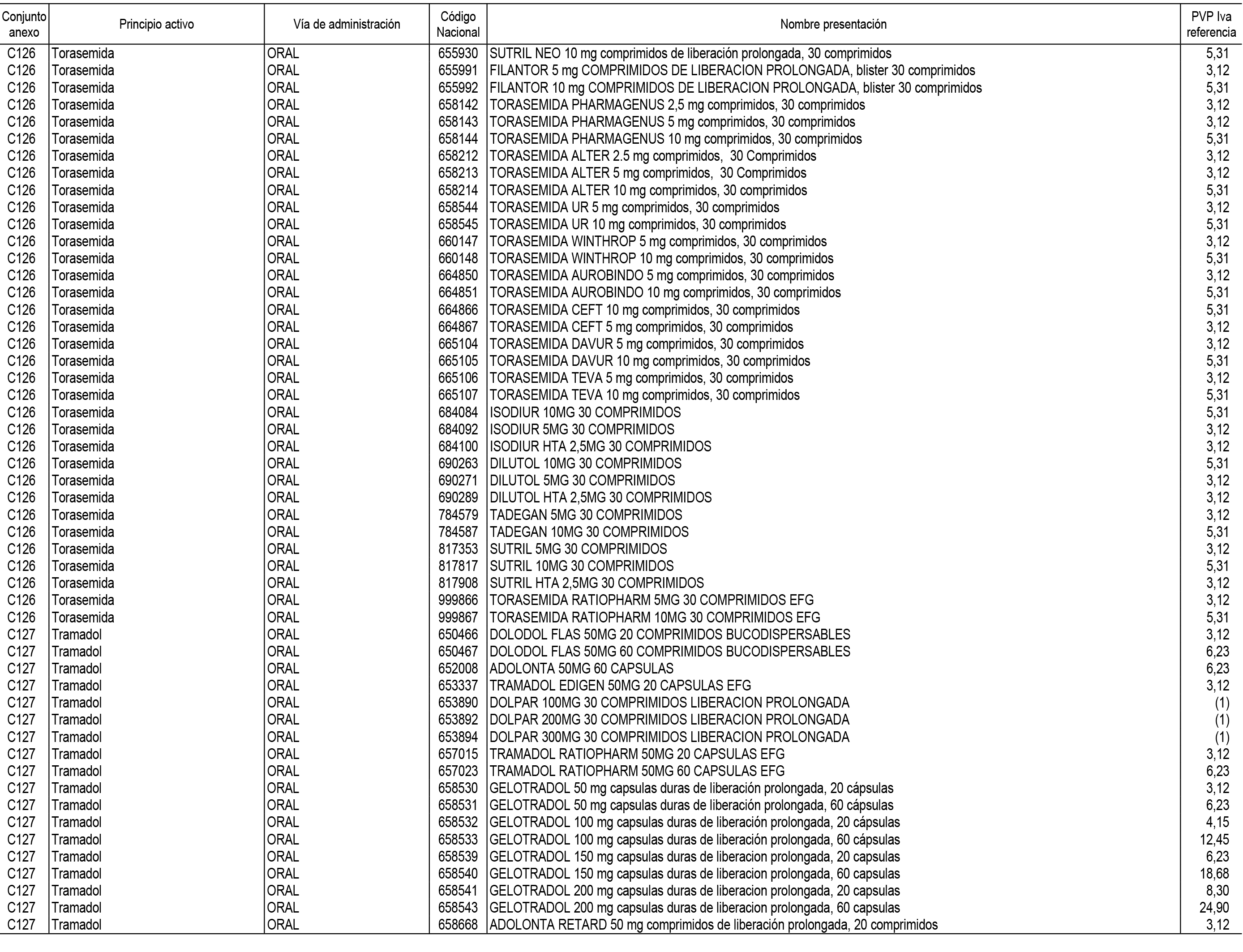
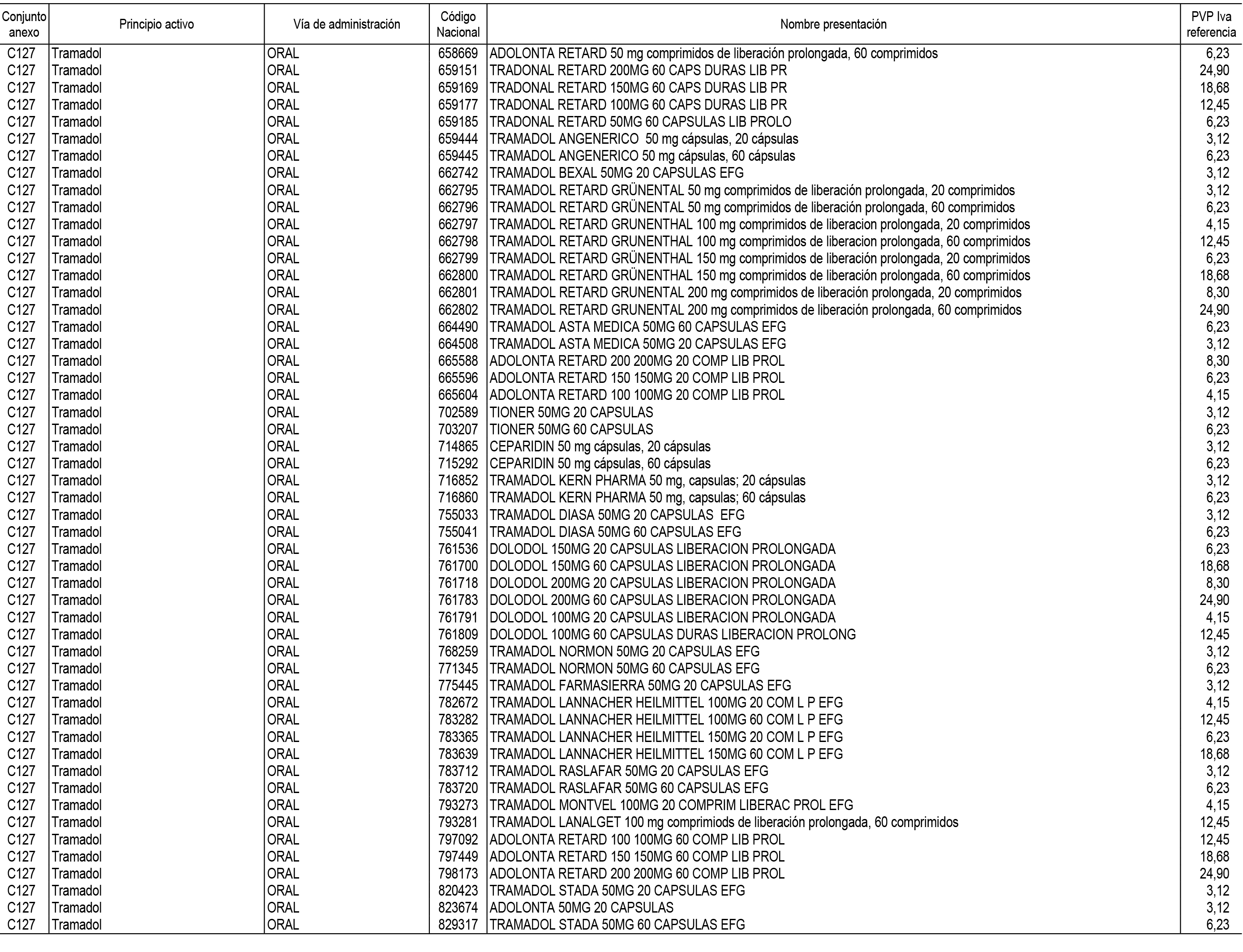
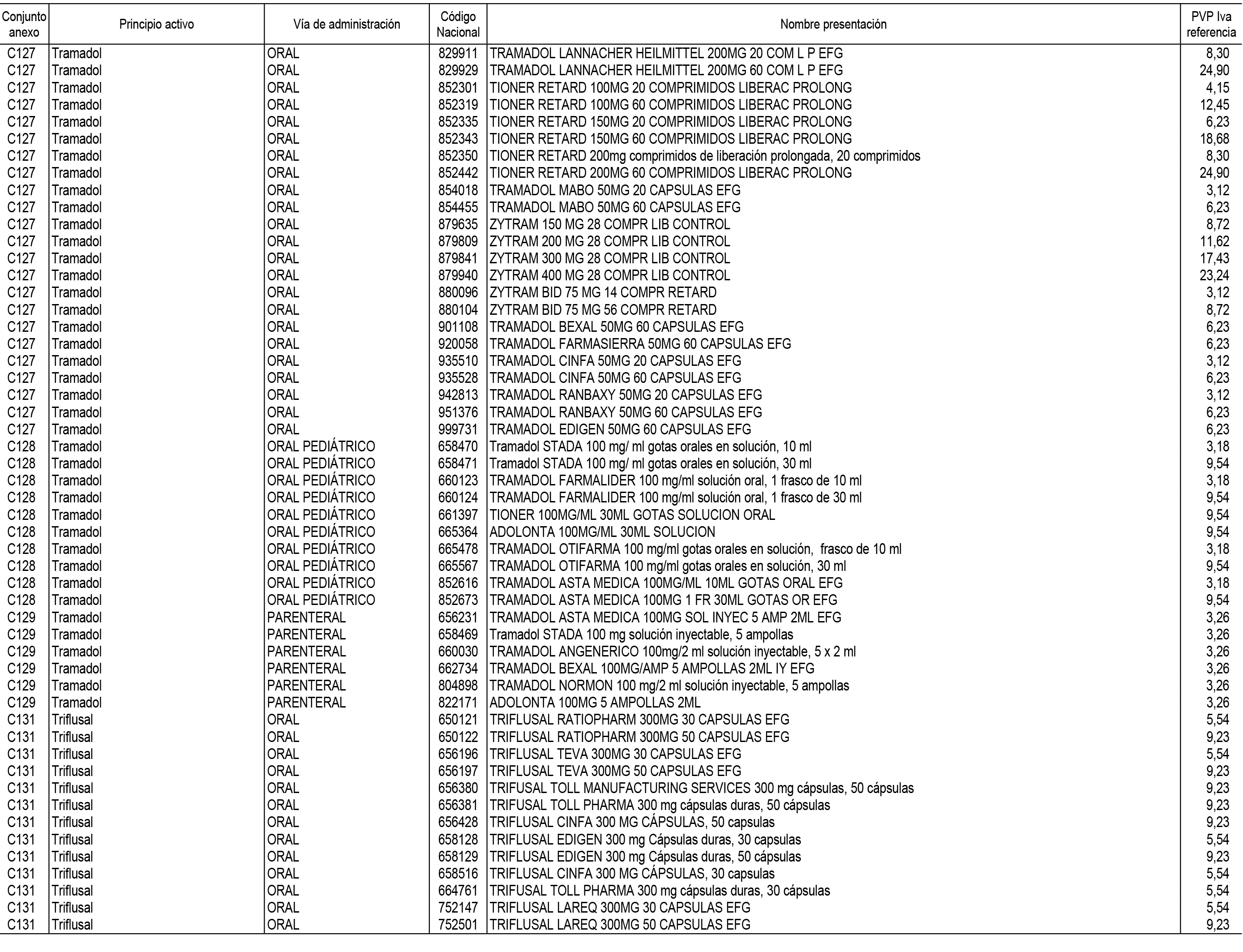
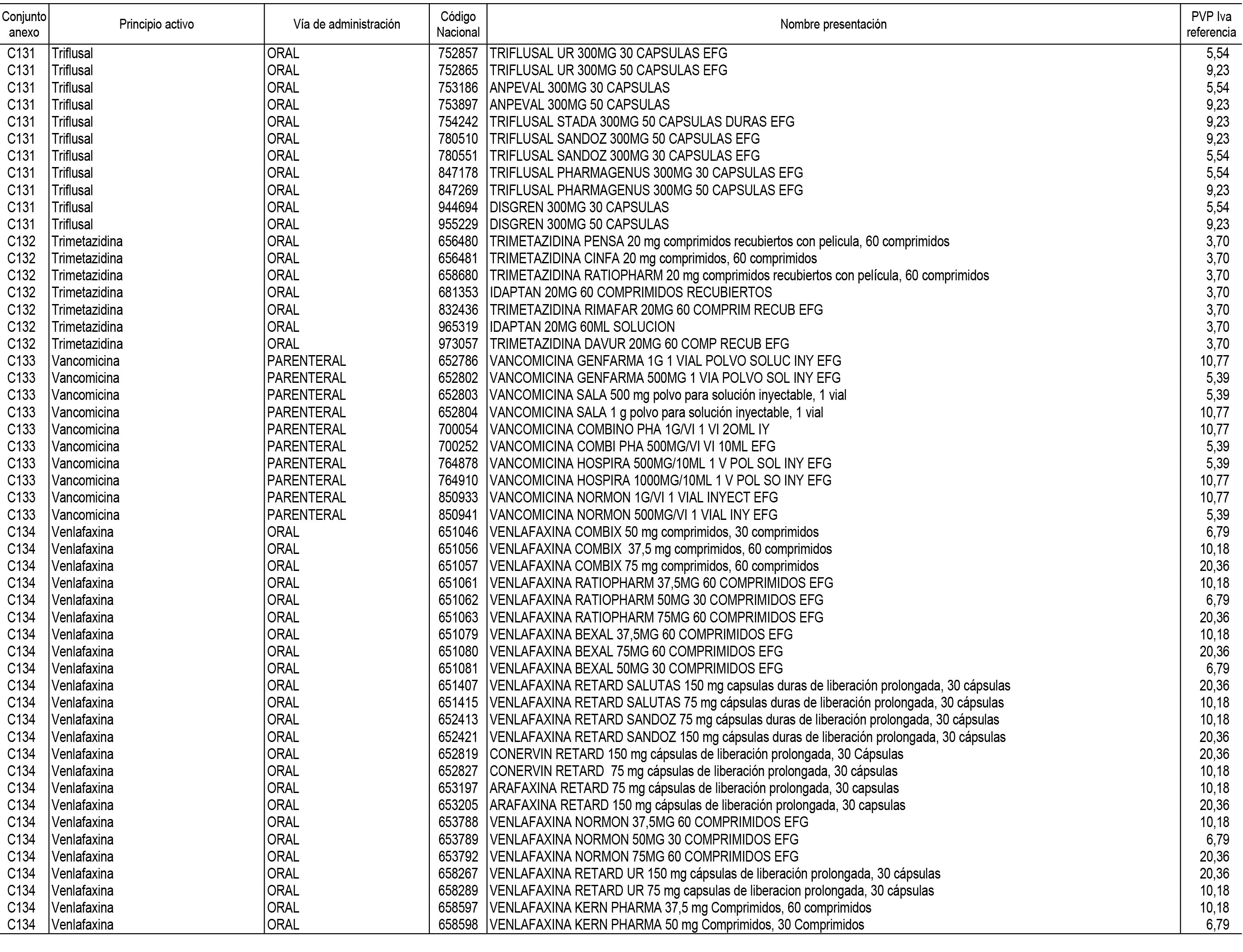
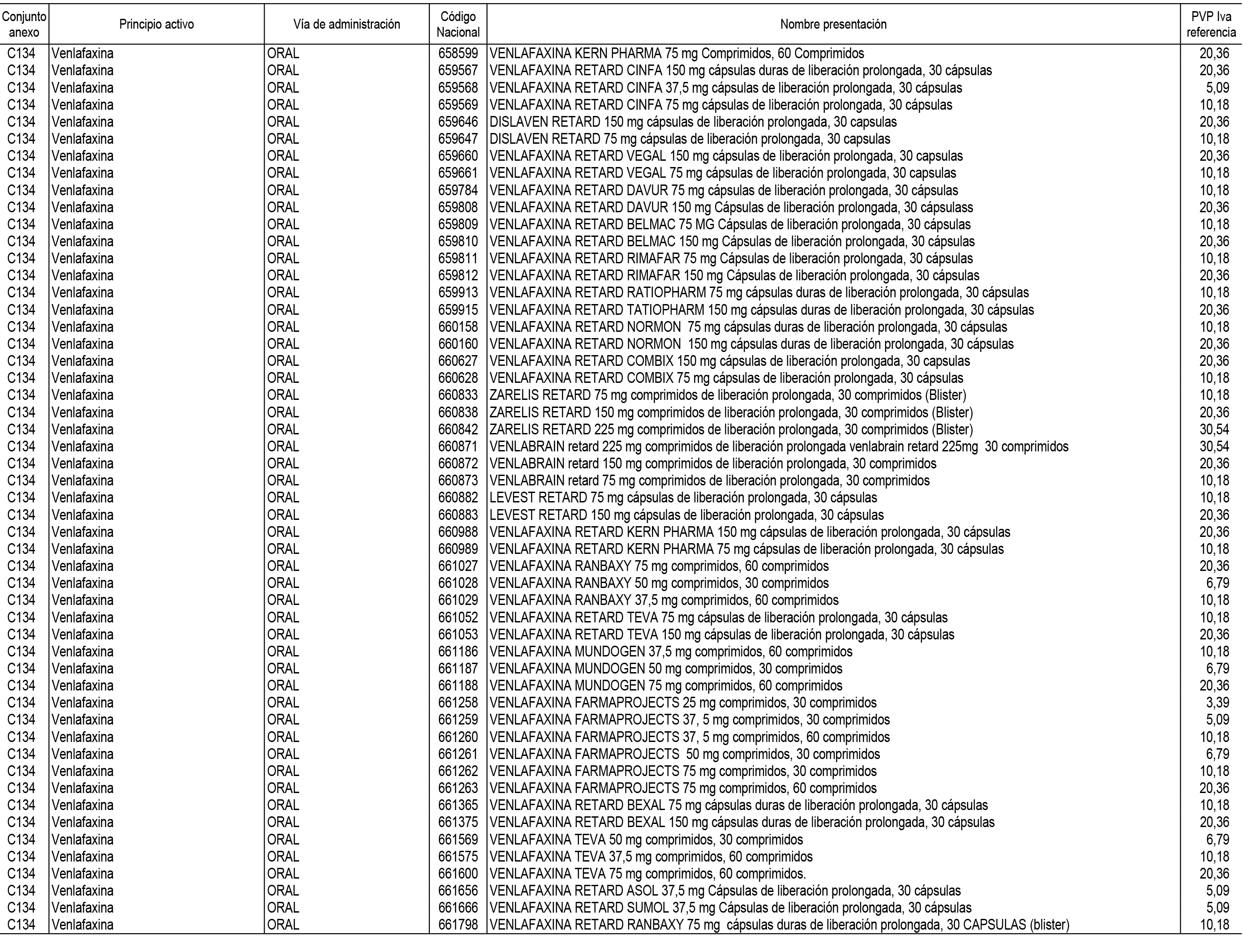
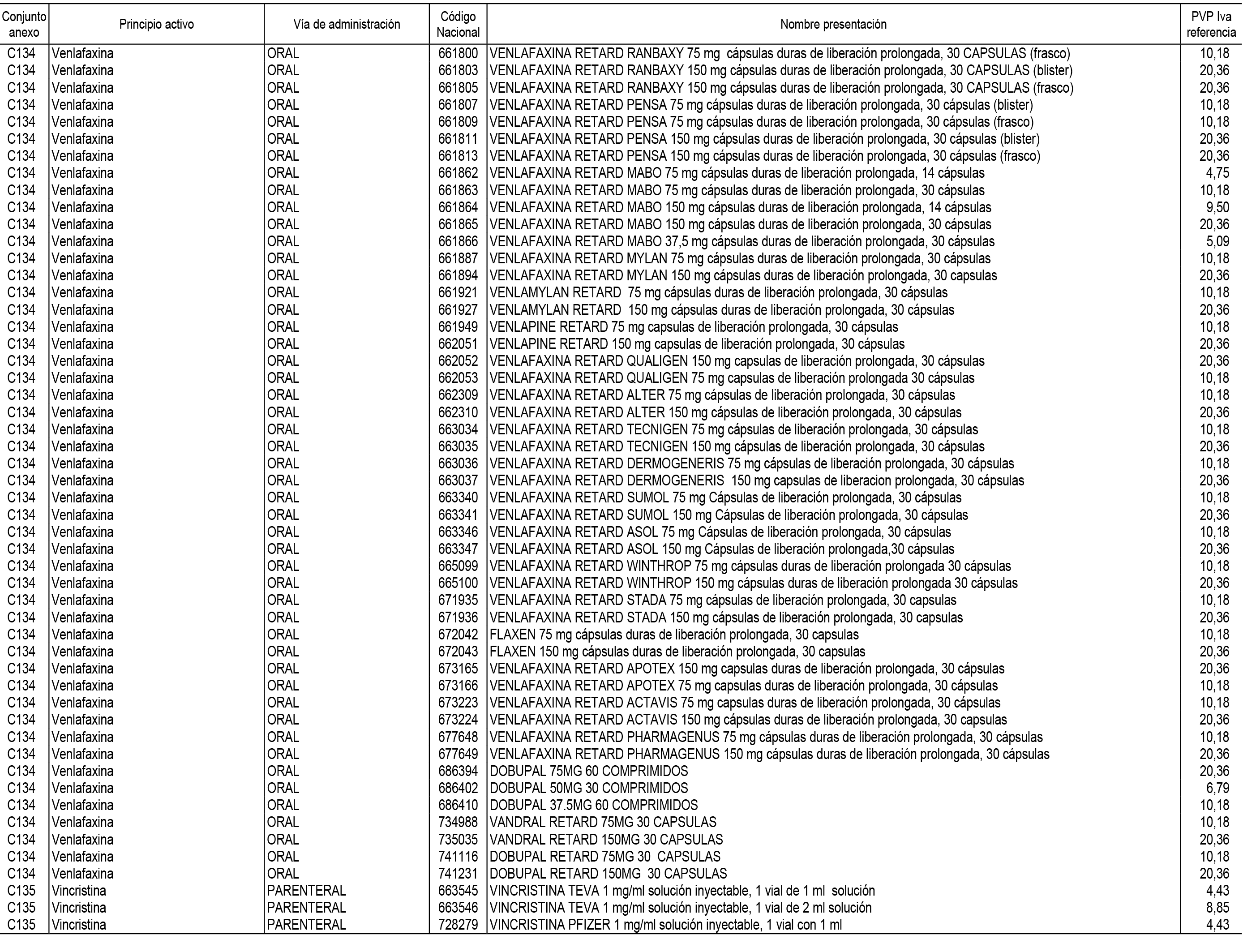
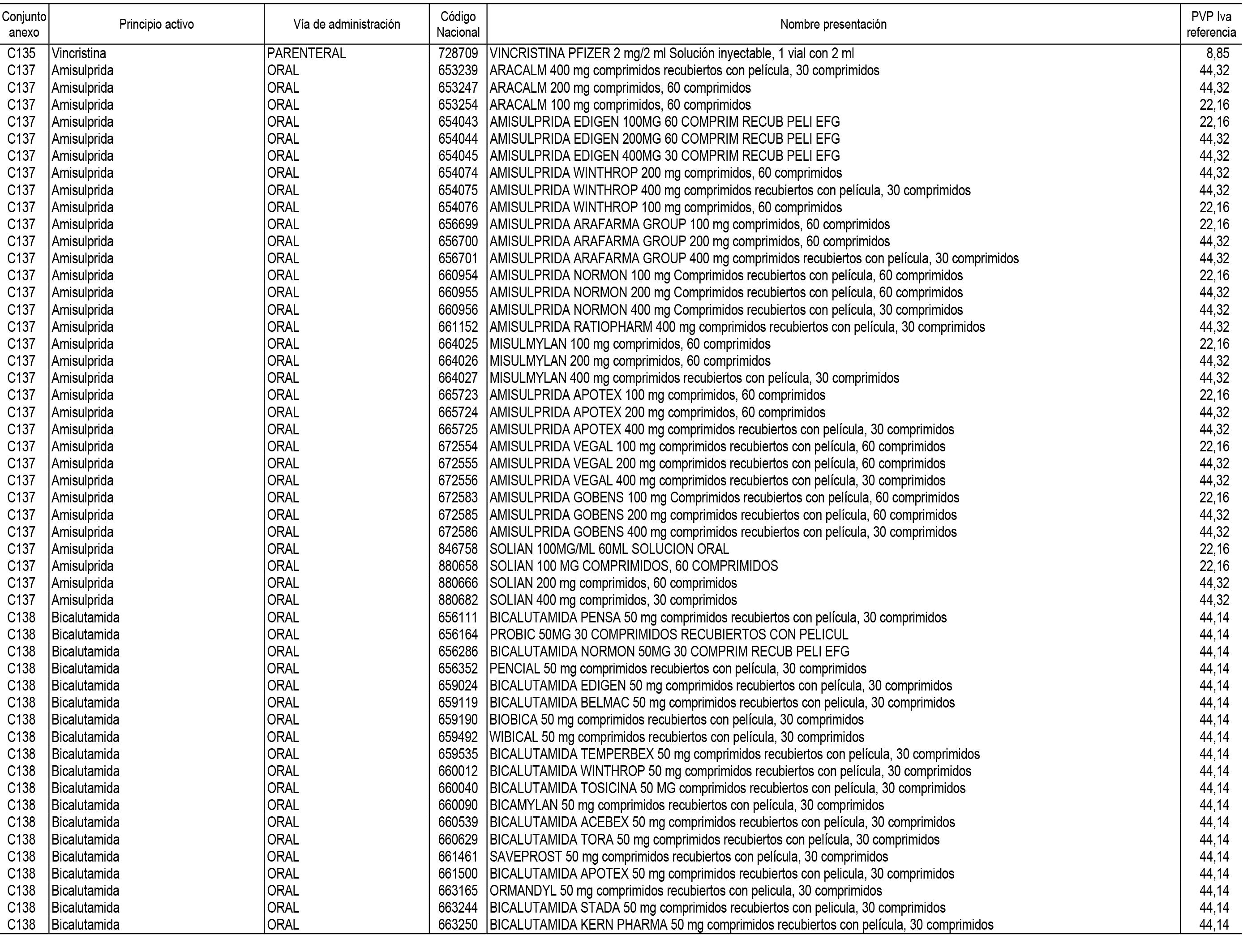
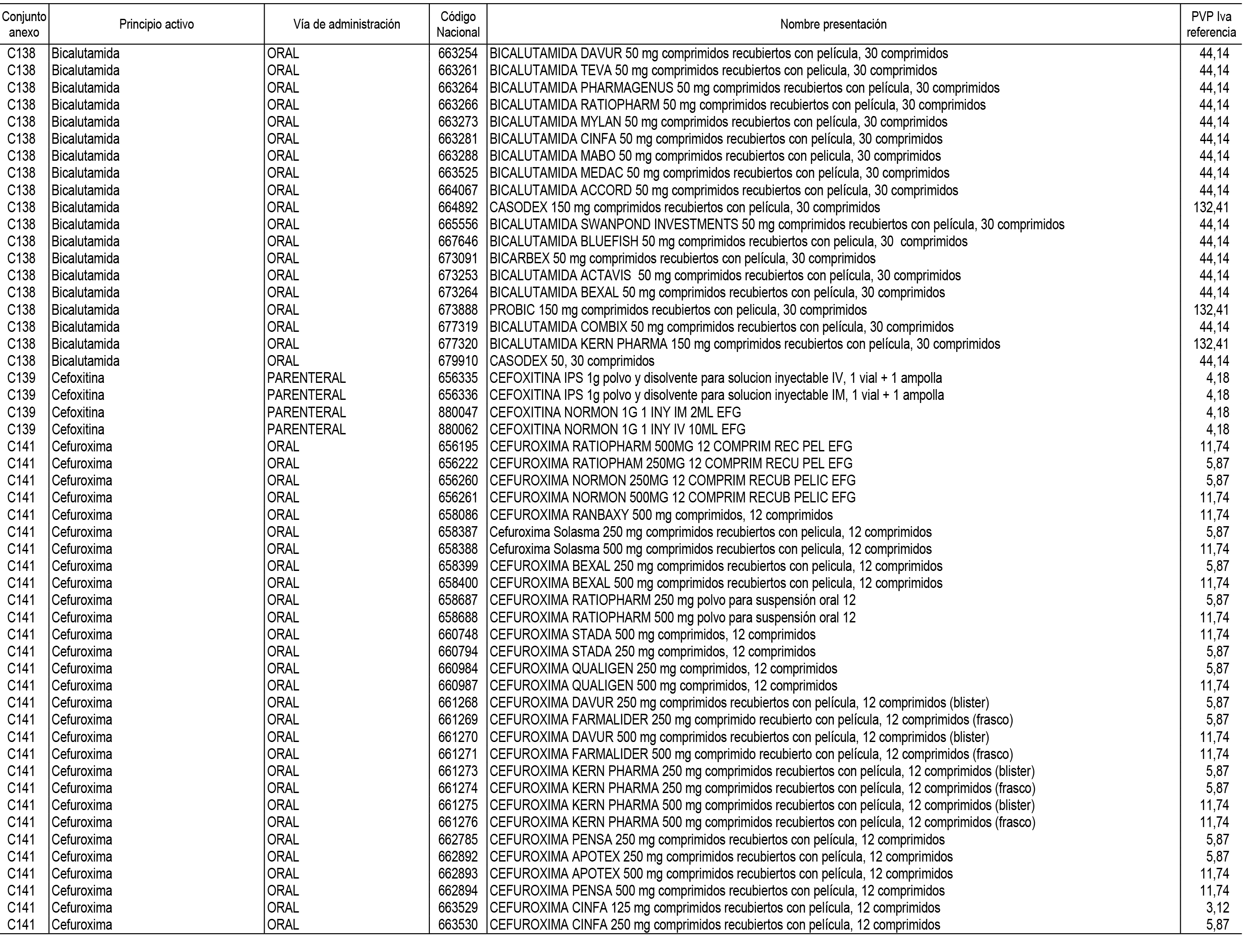
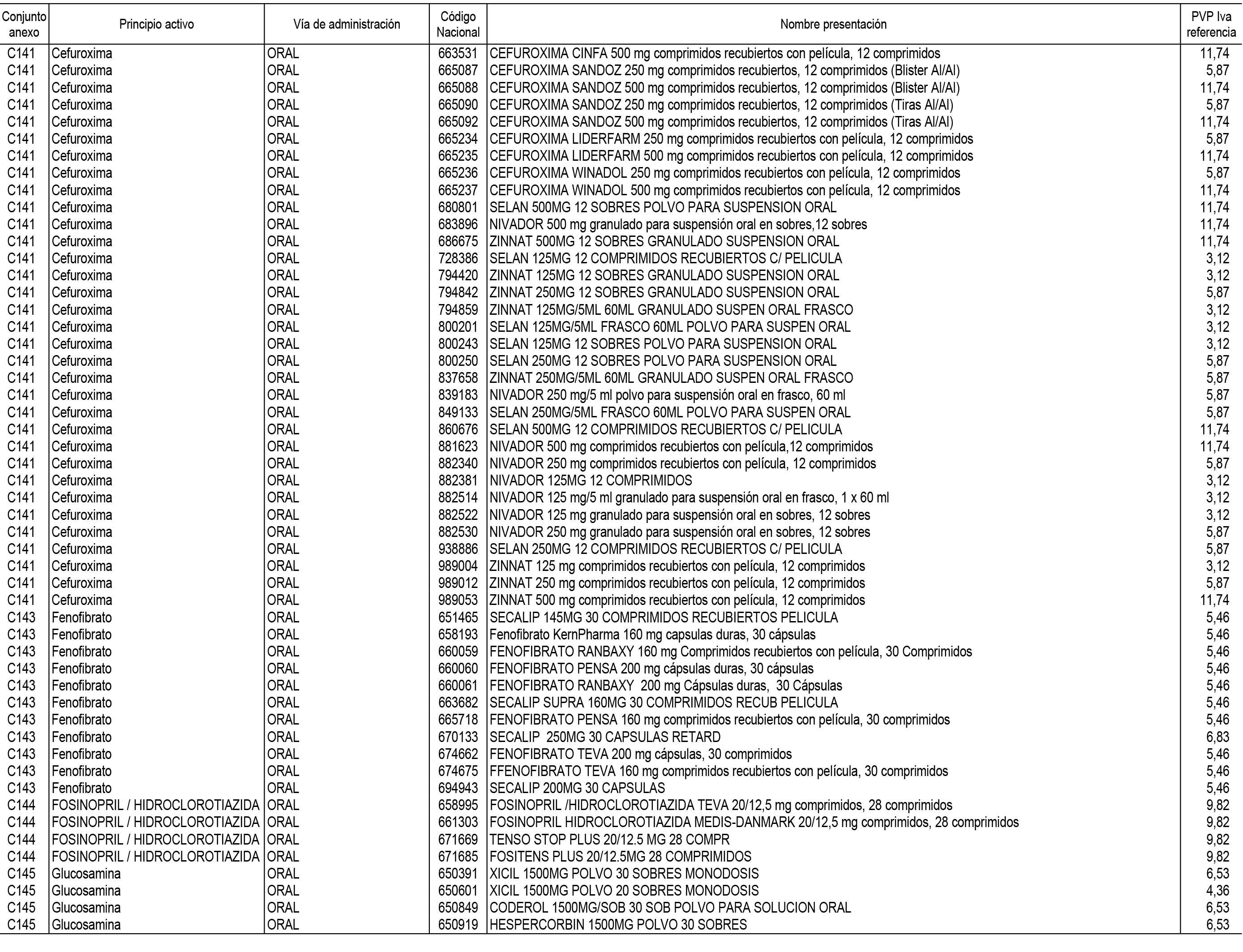
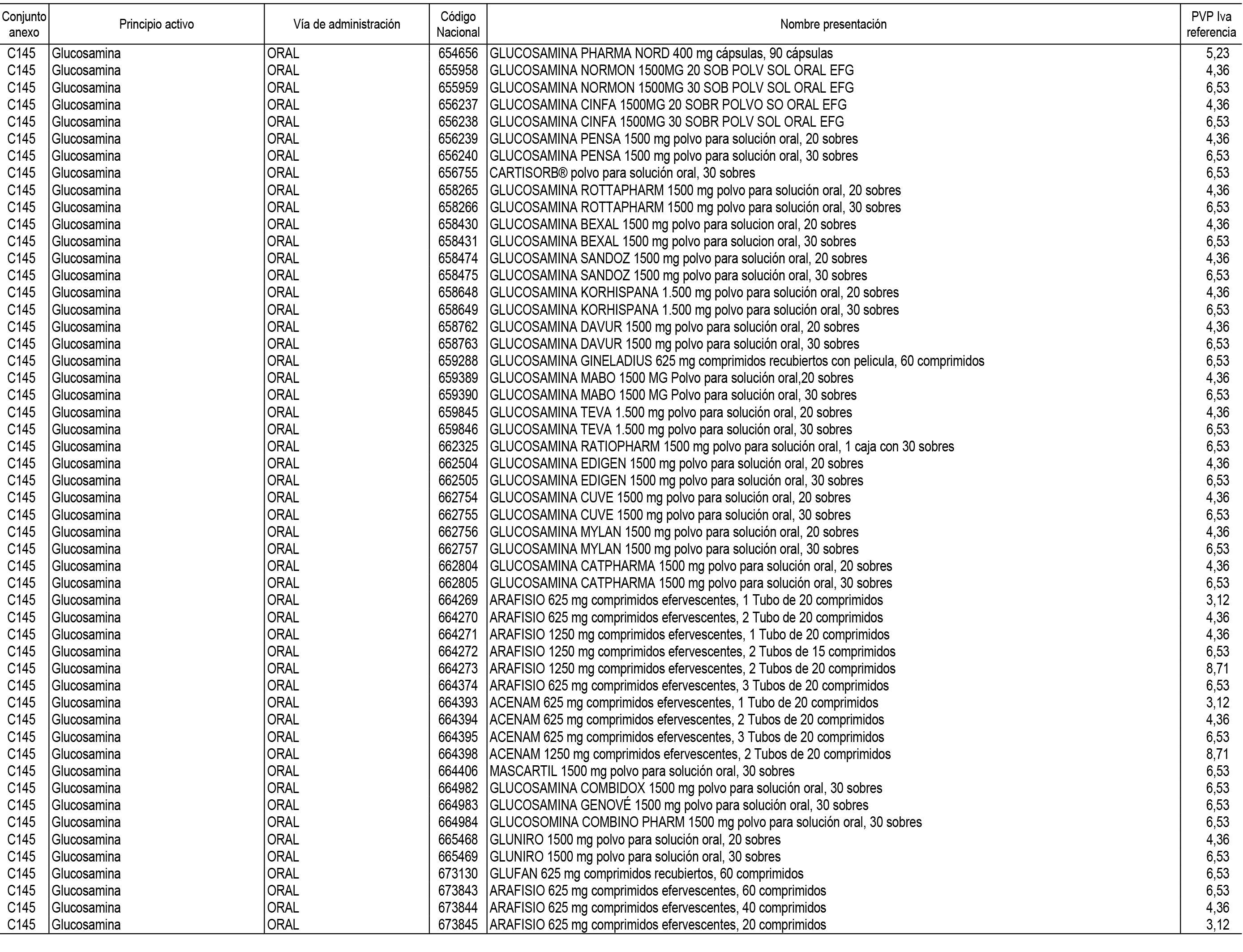
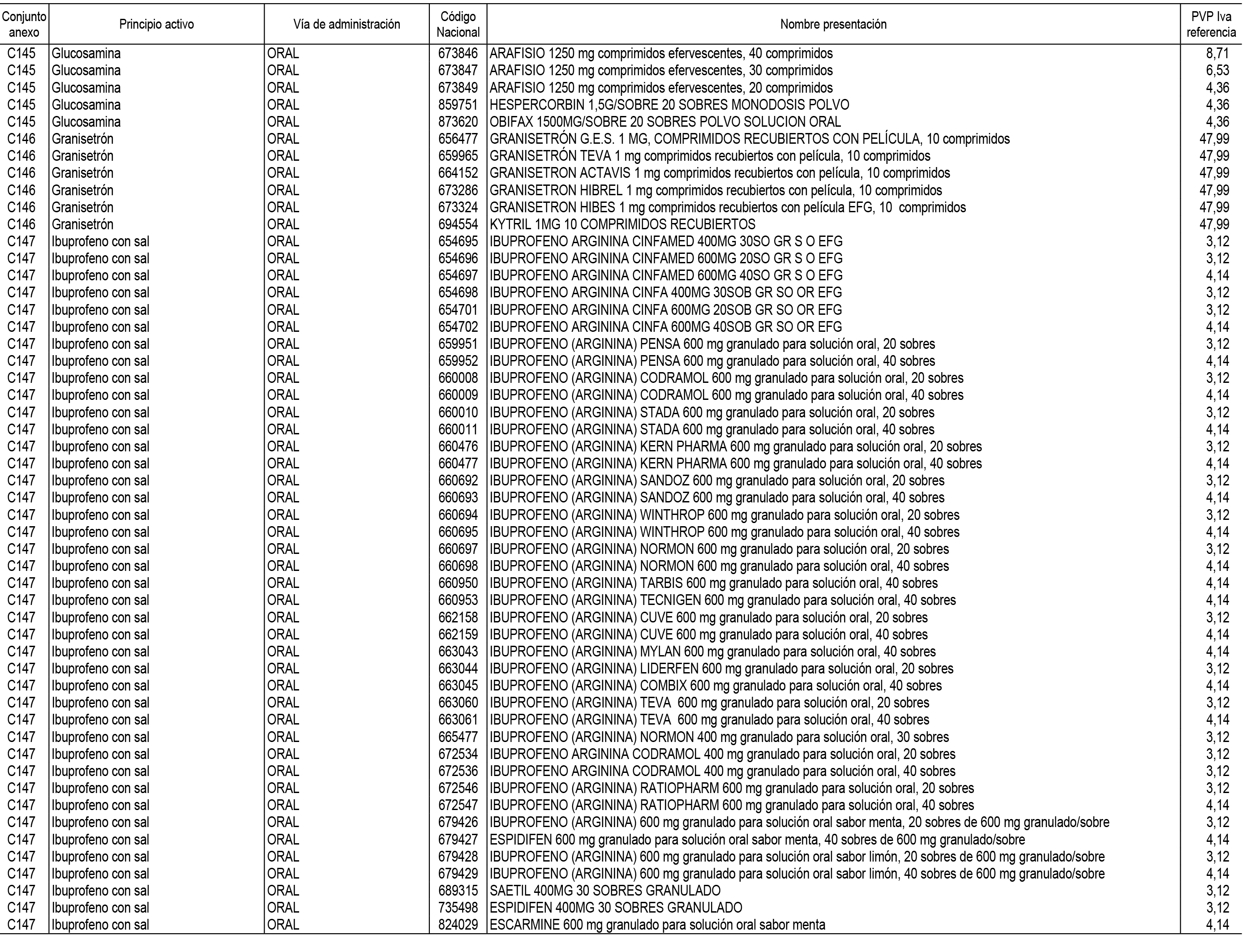
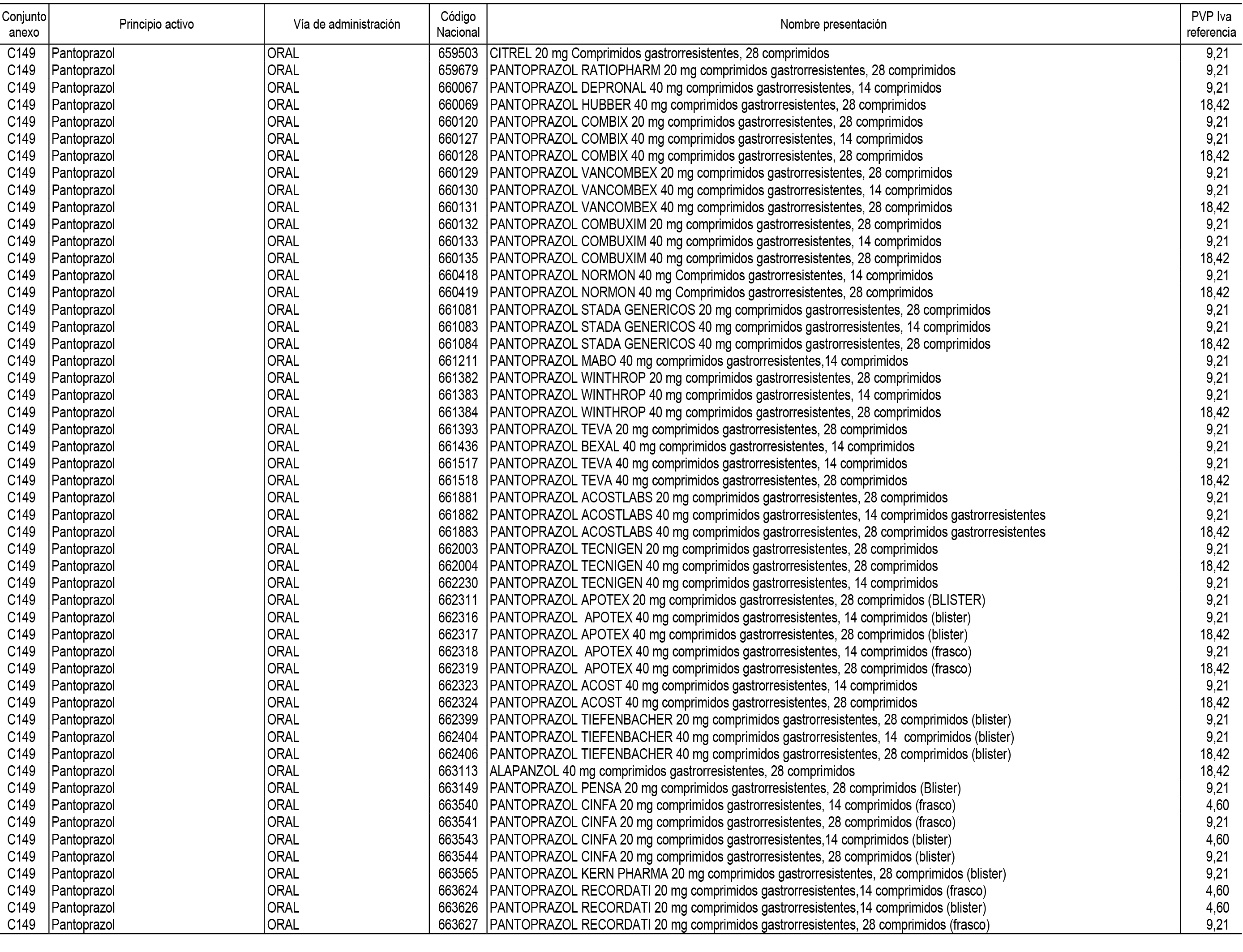
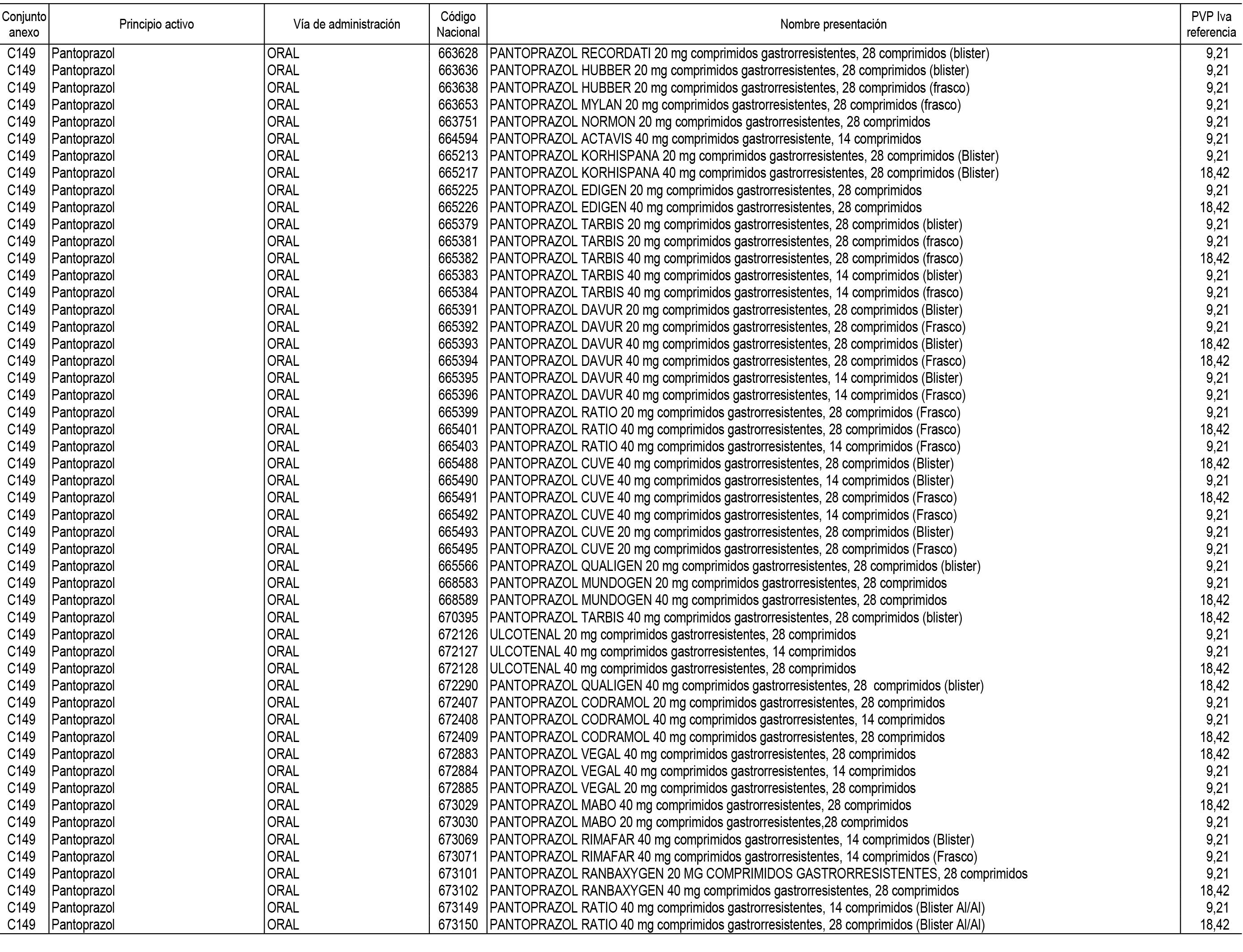
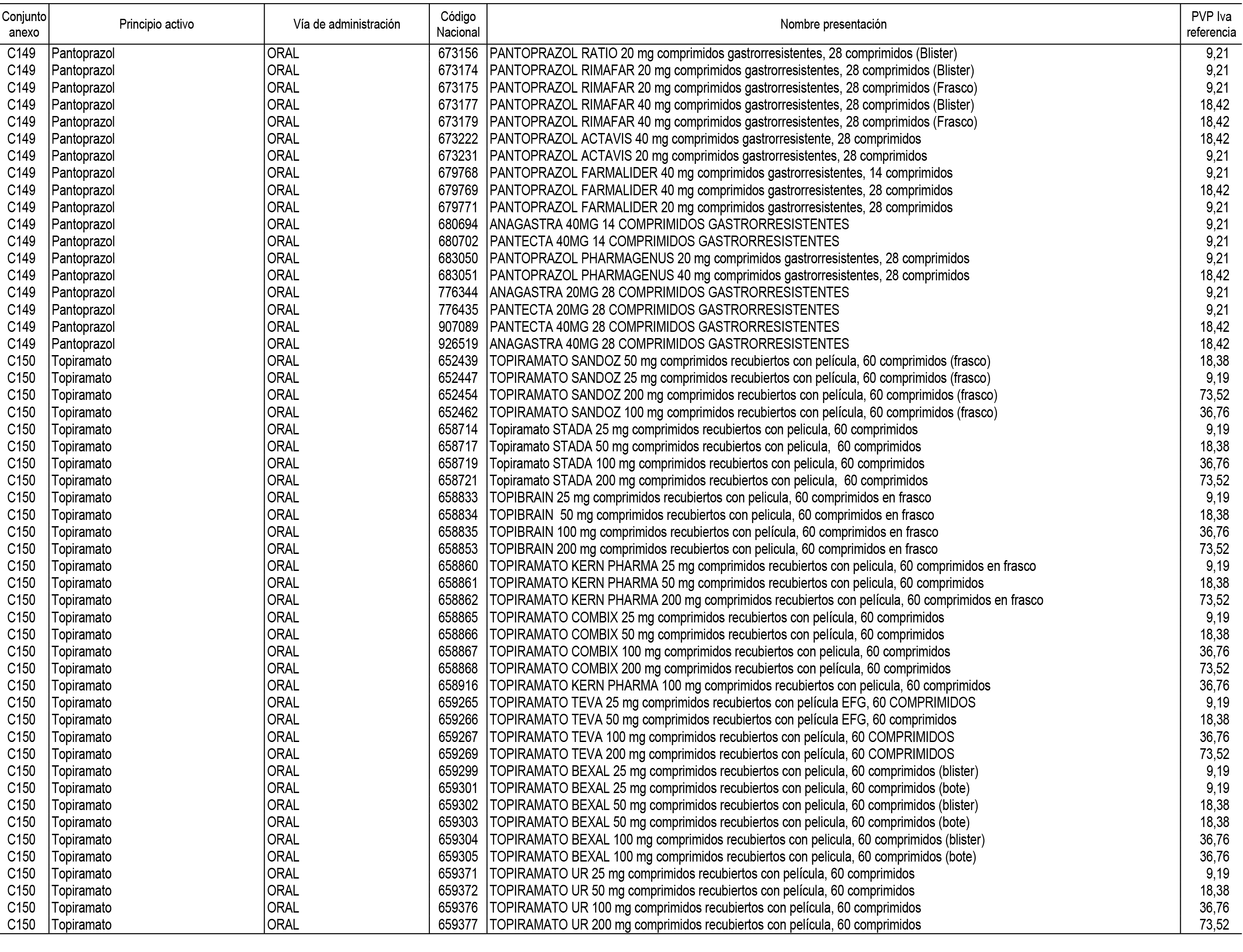
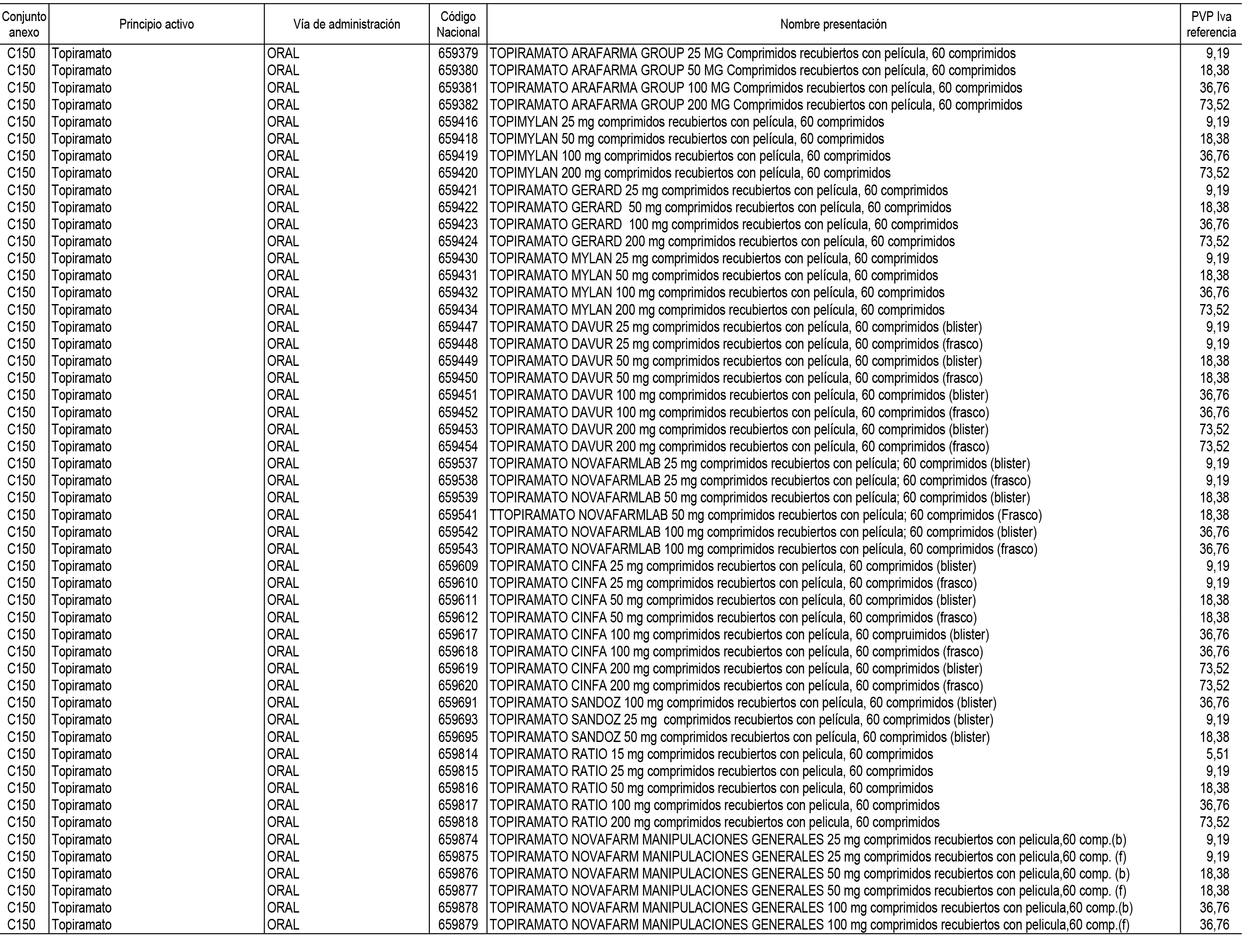
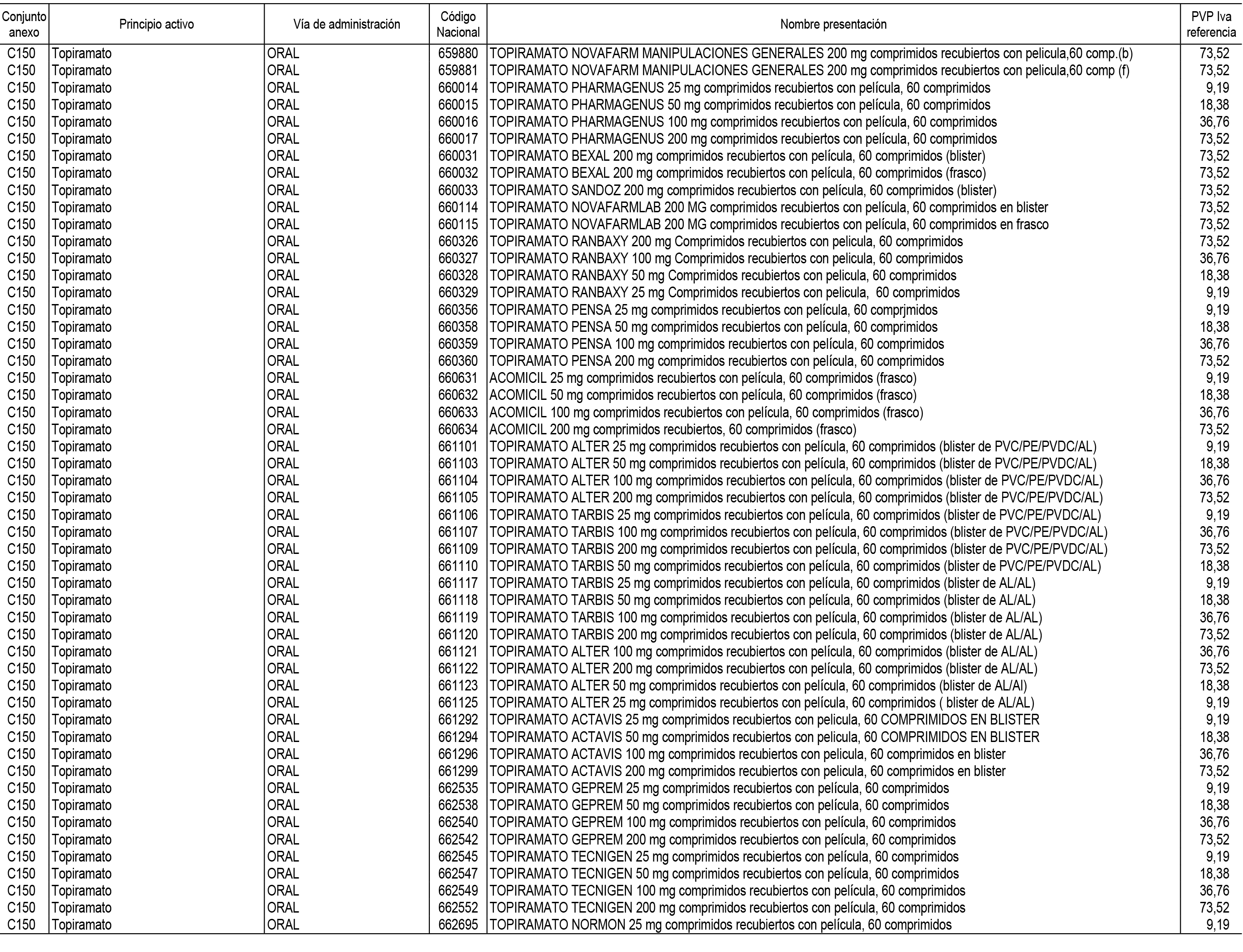
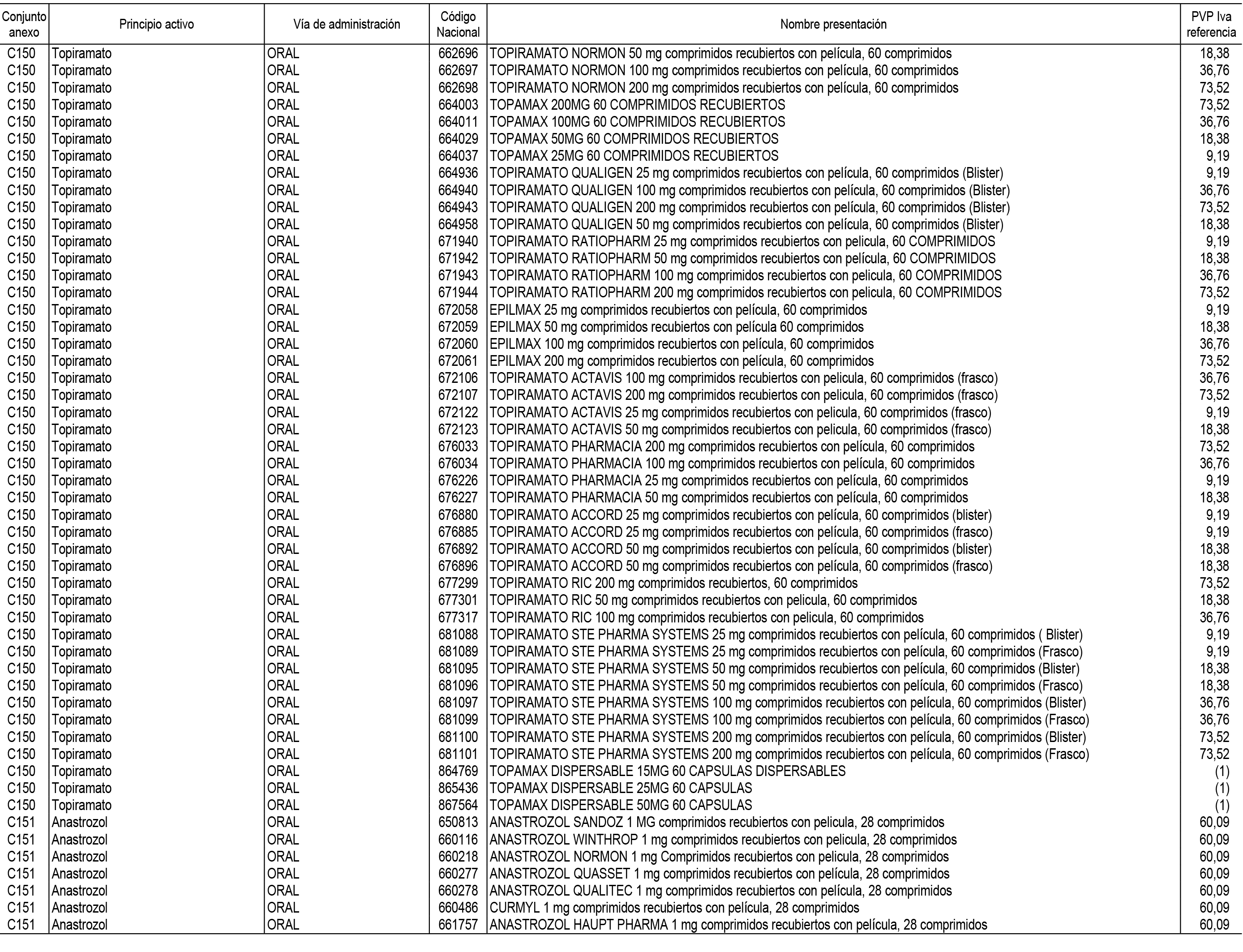
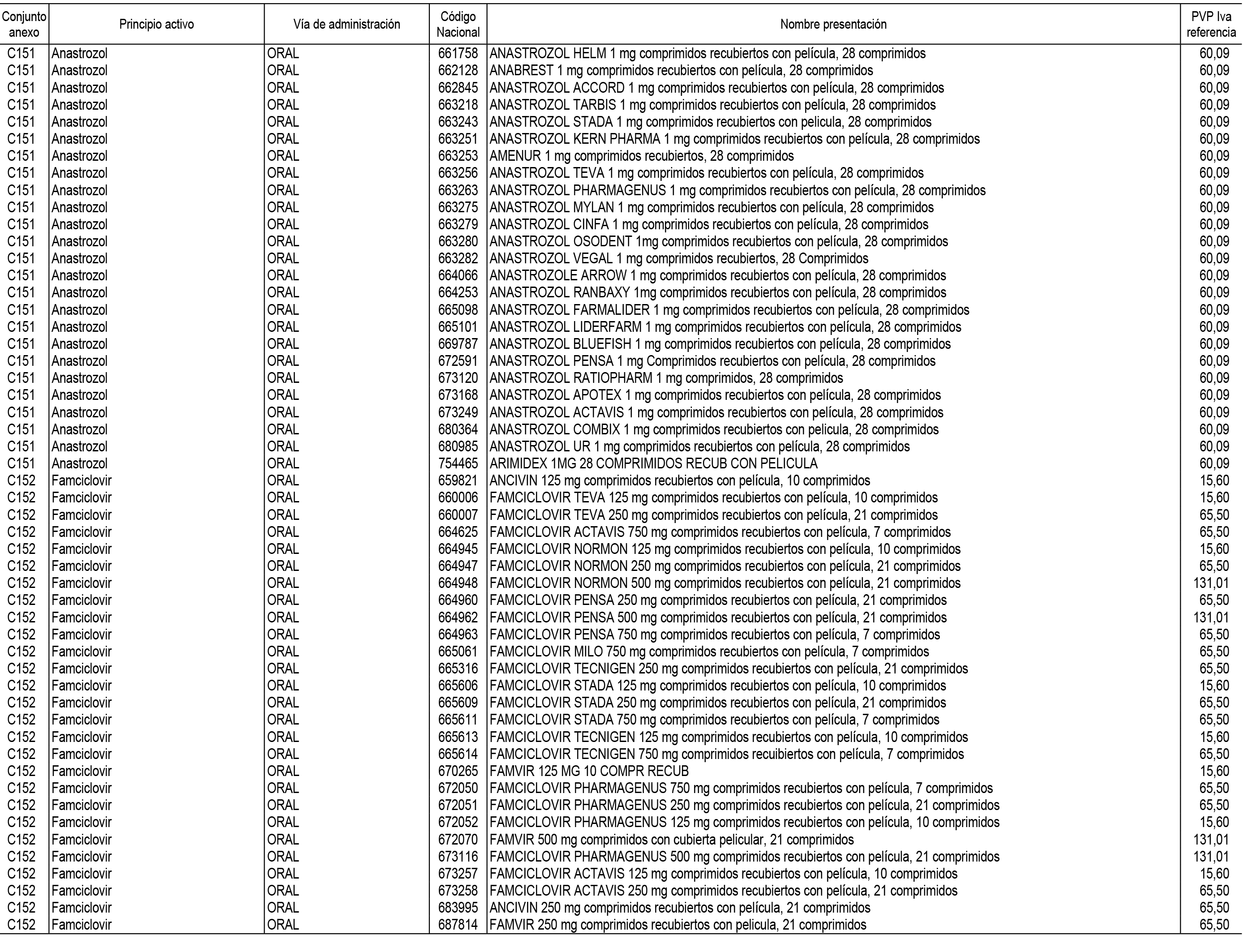
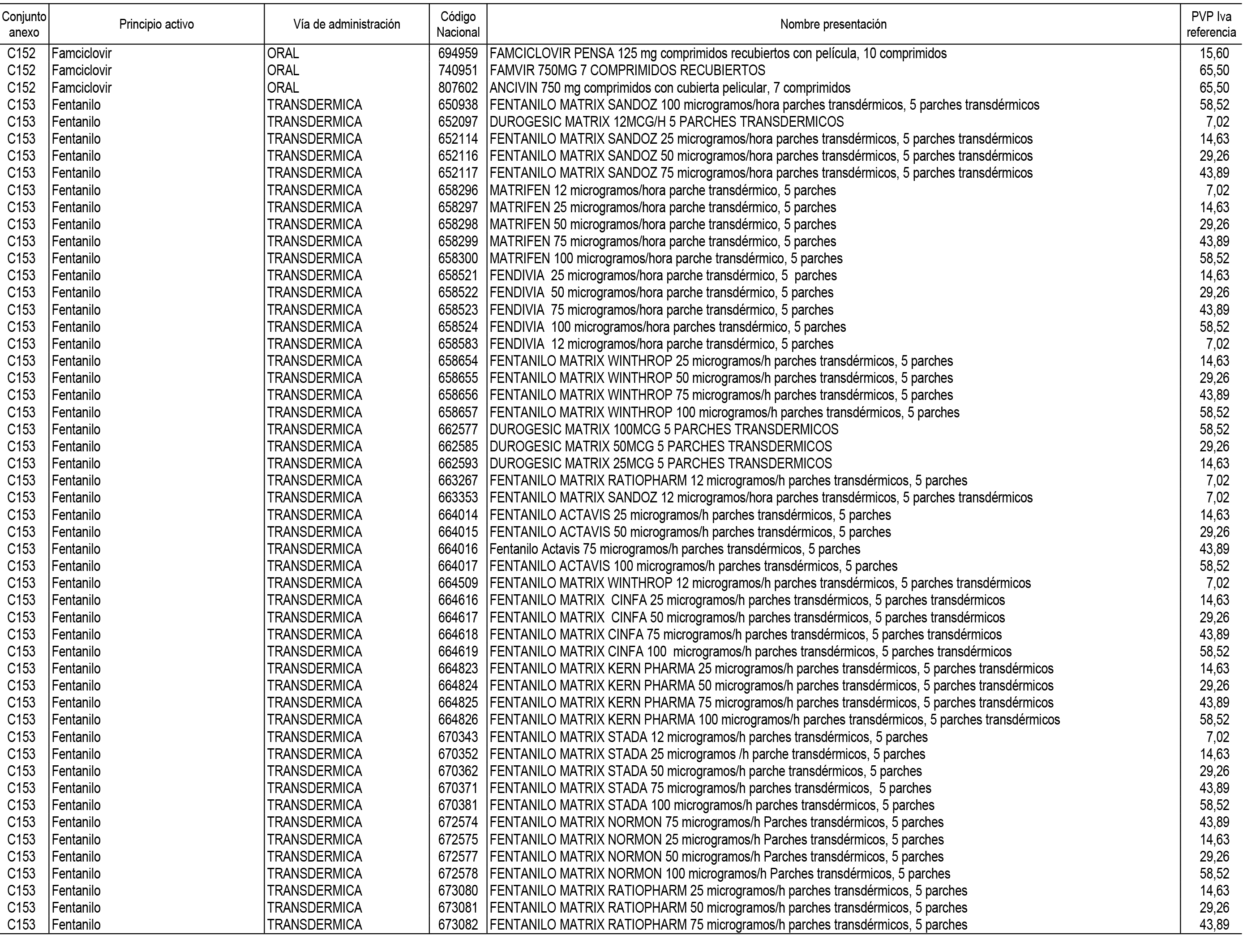
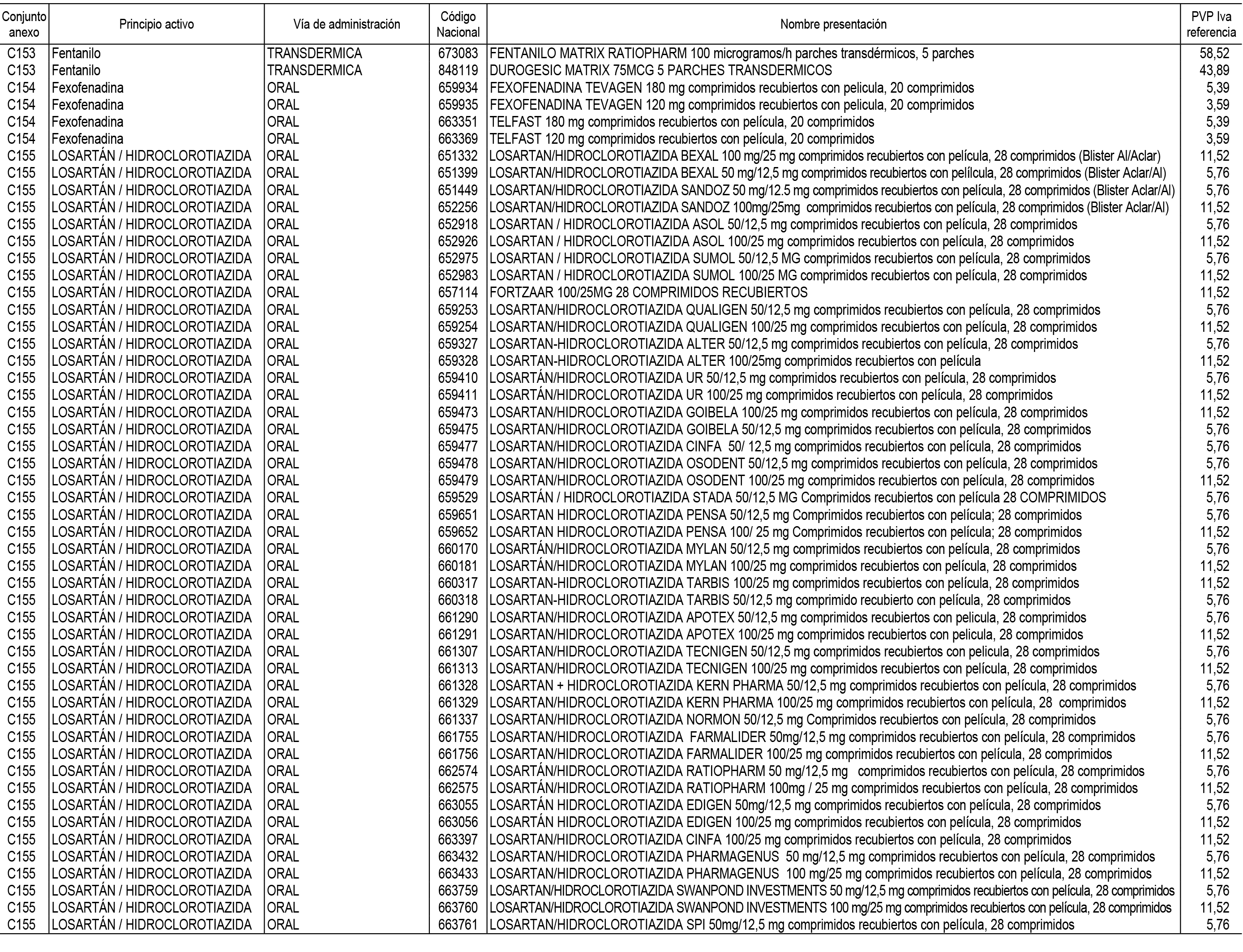
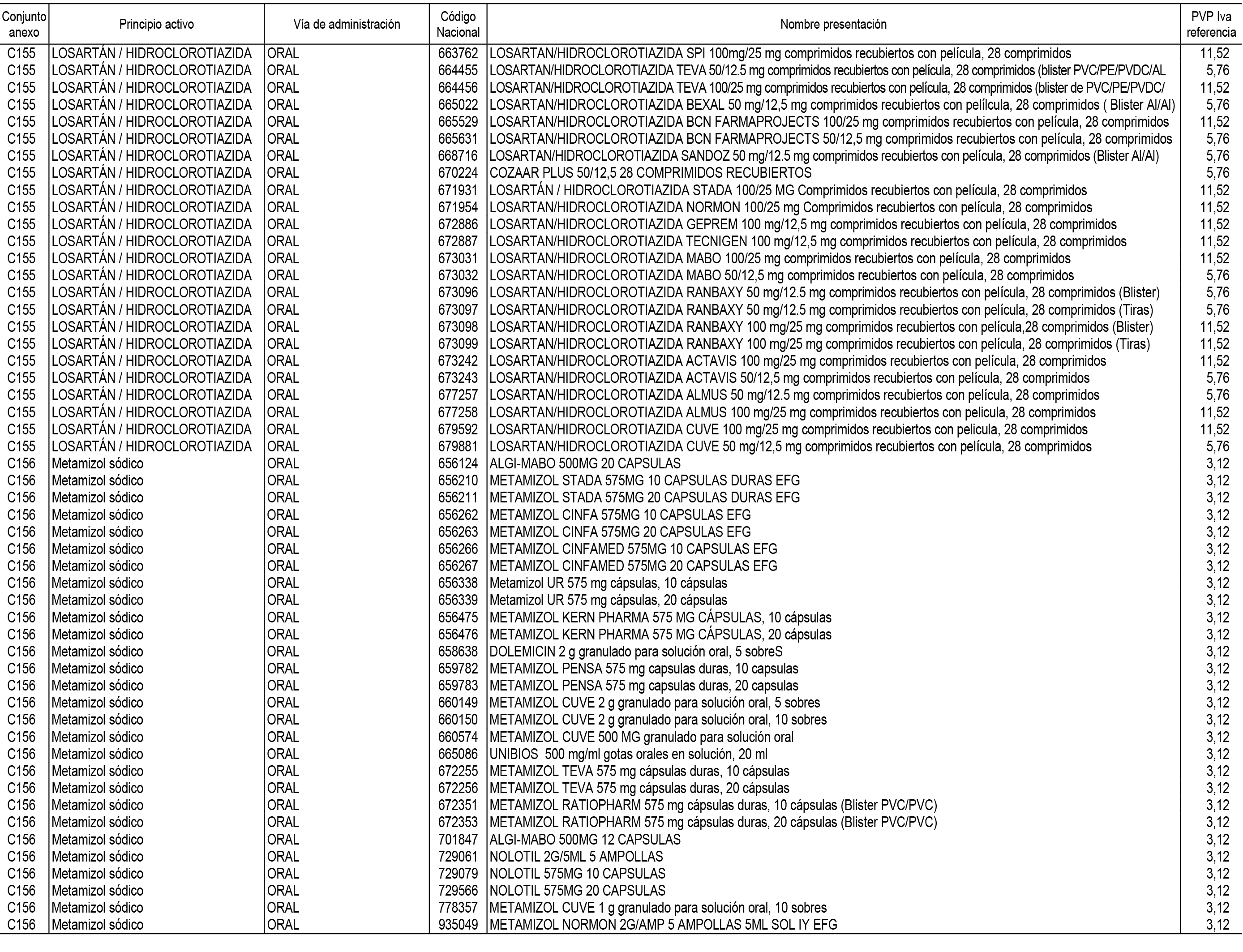
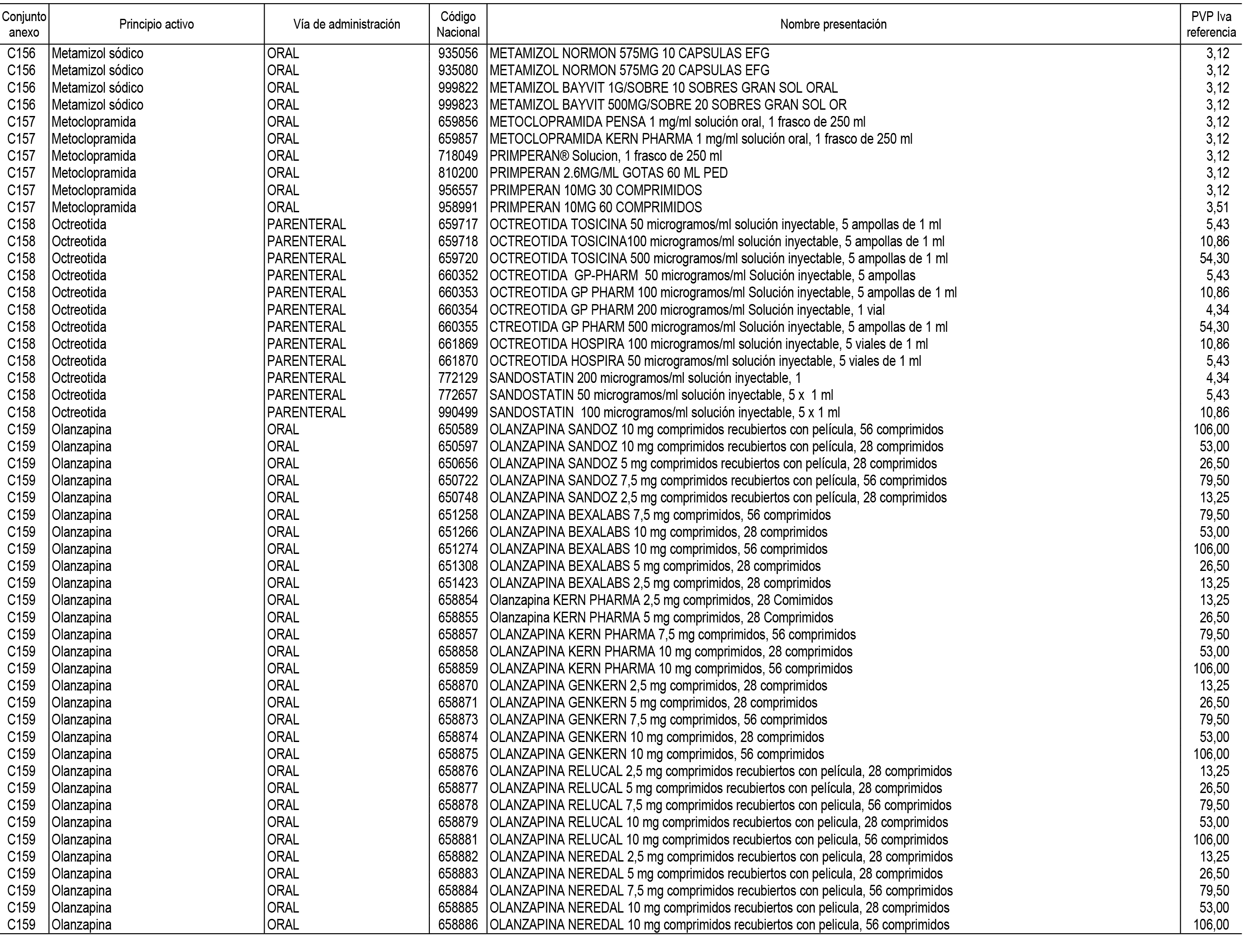
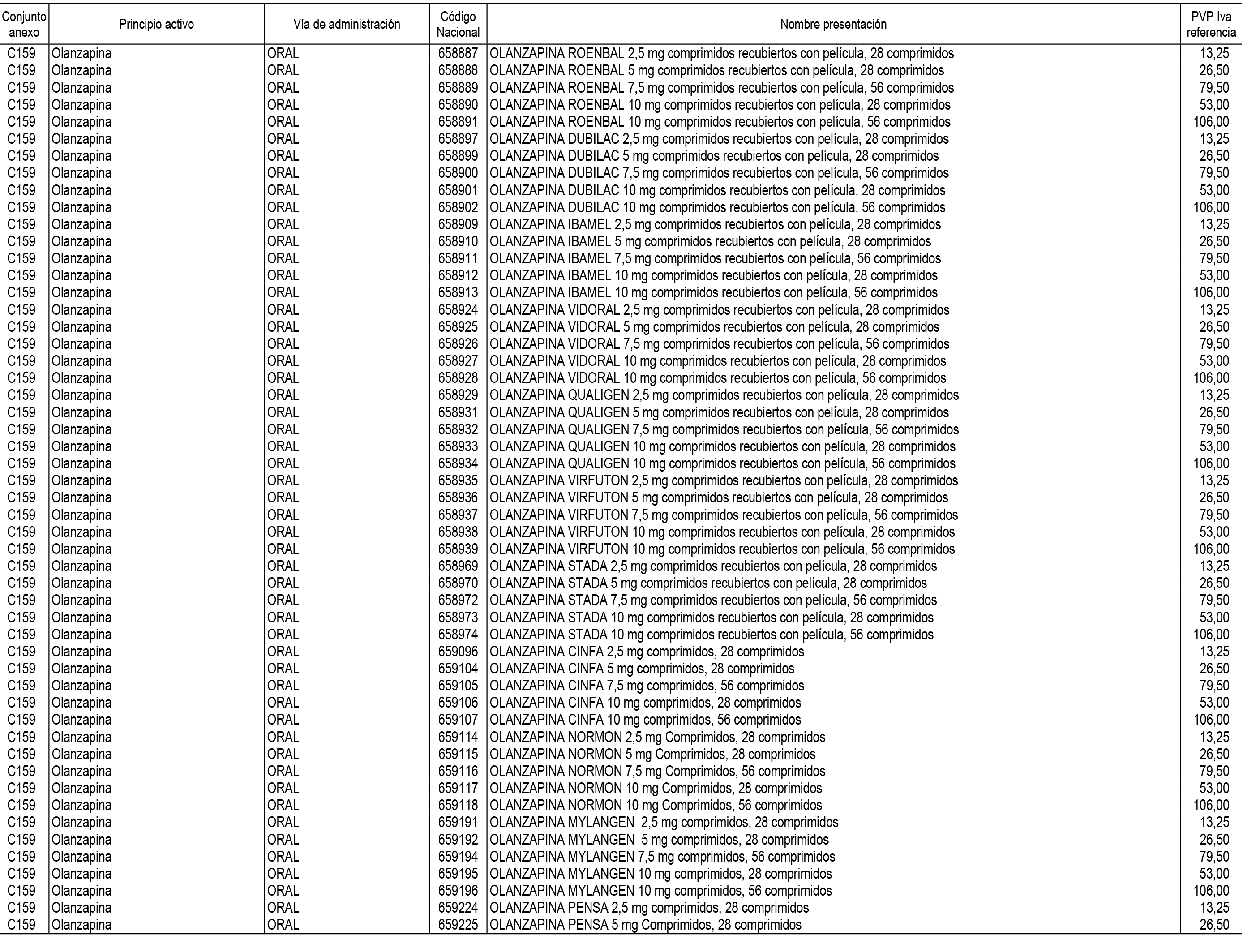
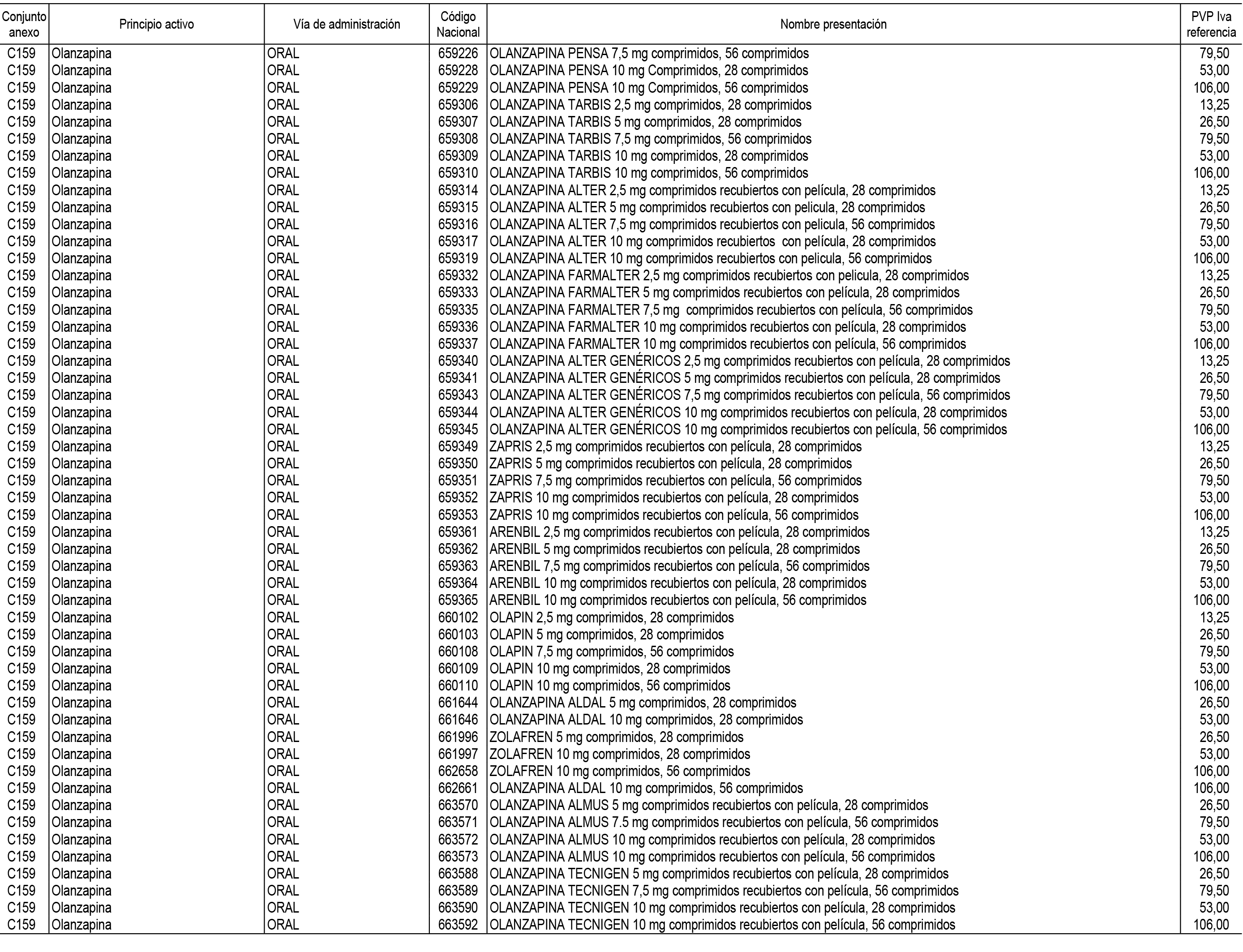
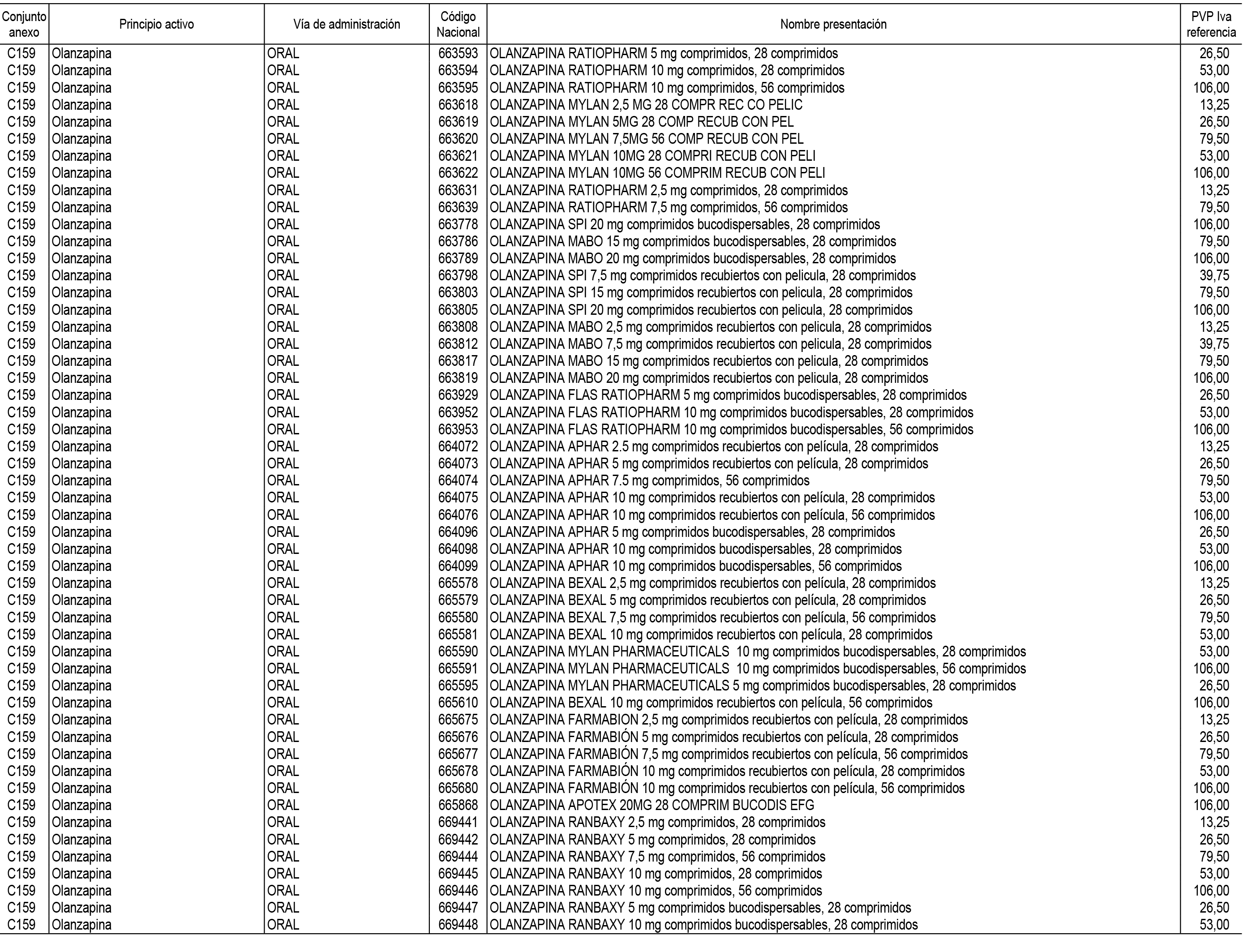
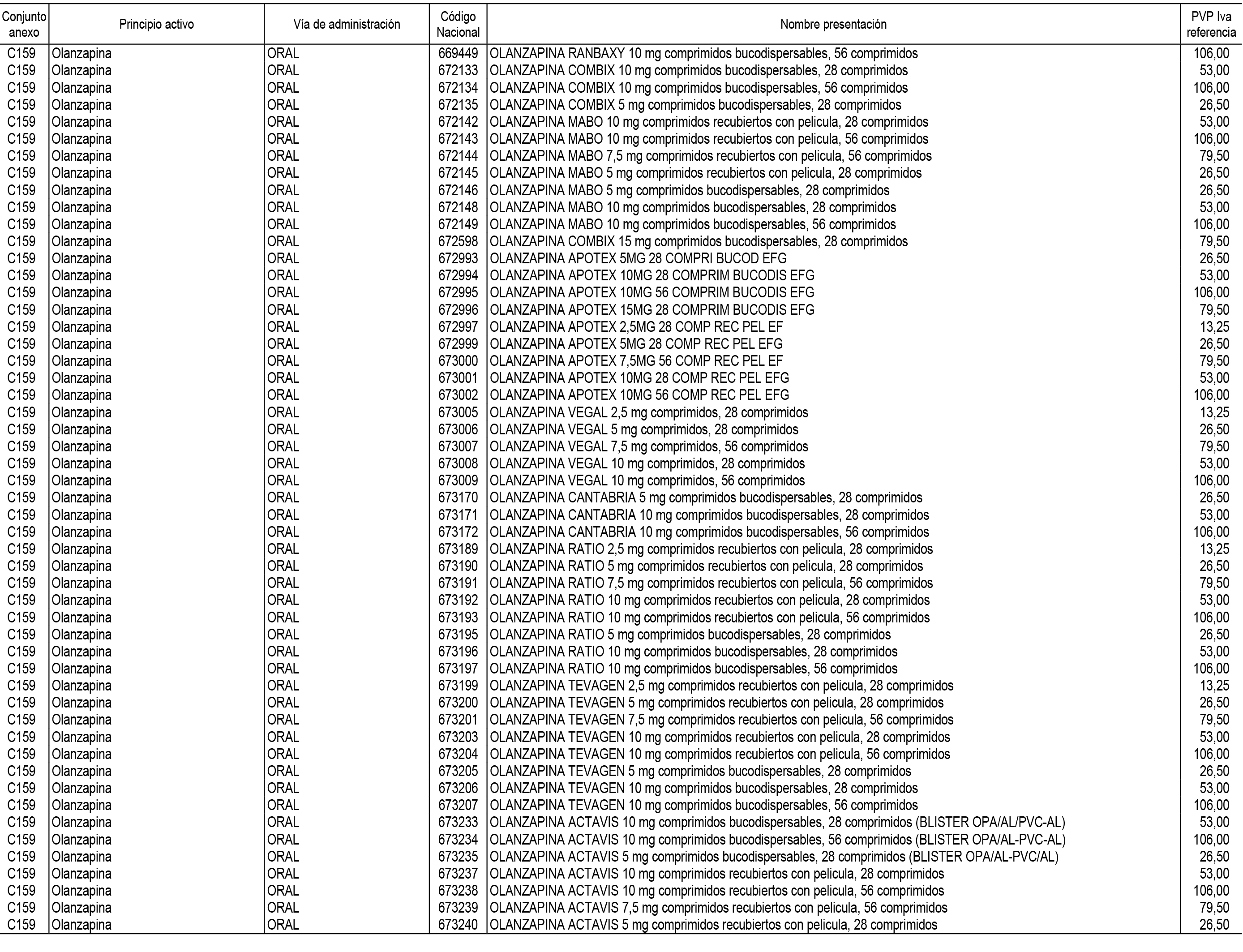
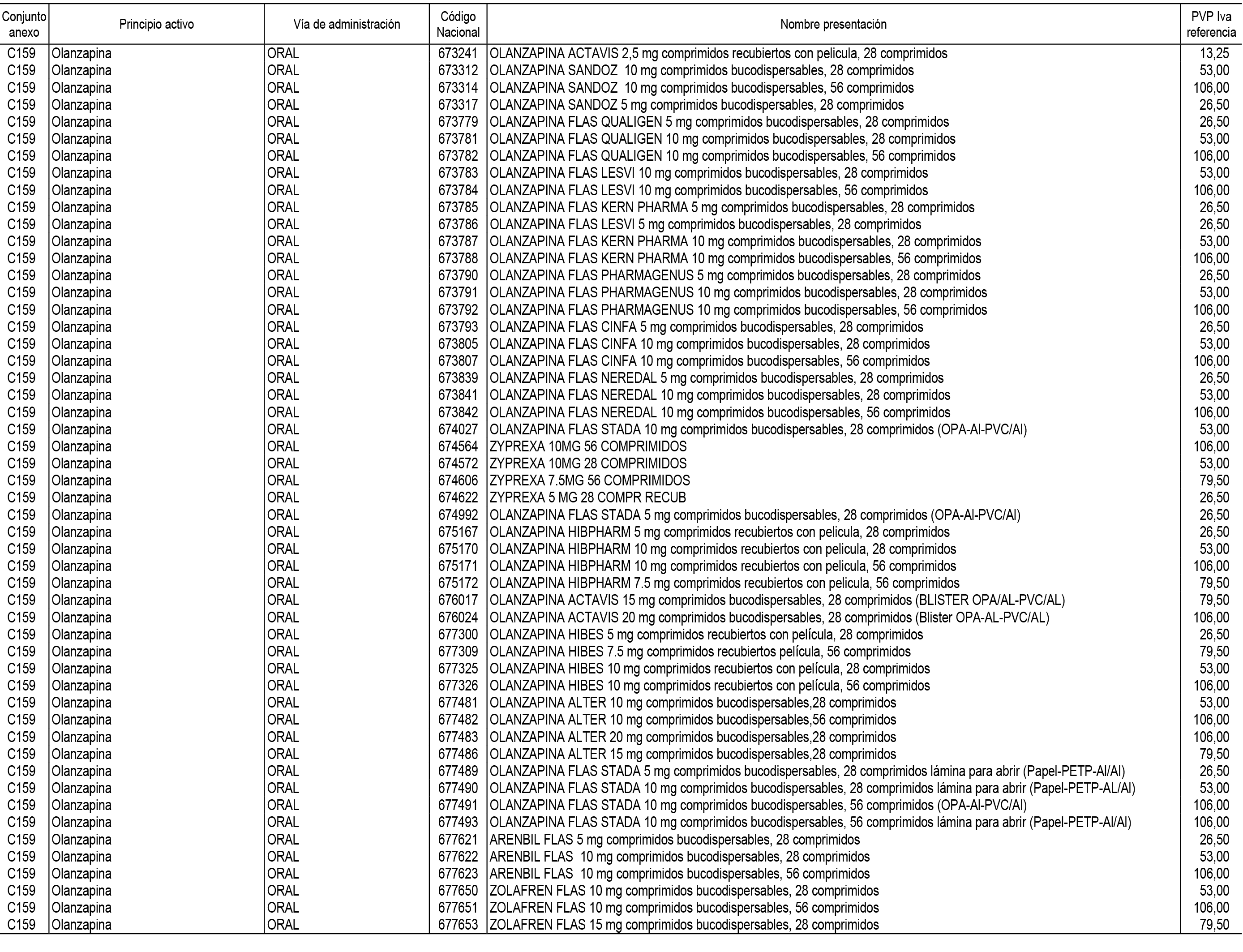
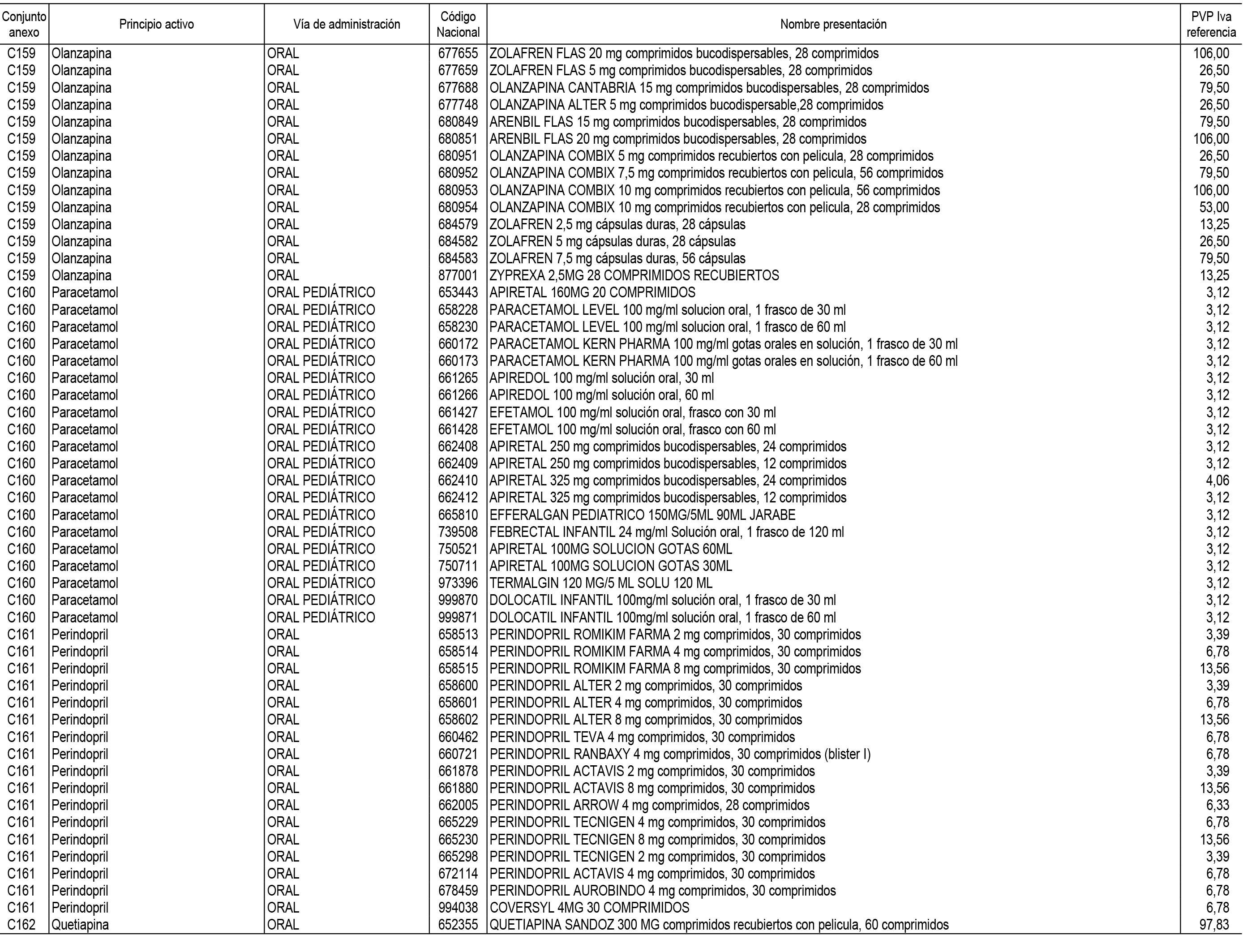
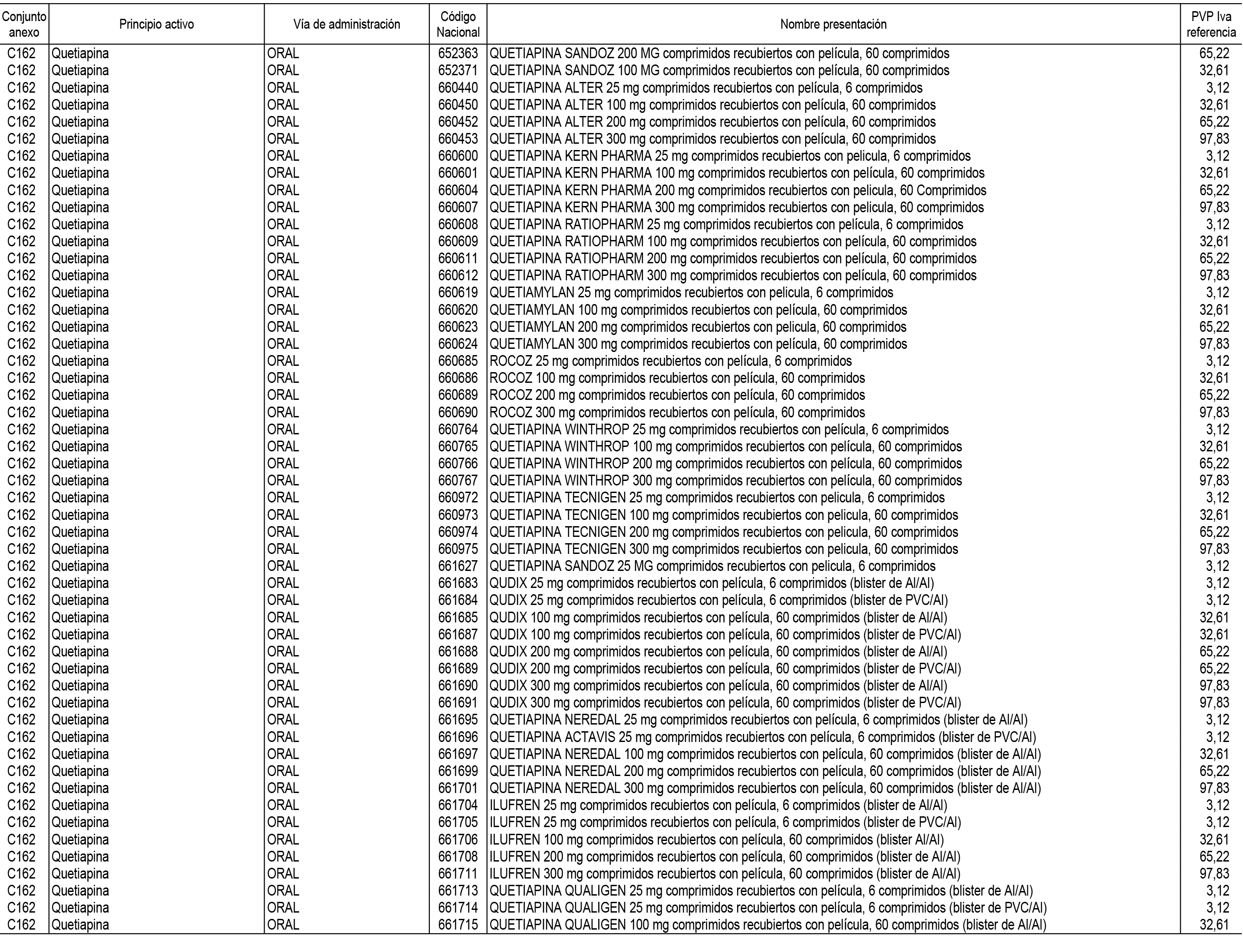
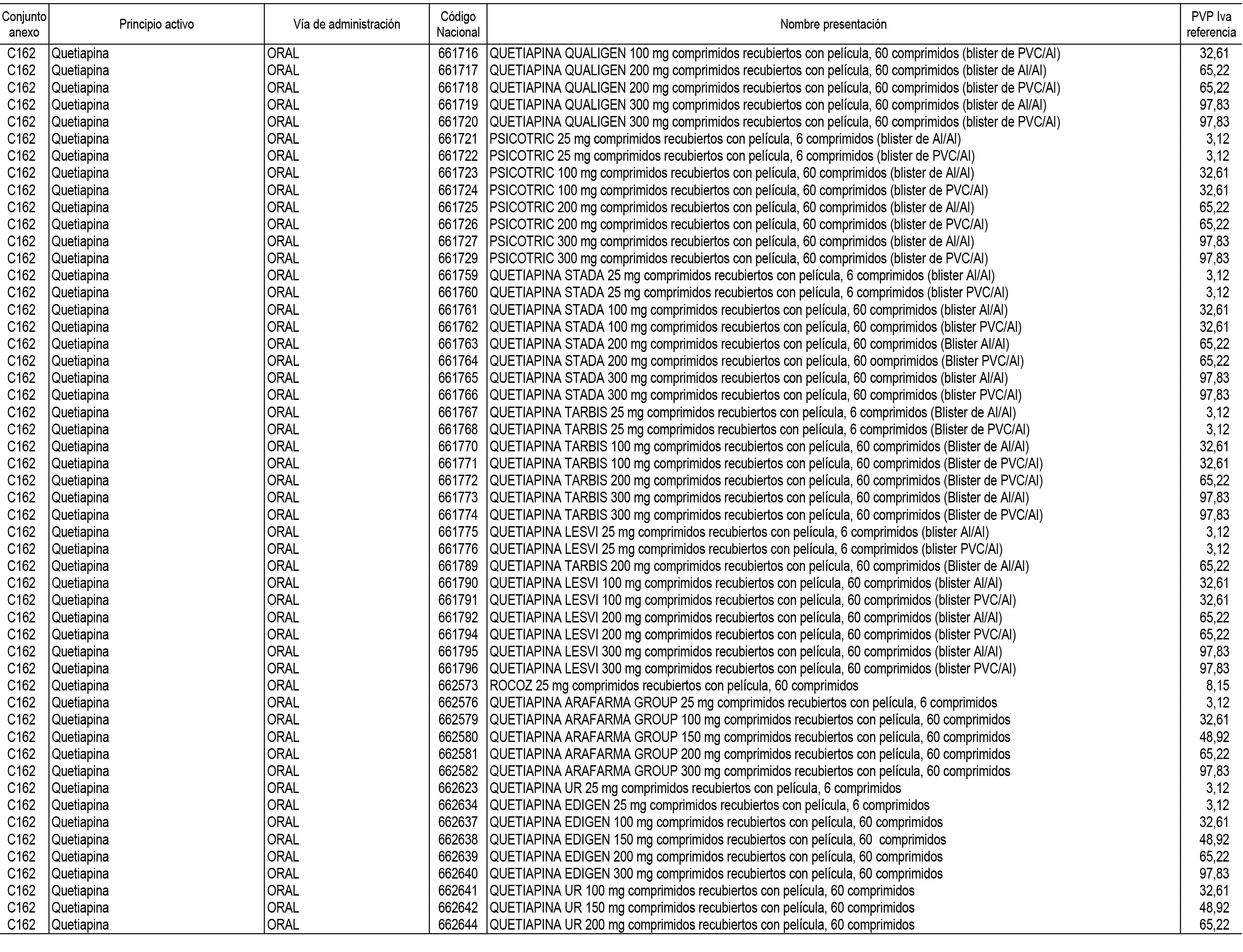
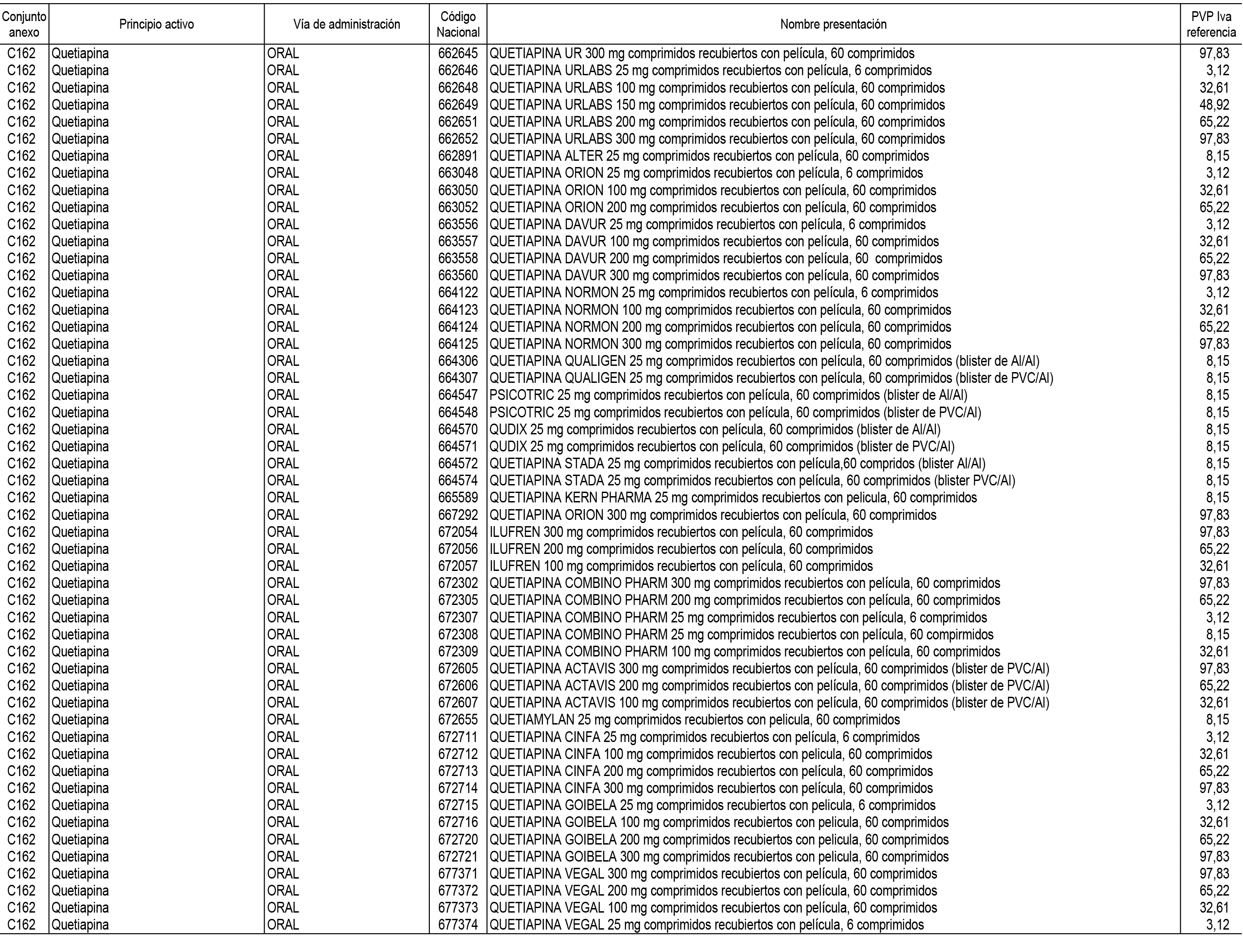
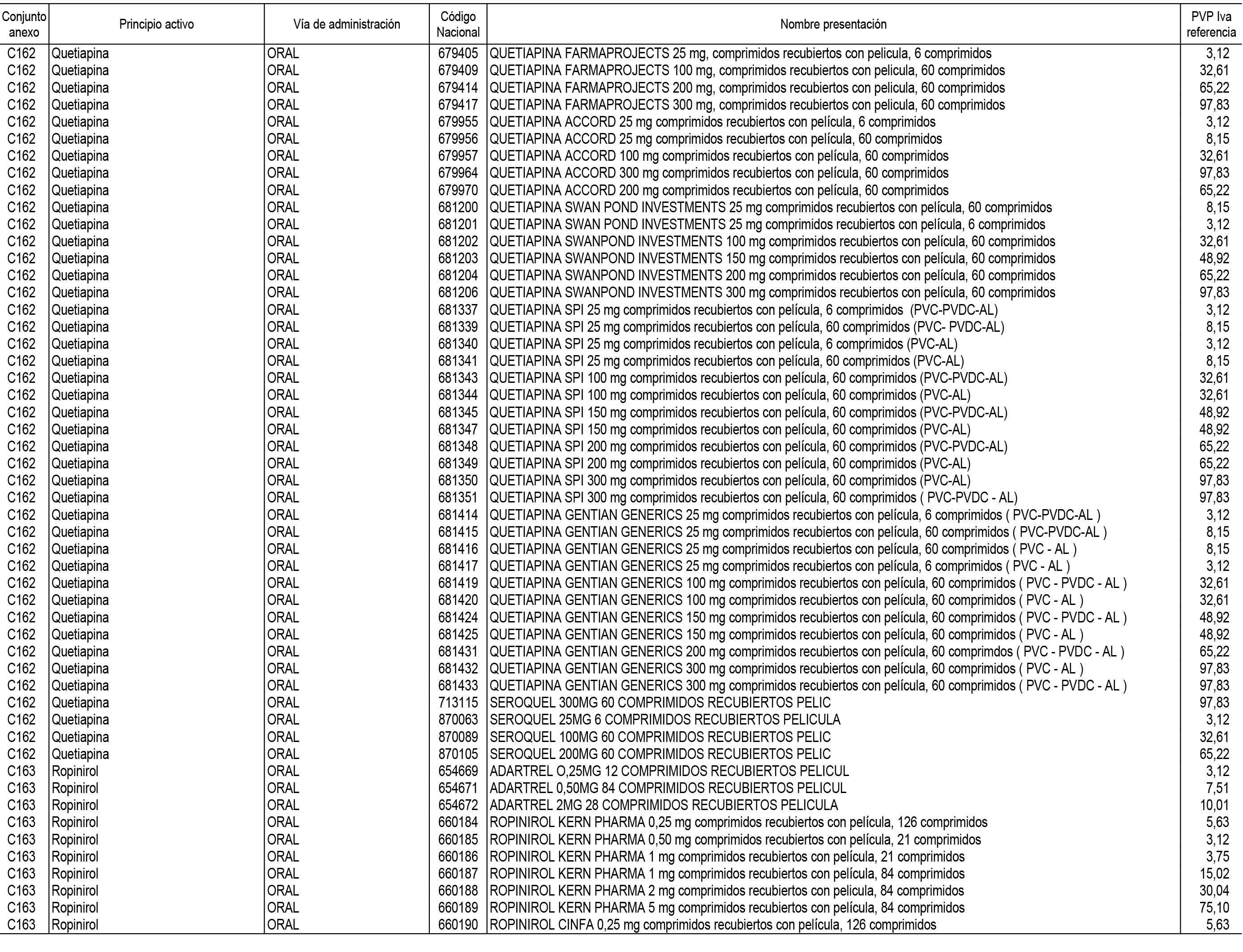
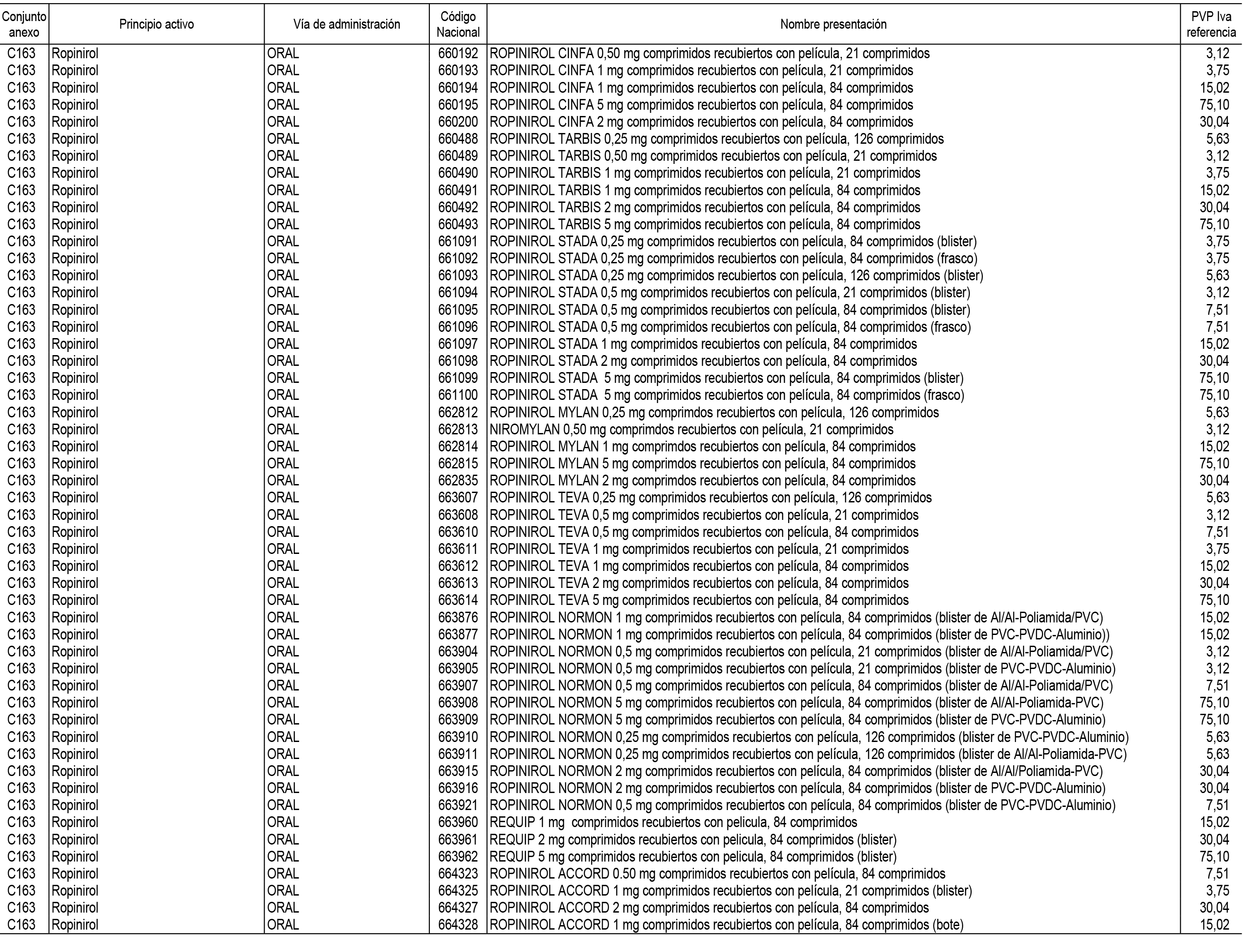
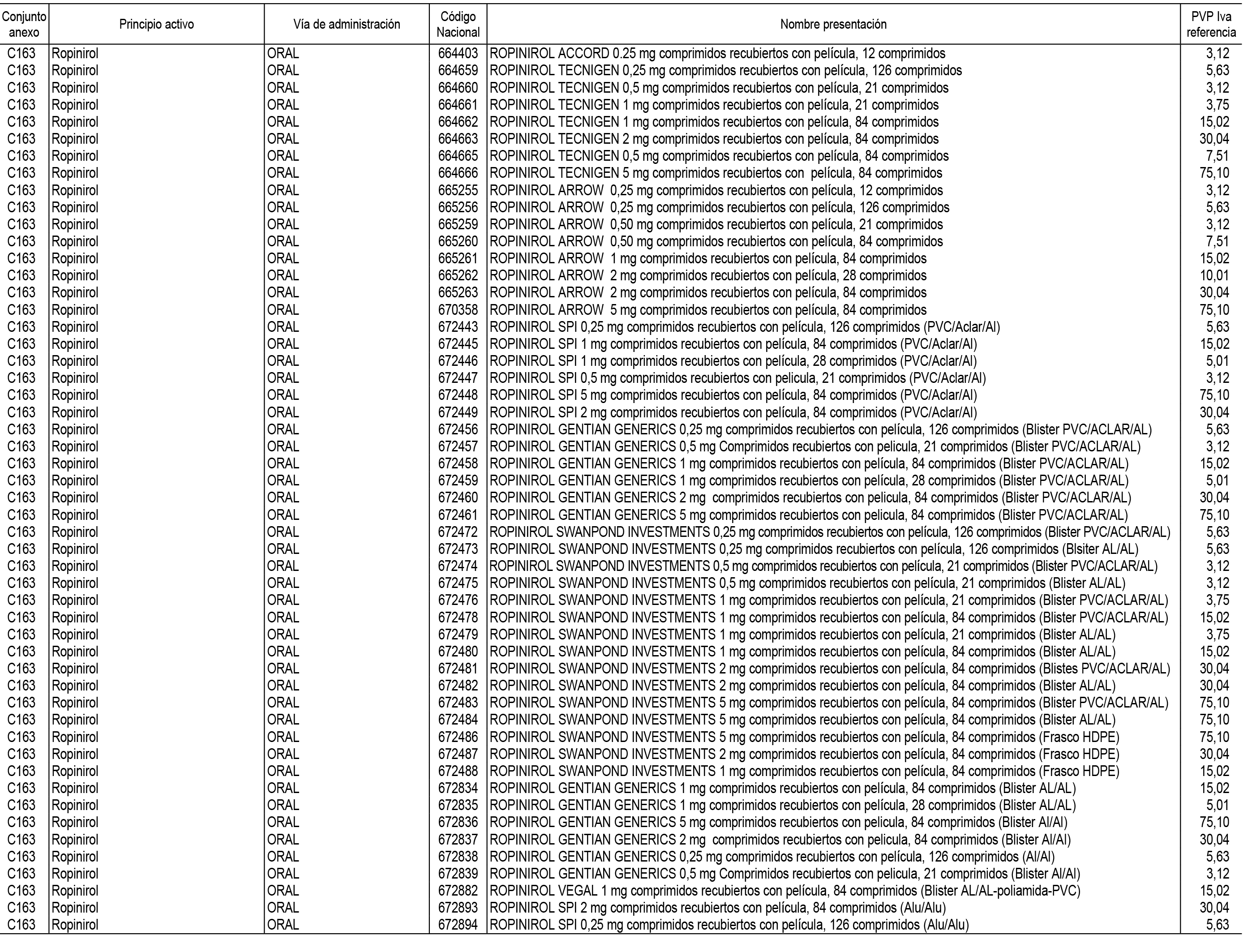
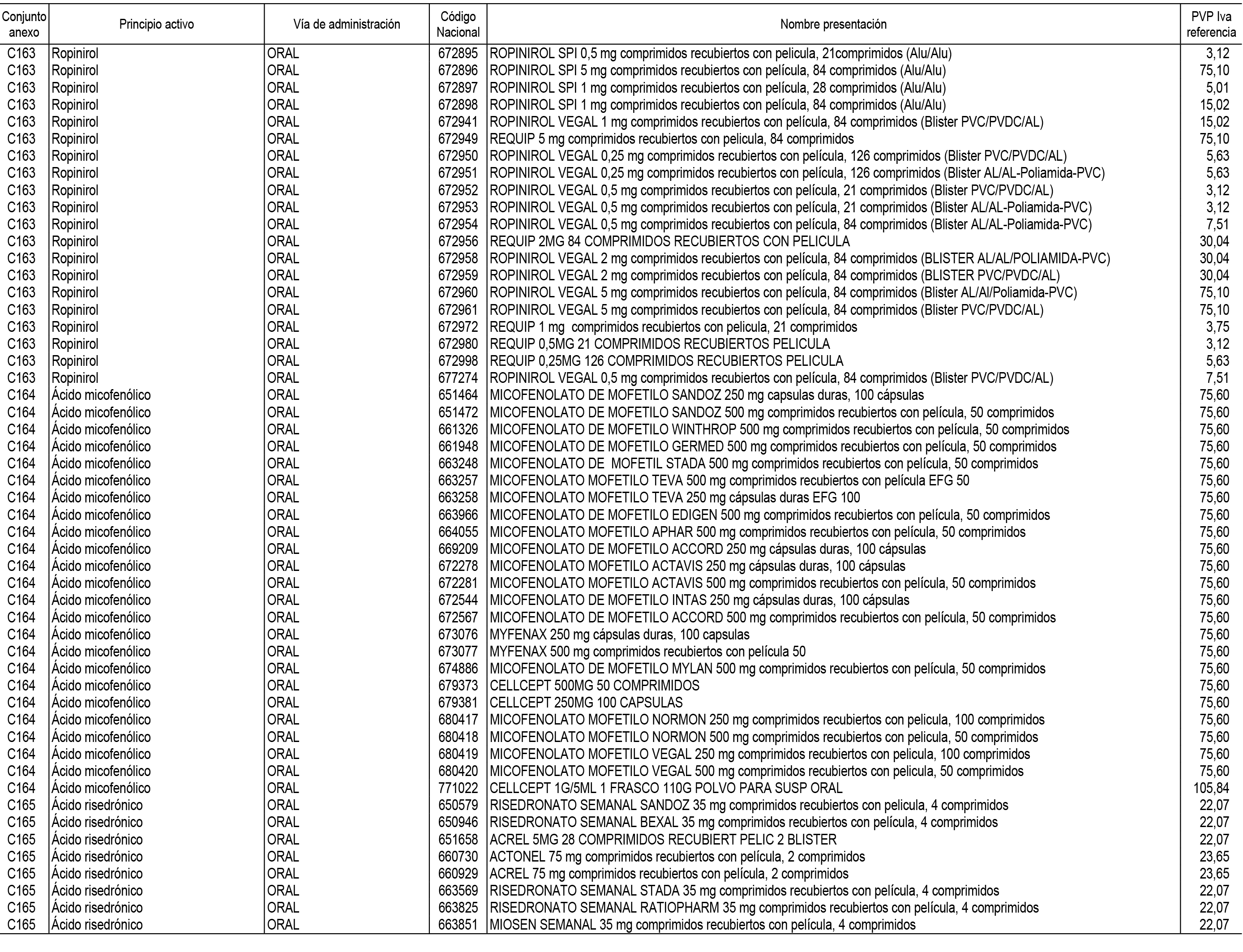
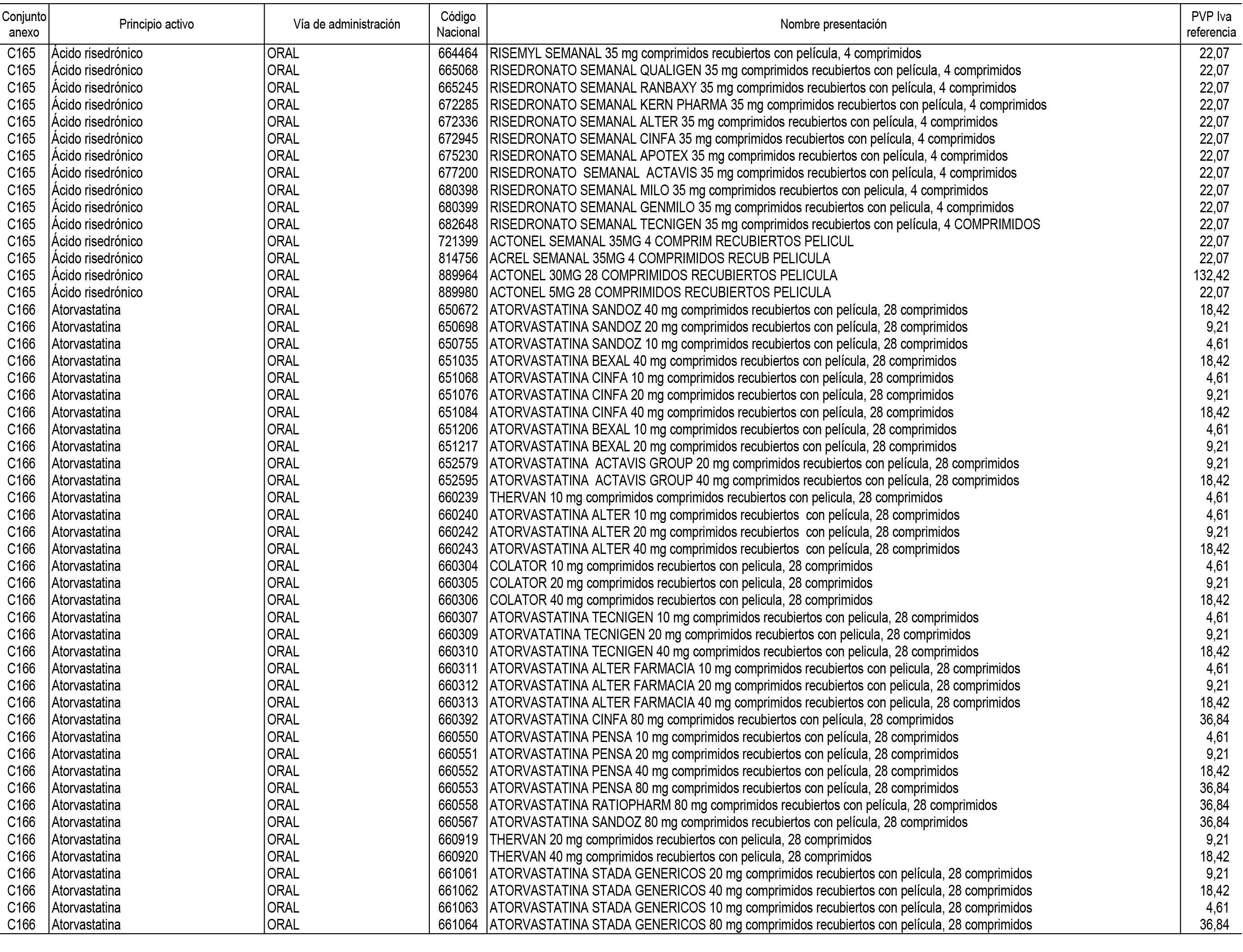
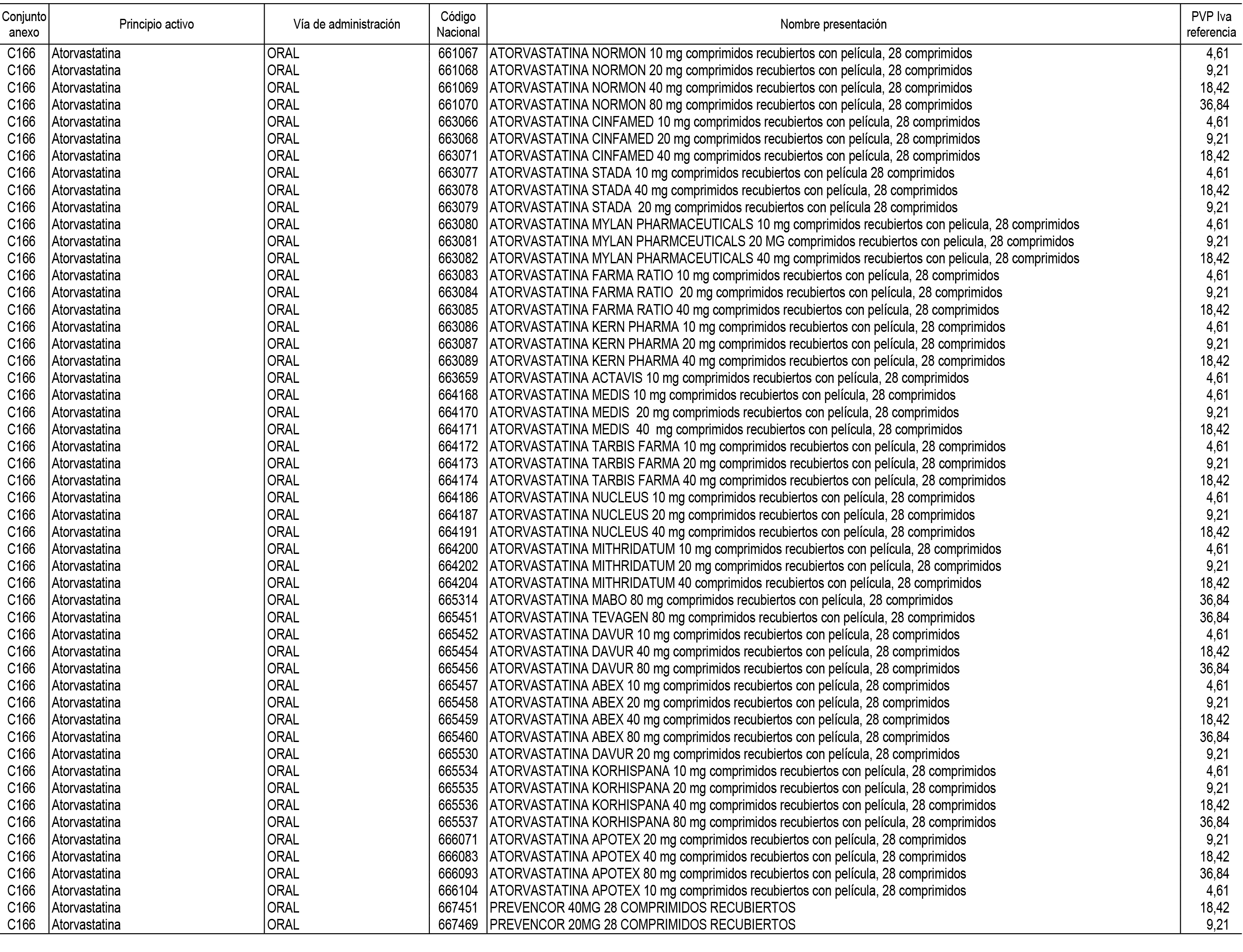
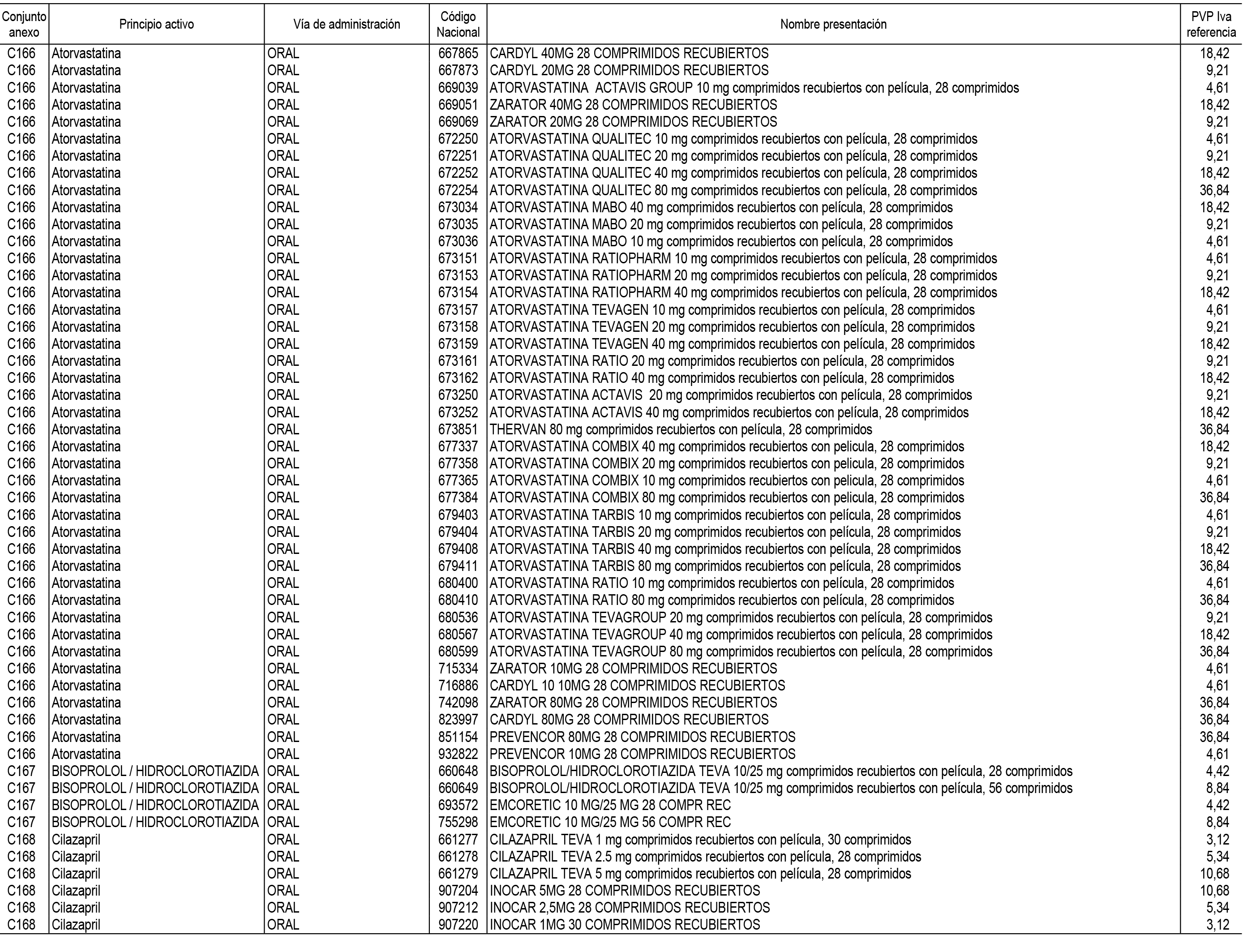
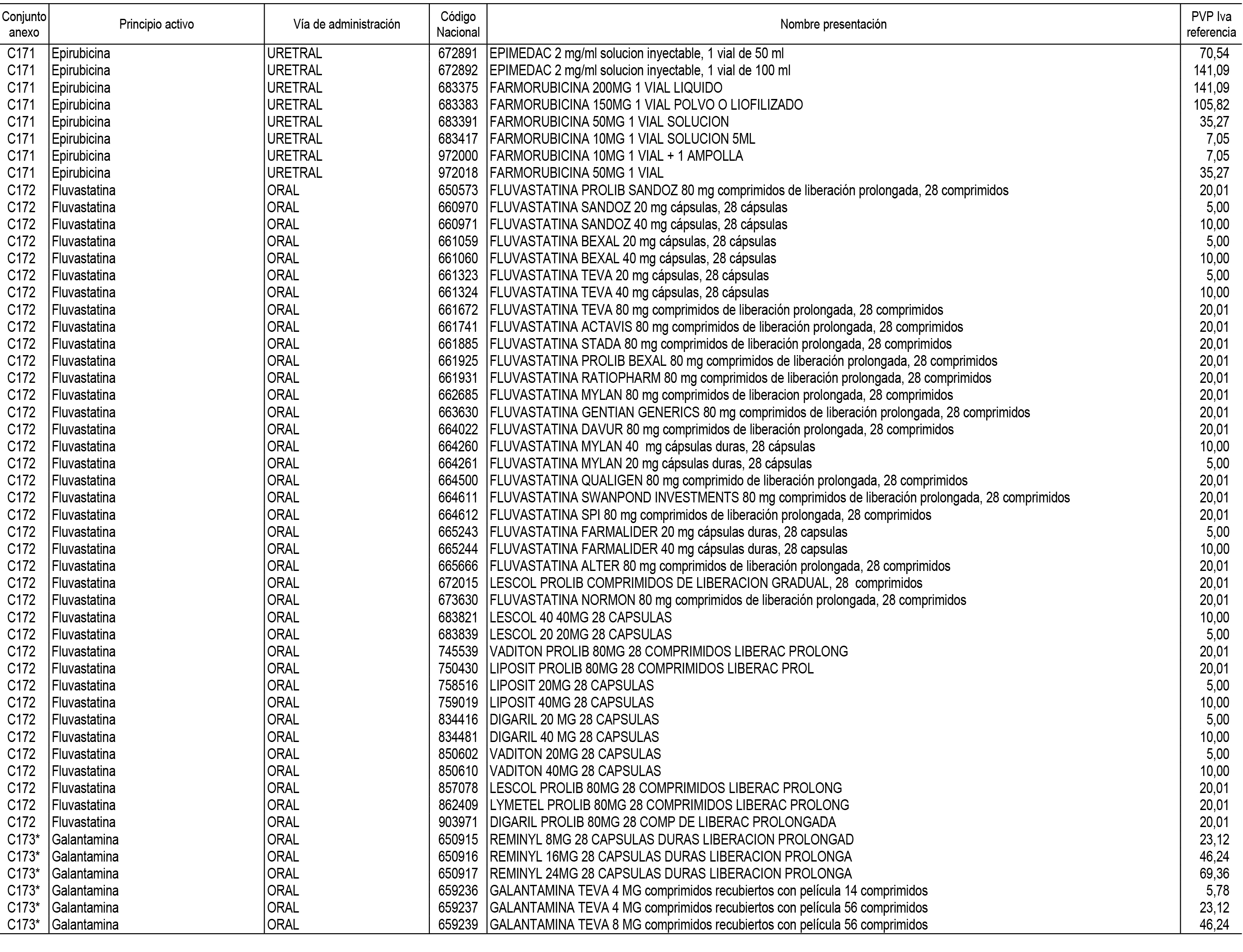
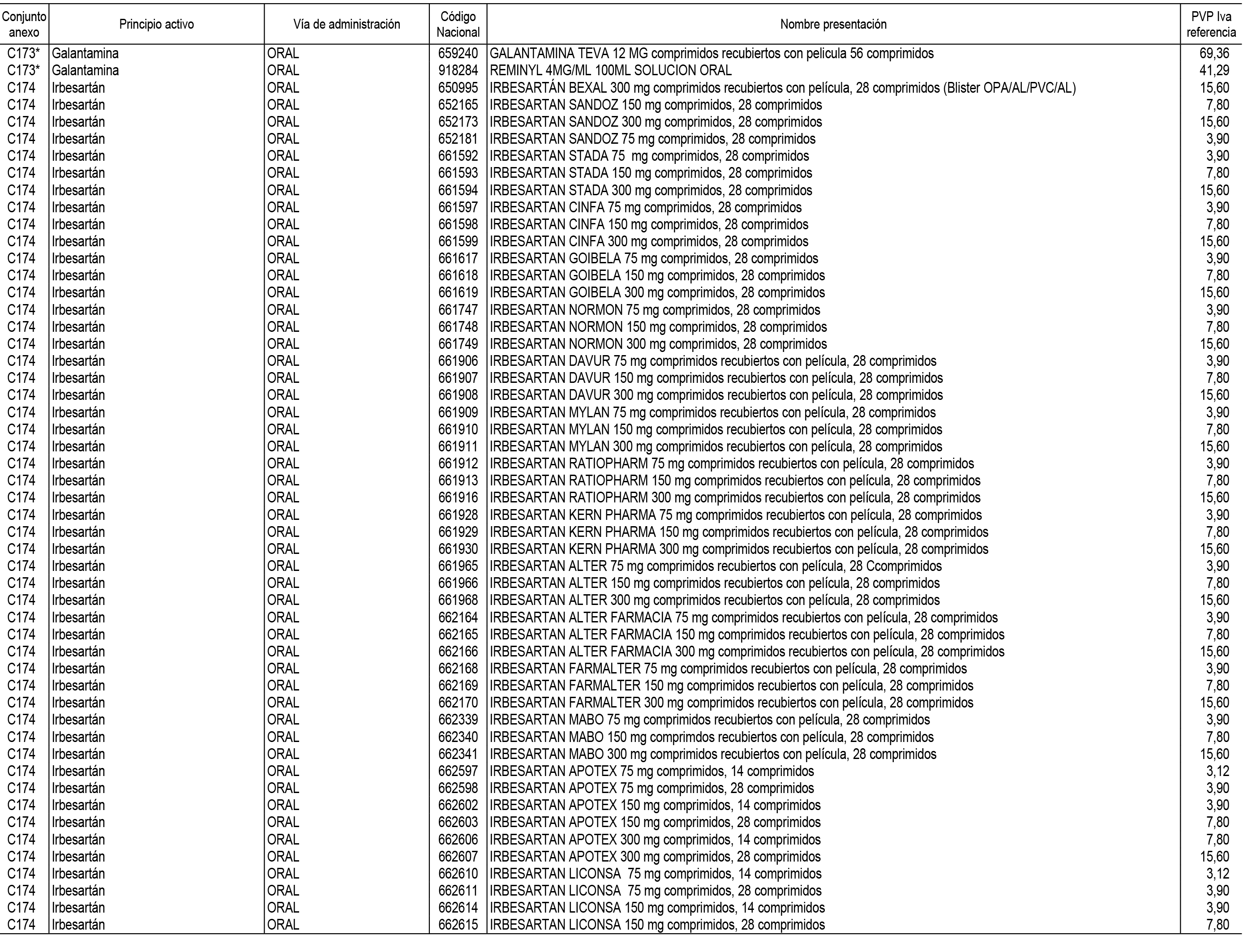
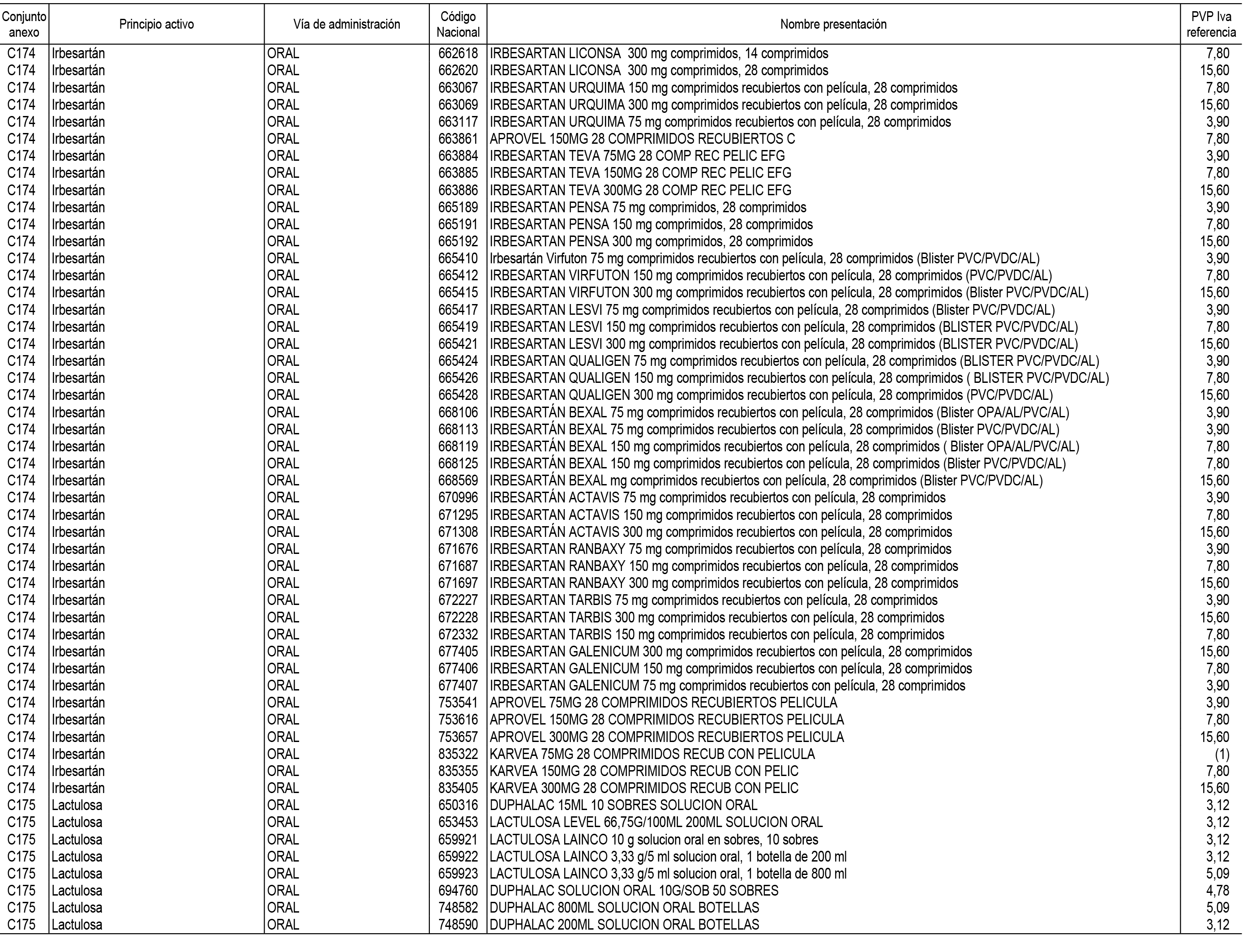
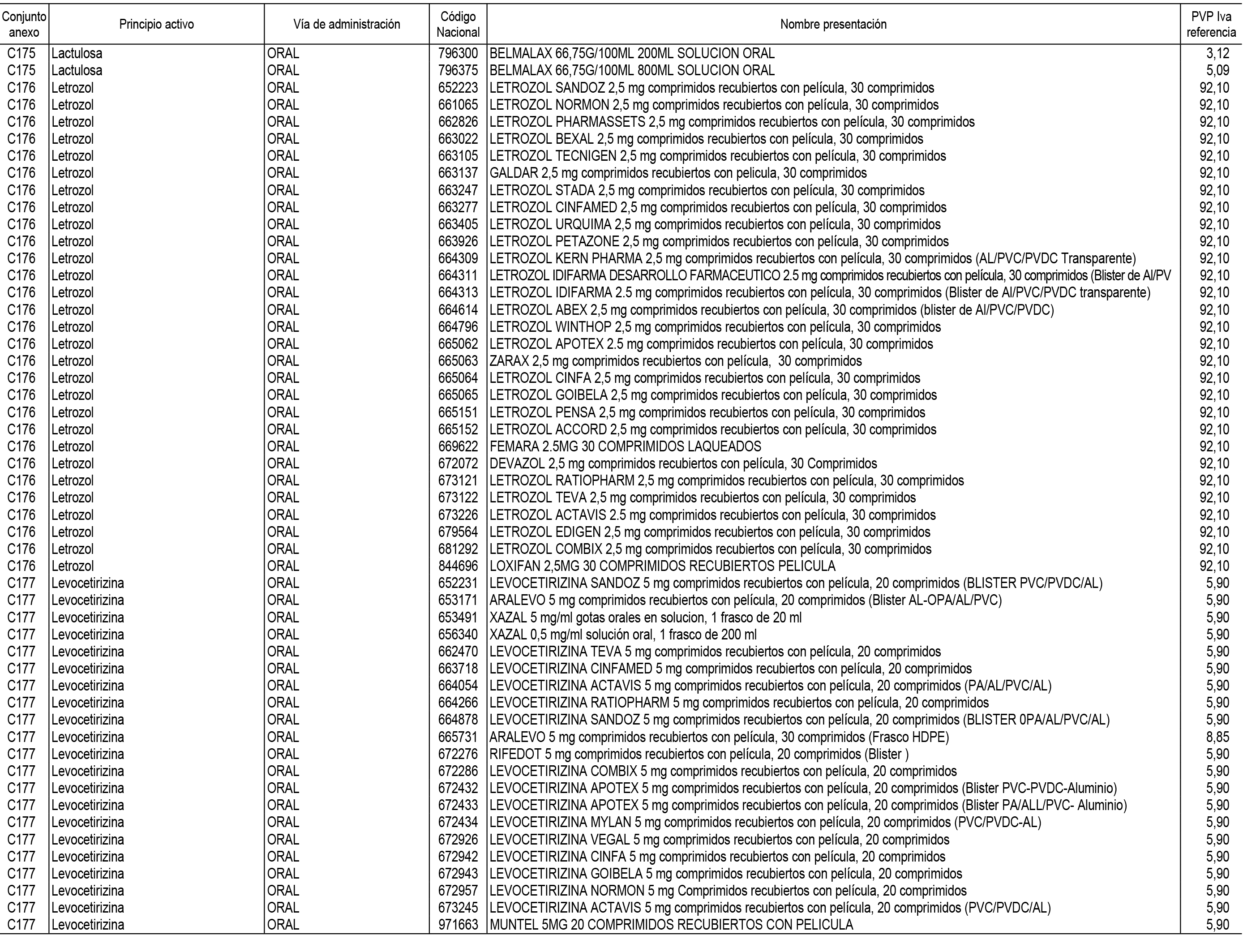
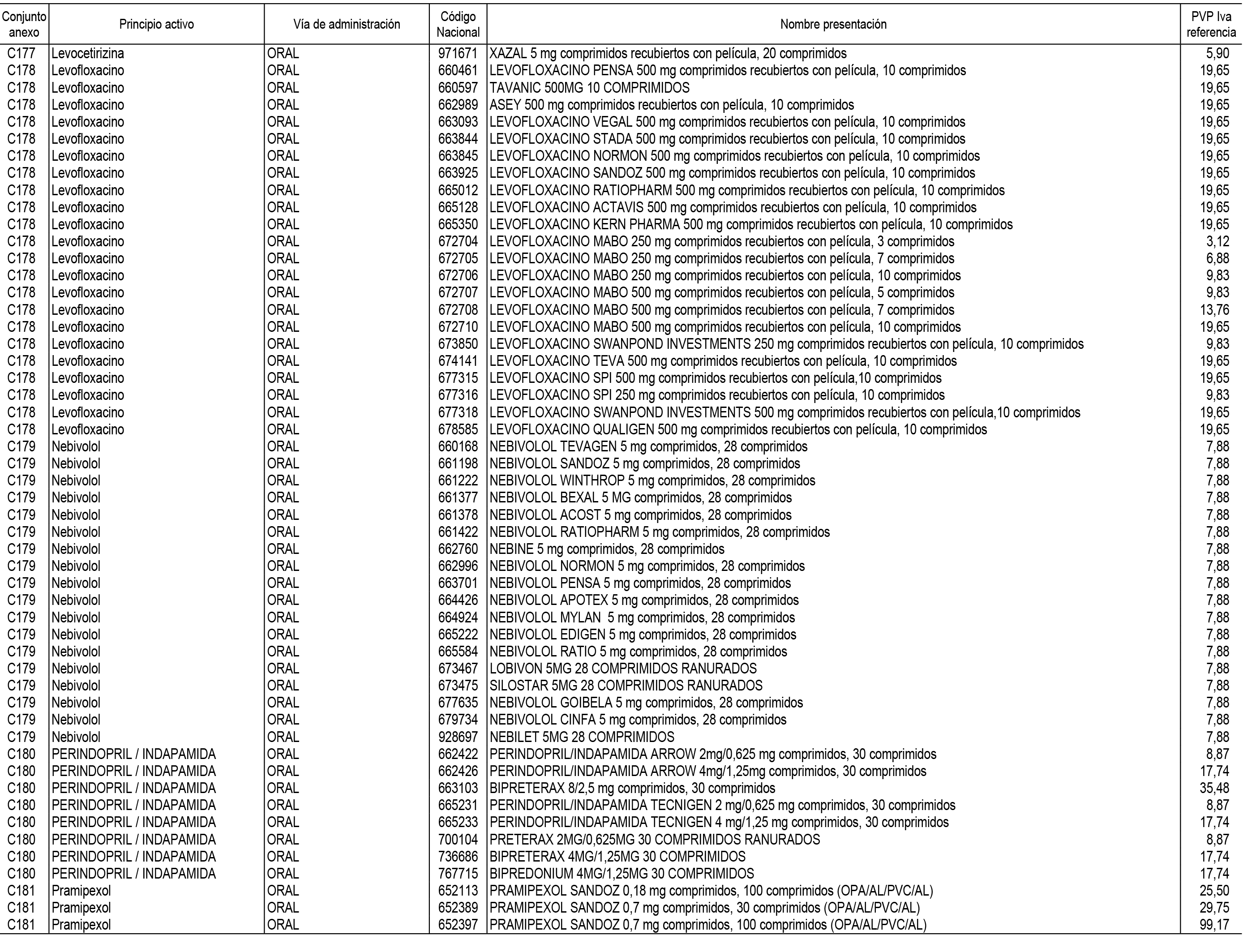
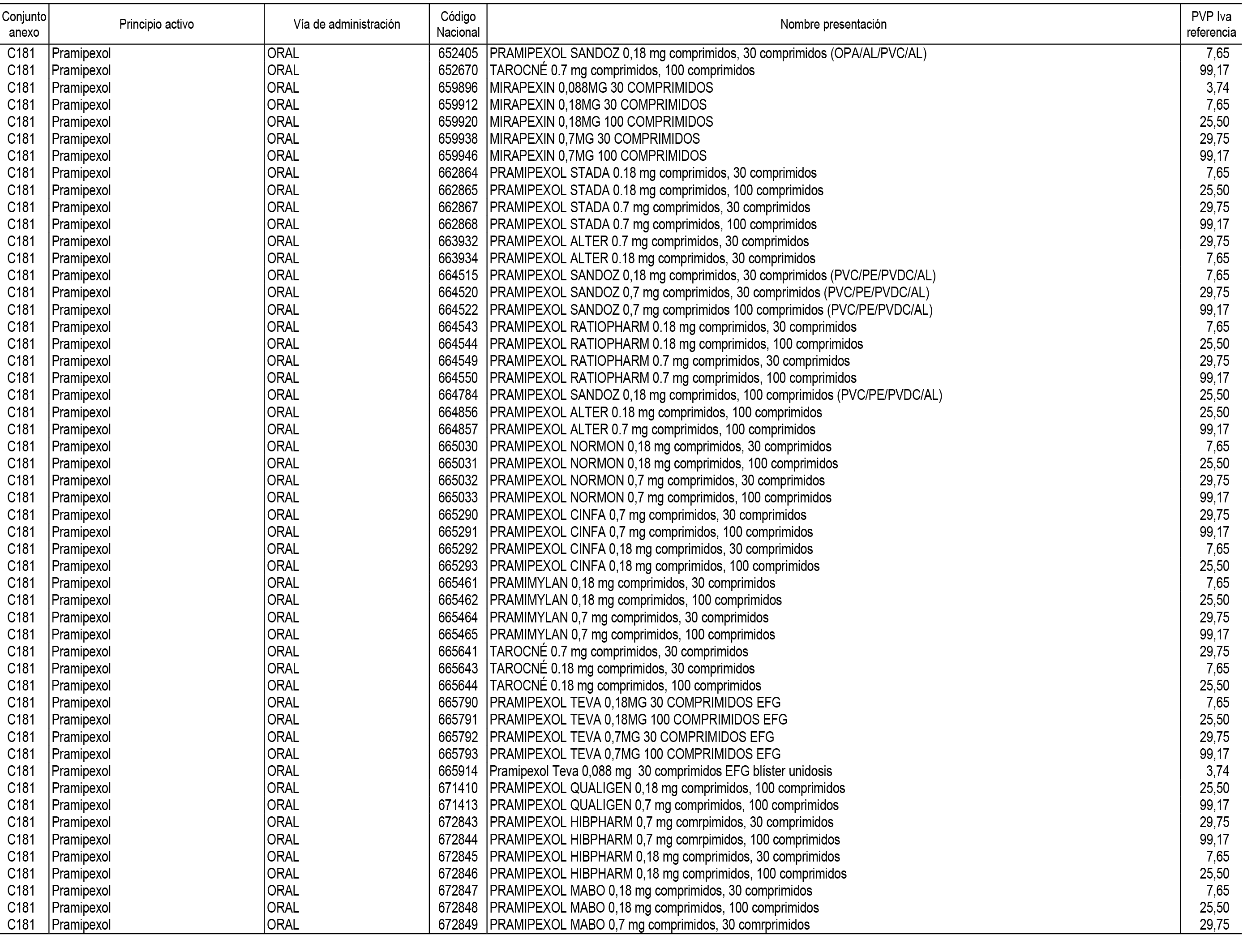
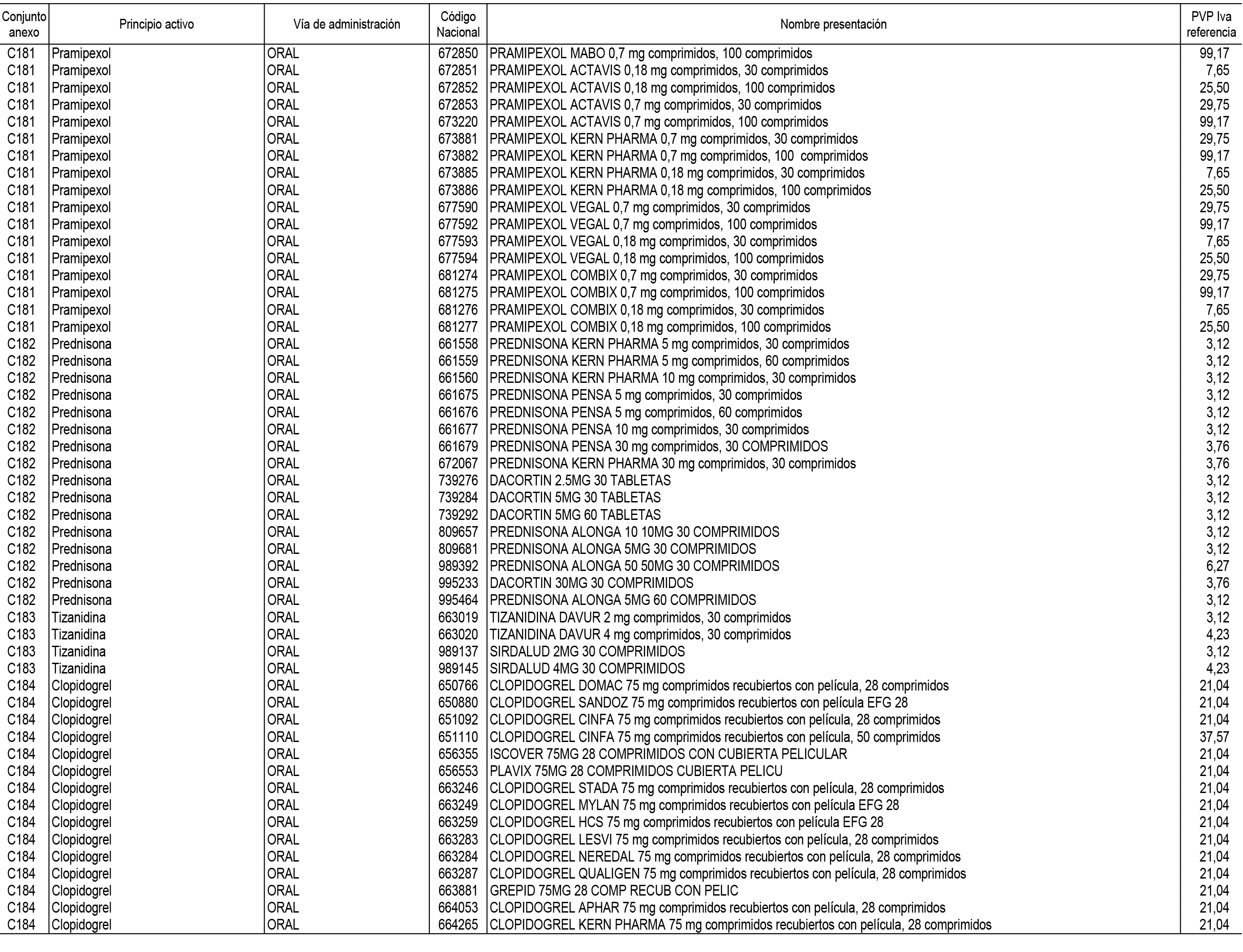
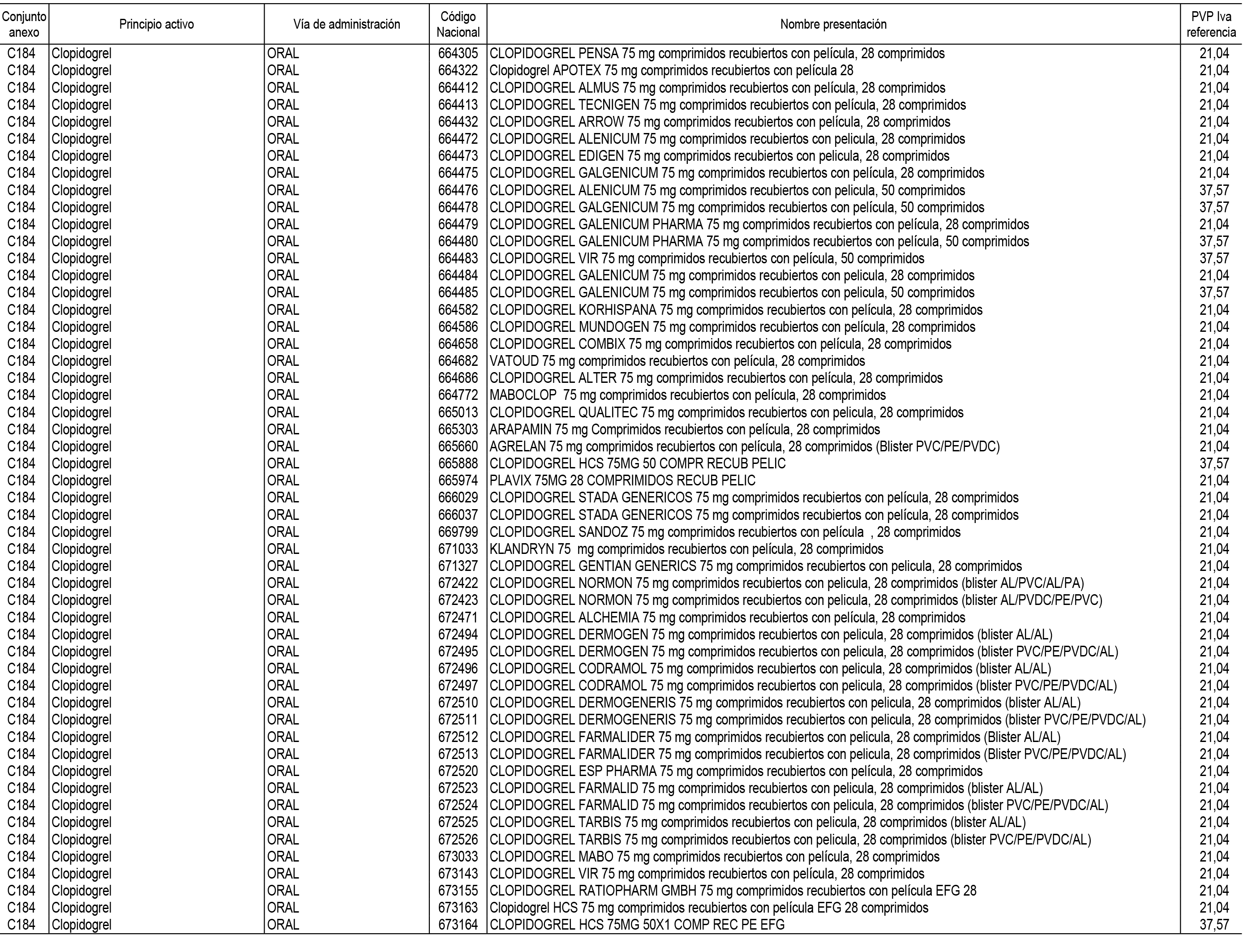
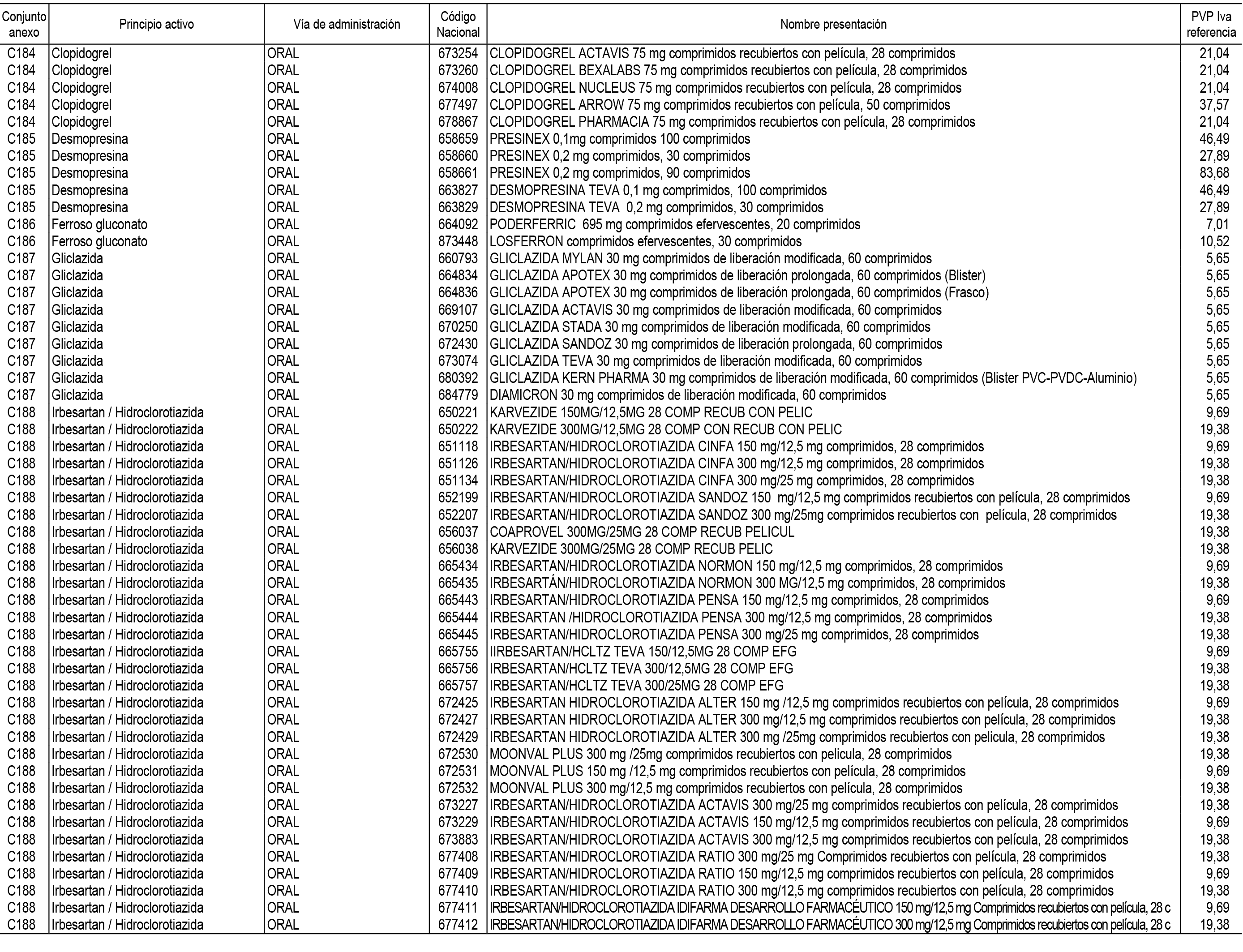
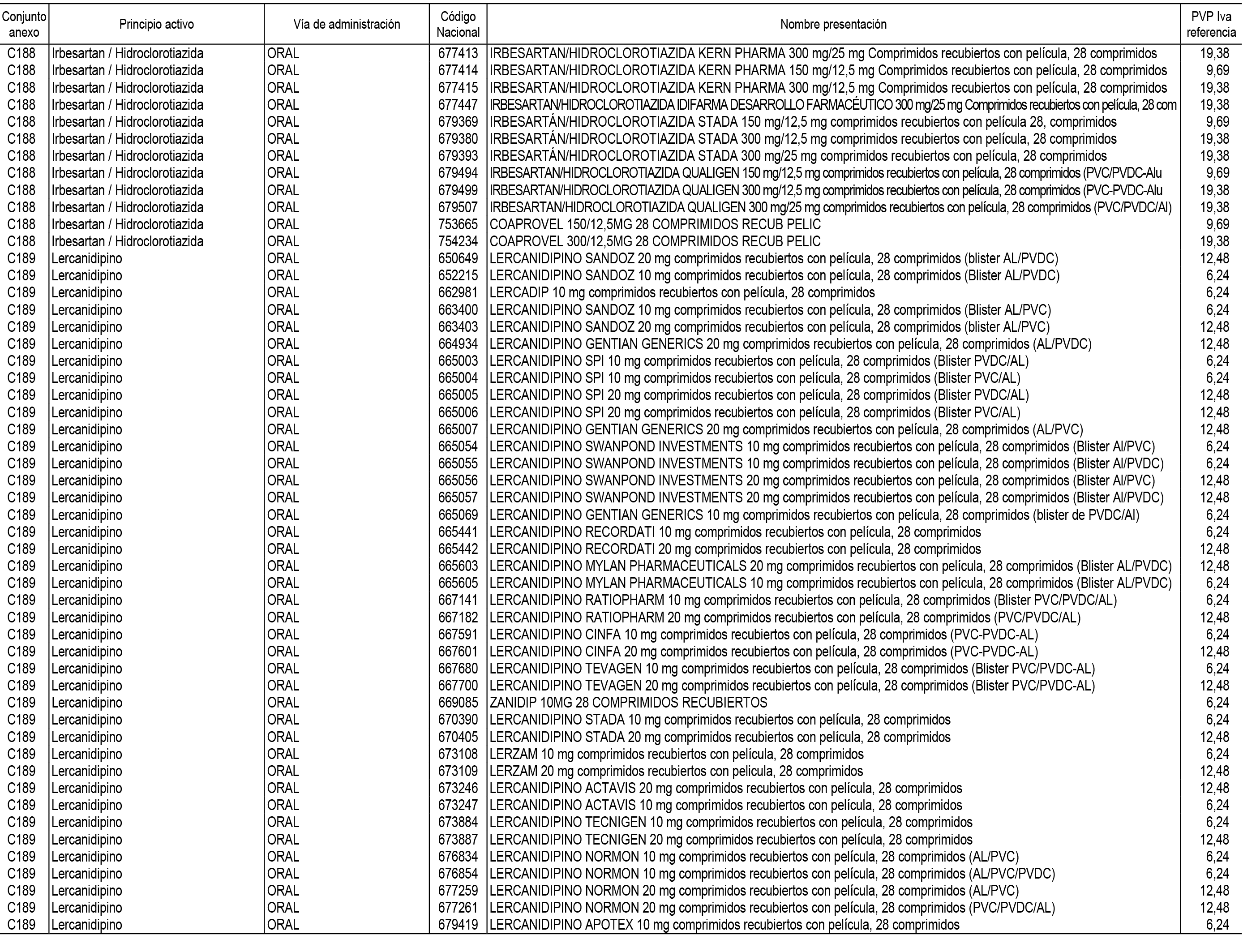
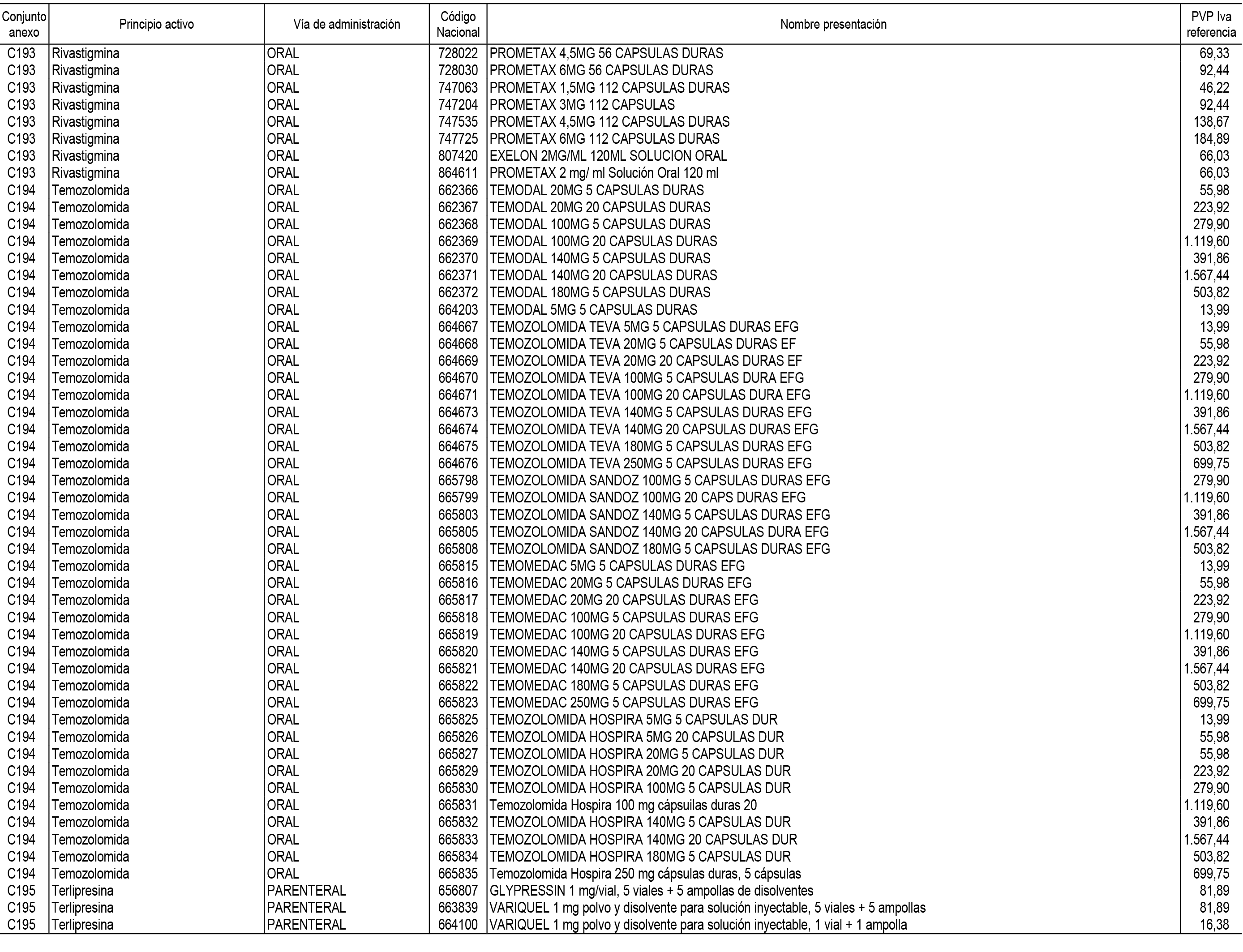
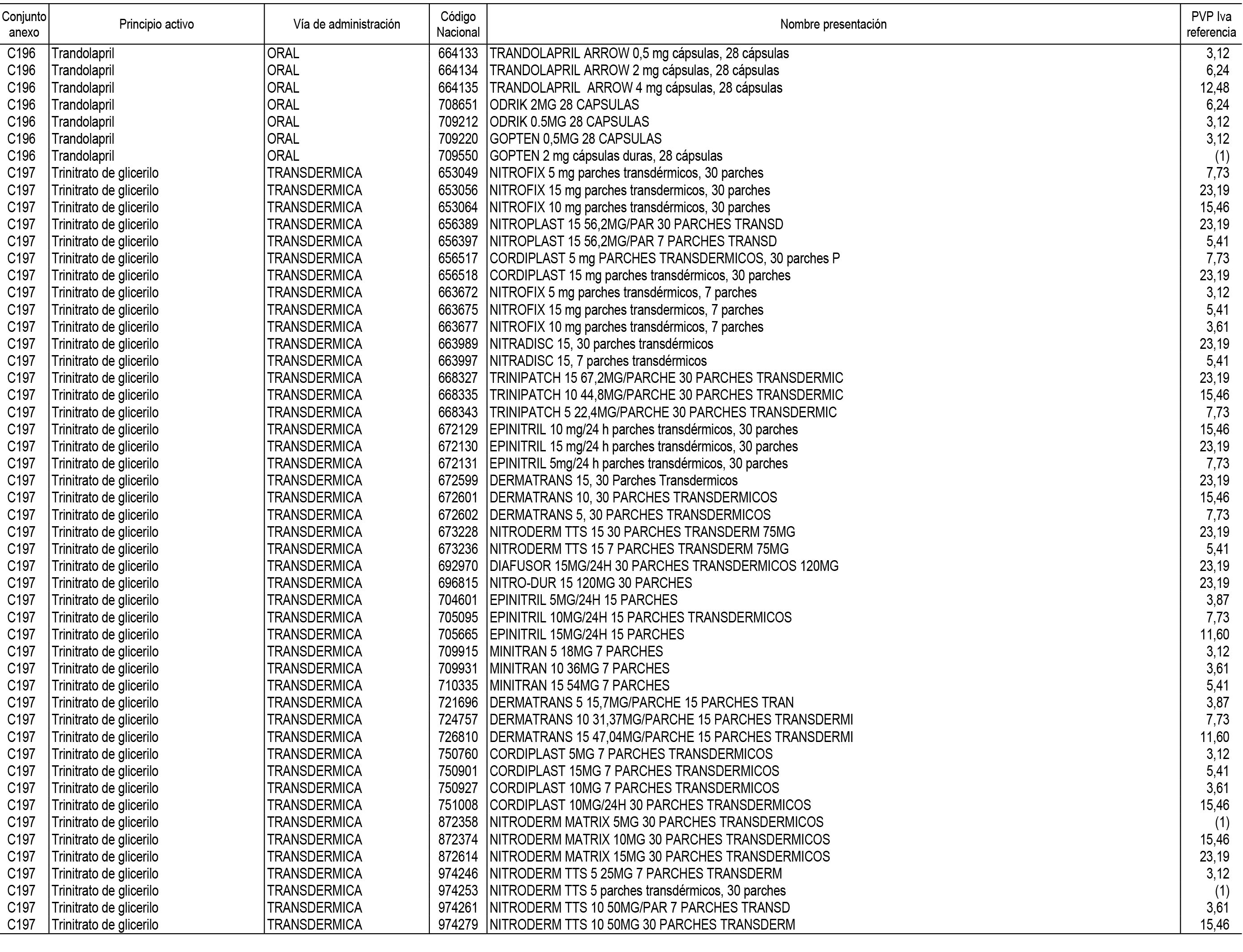
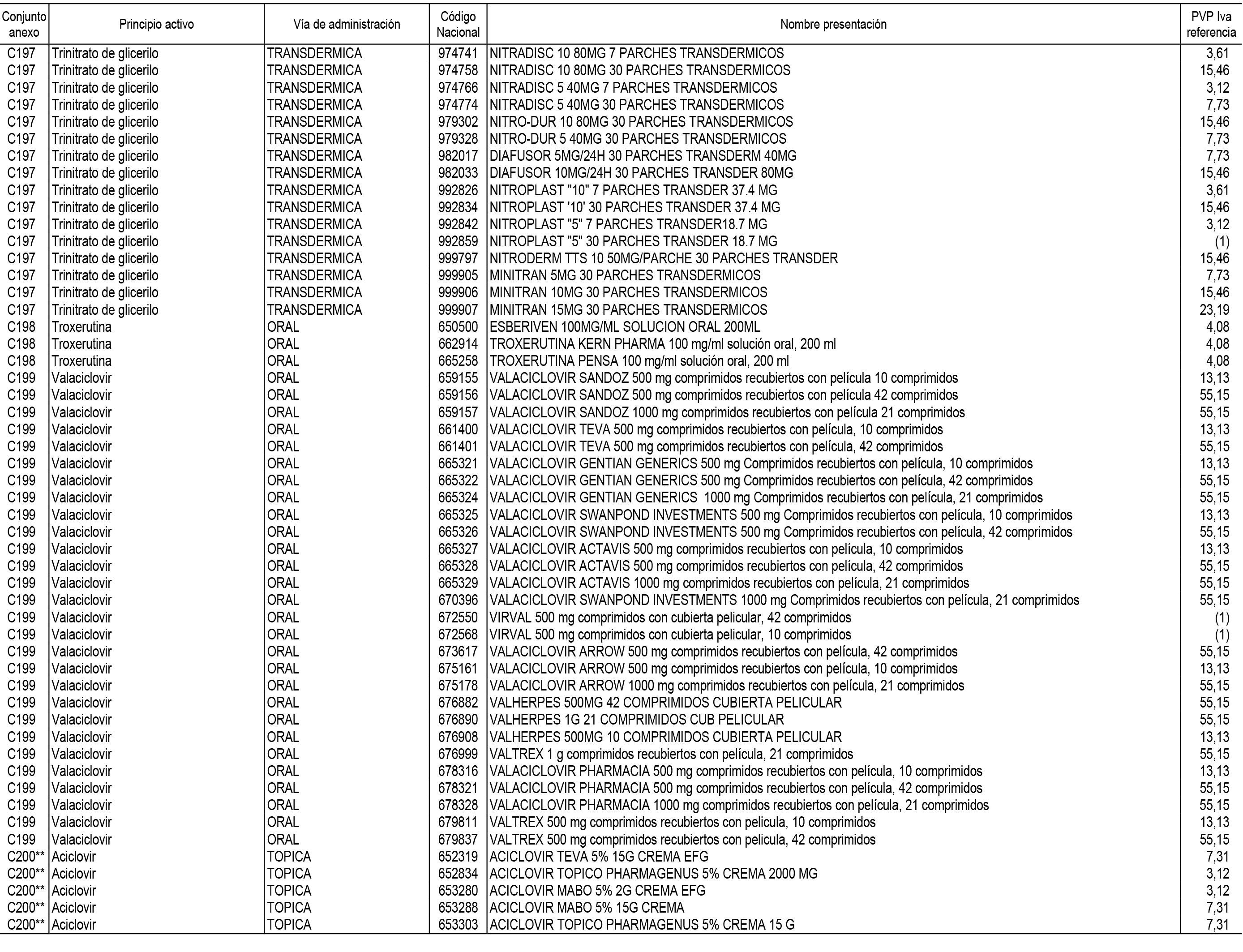
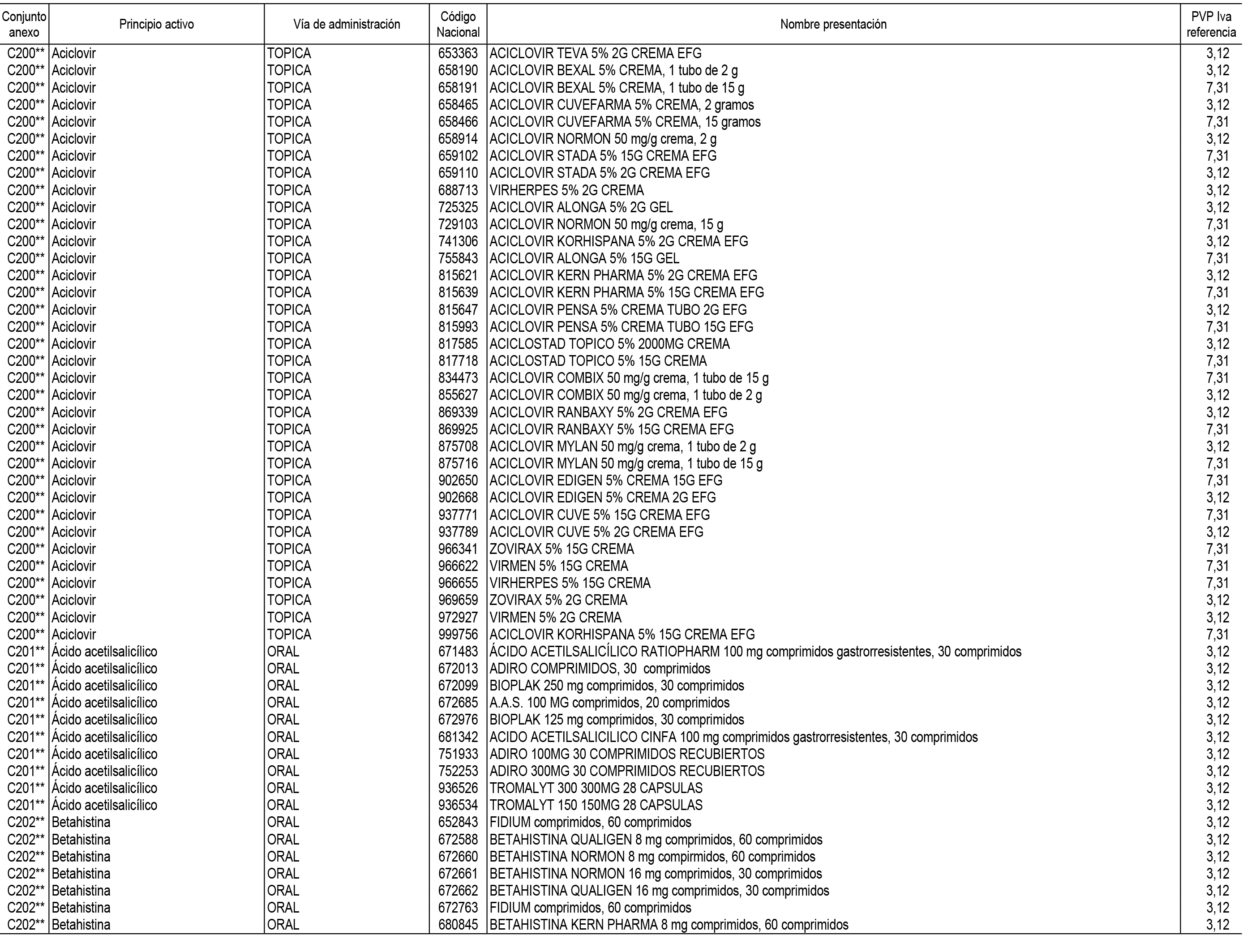
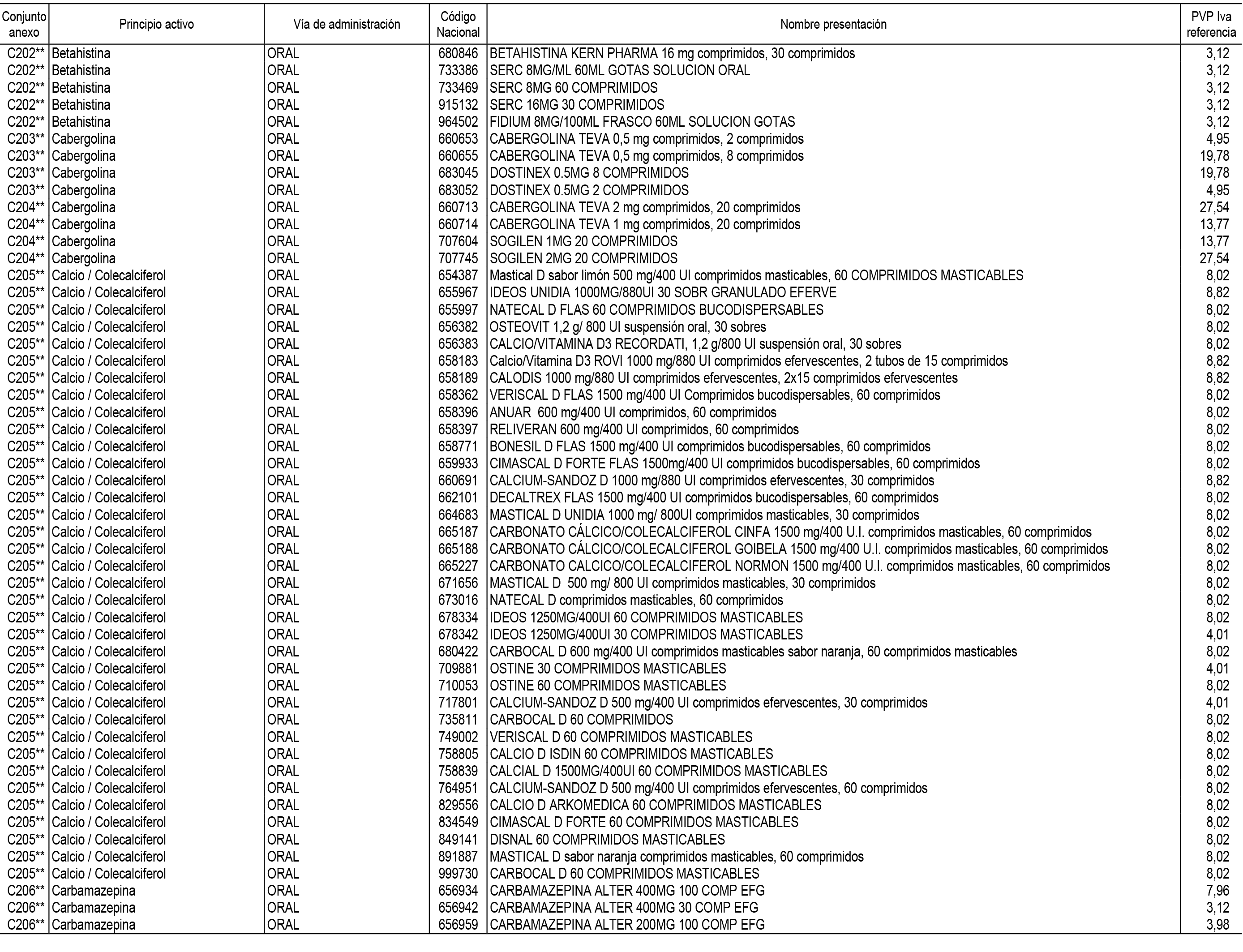
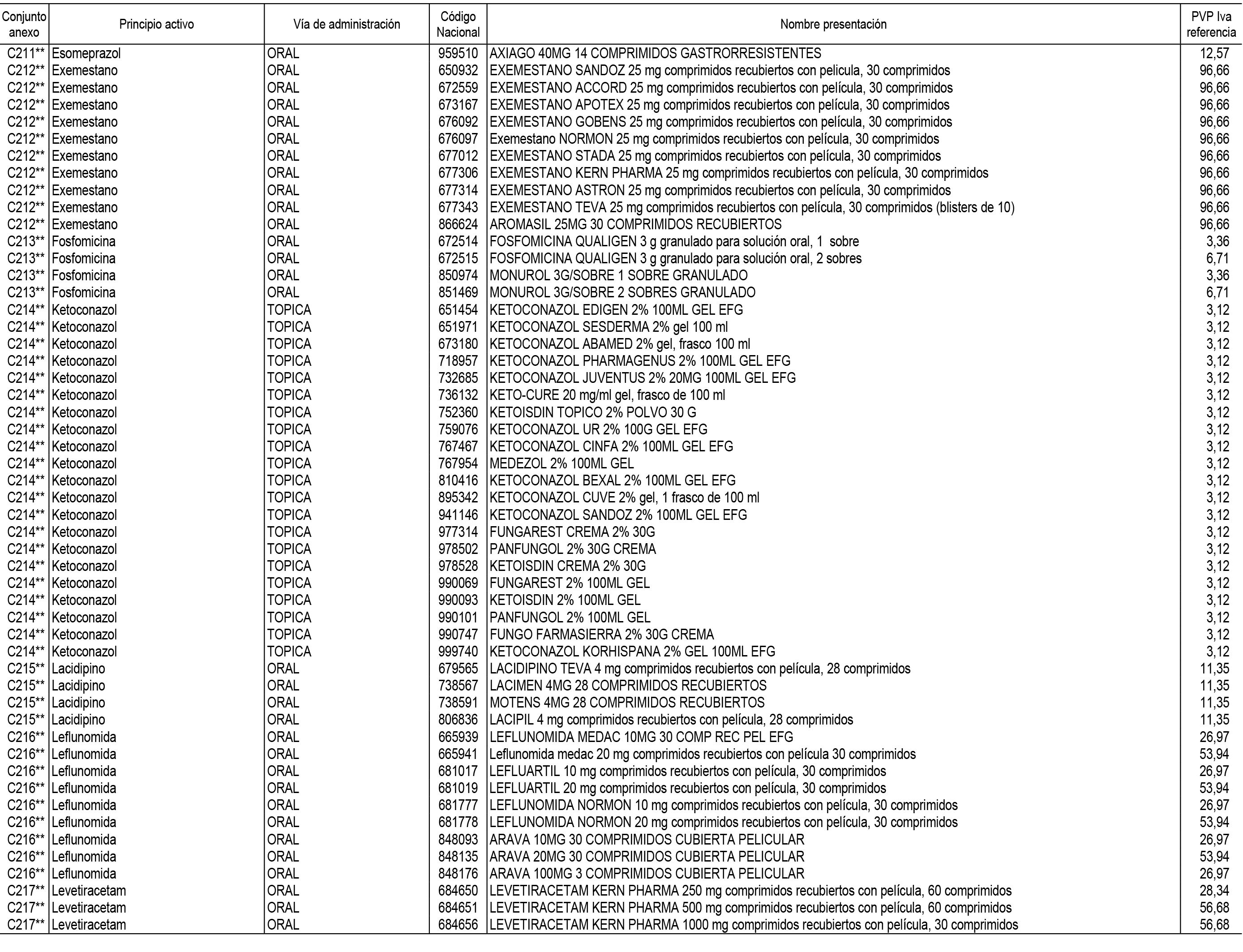
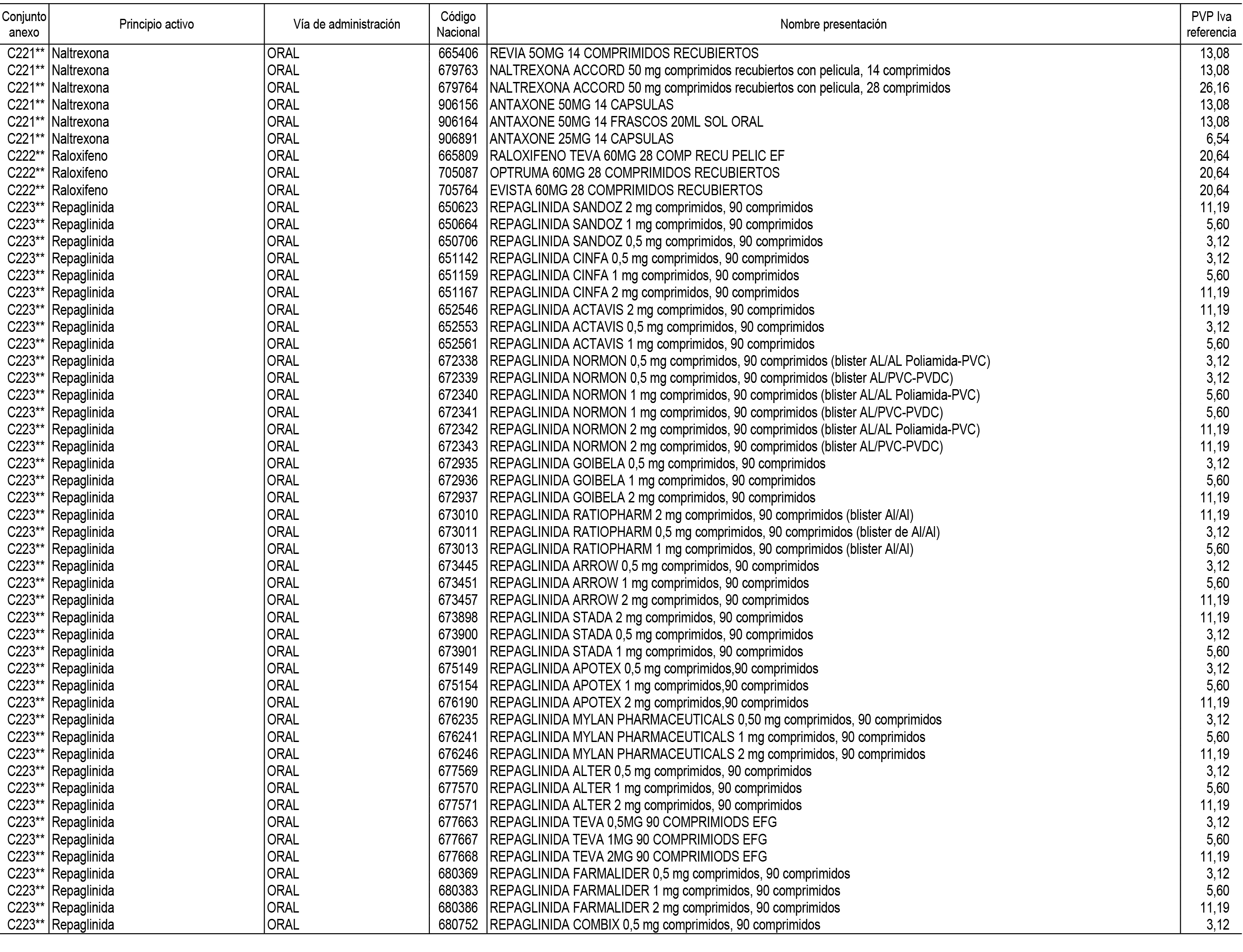
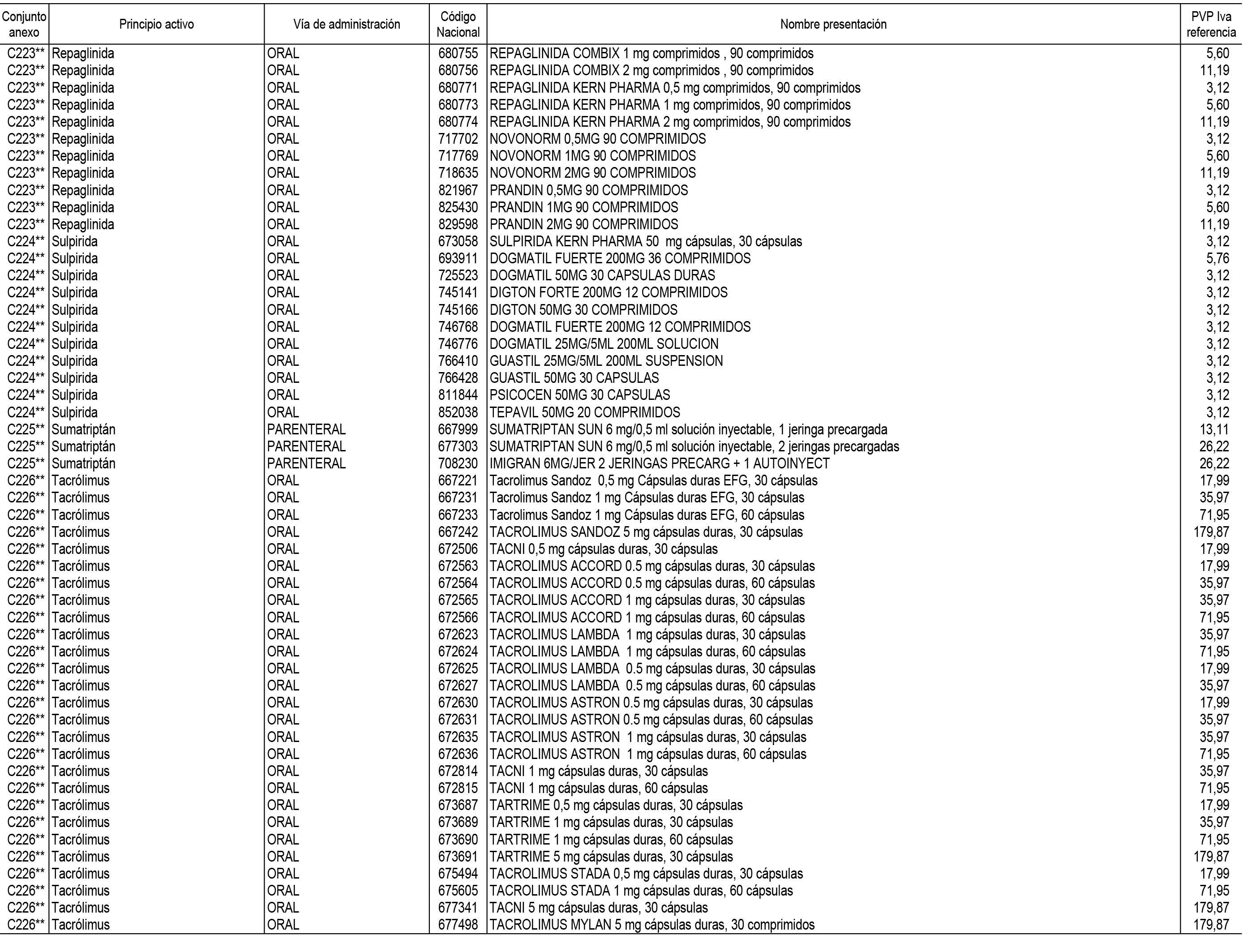
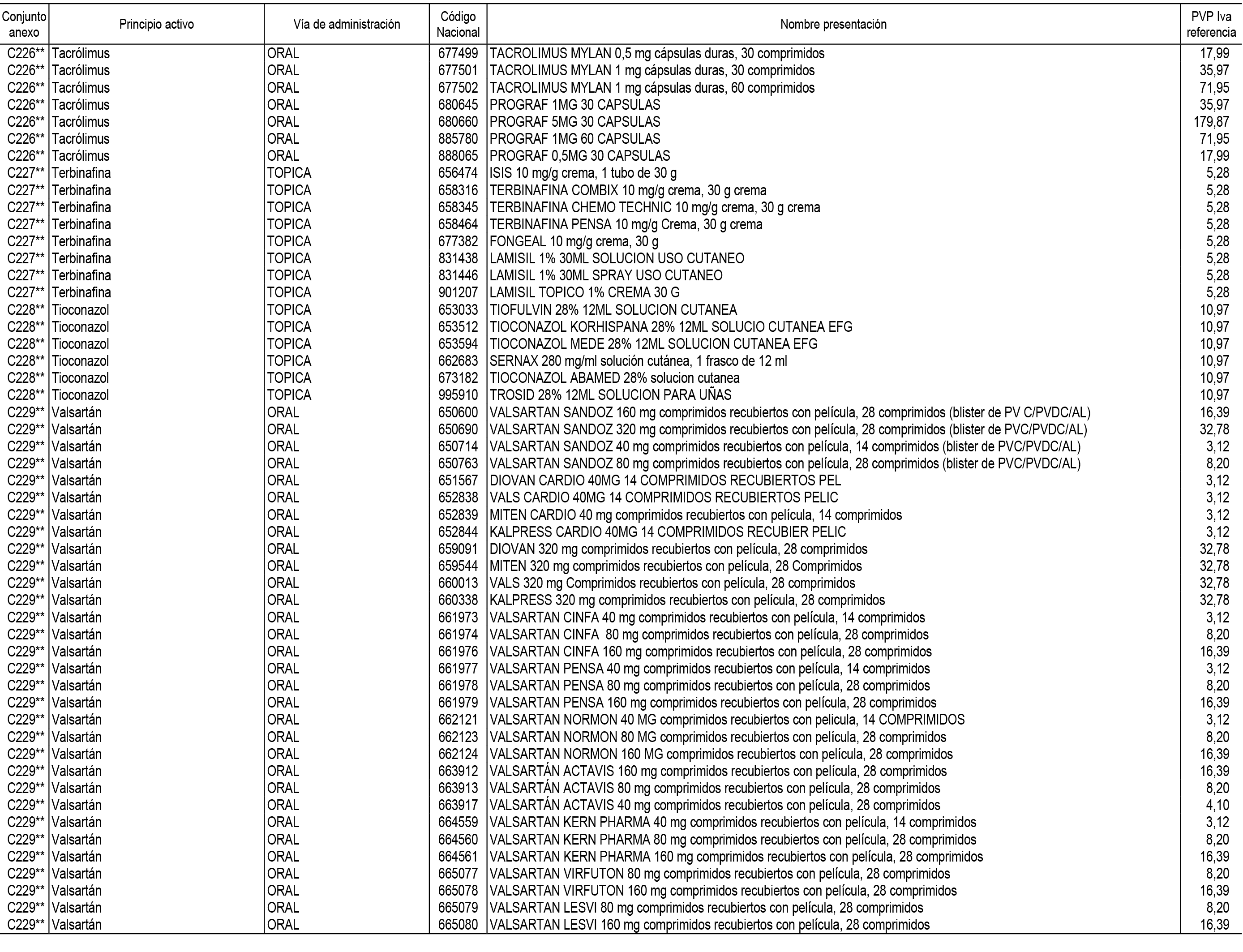
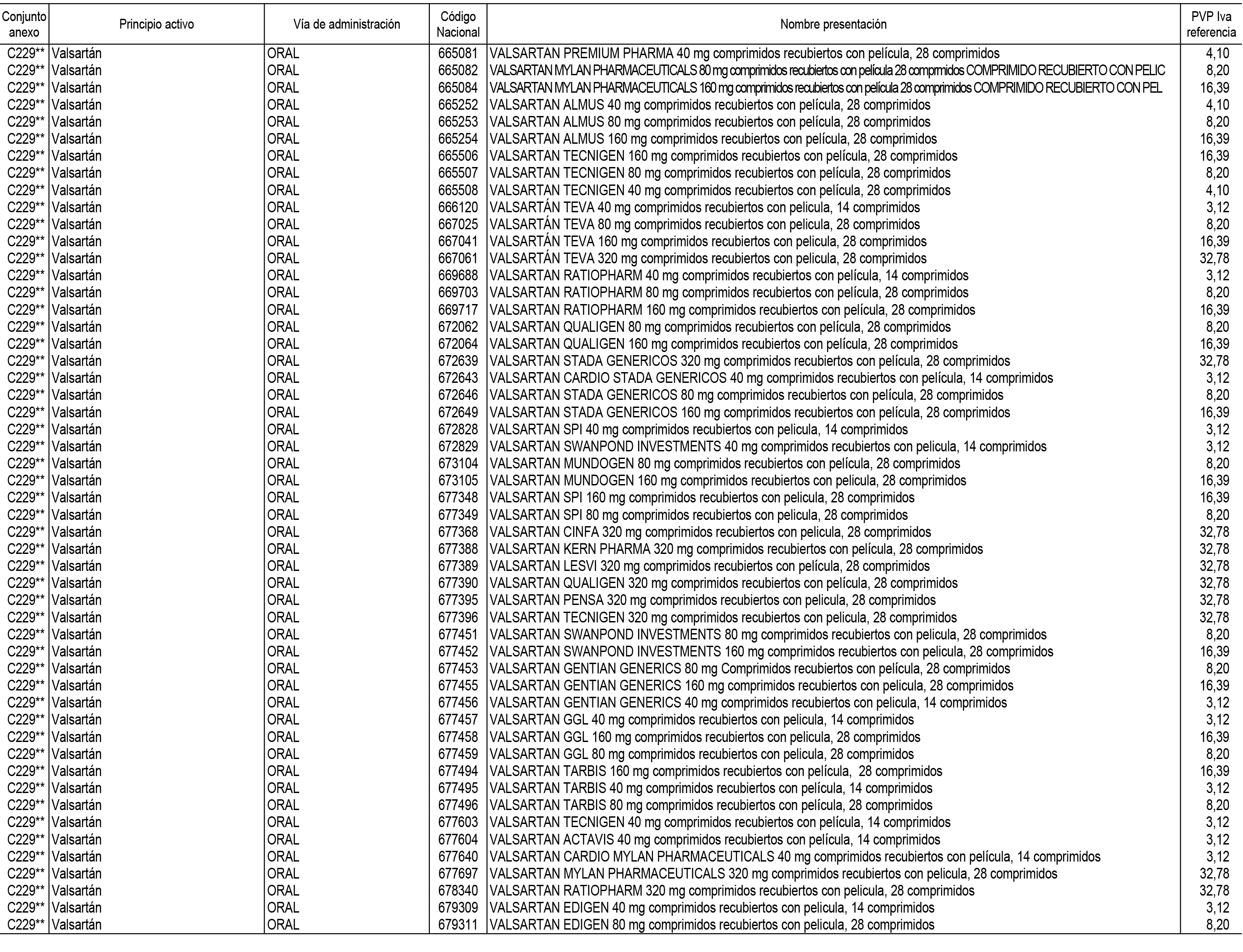
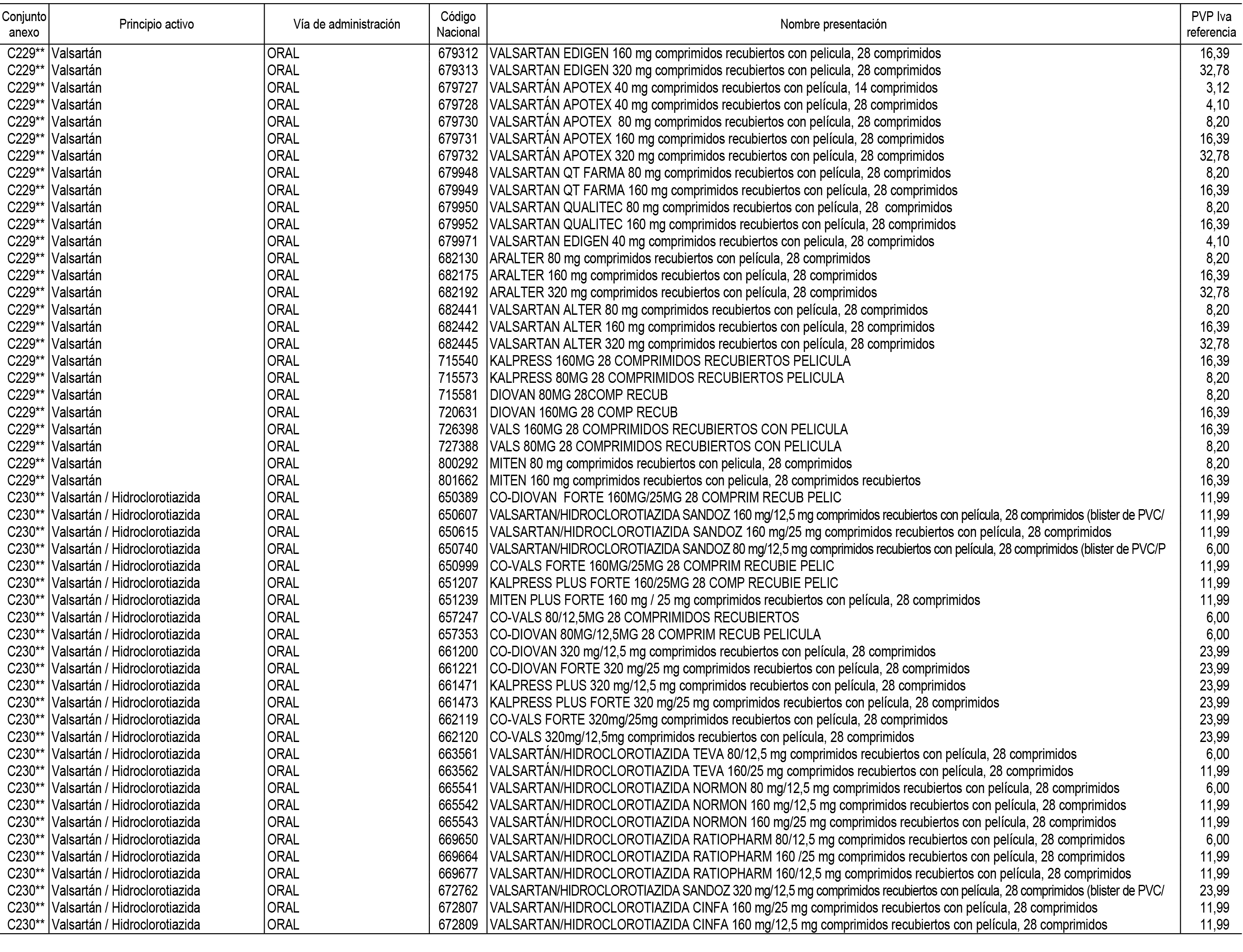
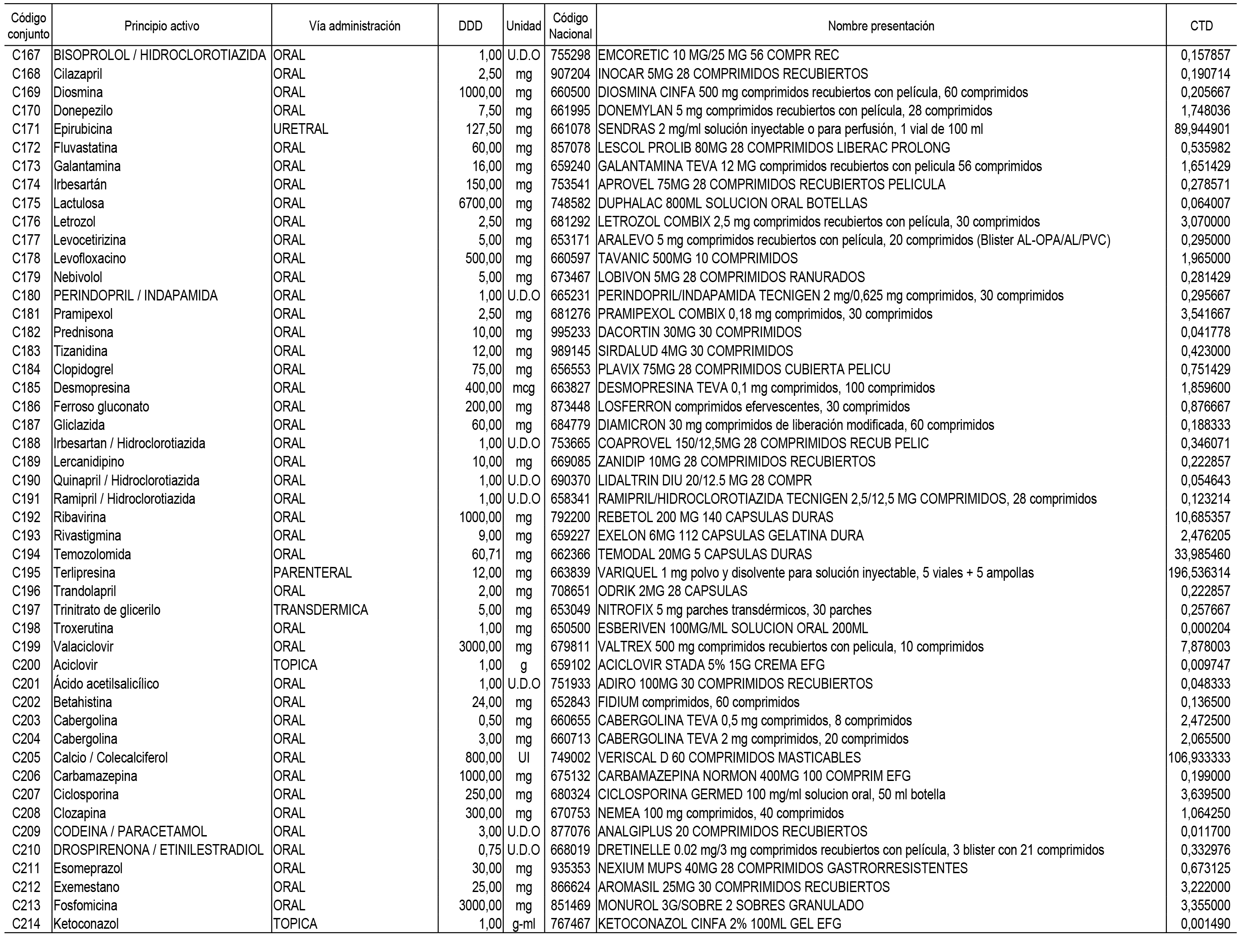
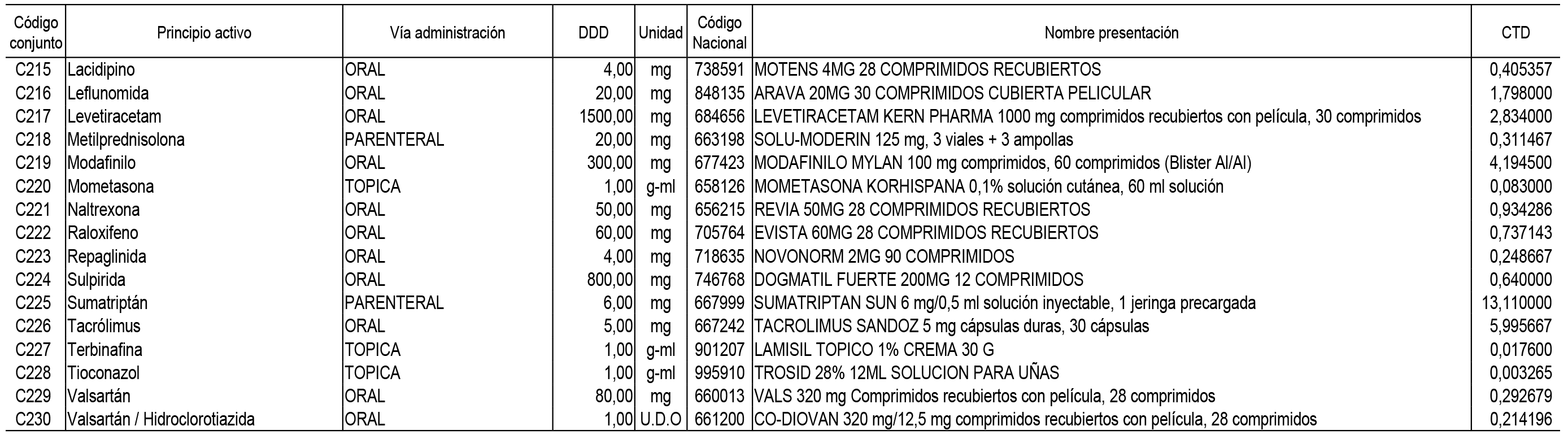
1. En aplicación del artículo 93.2 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, los conjuntos de medicamentos que se dispensen en oficinas de farmacia a través de receta médica oficial u orden de dispensación y sus precios de referencia son los que se relacionan en el Anexo 1 de esta Resolución.
Son de nueva creación los conjuntos enumerados del C-200 al C-230 del citado Anexo.
Los conjuntos que se indican en el Anexo 2 quedan suprimidos por haber desaparecido de forma sobrevenida los requisitos en los que se basó su creación, relativos en uno de los casos a la anulación de la autorización de comercialización de las presentaciones de medicamentos genéricos que formaban parte del conjunto, y en los demás por estar el precio de referencia del conjunto por debajo del umbral mínimo fijado en el apartado 3 del presente punto.
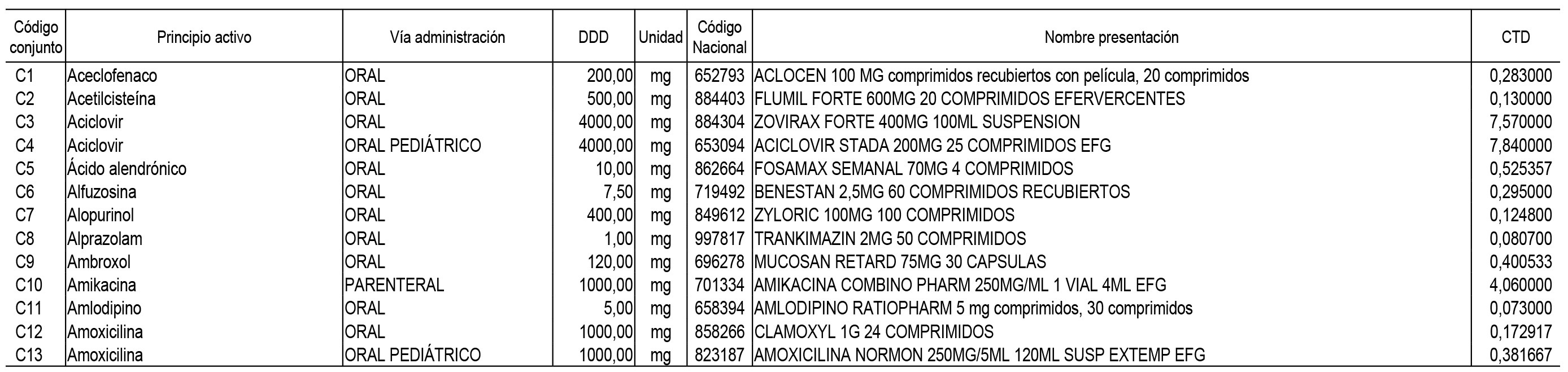
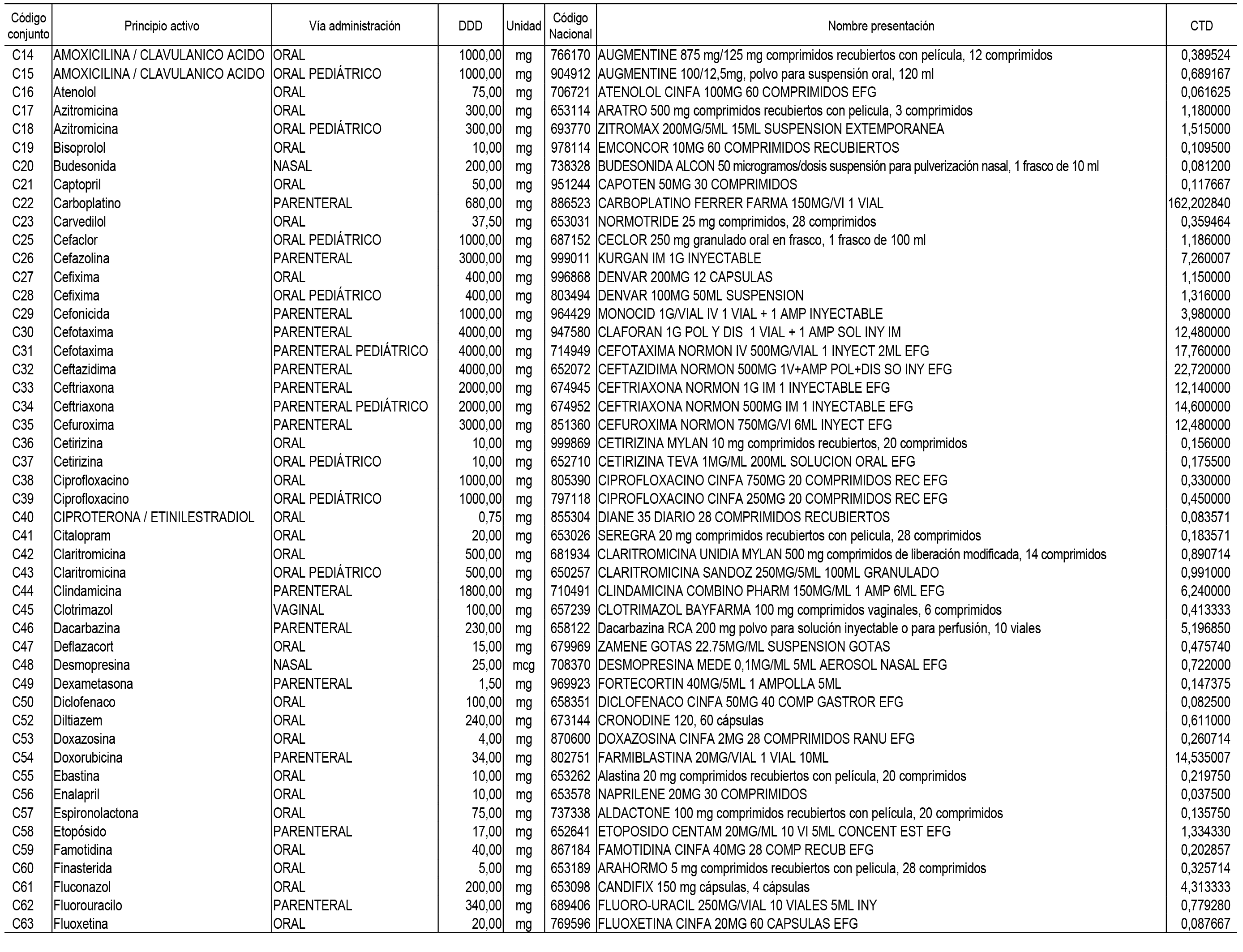
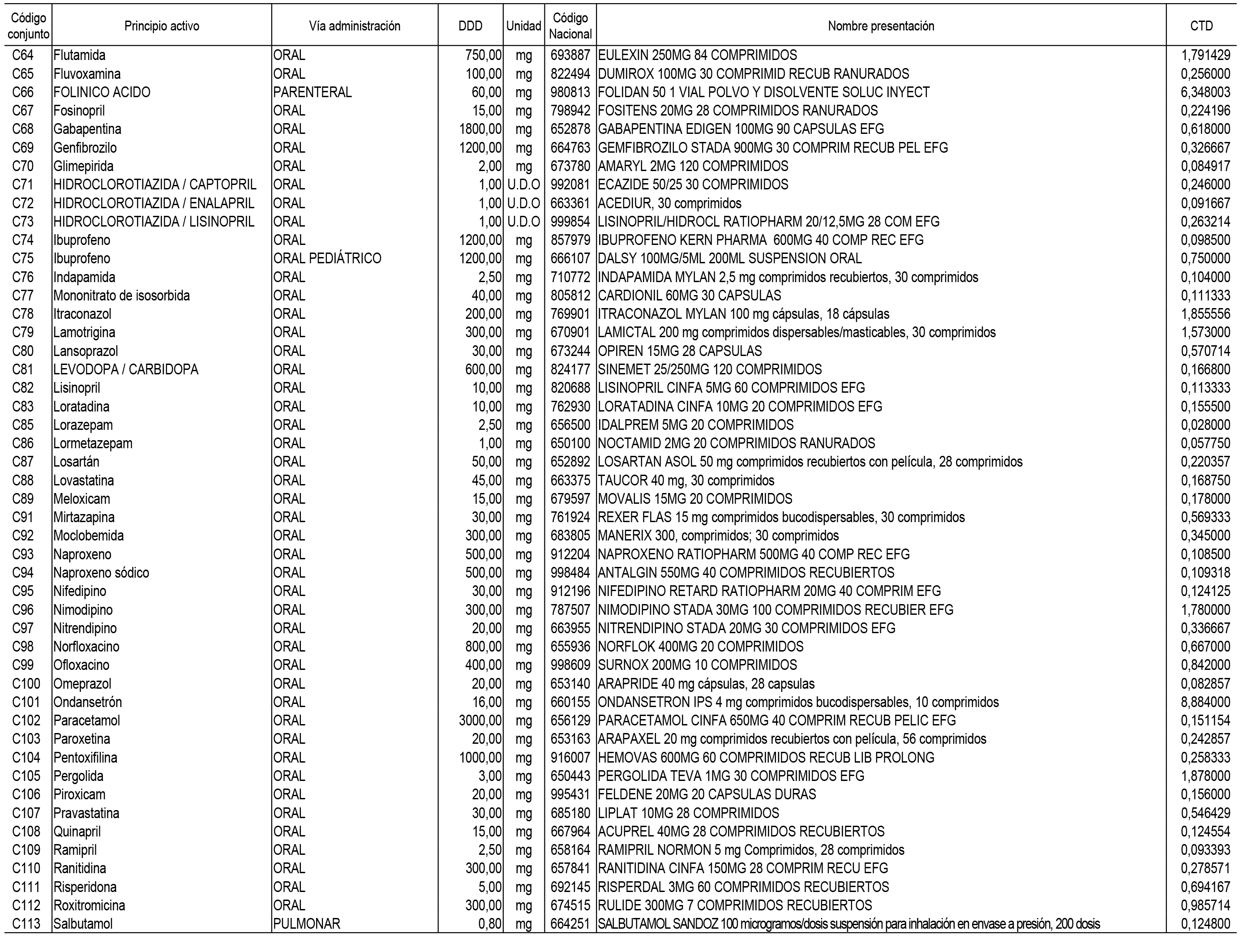
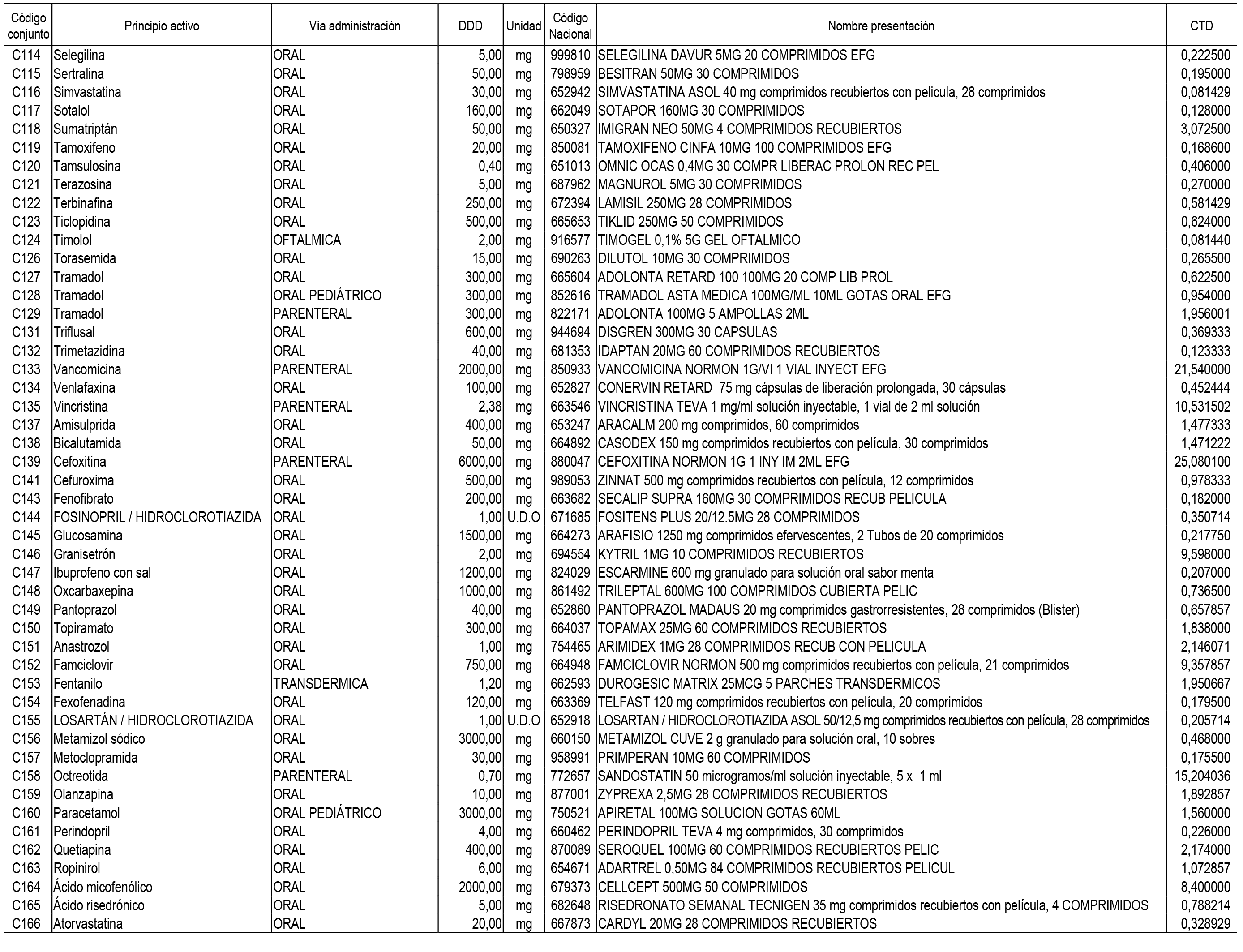
2. Las dosis diarias definidas, así como las presentaciones y su coste/tratamiento/día, tenidas en cuenta para el cálculo de los precios de referencia son las relacionadas en el Anexo 3.
3. Asimismo, en virtud de la potestad conferida por el párrafo segundo del apartado 2.º y por el punto a) del apartado 6.º del artículo 93 de la Ley 29/2006, de 26 de julio, se fija en 3,12 euros de precio de venta al público, impuestos incluidos, el umbral mínimo de los precios de referencia objeto de la presente Resolución.
2. Nuevas presentaciones excluidas temporalmente de la aplicación del sistema de precios de referencia
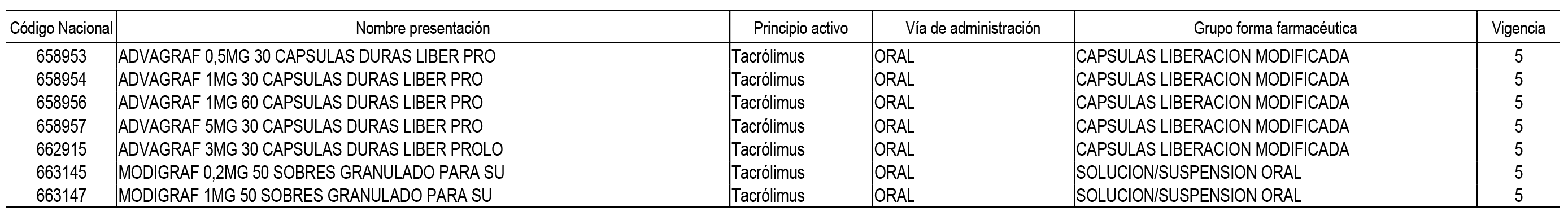
A efectos de aplicar lo establecido en el artículo 5 de la Orden SPI/3052/2010, de 26 de noviembre, se relacionan en el Anexo 4 las nuevas presentaciones de medicamentos que, por haber sido declaradas innovaciones galénicas, quedan excluidas del sistema de precios de referencia, así como el correspondiente periodo de exclusión.
3. Medicamentos cuya declaración como innovación galénica expira a partir de la entrada en vigor de la presente orden
Las presentaciones de medicamentos relacionadas en el Anexo 5 de la presente Resolución, cuya declaración como innovación galénica expira en el periodo comprendido entre diciembre de 2011 y noviembre de 2012, se incorporarán a los conjuntos correspondientes a partir del primer día del mes siguiente a expirar la mencionada declaración, de conformidad con lo dispuesto en el artículo 93.5 de la Ley 29/2006, de 26 de julio, y el artículo 5 de la Orden SPI/3052/2010, de 26 de noviembre.
4. Presentaciones de medicamentos con precio superior al de referencia
1. Para adaptarse a lo dispuesto en el último inciso del artículo 93.2 de la Ley 29/2006, de 26 de julio, las presentaciones de medicamentos con precio superior al de referencia, se suministrarán por los laboratorios a un precio industrial que se corresponda con uno igual o inferior al de referencia a partir del día 17 de febrero de 2012, inclusive. En estos supuestos no se modificará el Código Nacional de la presentación del medicamento.
2. En el supuesto de las presentaciones de medicamentos que formen parte de conjuntos inactivos lo previsto en el apartado anterior será de aplicación a partir del 50.º día natural siguiente a que se notifique por la Dirección General de Farmacia y Productos Sanitarios a todos los interesados la declaración expresa a la que se refiere el apartado 2 de la Disposición adicional primera de la Orden SPI/3052/2010, de 26 de noviembre.
5. Actualización de la información de los precios menores de las agrupaciones homogéneas de medicamentos
1. De conformidad, pues, con el último inciso del artículo 93.2 de la Ley 29/2006, de 26 de julio, las presentaciones de medicamentos afectadas por los precios de referencia, no podrán superar el precio de referencia del conjunto correspondiente. En tal caso, de acuerdo con lo establecido en los artículos 93.4 y 85.1 en concordancia con la disposición adicional decimocuarta de dicha Ley, cuando las mencionadas presentaciones estén integradas en agrupaciones homogéneas, el farmacéutico dispensará la presentación del medicamento que tenga menor precio.
2. Por ello, con base en lo acordado el 16 de diciembre de 2011 por la Comisión Permanente de Farmacia, que consideró conveniente que la actualización de los precios menores se hiciera coincidir con la aplicación de los nuevos precios de referencia, desde que esta resolución produzca sus efectos, la Dirección General de Farmacia y Productos Sanitarios procederá, de conformidad con lo establecido en la disposición adicional decimocuarta de la Ley 29/2006, de 26 de julio, a tramitar la actualización de la información de los precios menores correspondientes a las agrupaciones homogéneas de medicamentos.
6. Reducciones voluntarias de precios sin modificación de Código Nacional
1. Respecto de las presentaciones integradas en las agrupaciones homogéneas de medicamentos, los laboratorios podrán solicitar la bajada voluntaria de sus precios, sin modificar el Código Nacional, debiendo comunicarlo así a la Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad, Servicios Sociales e Igualdad mediante registro telemático a través del enlace http://registrotelematico.mspsi.es/ en el plazo de los diez días naturales desde que esta Resolución produzca sus efectos.
2. En cuanto a las presentaciones de medicamentos afectados por la presente Resolución, y no integradas en dichas agrupaciones homogéneas, que los laboratorios voluntariamente decidan comercializar a un precio inferior al de referencia, podrán hacerlo sin modificar el Código Nacional, debiendo comunicarlo igualmente a la Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad, Servicios Sociales e Igualdad mediante registro telemático a través del enlace http://registrotelematico.mspsi.es/ en el plazo de los diez días naturales desde que esta Resolución produzca sus efectos.
3. La Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad, Servicios Sociales e Igualdad podrá acordar un periodo adicional de bajadas voluntarias de los precios, en ningún caso superior a dos días naturales, en función de las solicitudes recibidas, haciendo público el acuerdo que se adopte a través de la pagina web del Ministerio de Sanidad, Servicios Sociales e Igualdad.
4. Las presentaciones de medicamentos a las que se refieren los apartados anteriores se suministrarán por los laboratorios al nuevo precio a partir del día 17 de febrero de 2012.
5. En el supuesto de las presentaciones de medicamentos que formen parte de conjuntos inactivos, lo previsto en el apartado anterior será de aplicación a partir del 50º día natural siguiente a que se notifique por la Dirección General de Farmacia y Productos Sanitarios a todos los interesados la declaración expresa a la que se refiere el apartado 2 de la disposición adicional primera de la Orden SPI/3052/2010, de 26 de noviembre.
6. A los medicamentos afectados por lo dispuesto en el punto 3 de la presente Resolución, el plazo fijado en los tres primeros apartados se aplicará en sus mismos términos, mientras que lo indicado en el apartado 4 podrá ser de aplicación a partir de los 50 días naturales previos a la fecha en que se produzca la expiración de la declaración de innovación galénica según lo señalado en el Anexo 5, debiendo suministrarse en todo caso a partir del primer día del mes siguiente a aquel en que se produzca la expiración de la declaración de innovación galénica.
7. Coexistencia de precios y devolución de existencias
1. Las existencias de las presentaciones de medicamentos que obren en poder de almacenes afectados por las reducciones de los precios previstos en esta Resolución, podrán seguir comercializándose al precio anterior hasta el día 9 de marzo de 2012 inclusive.
2. Las existencias de las presentaciones de medicamentos que obren en poder de las oficinas de farmacia afectadas por las reducciones de precios previstas en esta Resolución, podrán seguir comercializándose al precio anterior hasta el día 31 de marzo de 2012 inclusive.
3. En el supuesto de las presentaciones de medicamentos que formen parte de conjuntos inactivos, los plazos a los que se refieren los apartados anteriores serán de 70 días naturales para los almacenes y de 90 días naturales para las oficinas de farmacia, y se computarán desde el momento en que se notifique por la Dirección General de Farmacia y Productos Sanitarios la declaración expresa a la que se refiere el apartado 2 de la disposición adicional primera de la Orden SPI/3052/2010, de 26 de noviembre.
4. Al amparo de lo previsto en el artículo 6.2.5 del Real Decreto 726/1982, de 17 de marzo, por el que se regula la caducidad y devoluciones de las especialidades farmacéuticas a los laboratorios farmacéuticos, los almacenes de distribución y las oficinas de farmacia, sin coste adicional alguno para ellas, podrán devolver a los laboratorios farmacéuticos, a partir del día siguiente a la finalización del plazo contemplado en el apartado dos, y conforme a lo establecido en el artículo 8 del citado Real Decreto, las existencias de las presentaciones con precio en el embalaje anterior a las reducciones establecidas en esta Resolución.
8. Gasto financiado con cargo a fondos públicos a través de receta médica oficial u orden de dispensación
1. El Sistema Nacional de Salud, incluidos los regímenes especiales de la Mutualidad General de Funcionarios Civiles del Estado (MUFACE), del Instituto Social de las Fuerzas Armadas (ISFAS) y de la Mutualidad General Judicial (MUGEJU), mantendrá, hasta el día 31 de marzo de 2012 inclusive, el precio anterior de los medicamentos afectados por lo establecido en el punto 1 a efectos de facturación y en lo que se refiere, exclusivamente, a la parte del gasto satisfecho directamente por dicho Sistema. Asimismo, los actuales menores precios de las agrupaciones homogéneas de medicamentos se mantendrán hasta esa fecha, incorporándose en el Nomenclátor de facturación de productos farmacéuticos del Sistema Nacional de Salud correspondiente al 1 de abril de 2012 la actualización de los menores precios de las agrupaciones de medicamentos, así como los nuevos precios de referencia.
2. Se liquidarán con los nuevos precios las facturaciones al Sistema Nacional de Salud, incluidos los regímenes especiales mencionados en el apartado anterior, cerradas a partir del día 1 de abril de 2012.
3. En el supuesto de las presentaciones de medicamentos que formen parte de conjuntos inactivos, la fecha a que se refiere el apartado primero se entenderá el último día del mes en que expire el plazo señalado en el apartado tercero del punto 7 para las oficinas de farmacia, mientras que la fecha a que se refiere el apartado segundo será la coincidente con el día 1 del mes siguiente.
9. Efectos de la Resolución
De acuerdo con lo establecido en el artículo 57.2 de la Ley 30/1992, de 26 de noviembre, de Régimen Jurídico de las Administraciones Públicas y del Procedimiento Administrativo Común, la presente Resolución producirá efectos desde el día de su publicación en el «Boletín Oficial del Estado».
10. Recursos
Al amparo de lo dispuesto en el artículo 93.10 de la Ley 29/2006, de 26 de julio, y de conformidad con los artículos 114 y 115 de la Ley 29/1992, de 26 de noviembre, esta Resolución podrá ser recurrida en alzada ante el Secretario General de Sanidad del Ministerio de Sanidad, Servicios Sociales e Igualdad en el plazo de un mes.
Madrid, 28 de diciembre de 2011.–La Directora General de Farmacia y Productos Sanitarios, M.ª Dolores Vaquero García.



























Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid