El artículo 93 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, establece el sistema de precios de referencia en la financiación con fondos públicos de medicamentos prescritos y dispensados a través de receta médica oficial del Sistema Nacional de Salud. El precepto legal encomienda al Ministro de Sanidad, Política Social e Igualdad, previo acuerdo de la Comisión Delegada del Gobierno para Asuntos Económicos e informe del Consejo Interterritorial del Sistema Nacional de Salud, la determinación de dichos conjuntos que sirven como base para la fijación de los precios de referencia, así como la cuantía de éstos últimos.
Ese mismo artículo, en la redacción dada por el Real Decreto-ley 4/2010, de 26 de marzo, de racionalización del gasto farmacéutico con cargo al Sistema Nacional de Salud, prevé que el precio de referencia será, para cada conjunto, el coste/tratamiento/día menor de las presentaciones de medicamentos en él agrupadas por cada vía de administración, calculados según la dosis diaria definida. Razón por la que se hace necesario fijar los conjuntos y sus respectivos precios de referencia de conformidad con las nuevas reglas aplicables al sistema de precios de referencia.
Igualmente el artículo 93 precisa que la determinación de nuevos conjuntos y precios de referencia, así como la revisión de los precios de referencia correspondientes a conjuntos ya determinados, se realizará como mínimo una vez al año, por lo que teniendo en cuenta, además, que el citado Real Decreto-ley 4/2010, de 26 de marzo, procedió asimismo a modificar el artículo 91 de la Ley 29/2006, de 26 de julio, en el sentido de suprimir el apartado sexto del mismo, se concluye que resulta posible hacer uso de la facultad otorgada por el artículo 93 de la citada Ley.
Por otra parte, y de acuerdo con el párrafo primero del apartado 2 del articulo 93, según redacción dada por la disposición final segunda de la Ley 34/2010, de 5 de agosto, de modificación de las Leyes 30/2007, de 30 de octubre, de Contratos del Sector Público, 31/2007, de 30 de octubre, sobre procedimientos de contratación en los sectores del agua, la energía, los transportes y los servicios postales, y 29/1998, de 13 de julio, reguladora de la Jurisdicción Contencioso- Administrativa para adaptación a la normativa comunitaria de las dos primeras, podrán crearse conjuntos cuando hayan transcurrido diez años desde la fecha inicial de la autorización del medicamento en España u once en caso de nueva indicación.
En consecuencia, mediante esta orden se procede, a efectos de dar cumplimiento a lo dispuesto por el citado artículo 93 de la Ley 29/2006, de 26 de julio, a la determinación de los conjuntos de medicamentos y sus precios de referencia, para lo cual establece también la fórmula de cálculo de éstos últimos.
Asimismo, de conformidad con la habilitación contemplada en el apartado segundo del artículo 93 de la Ley 29/2006, de 26 de julio, y habida cuenta de que el Real Decreto 1338/2006, de 21 de noviembre, que desarrollaba determinados aspectos del mencionado artículo en el marco del sistema de precios de referencia, ha sido anulado en virtud de la sentencia de 9 de marzo de 2010, de la Sala Tercera del Tribunal Supremo, publicada en el «Boletín Oficial del Estado» n.º 107, de 3 de mayo de 2010, los artículos 3, 4 y 5 de la presente Orden ministerial regulan los supuestos, requisitos, procedimiento y efectos de la declaración de innovación galénica de interés terapéutico. Igualmente, y a efectos de evitar los perjuicios no deseados que se pudieran derivar de la revocación de todas las declaraciones de innovación galénica acordadas al amparo de dicho Real Decreto, se procede a convalidar, mediante la disposición adicional octava, todas aquellas innovaciones galénicas que se hubieran declarado conforme al procedimiento regulado en aquel Real Decreto. Todo ello, a su vez, motiva la necesidad de incluir en el texto tres disposiciones transitorias que regulen los efectos de las innovaciones galénicas de interés terapéutico declaradas con anterioridad a la entrada en vigor de la presente orden (disposición transitoria primera), los procedimientos iniciados al amparo del Real Decreto anulado y que, consecuentemente, no han sido resueltos (disposición transitoria segunda), así como para establecer un procedimiento y otorgar un plazo a aquellas nuevas formas farmacéuticas que hayan sido autorizadas desde tres meses antes de la fecha de anulación del Real Decreto citado, y hasta la entrada en vigor de la presente orden, siempre que esta declaración no hubiera sido solicitada (disposición transitoria tercera).
De lo anterior, y teniendo en cuenta que existen determinadas presentaciones de medicamentos cuya declaración como innovación galénica expirará en el plazo de los doce meses siguientes a la fecha de entrada en vigor de la presente orden, en el artículo 6 se facilita su incorporación al sistema de precios de referencia, de conformidad con lo dispuesto en el artículo 93.2 de la Ley 29/2006, de 26 de julio, en relación con el artículo 5 de esta Orden, permitiendo el ejercicio de la opción prevista en el ya citado artículo 93.5 de la Ley 29/2006.
En cuanto a los supuestos y el procedimiento para hacer efectiva la rebaja del precio de aquellos medicamentos cuyo precio industrial en aplicación del sistema de precios de referencia se vea afectado en más del cincuenta por ciento, visto que eran cuestiones recogidas en el Real Decreto 1338/2006, de 21 de noviembre arriba citado, pasan a regularse en el artículo 7 de esta Orden en virtud de la habilitación conferida por el apartado segundo del artículo 93 de la Ley 29/2006, de 26 de julio, posibilitándose, mediante lo establecido por la disposición adicional quinta, el ejercicio de la opción prevista en el artículo 93.5 de la misma Ley.
Esta orden incorpora, además, a efectos de la formación de determinados conjuntos, 86 presentaciones de medicamentos genéricos sometidas a medida cautelar de inmovilización como consecuencia de resolución judicial dictada en procedimiento relativo a la protección de derechos de propiedad industrial. Estos conjuntos no producirán efectos hasta que se incluya en los mismos una presentación de medicamento genérico comercializada no afectada por medida cautelar de inmovilización, o se notifique, por parte del Tribunal o Juzgado al Ministerio de Sanidad, Política Social e Igualdad, la sentencia firme que desestime las pretensiones del titular de la patente del medicamento o el auto por el que se dejen sin efecto las medidas cautelares de inmovilización del medicamento genérico, para lo cual se ha consignado la correspondiente anotación en el Nomenclátor oficial de productos farmacéuticos del Sistema Nacional de Salud. Si la resolución judicial es favorable a los intereses del titular del medicamento genérico, o se produce la incorporación de una presentación de medicamento genérico comercializada no sometida a medidas cautelares de inmovilización, las anotaciones serán suprimidas, aplicándose a las presentaciones contenidas en dichos conjuntos las disposiciones contempladas en la presente norma. En caso contrario, los conjuntos permanecerán inactivos hasta que sean suprimidos, en su caso, por la orden de revisión correspondiente.
En otro ámbito, y a los efectos de facilitar el ejercicio de la opción referida en el artículo 93.5, así como de presentar la opción de reducciones voluntarias de precios sin modificación del Código Nacional, o cualquier otro acto que deba entenderse con la Administración, tal y como se prevé en la disposición adicional sexta del presente proyecto, las comunicaciones de los laboratorios deberán dirigirse mediante registro telemático, en aplicación del artículo 27.6 de la Ley 11/2007, de 22 de junio, de acceso electrónico de los ciudadanos a los servicios públicos, habida cuenta de que la presente orden tiene como destinatarios a personas jurídicas o colectivos de personas físicas que tienen garantizado el acceso y la disponibilidad de los medios tecnológicos precisos.
Por último y para facilitar la aplicación de lo previsto en los artículos 85, 86 y 93.4 de la Ley 29/2006, esta orden establece que el Nomenclátor oficial de productos farmacéuticos del Sistema Nacional de Salud incorporará las agrupaciones de las presentaciones de medicamentos, incluidas o no en el sistema de precios de referencia, siendo el medicamento de menor precio el de cuantía inferior de entre todas las presentaciones de cada agrupación. Respecto a esta información cuya última actualización se incluyó en el Nomenclátor de julio de 2010, la orden establece su actualización en la misma fecha a partir de la que se liquiden con los nuevos precios de referencia las facturaciones al Sistema Nacional de Salud, debiendo informarse junto al Nomenclátor con un mes de antelación.
En su elaboración han sido consultadas las Comunidades Autónomas y oídos los sectores afectados, se ha sometido a informe previo del Consejo Interterritorial del Sistema Nacional de Salud y del Comité Consultivo y se ha recabado el acuerdo de la Comisión Delegada del Gobierno para Asuntos Económicos.
En su virtud, de acuerdo con el Consejo de Estado, dispongo:
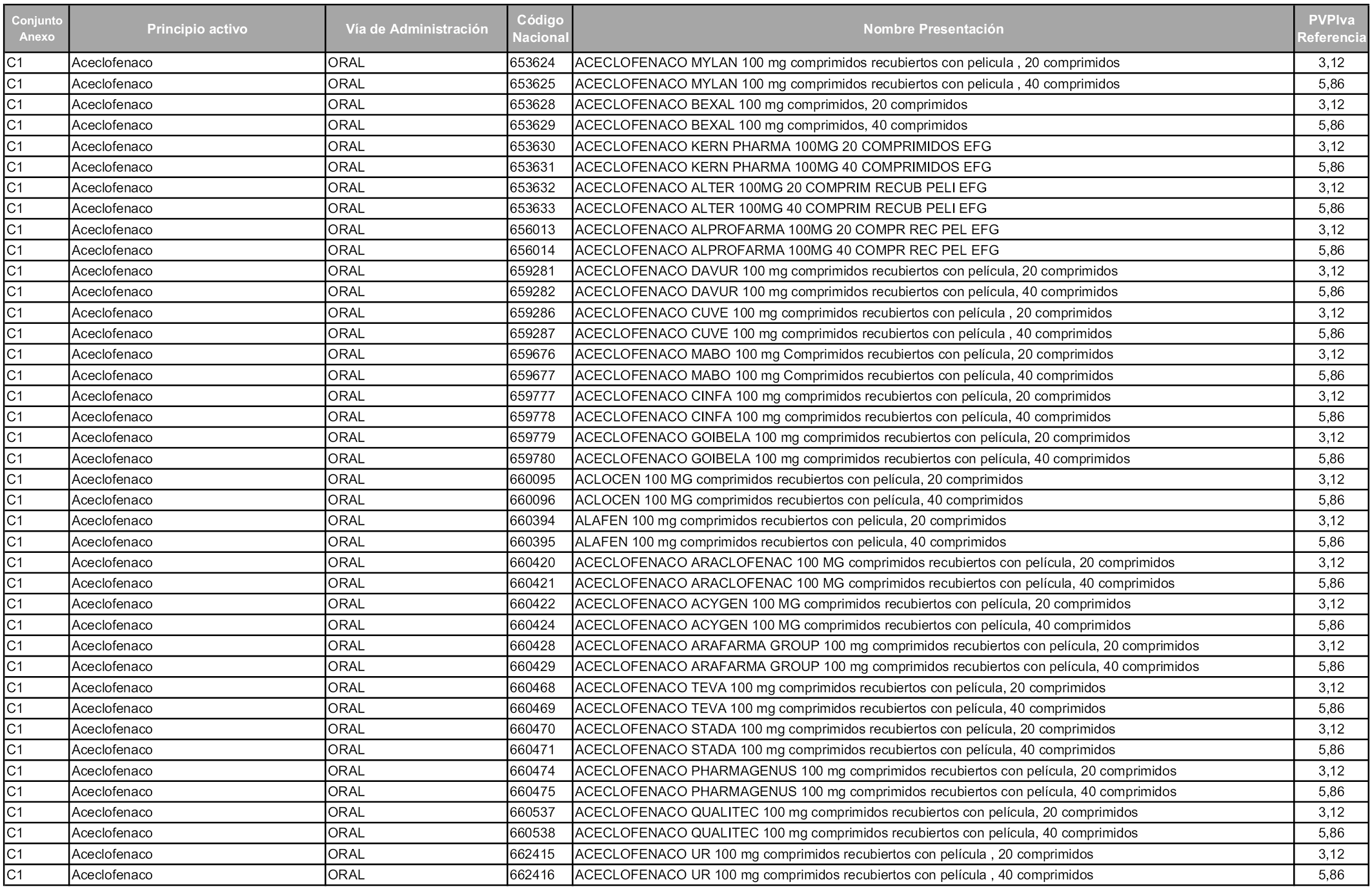
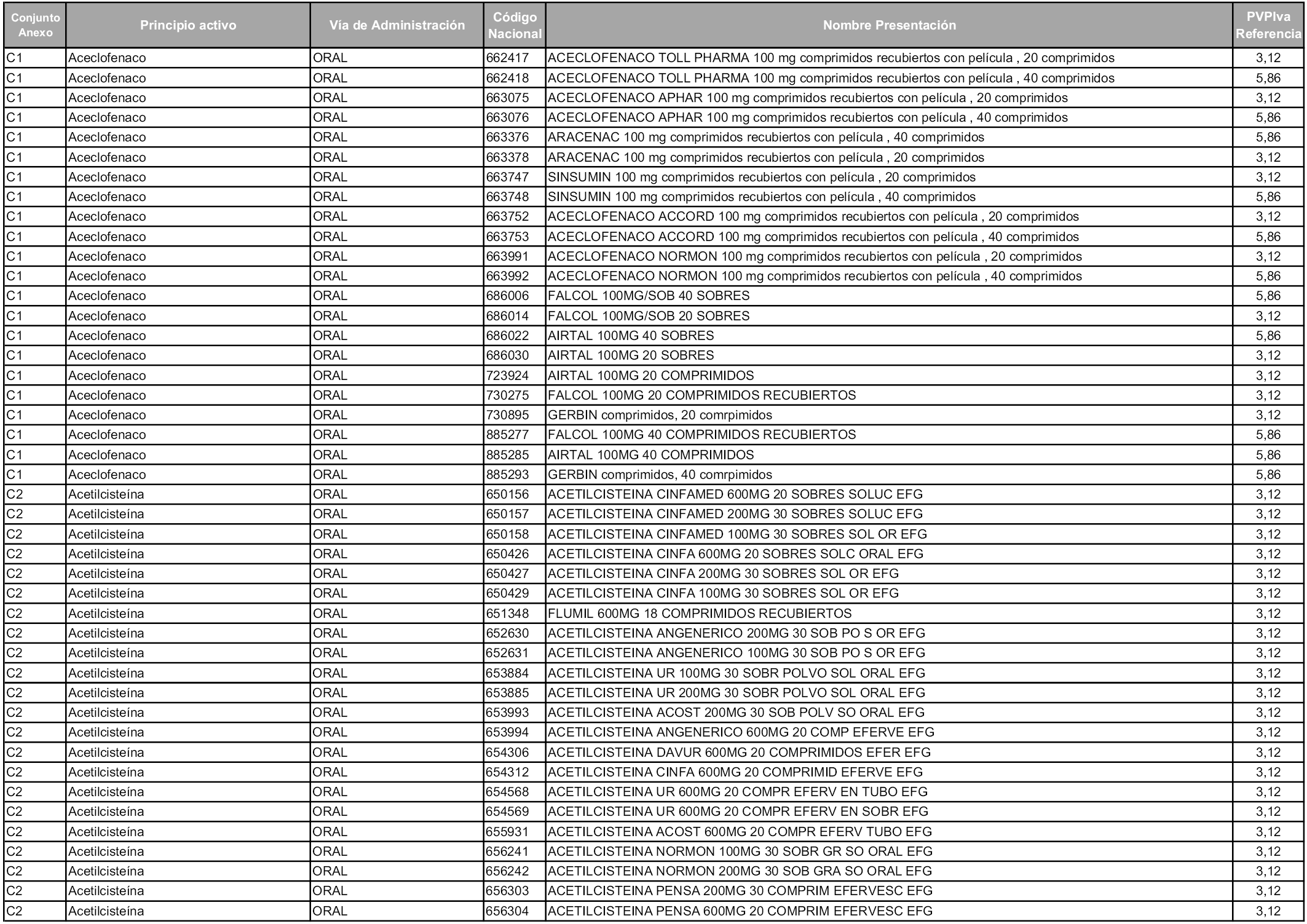
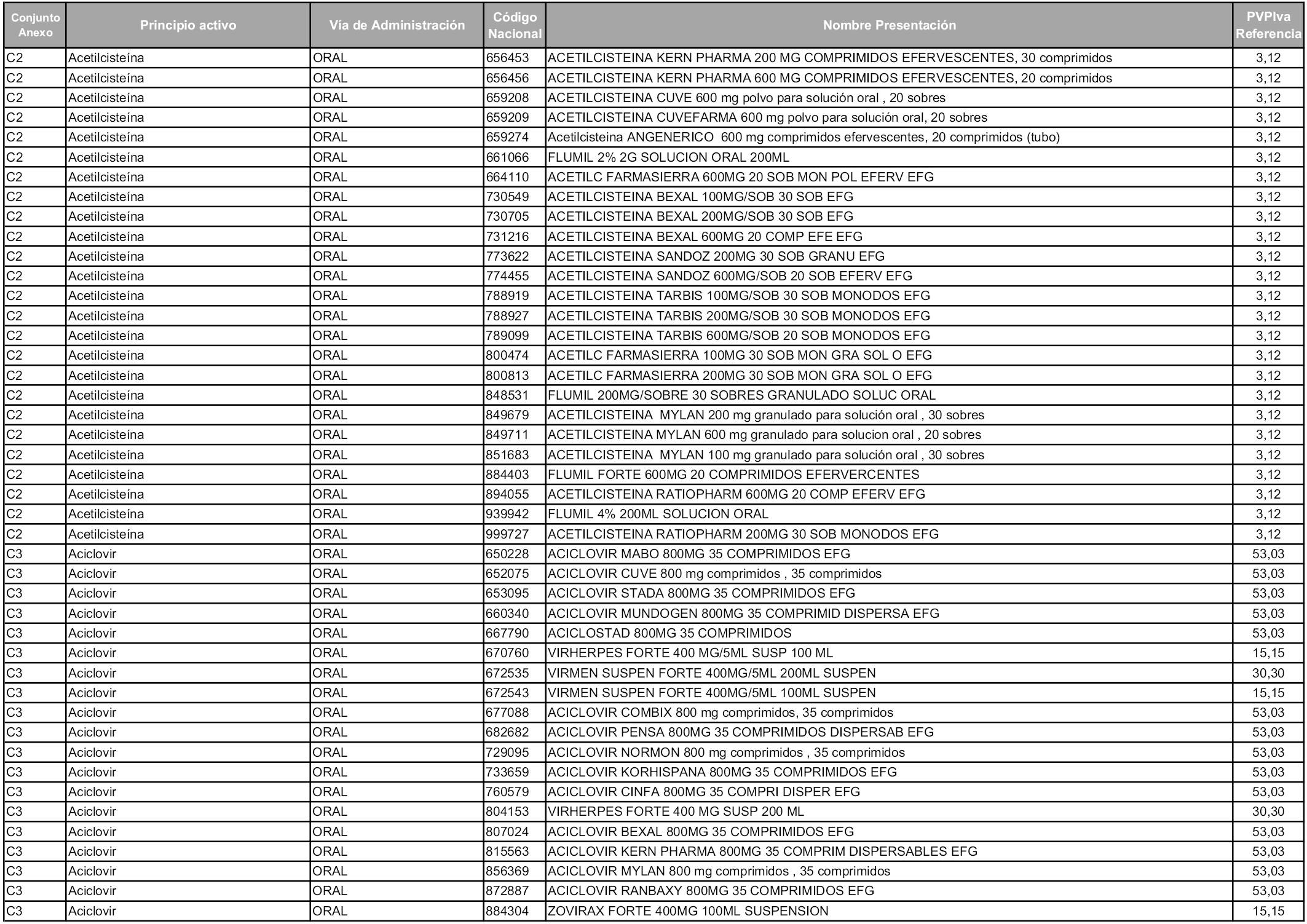
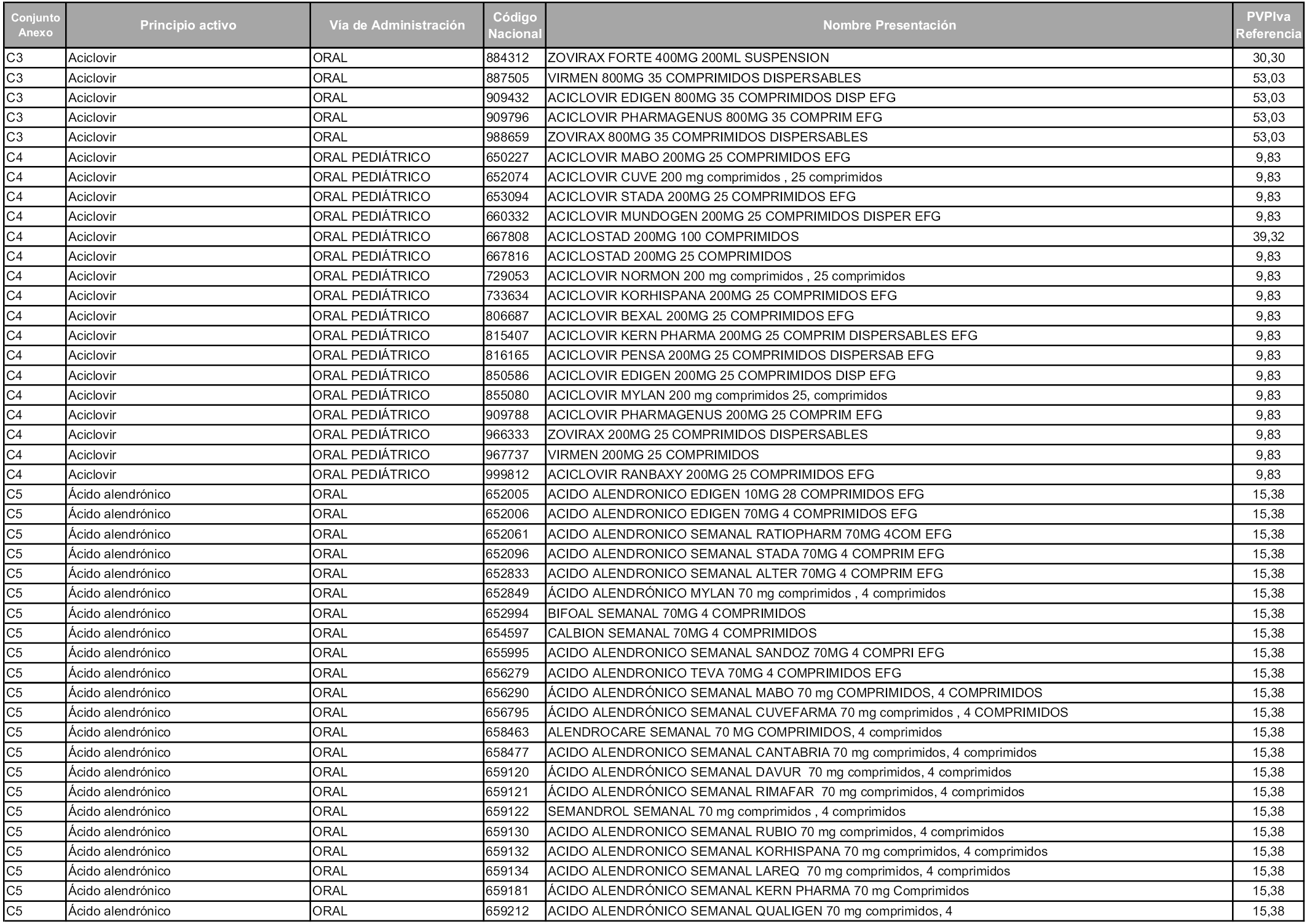
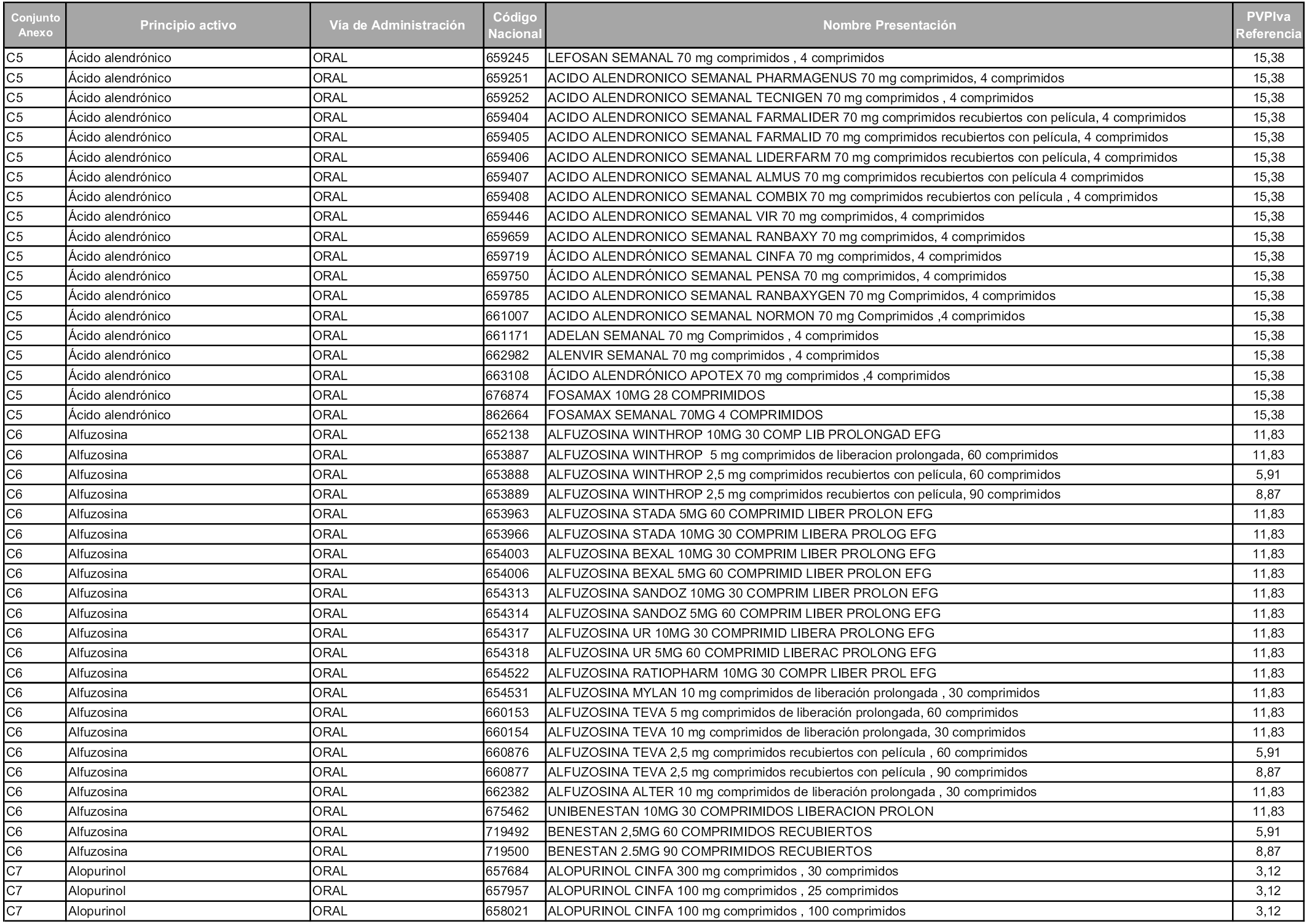
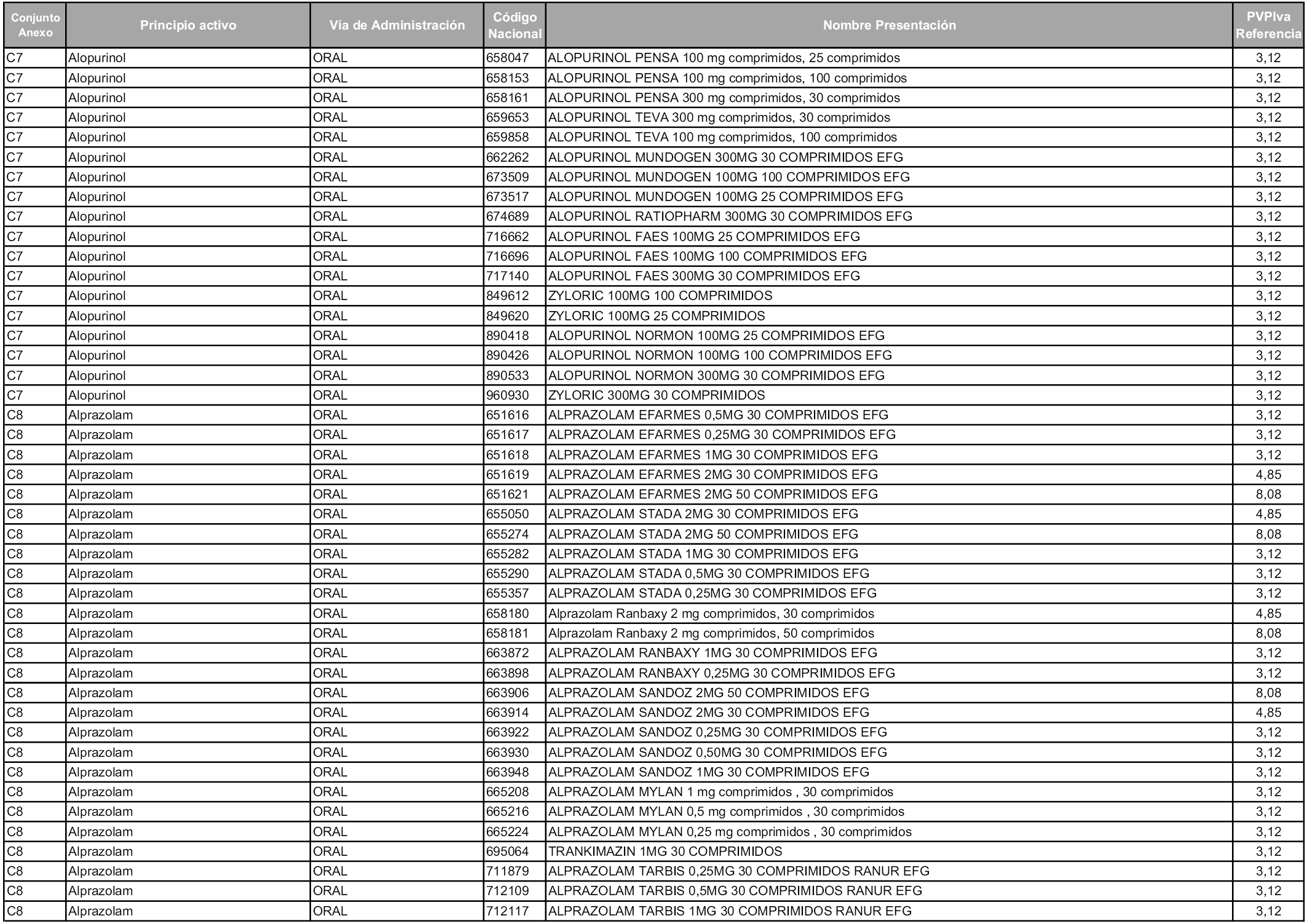
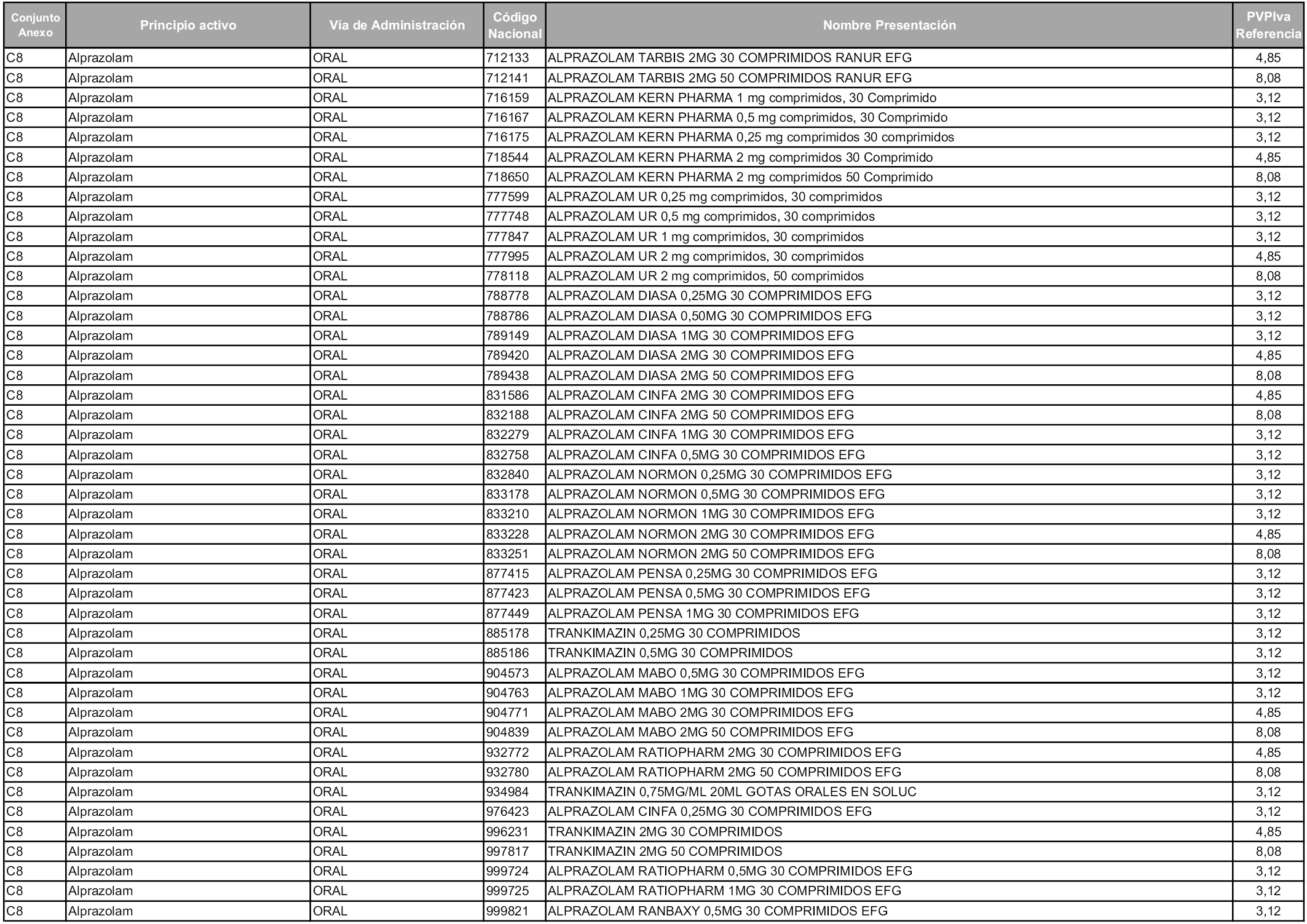
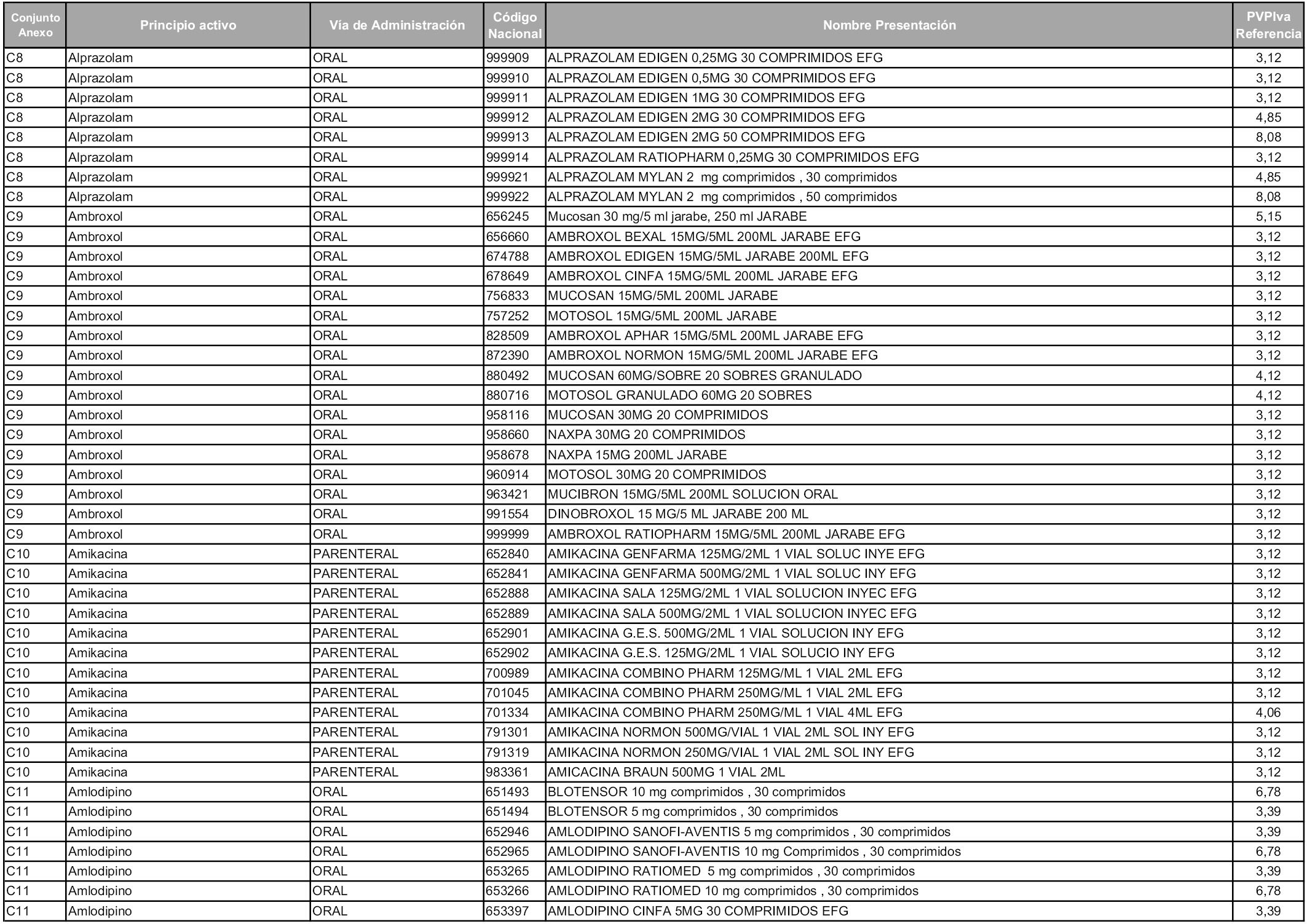
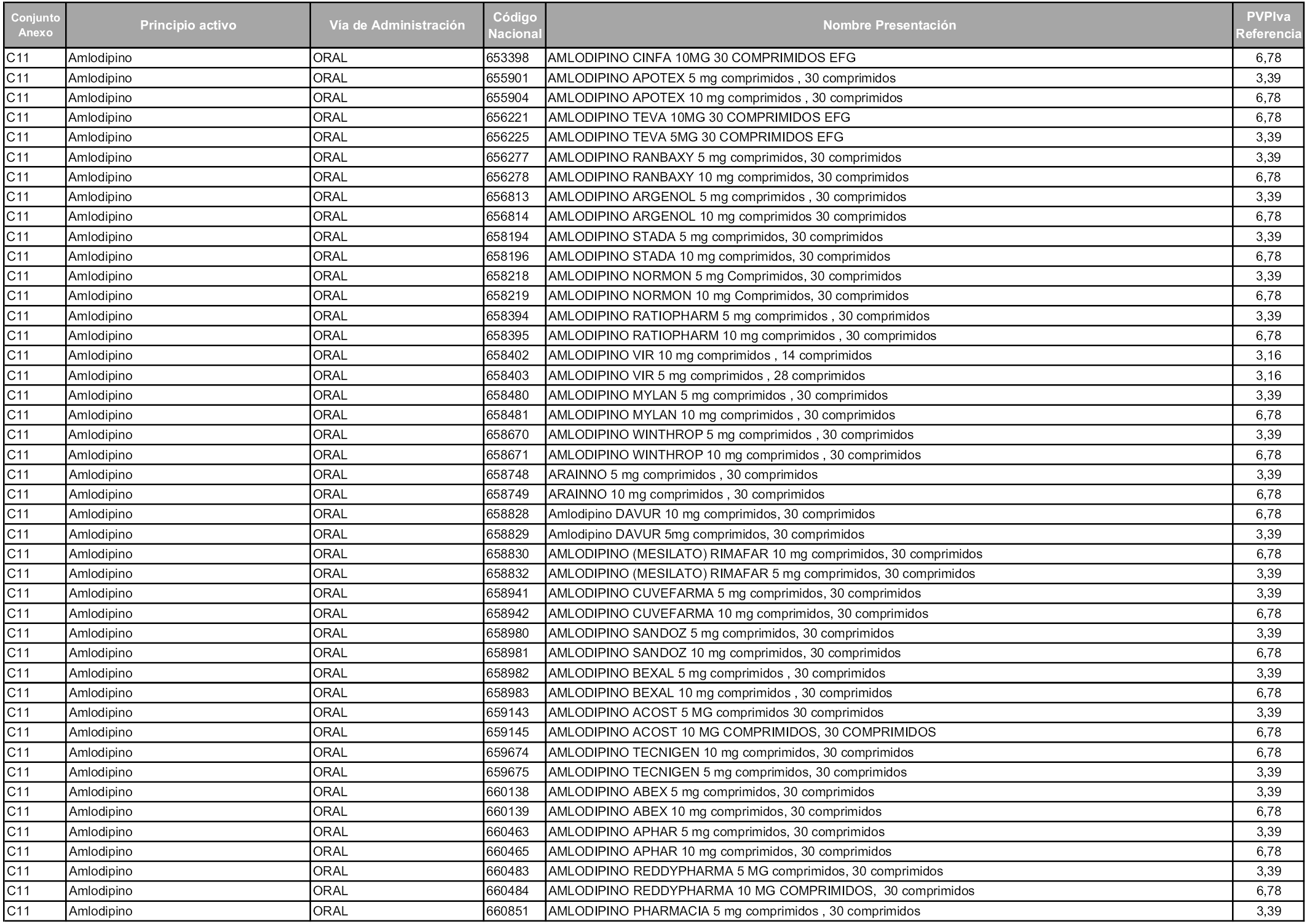
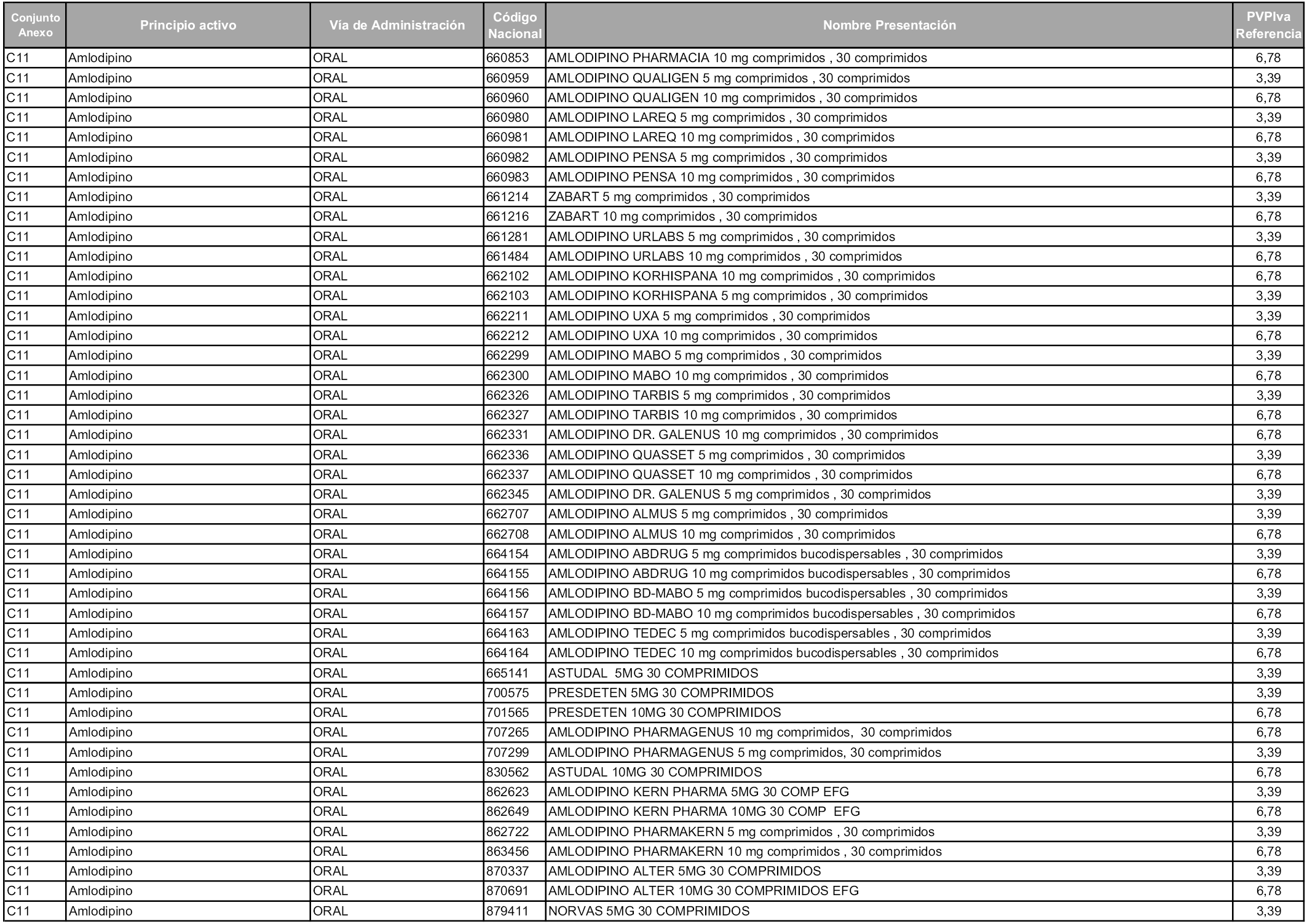
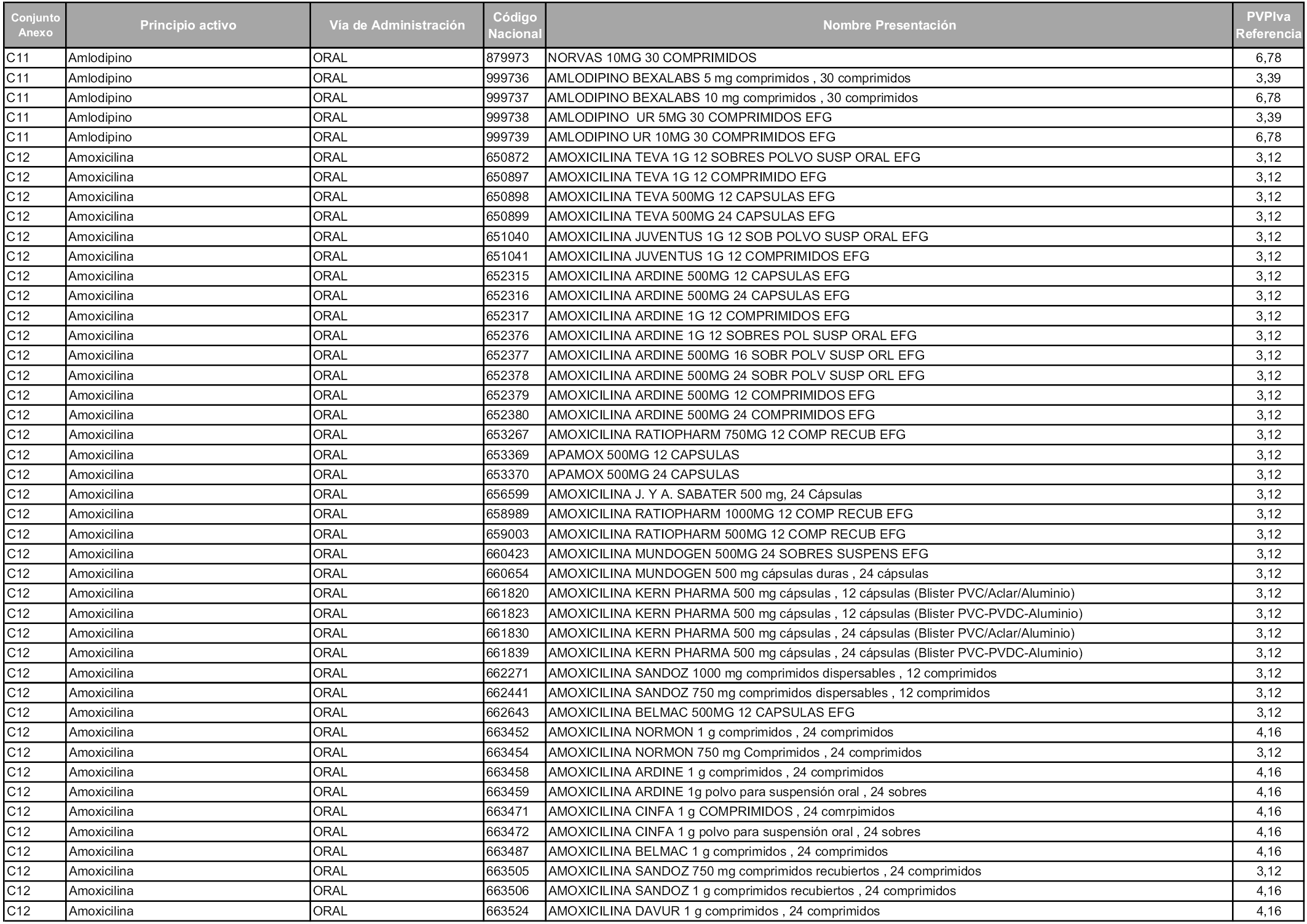
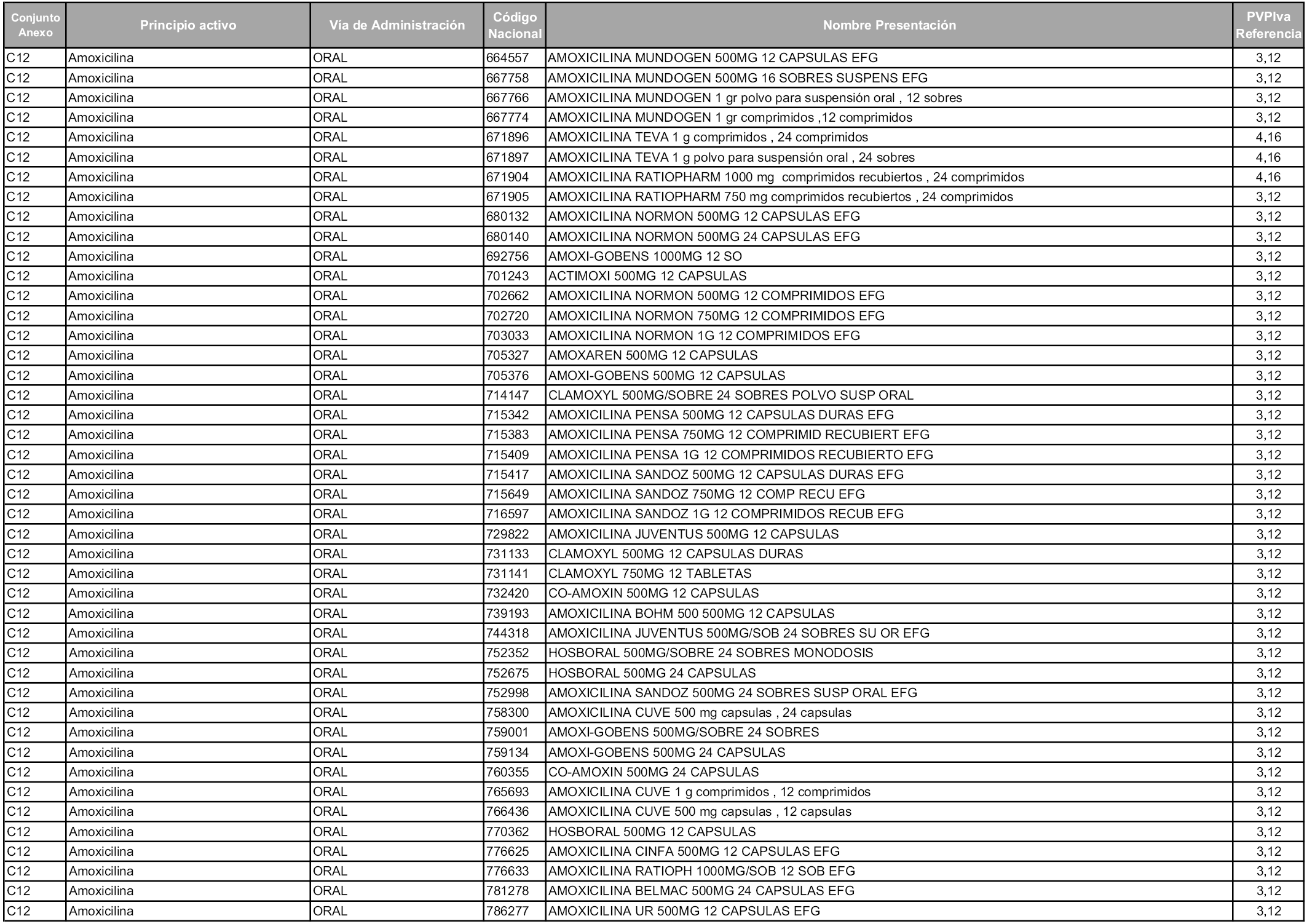
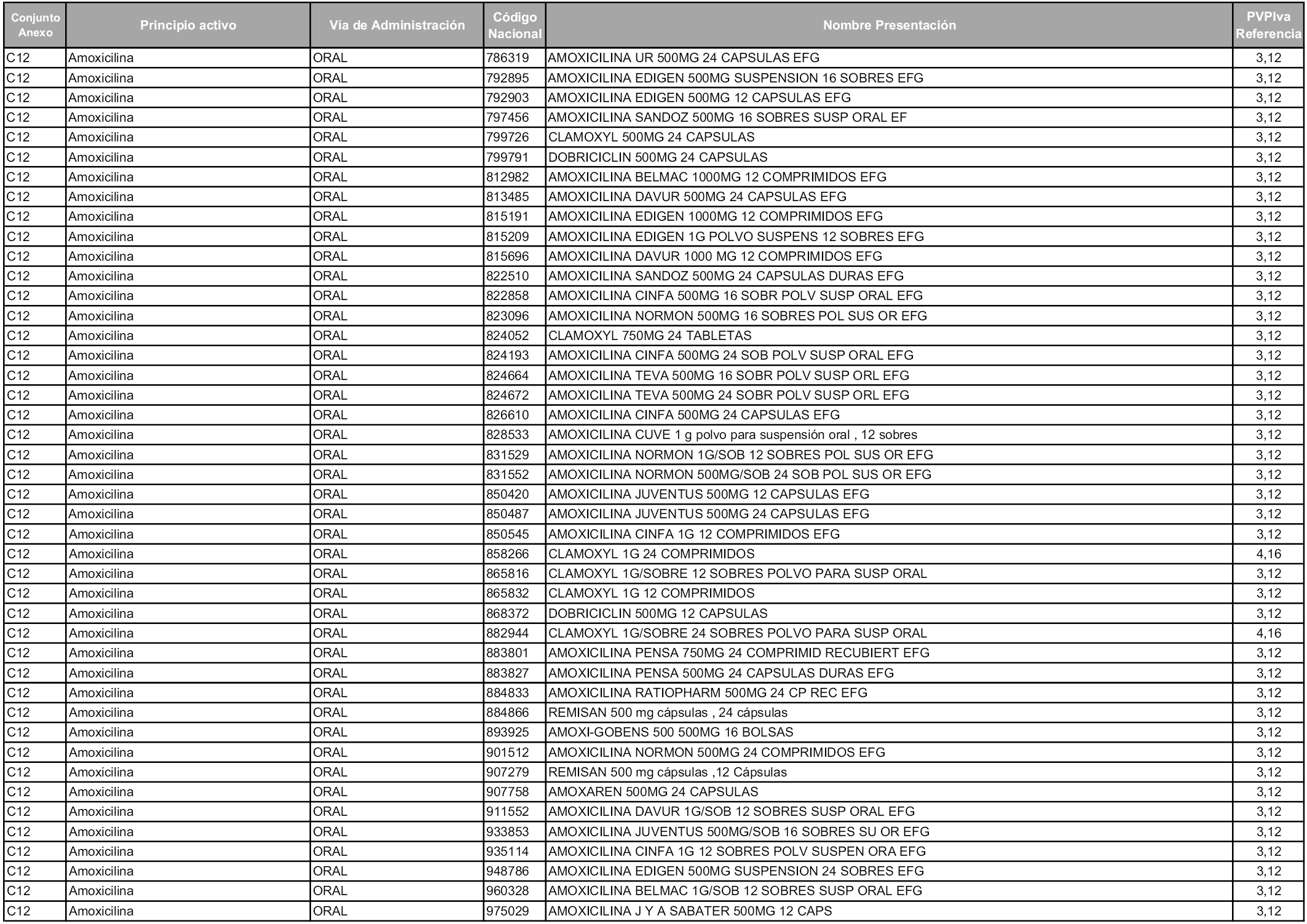
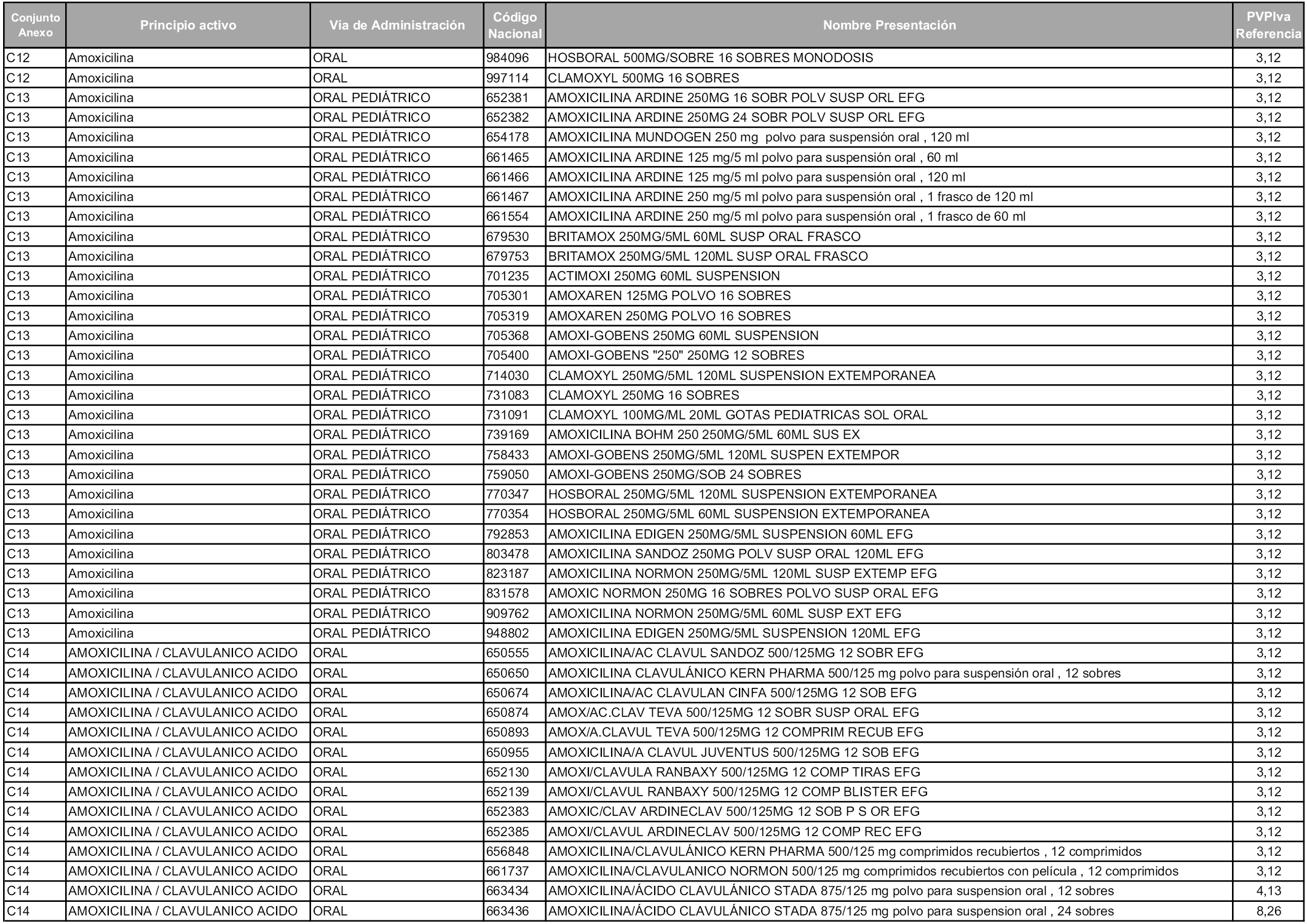
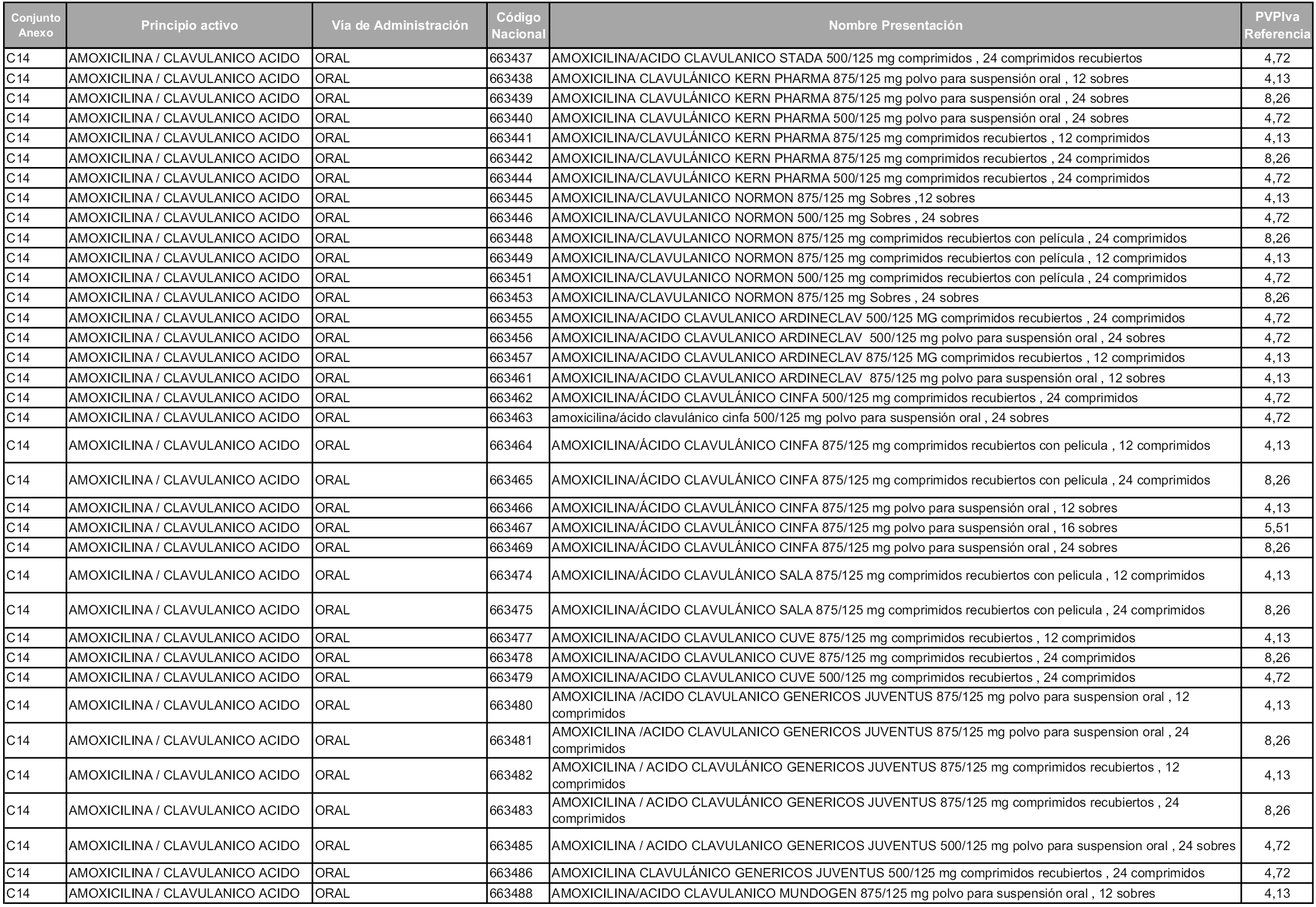
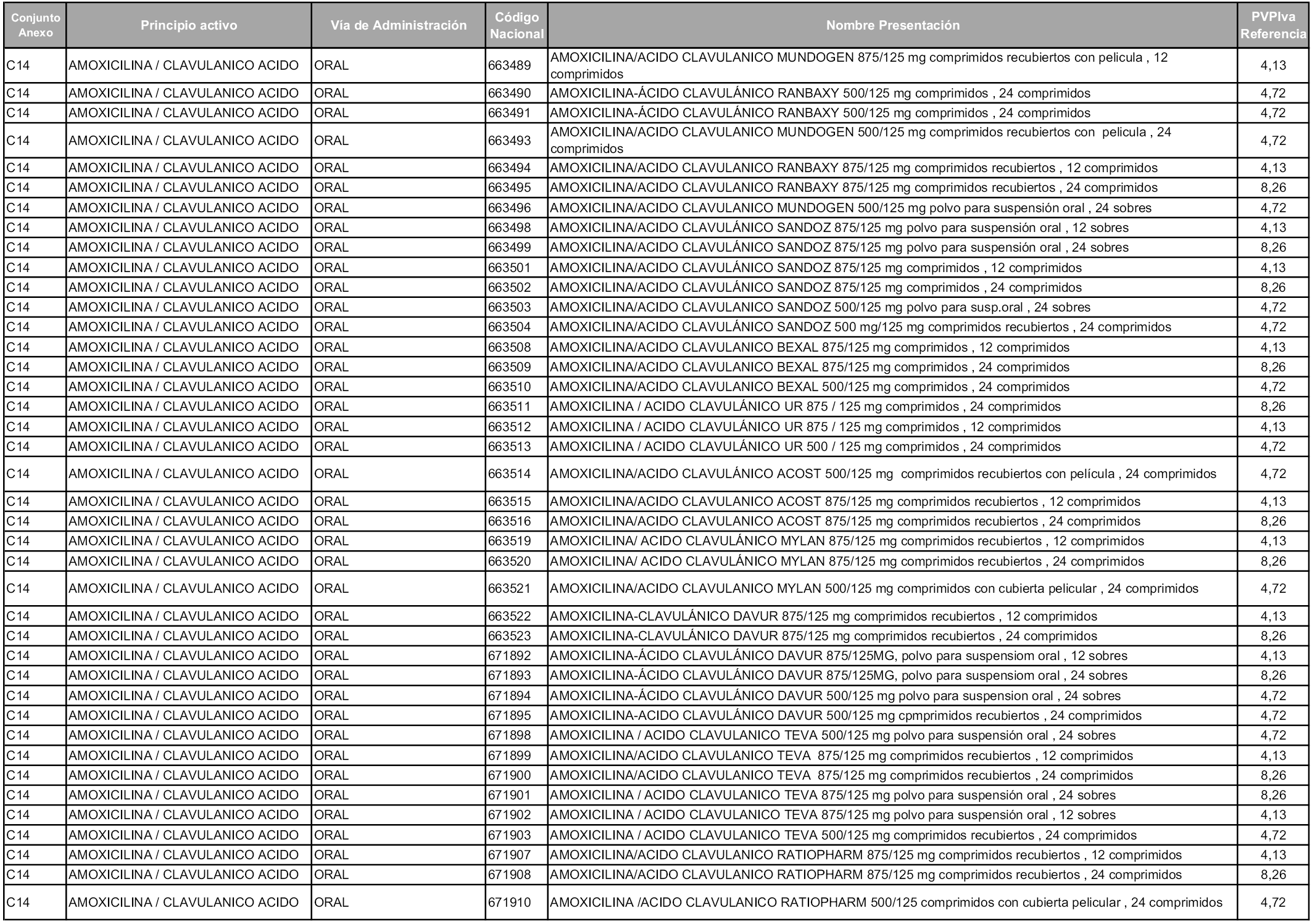
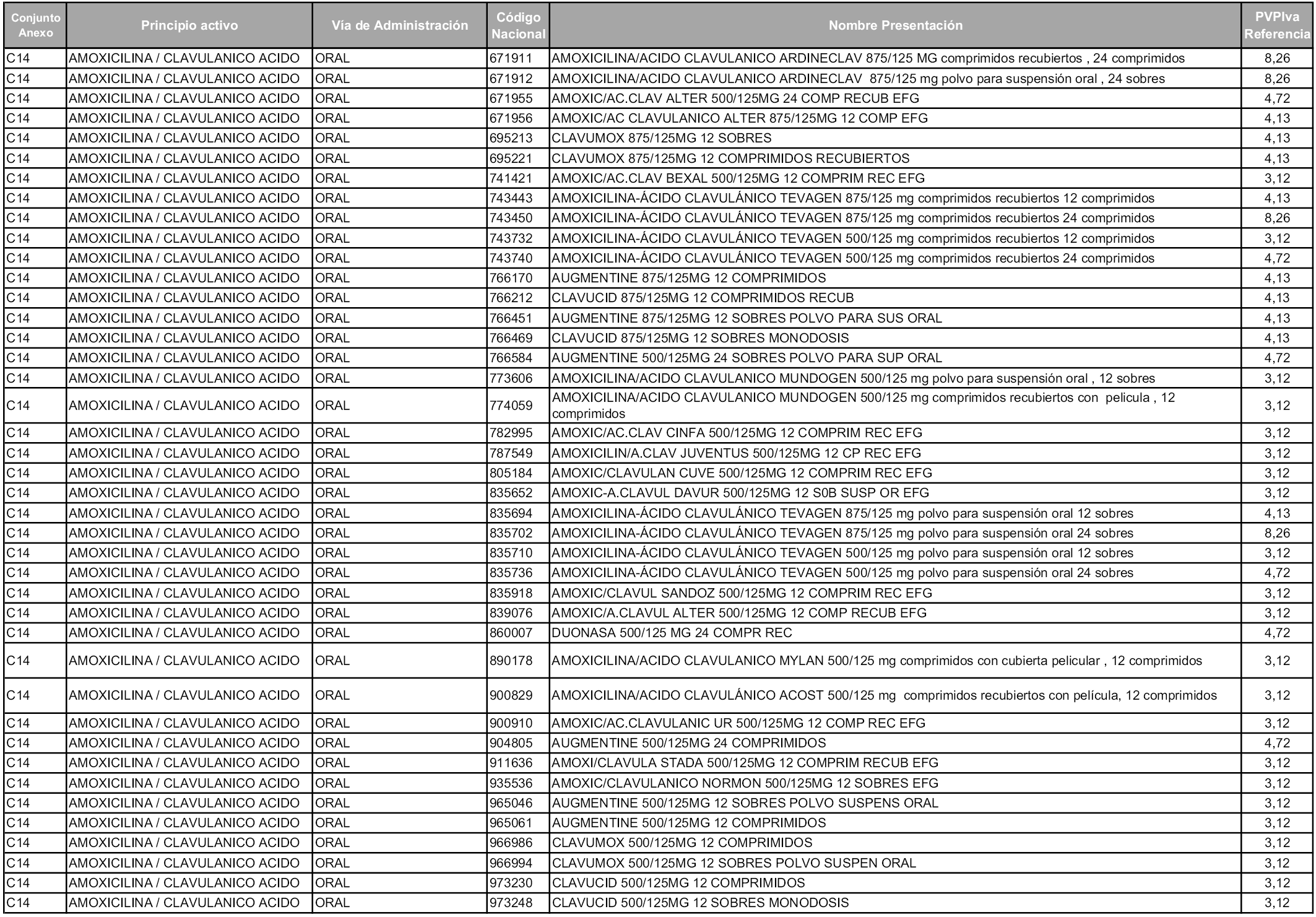
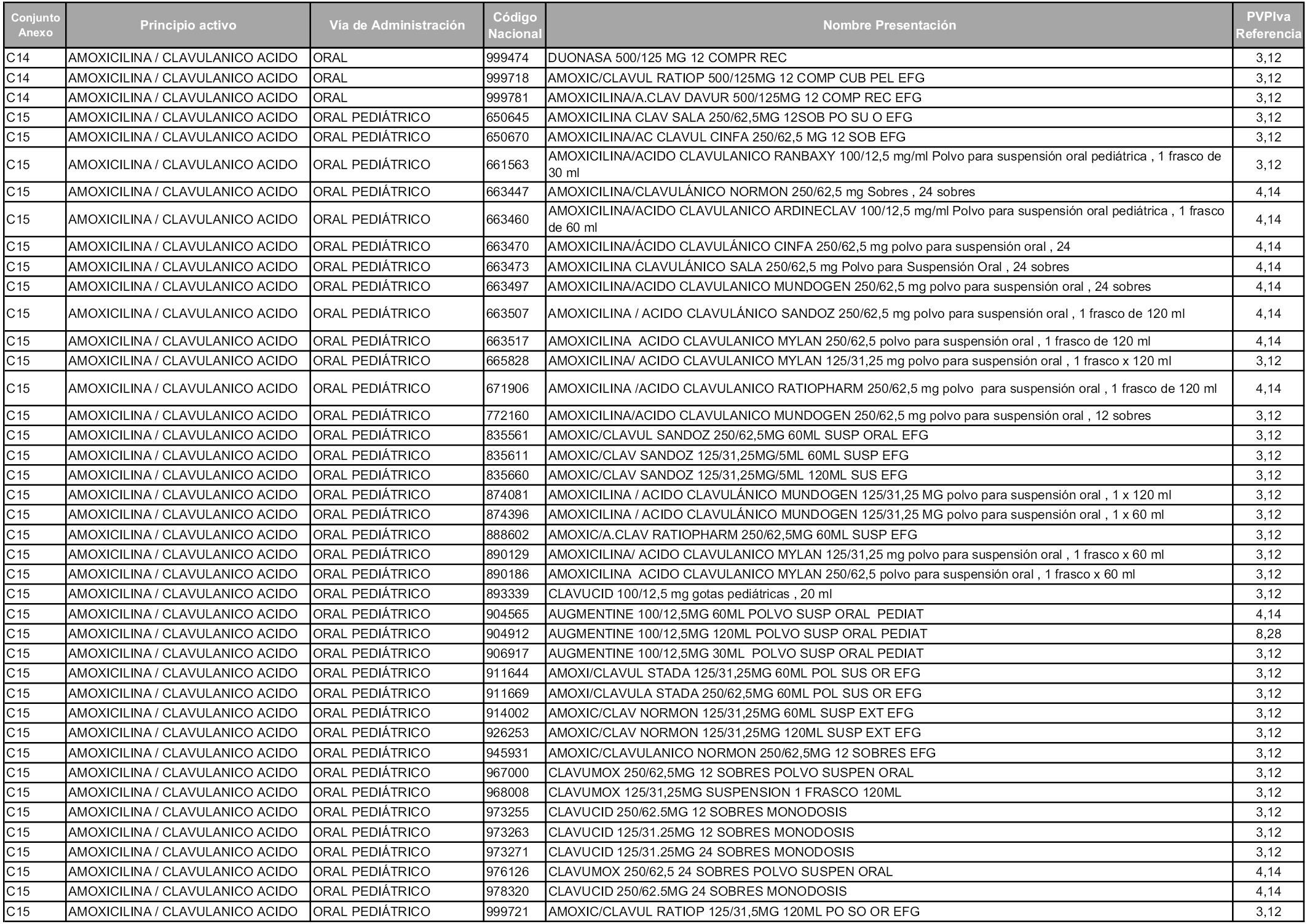
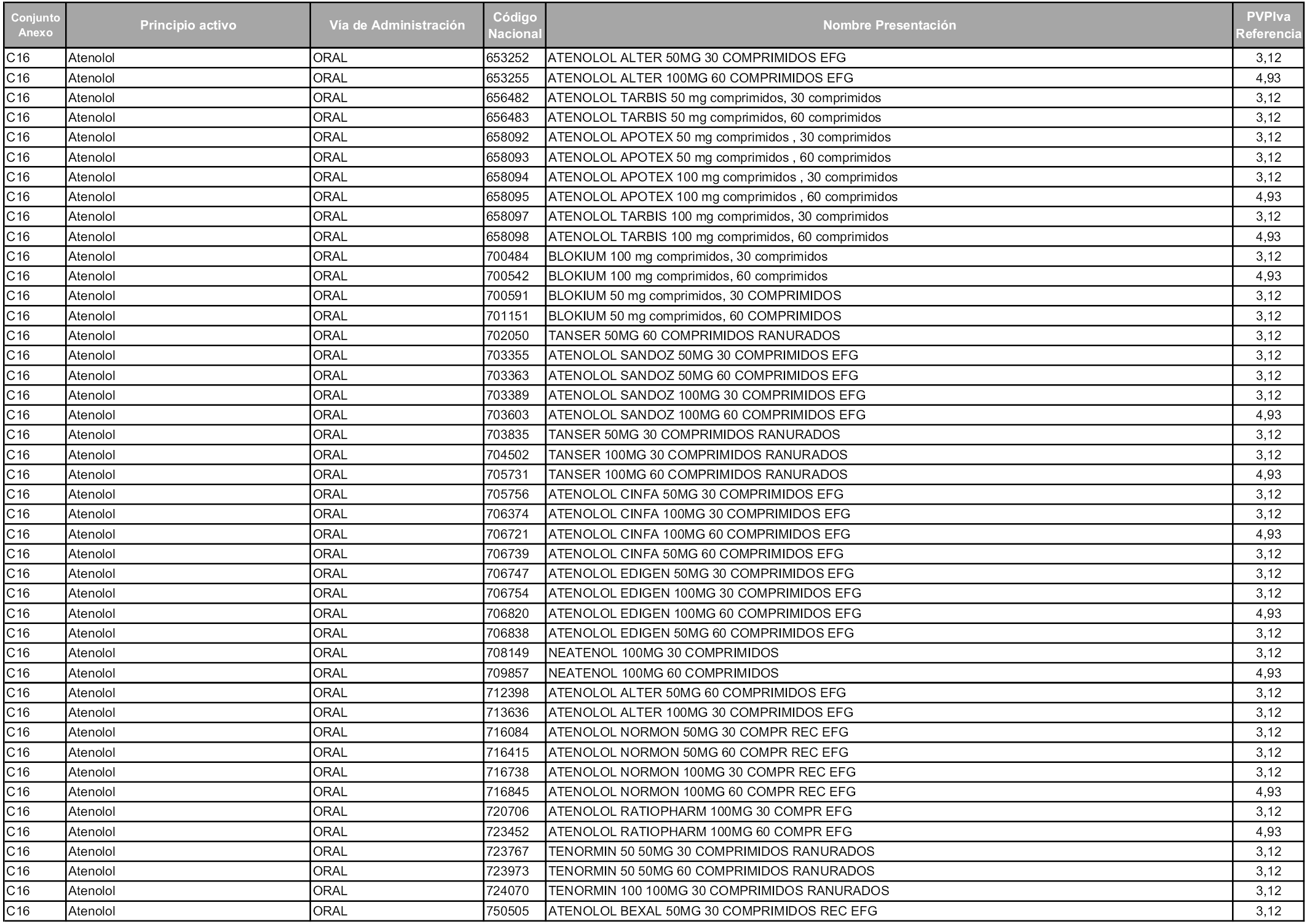
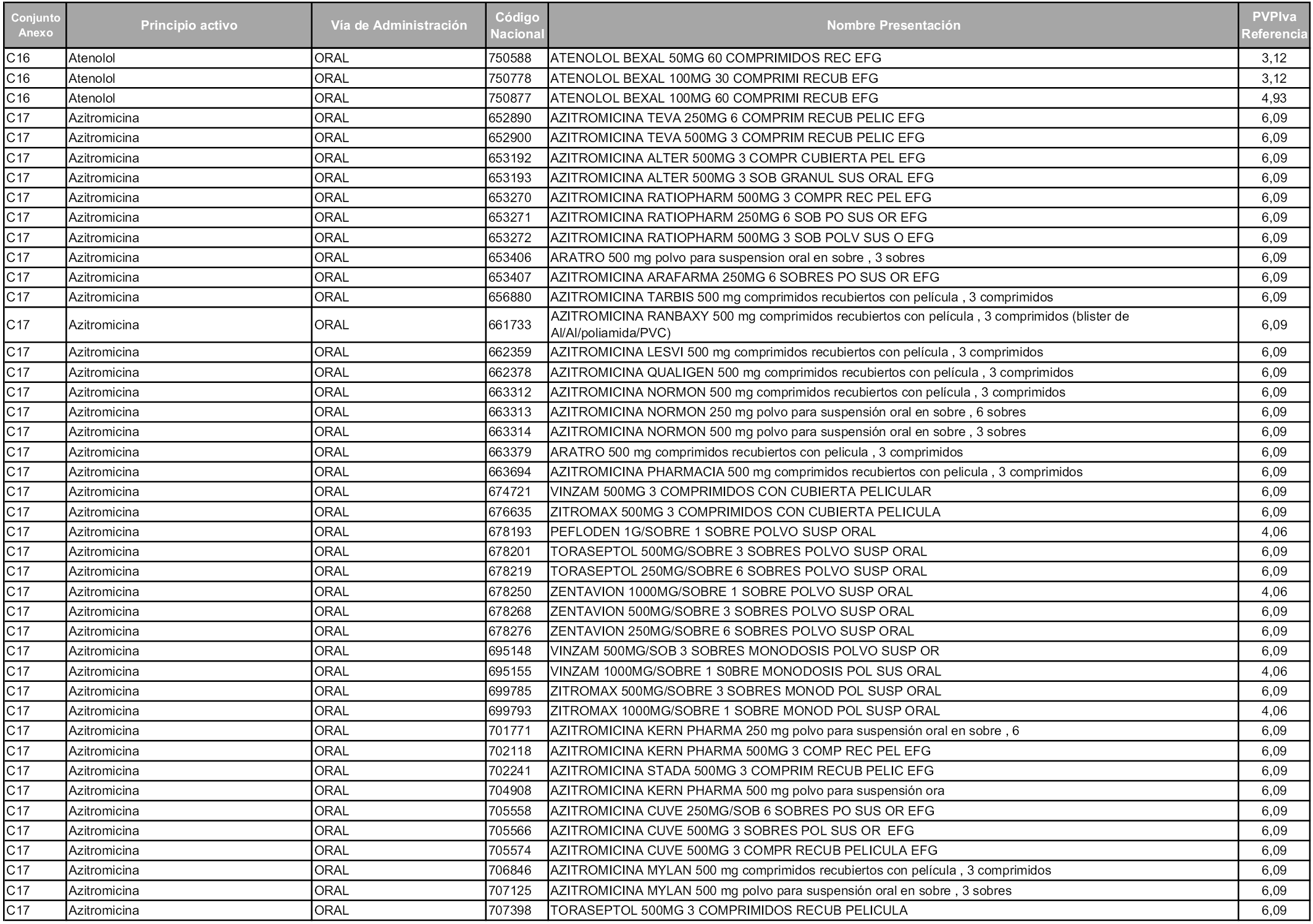
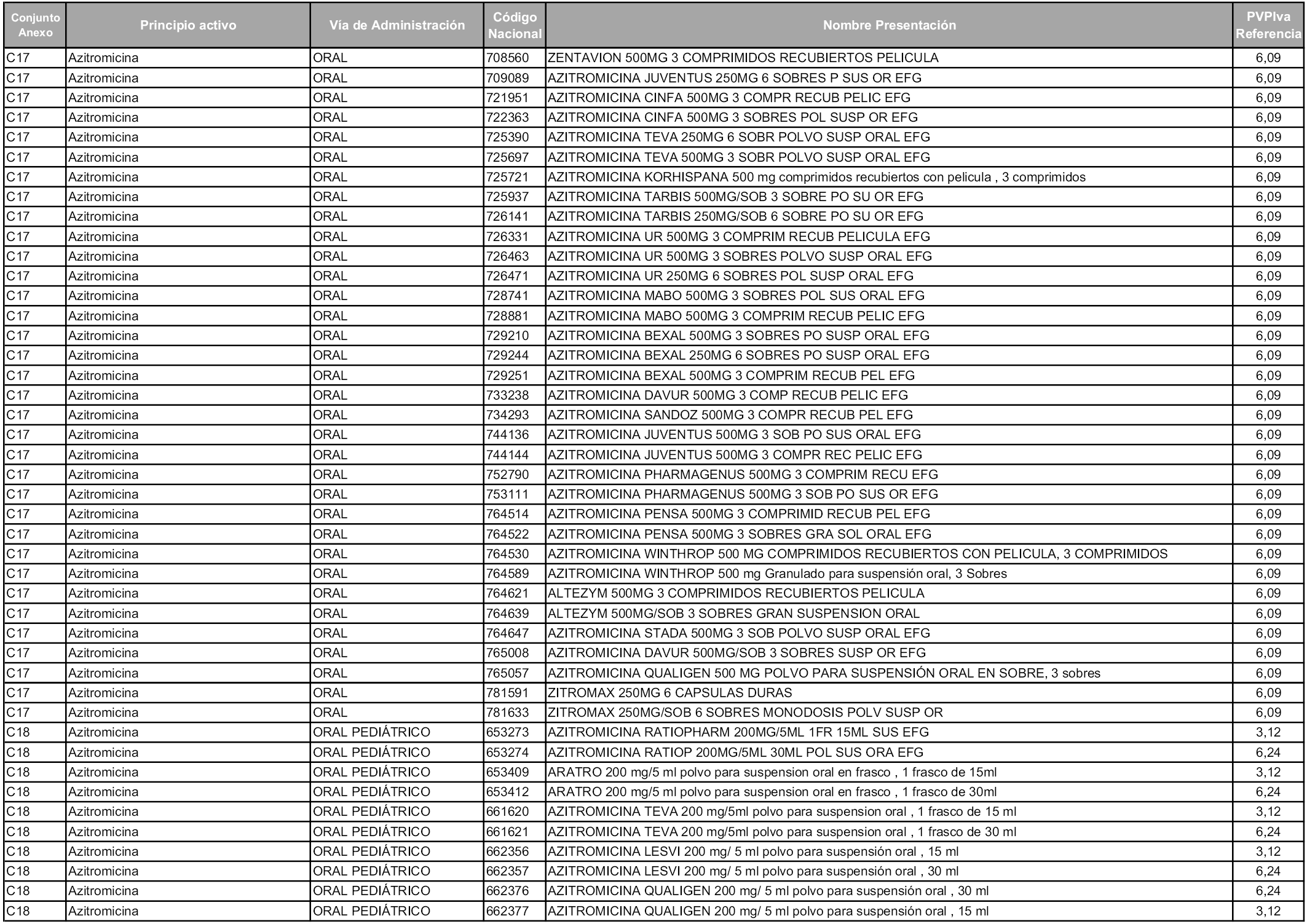
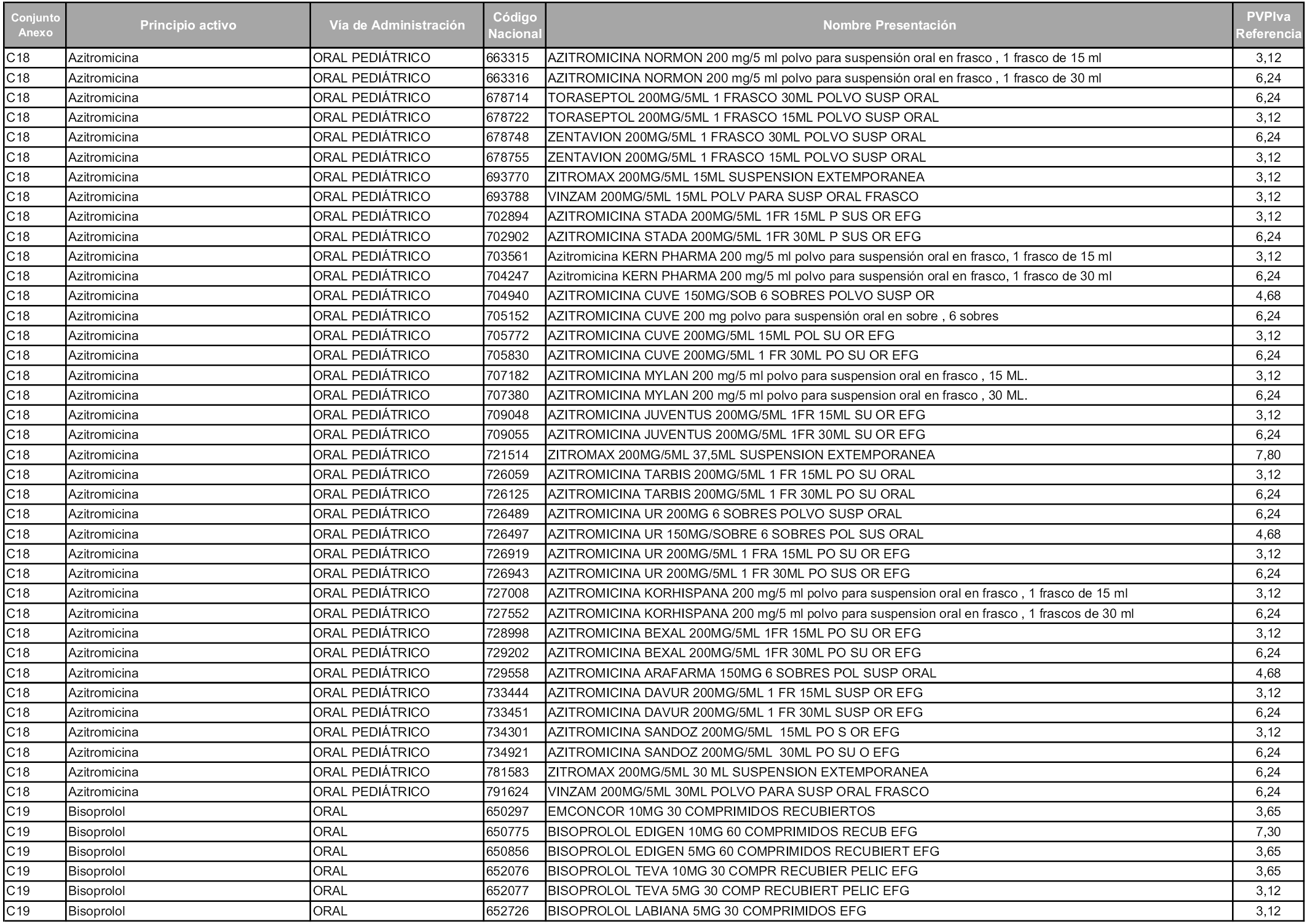
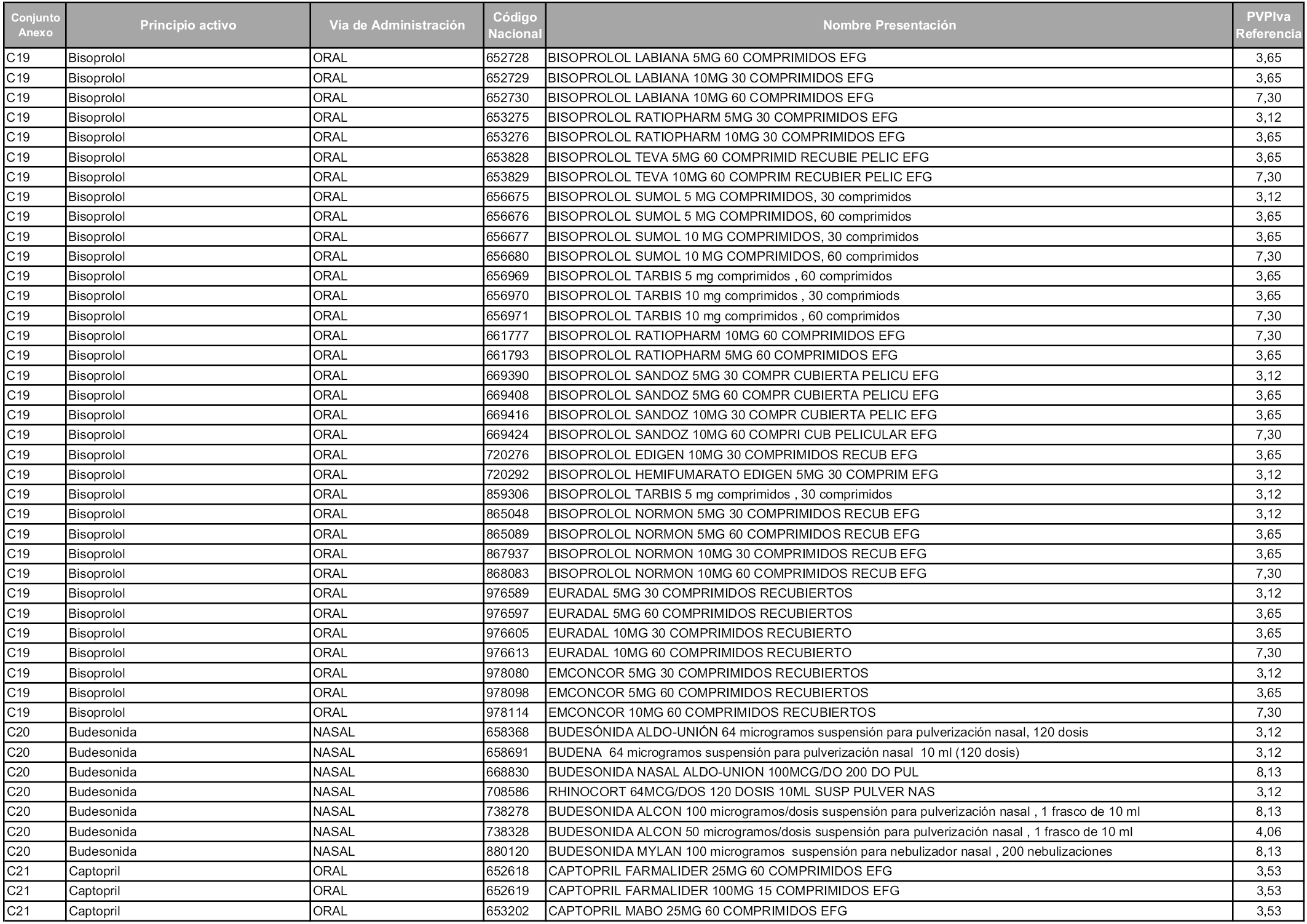
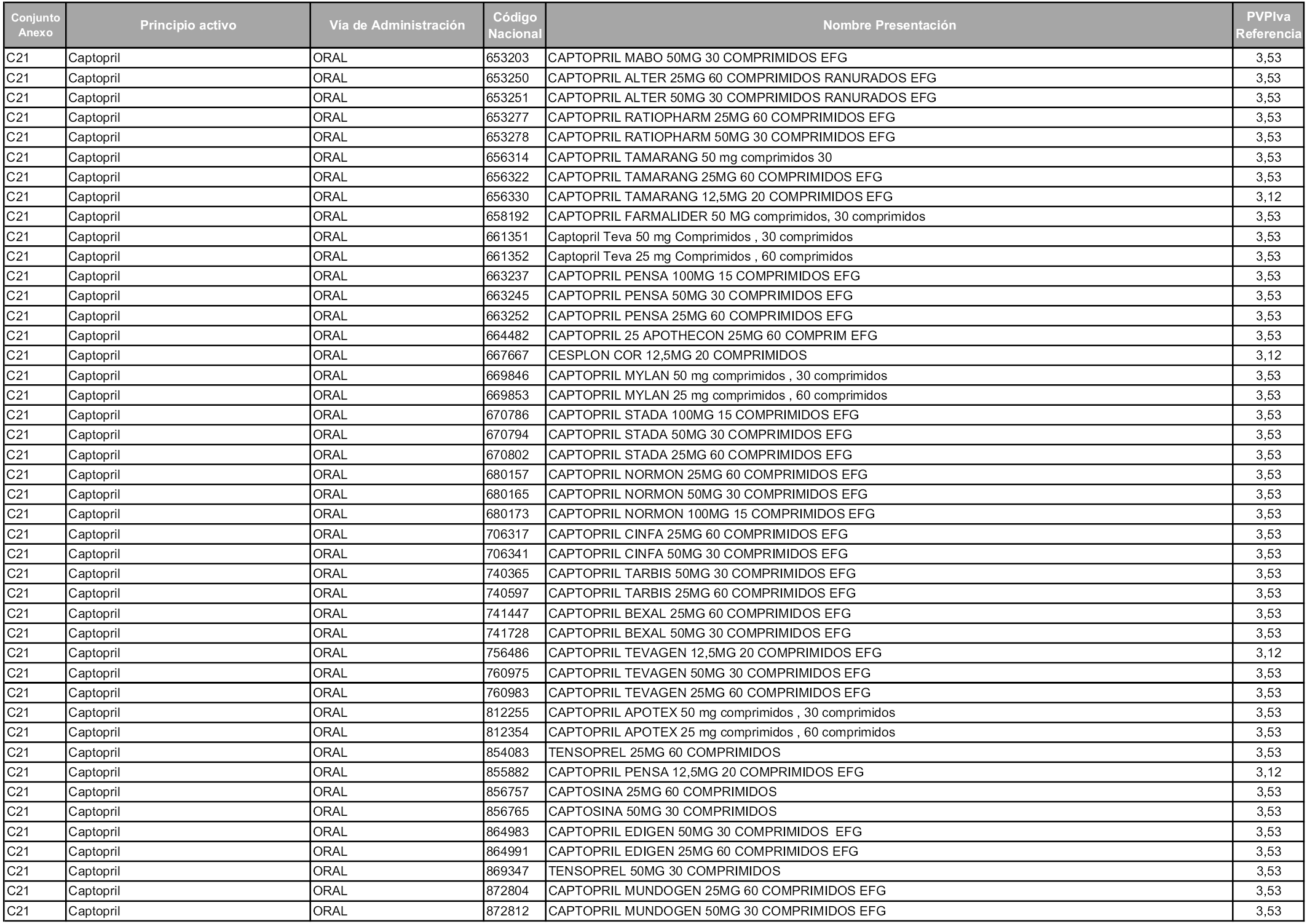
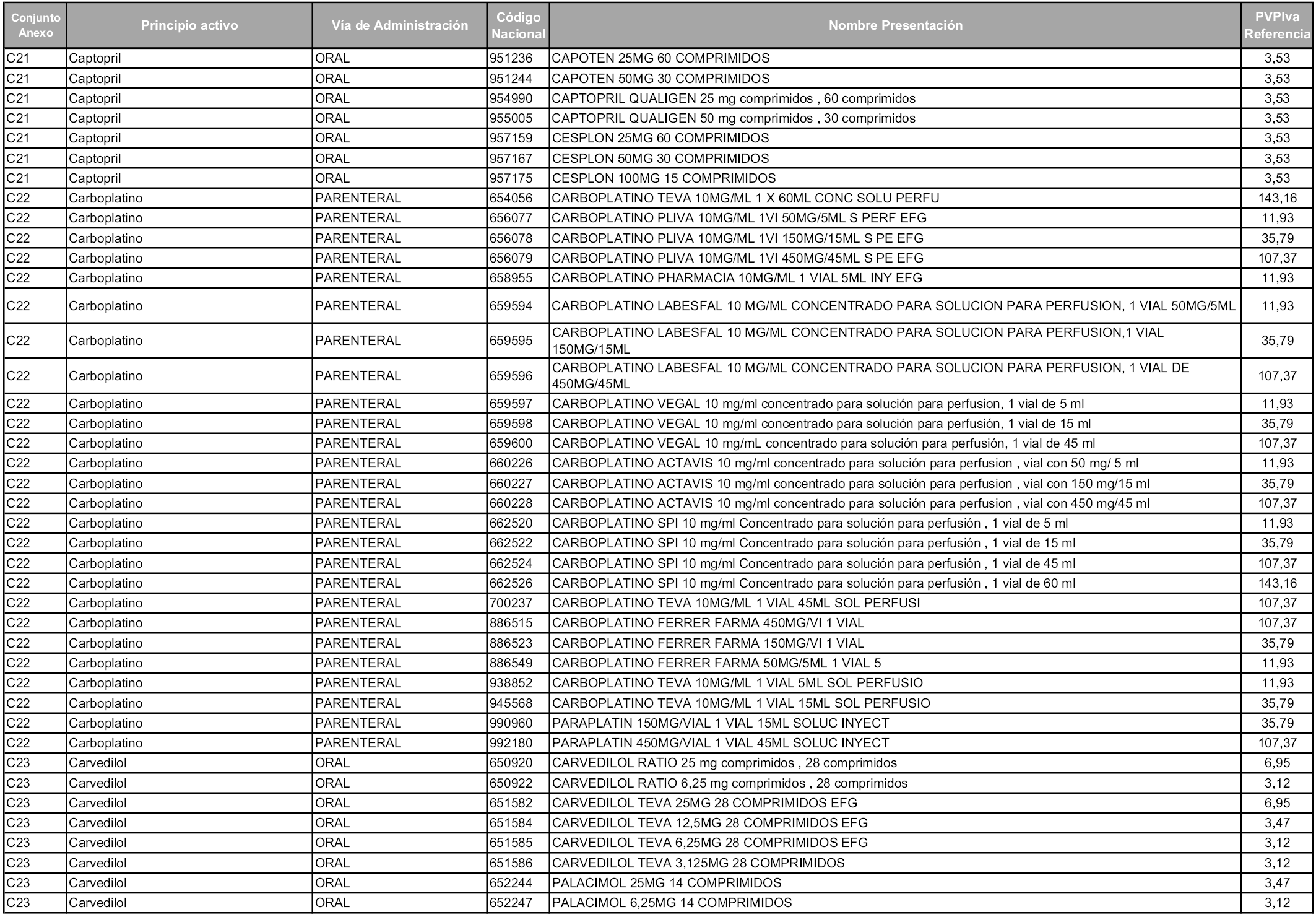
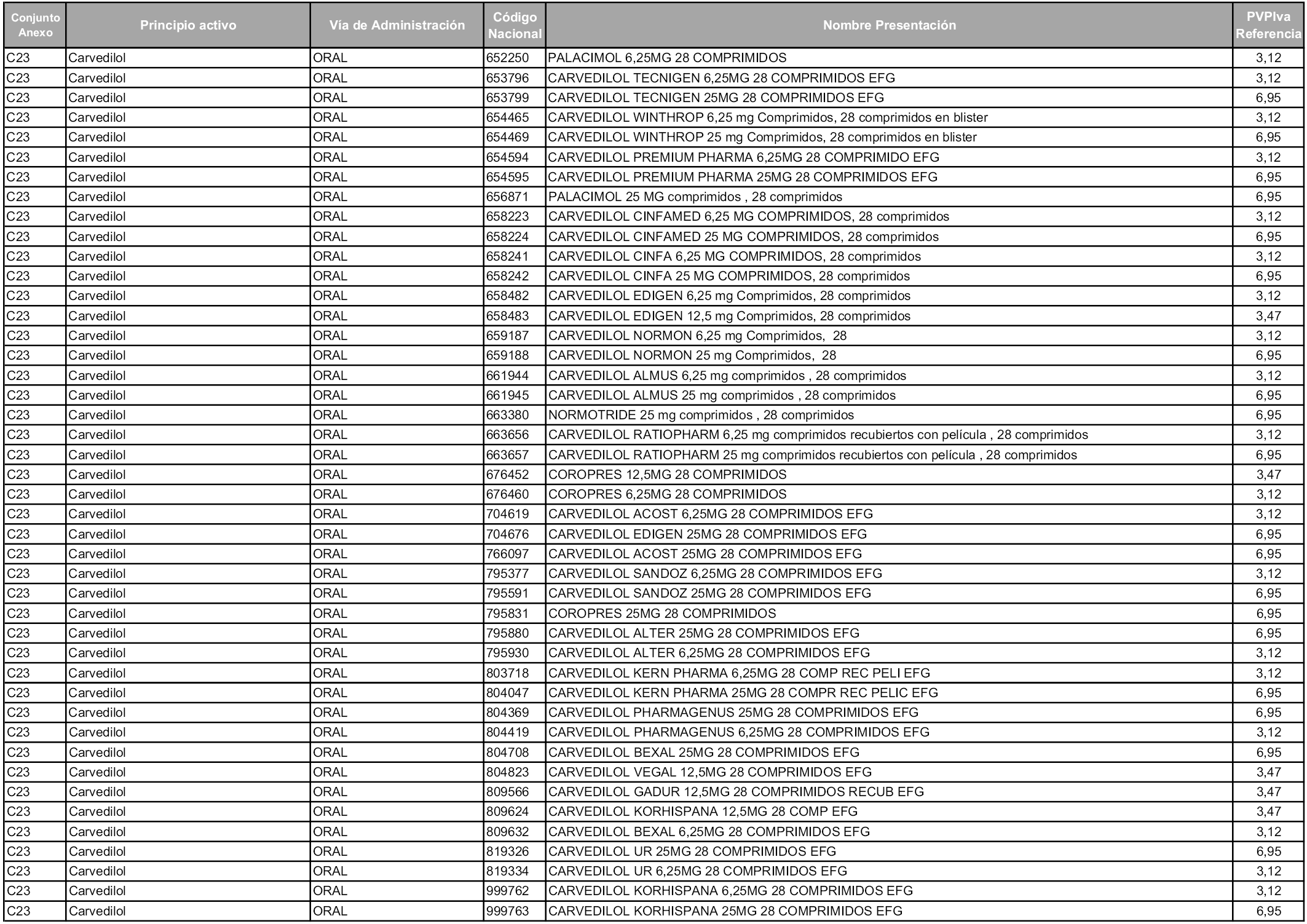
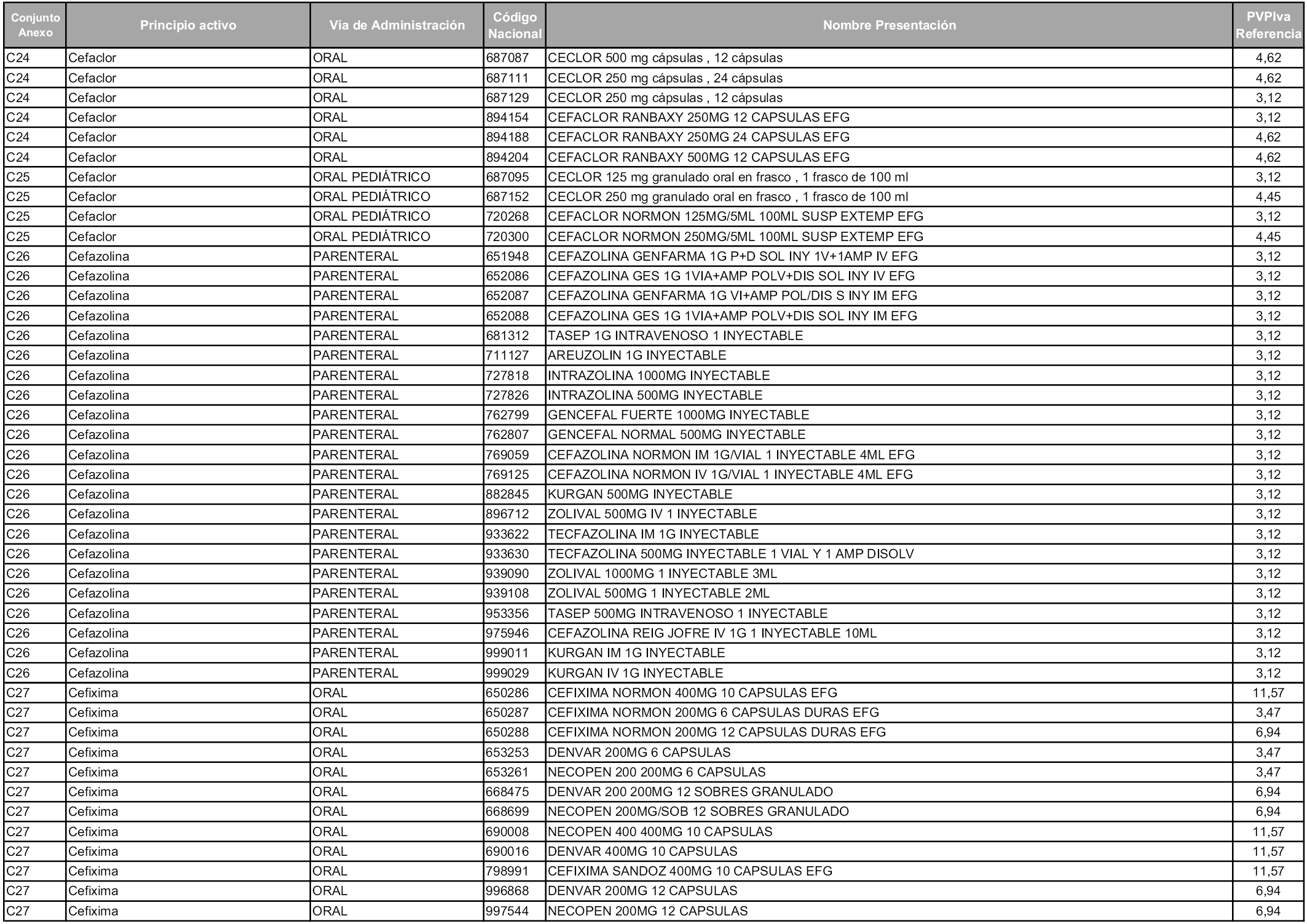
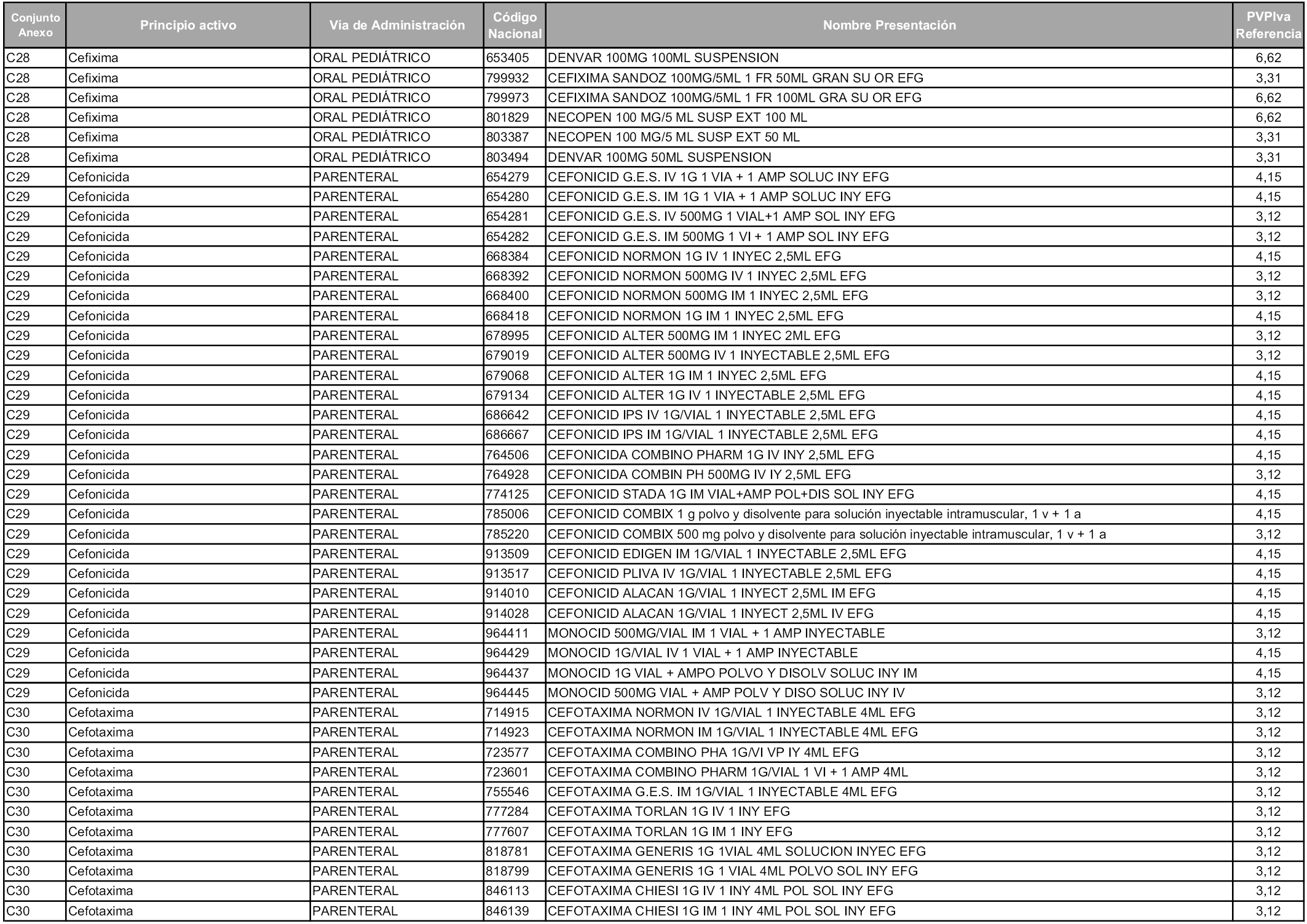
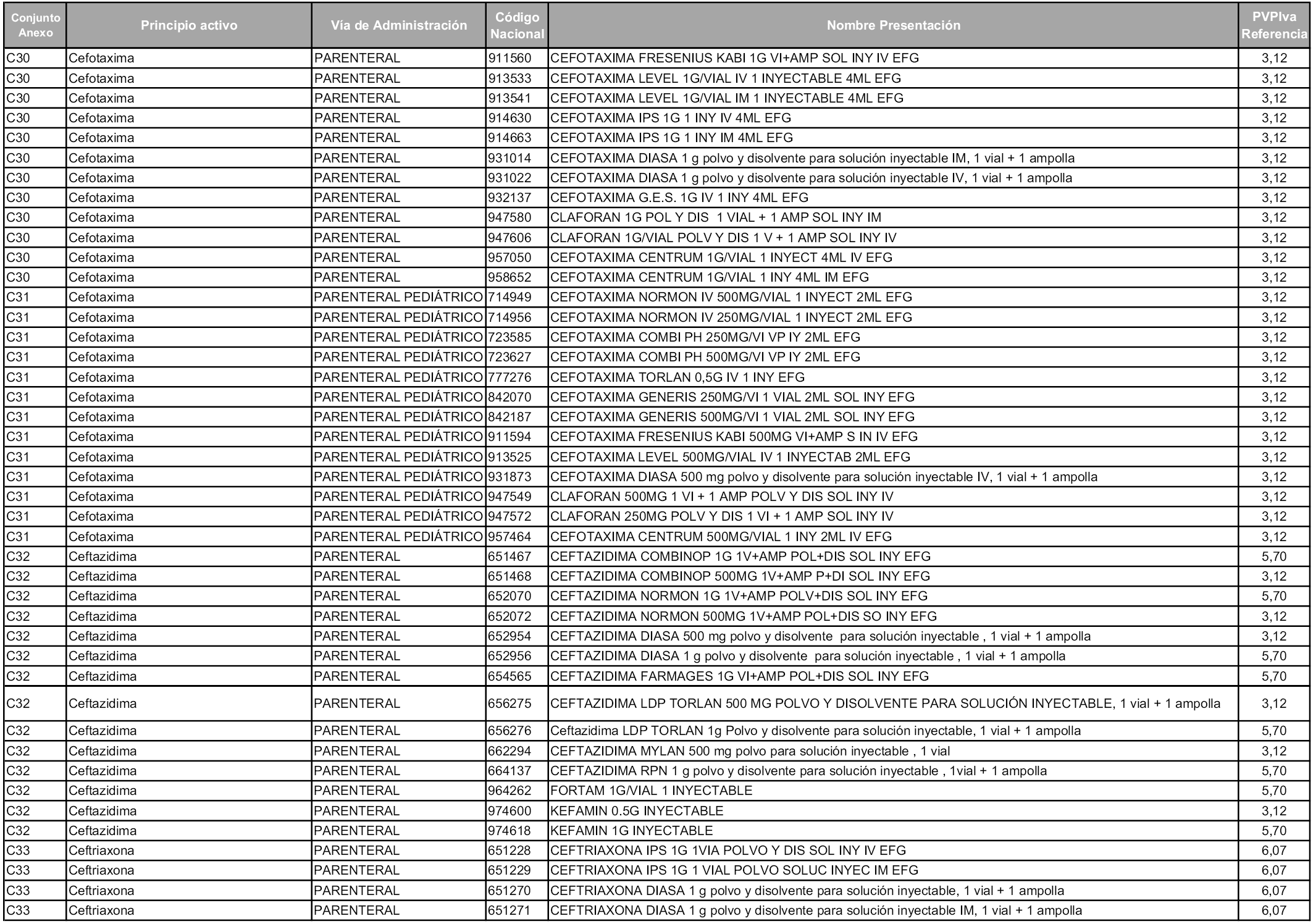
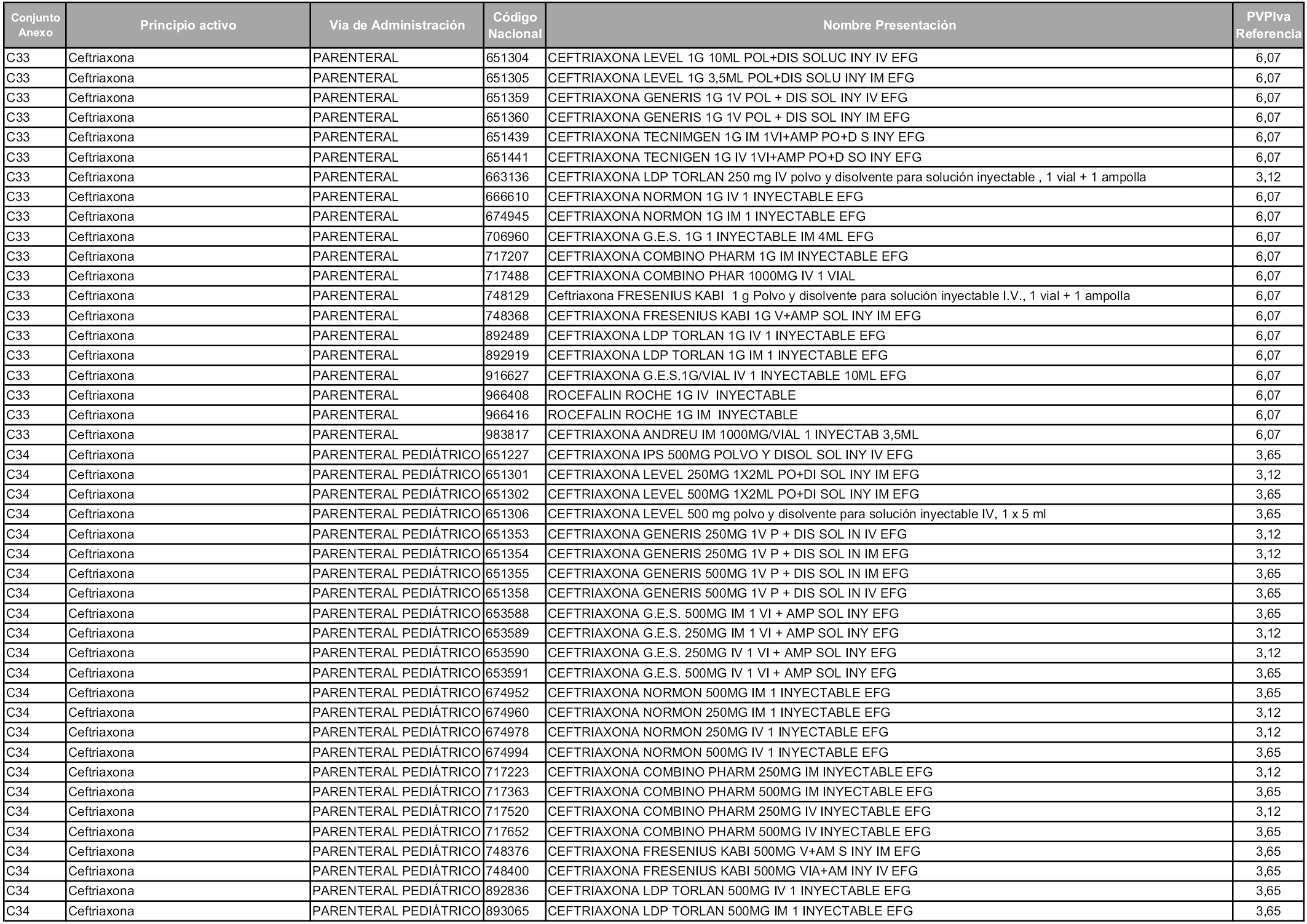
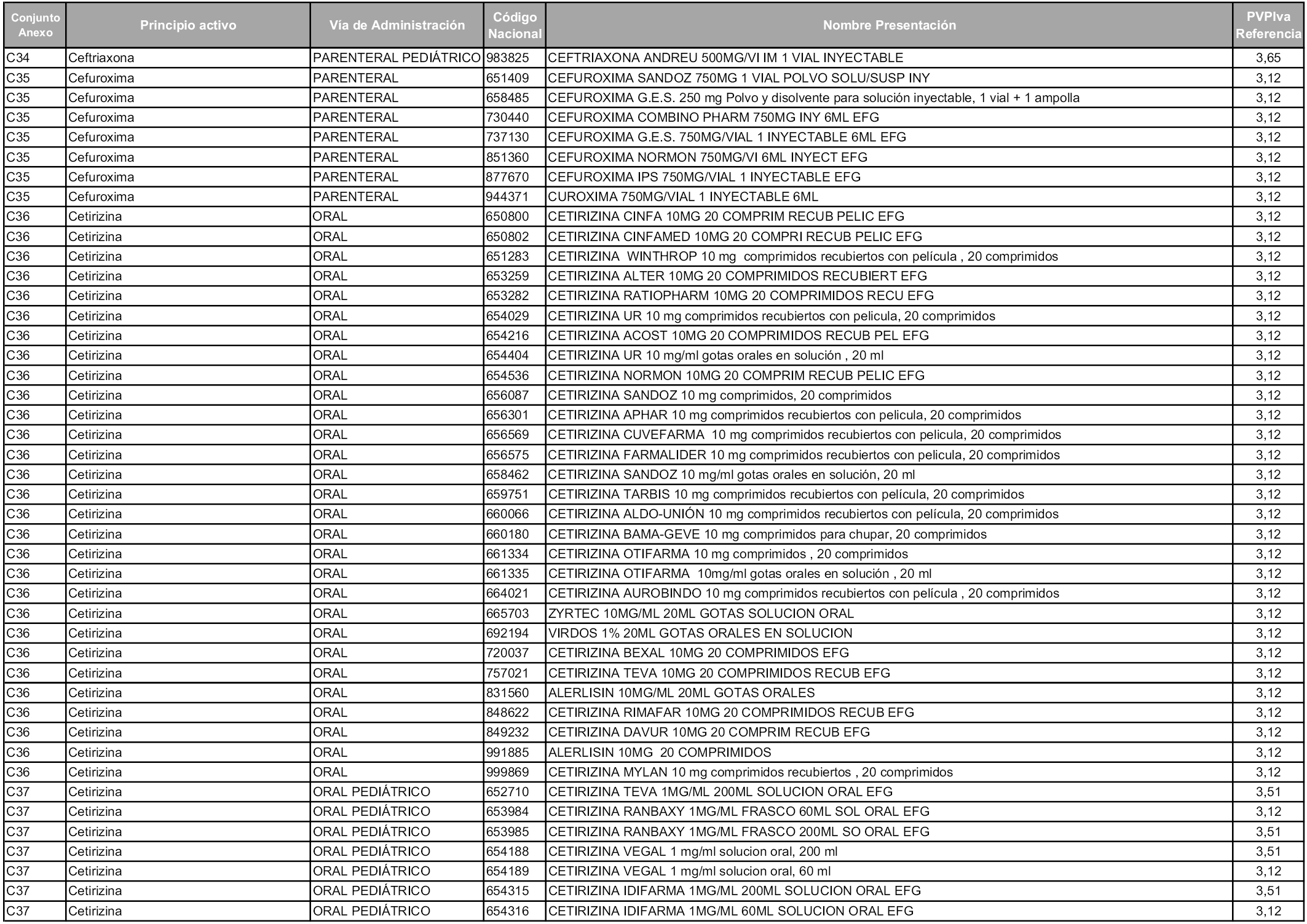
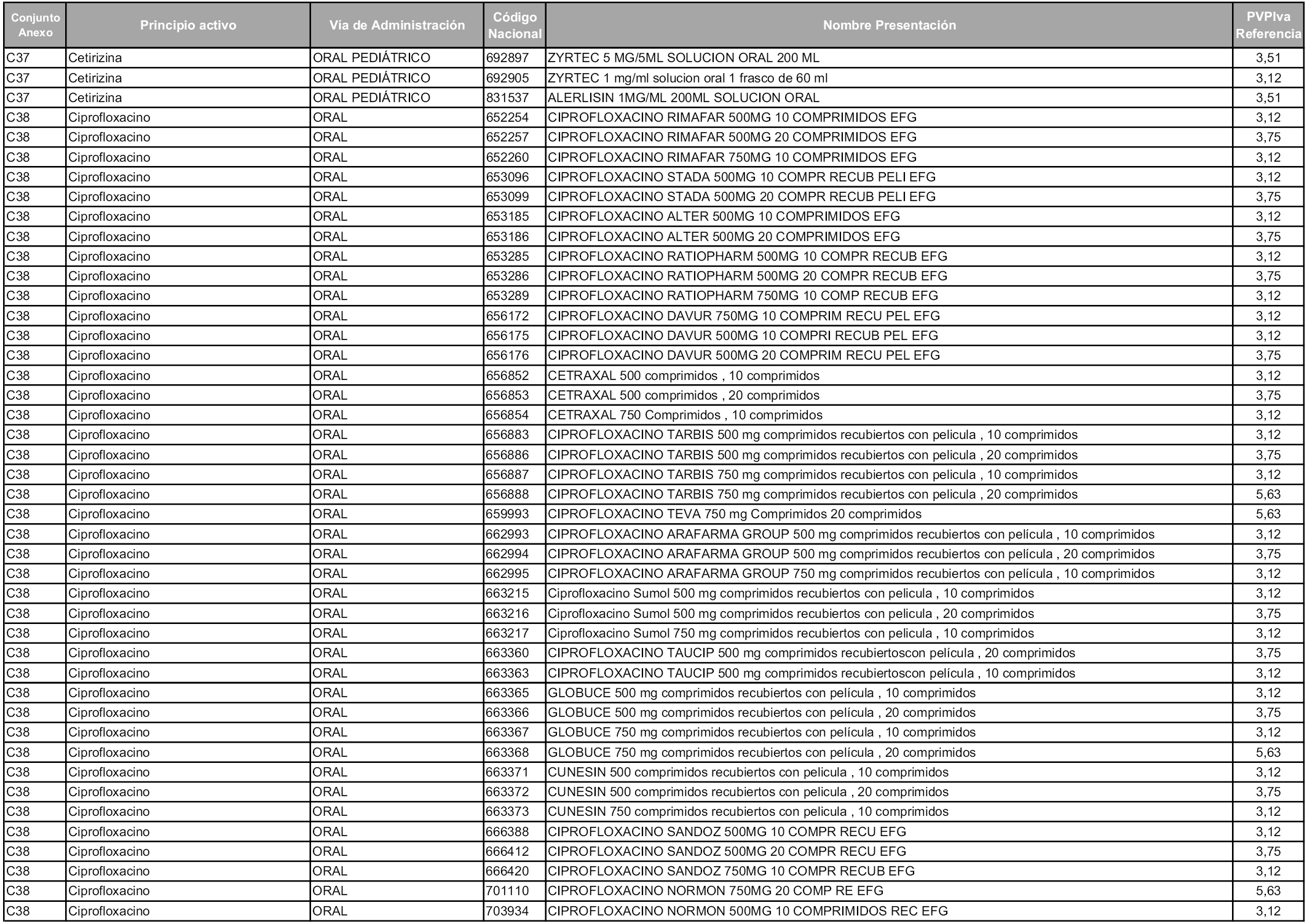
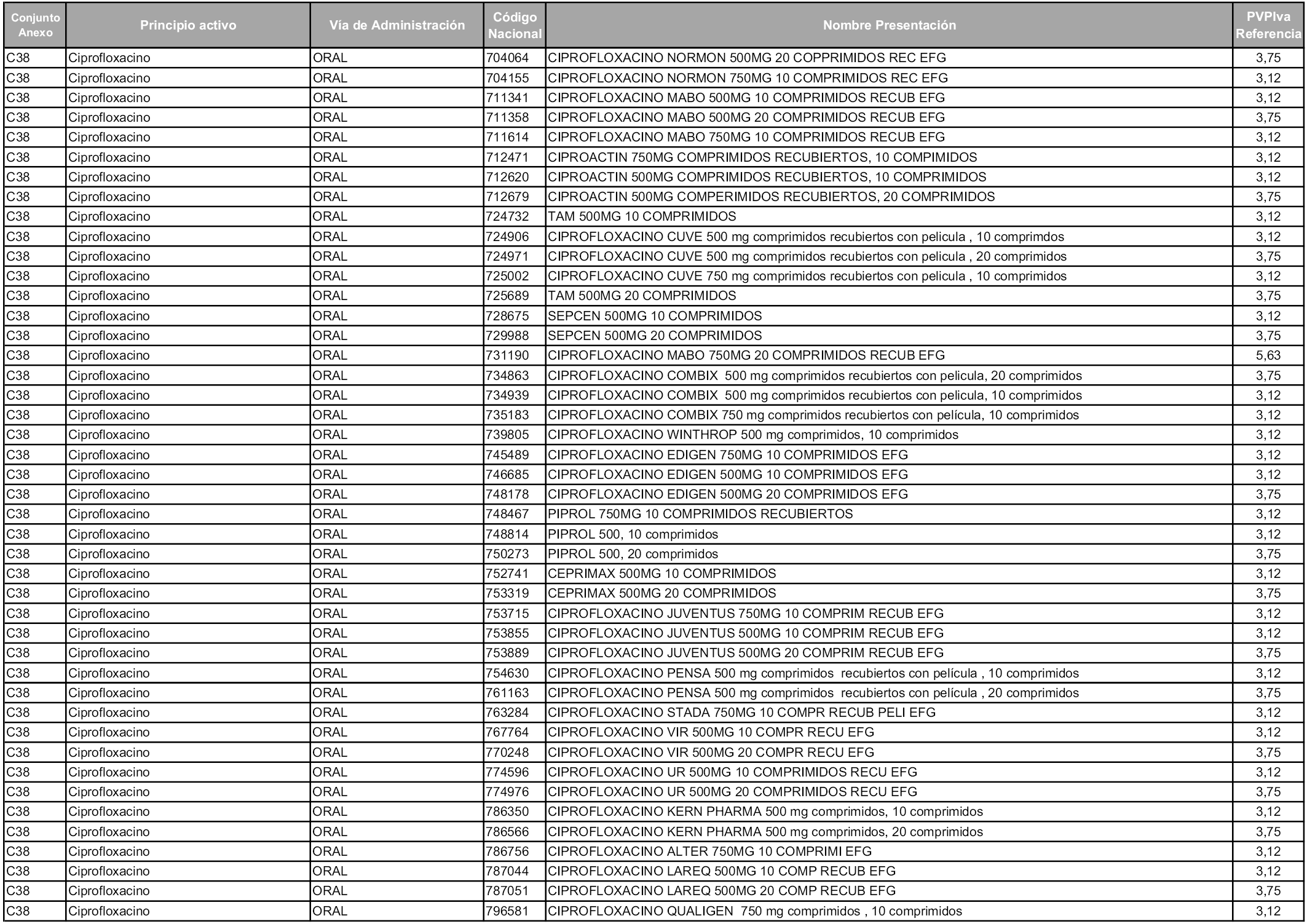
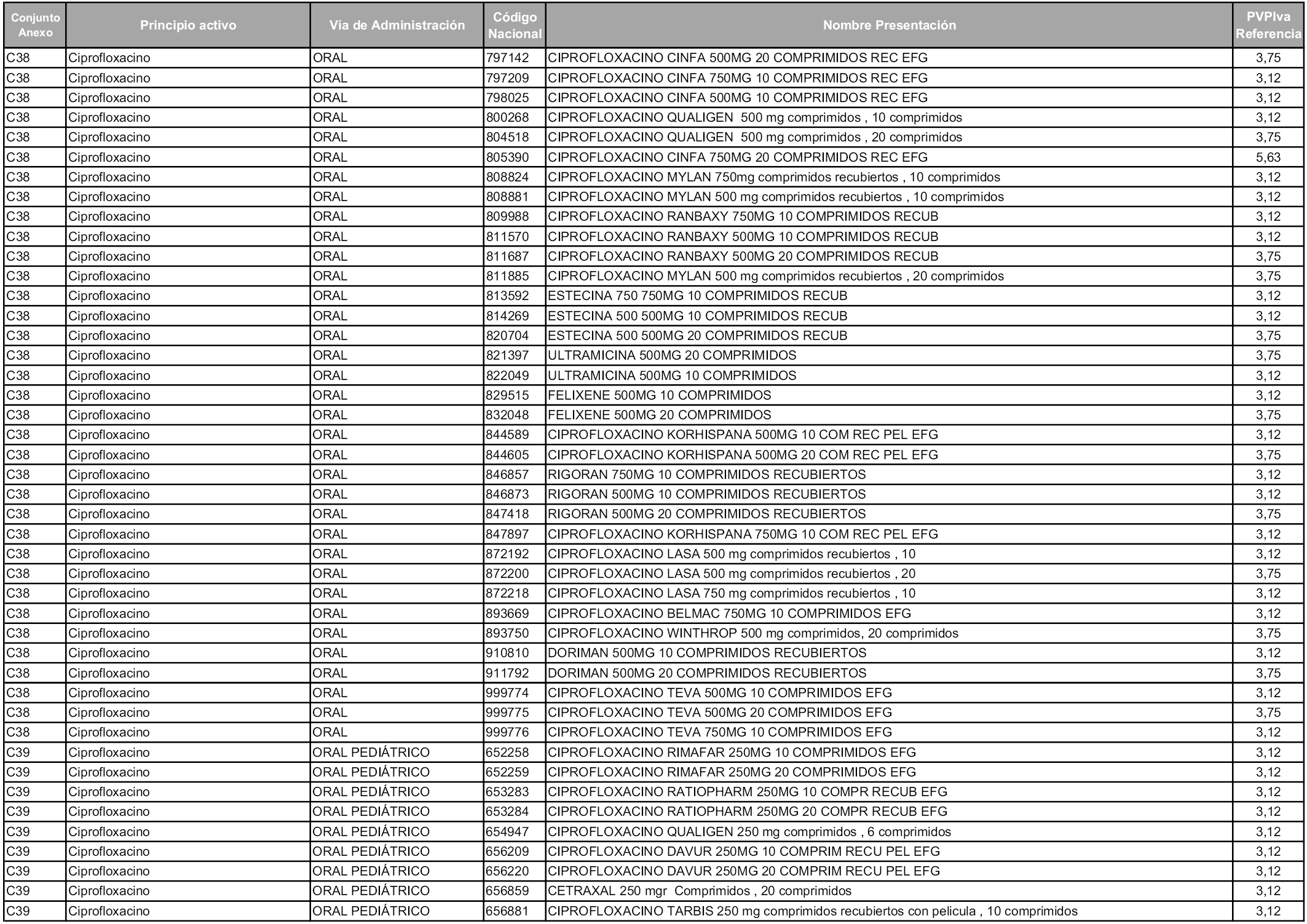
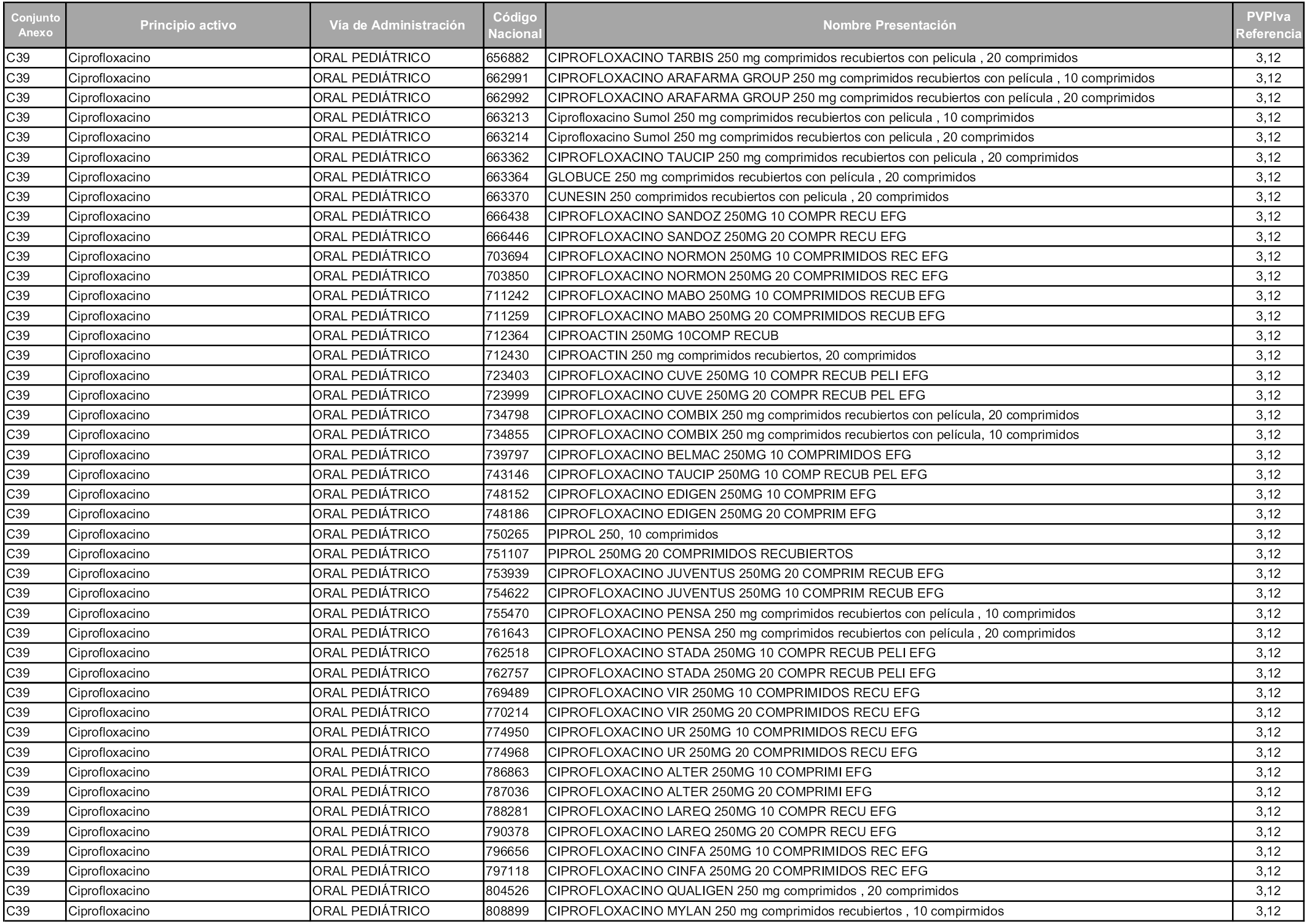
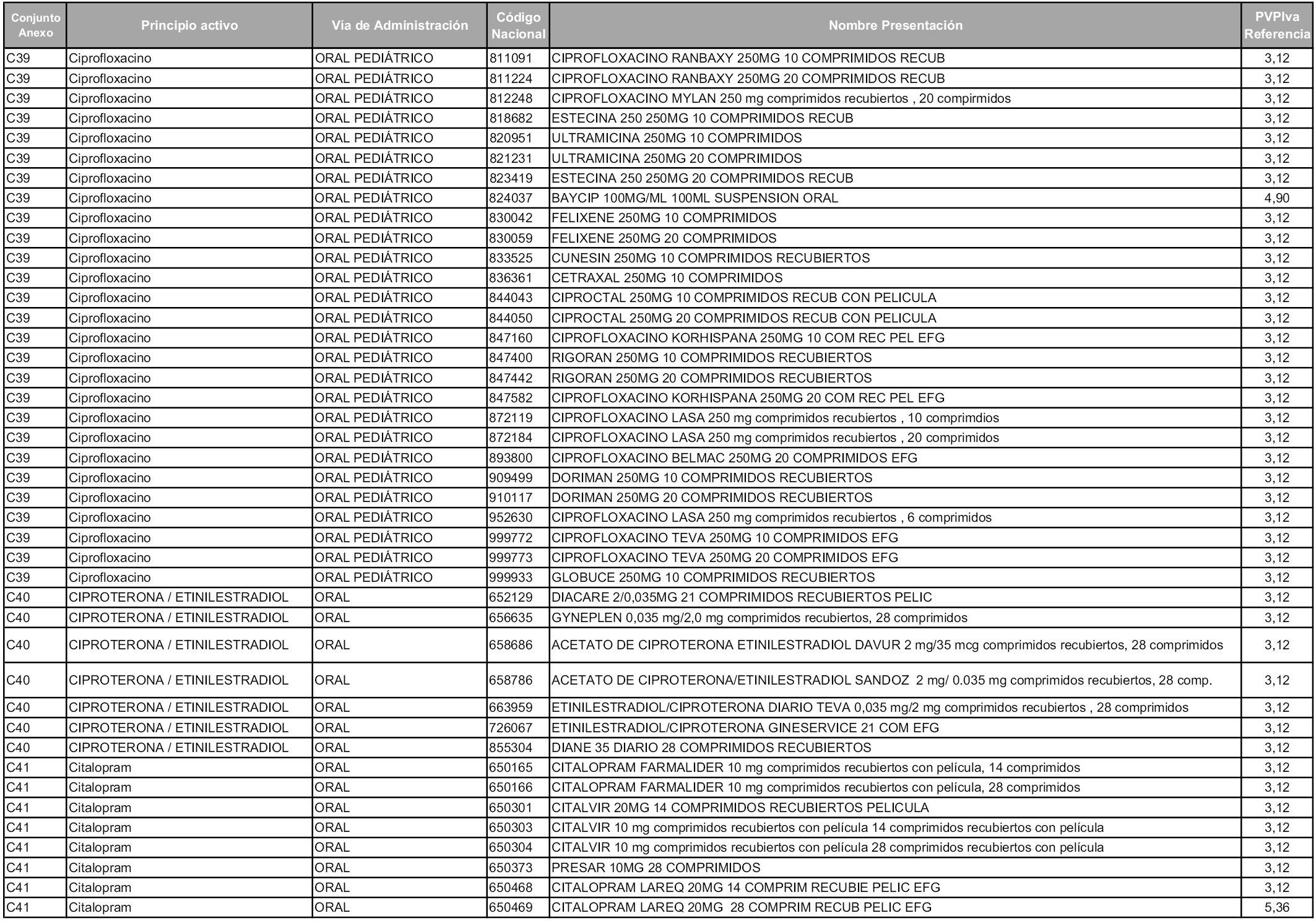
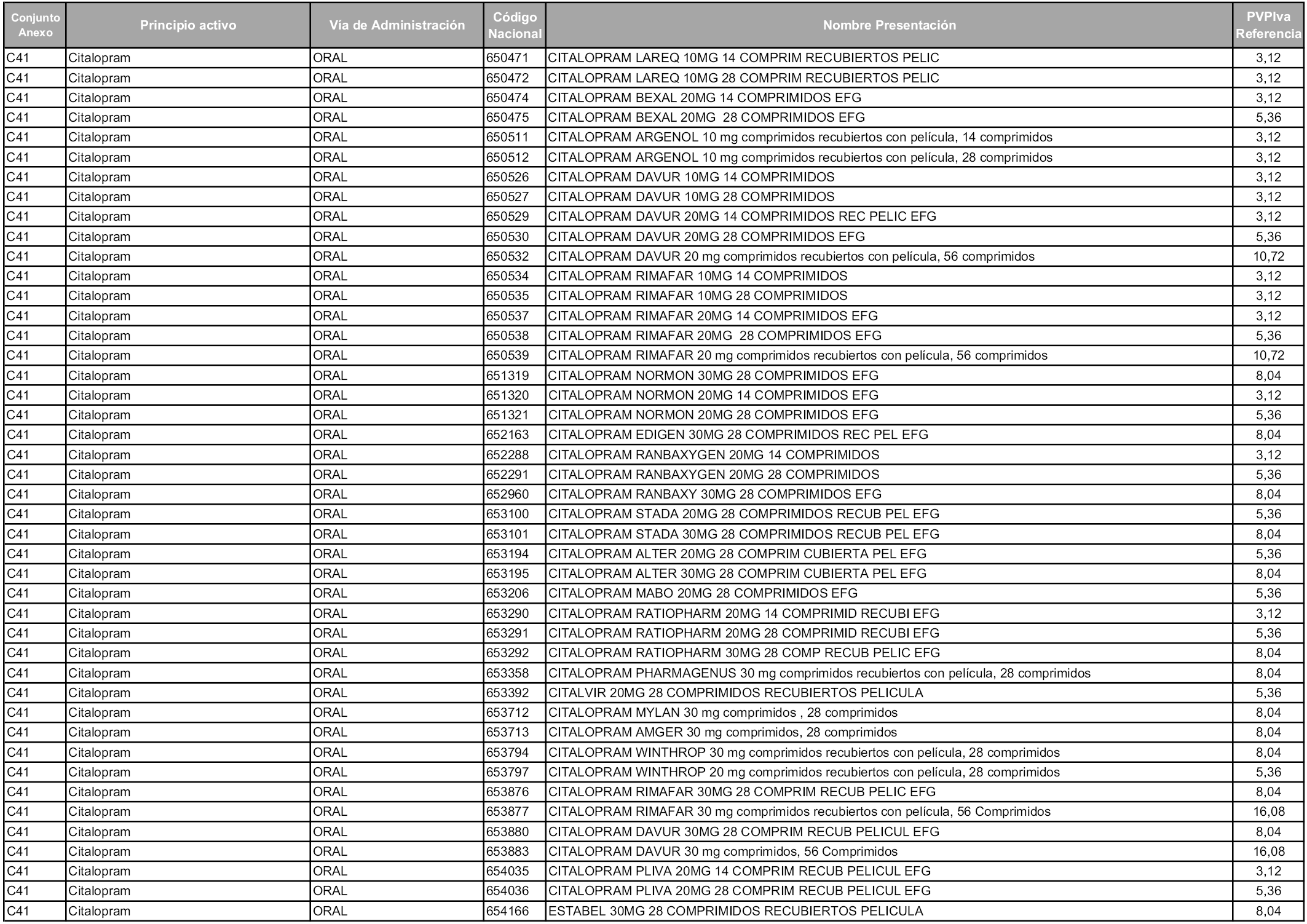
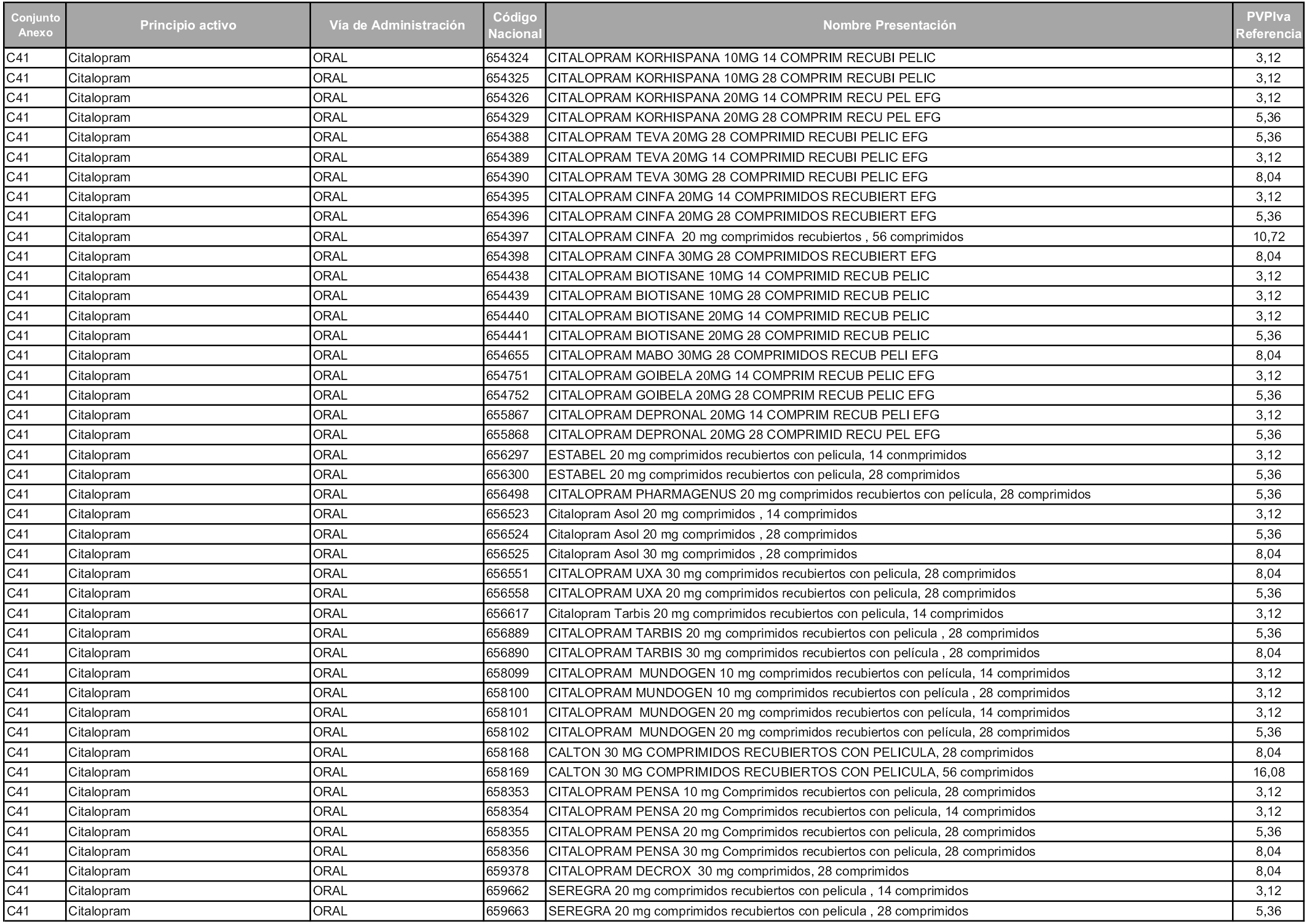
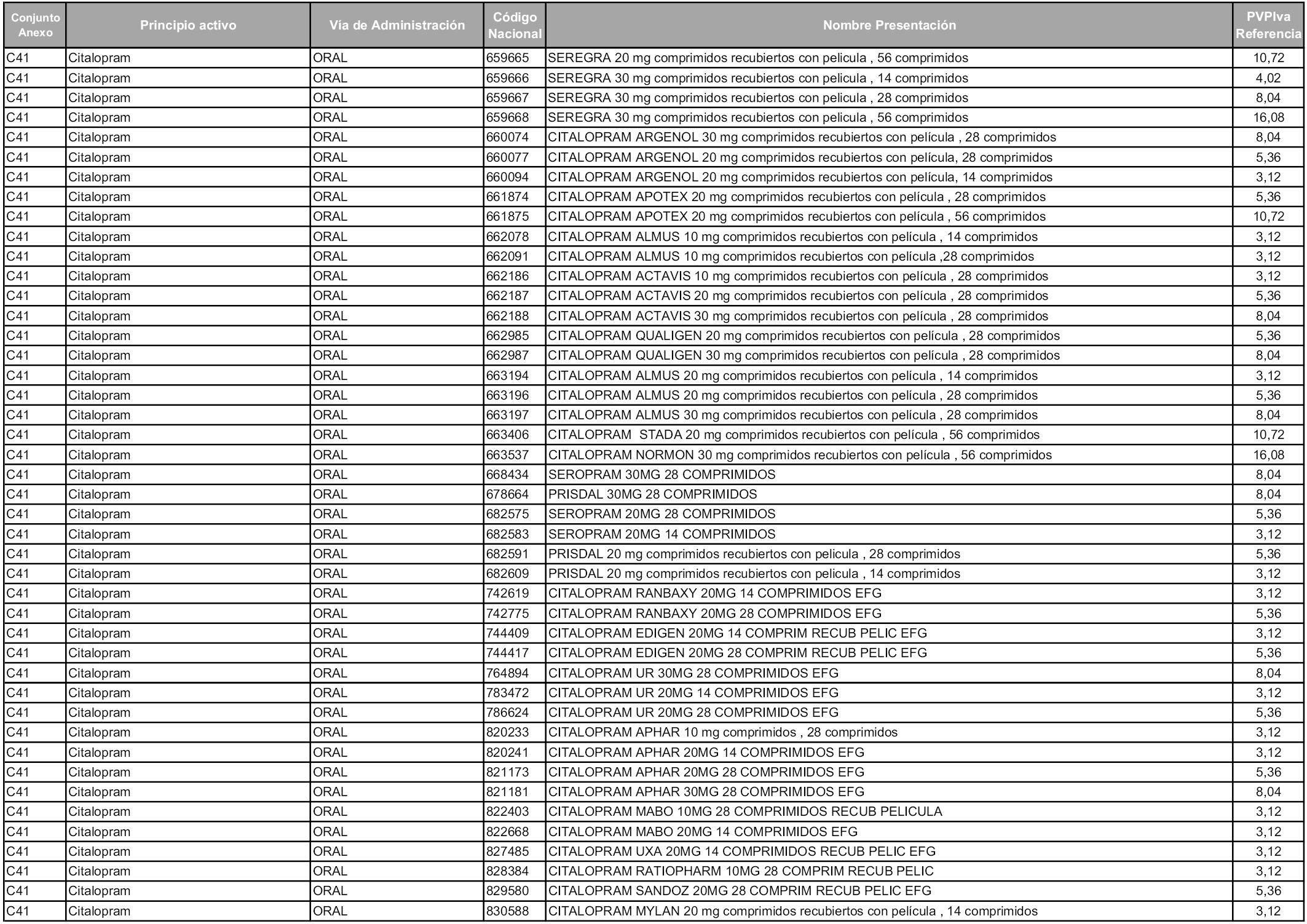
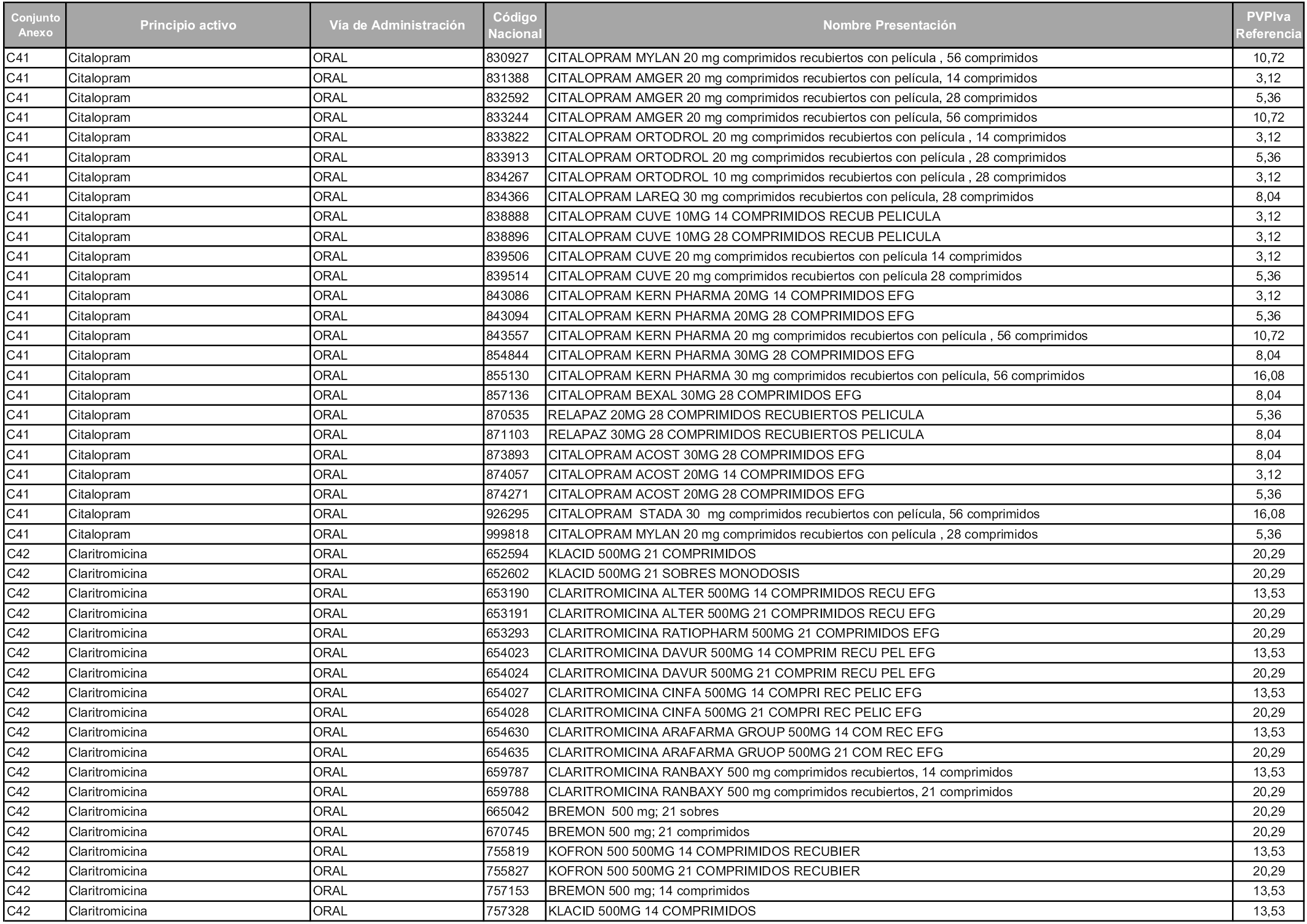
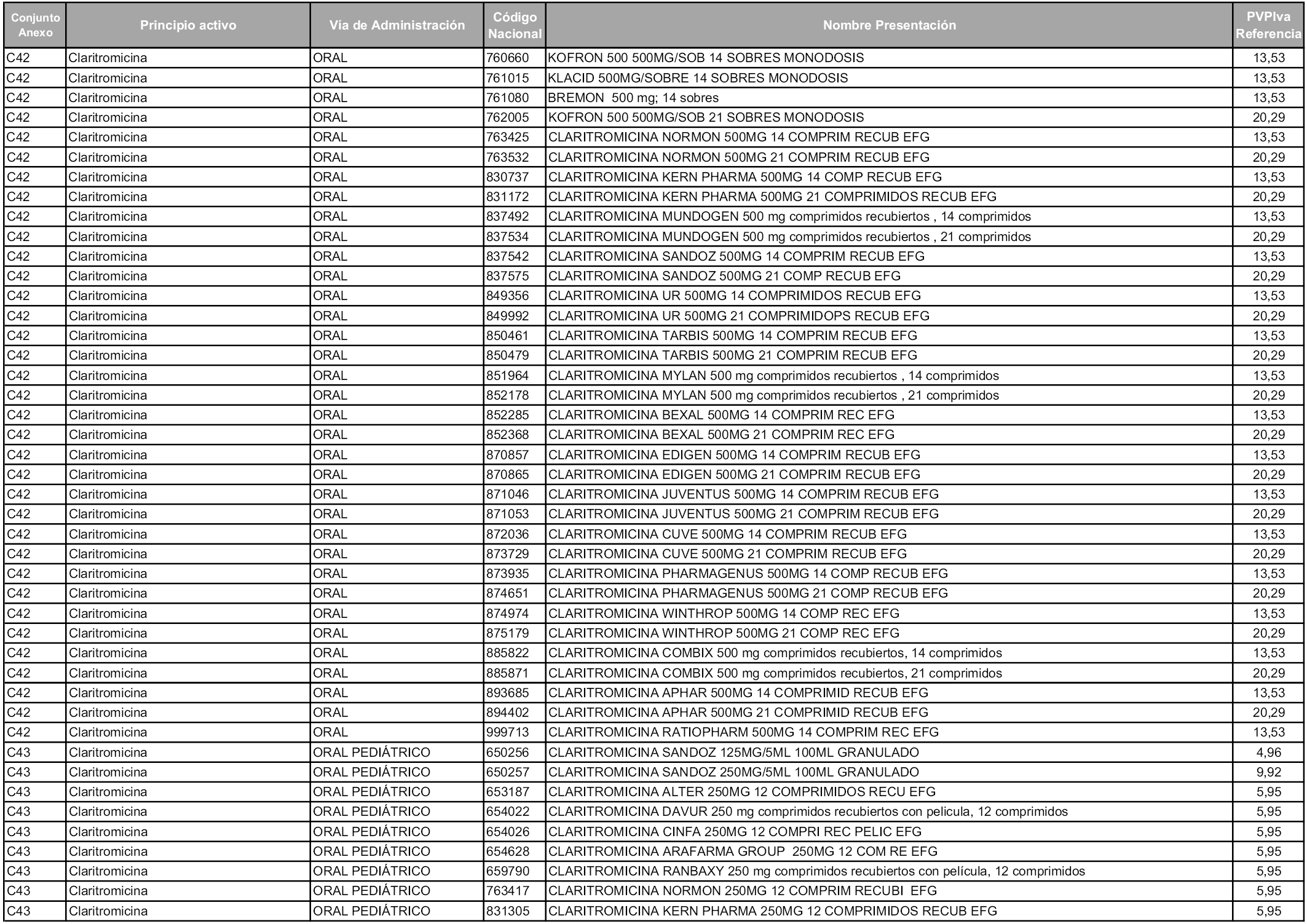
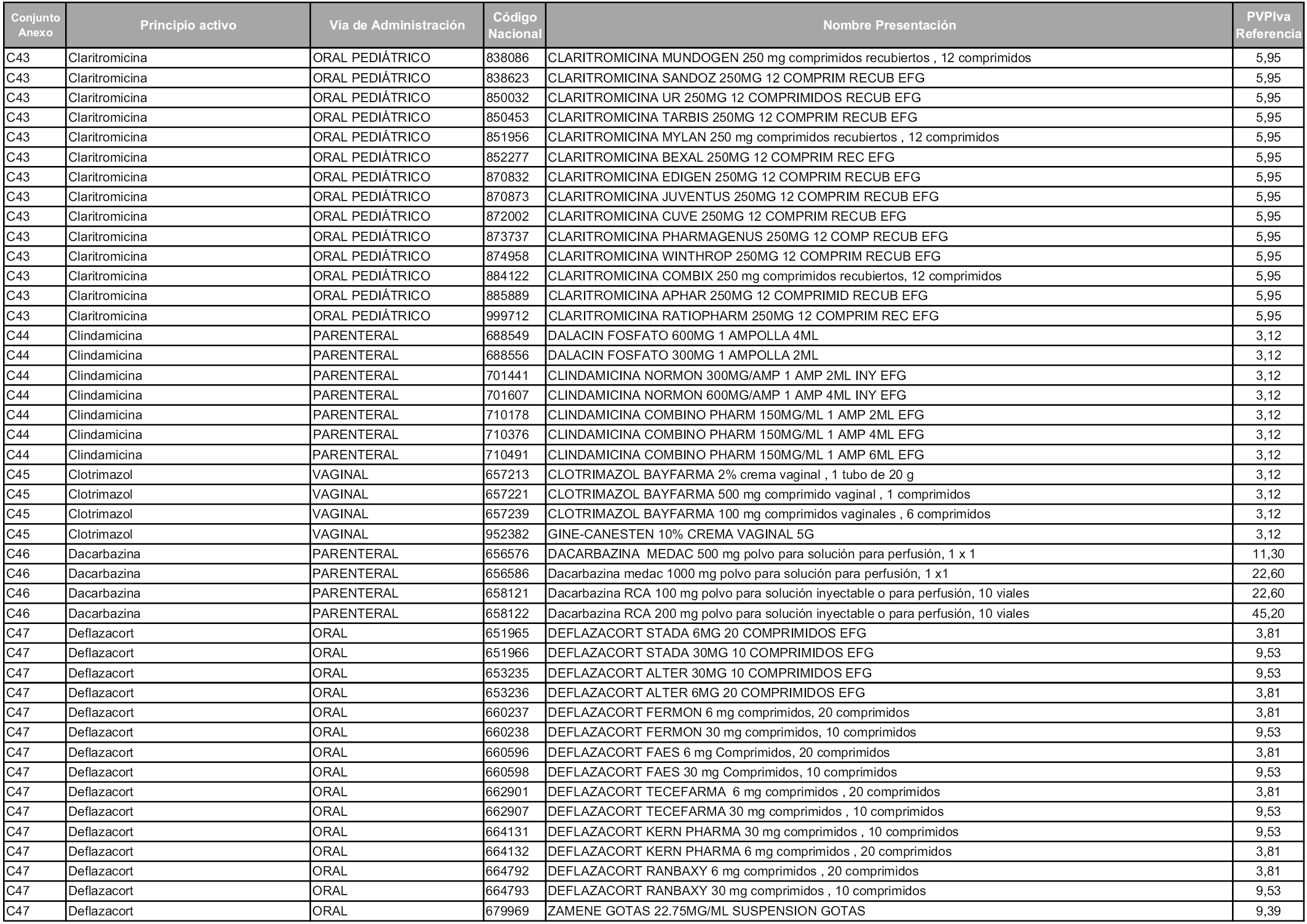
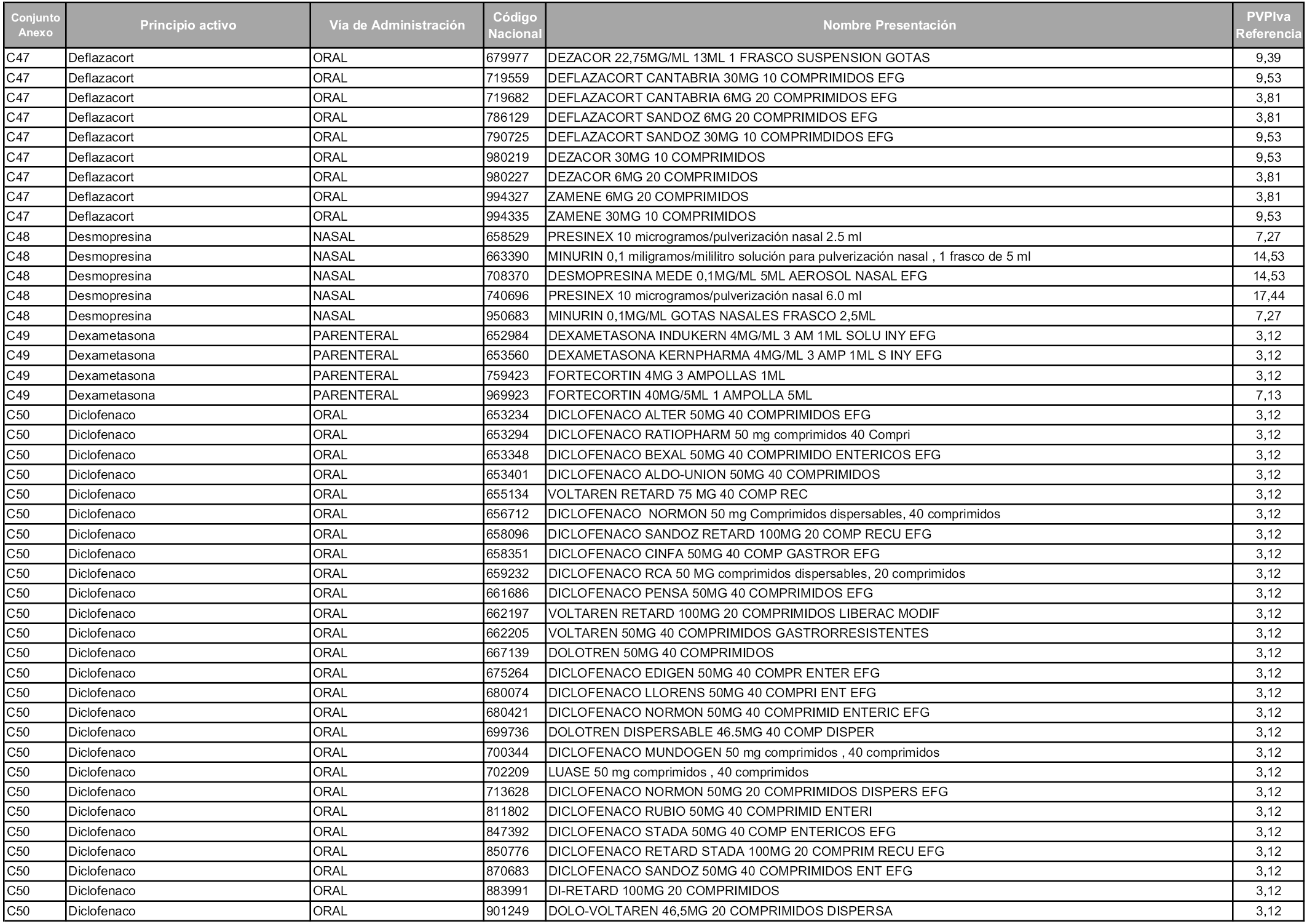
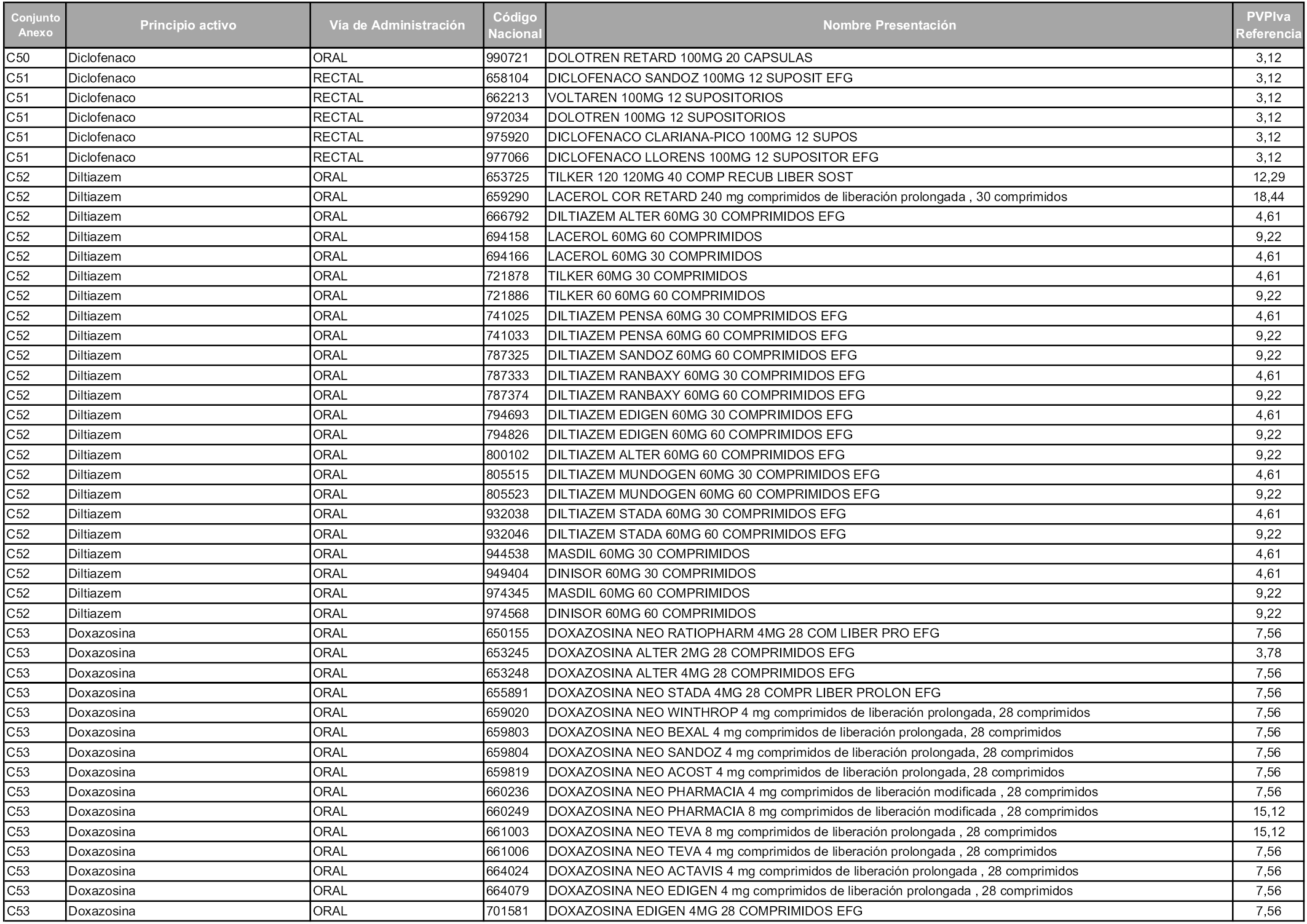
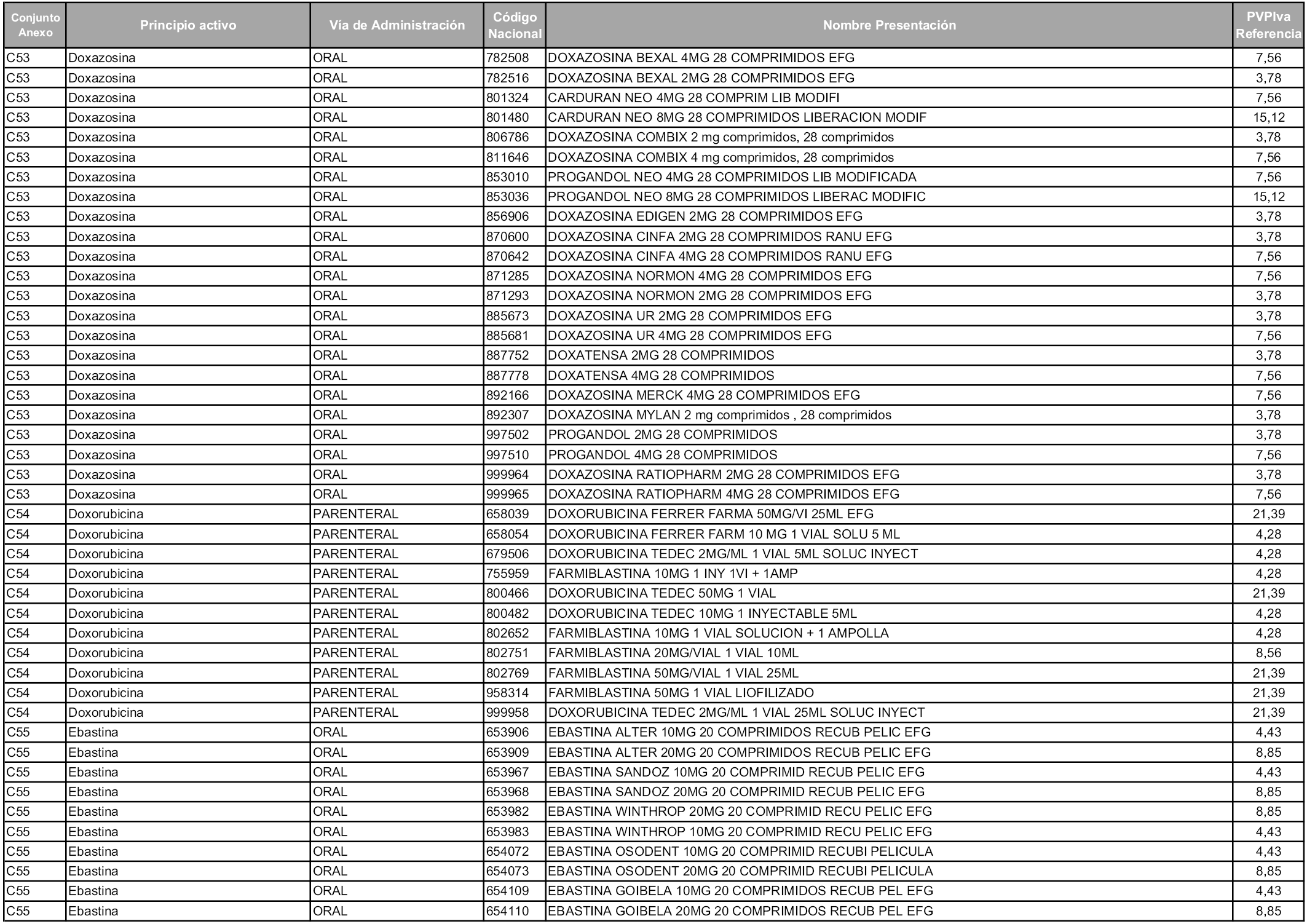
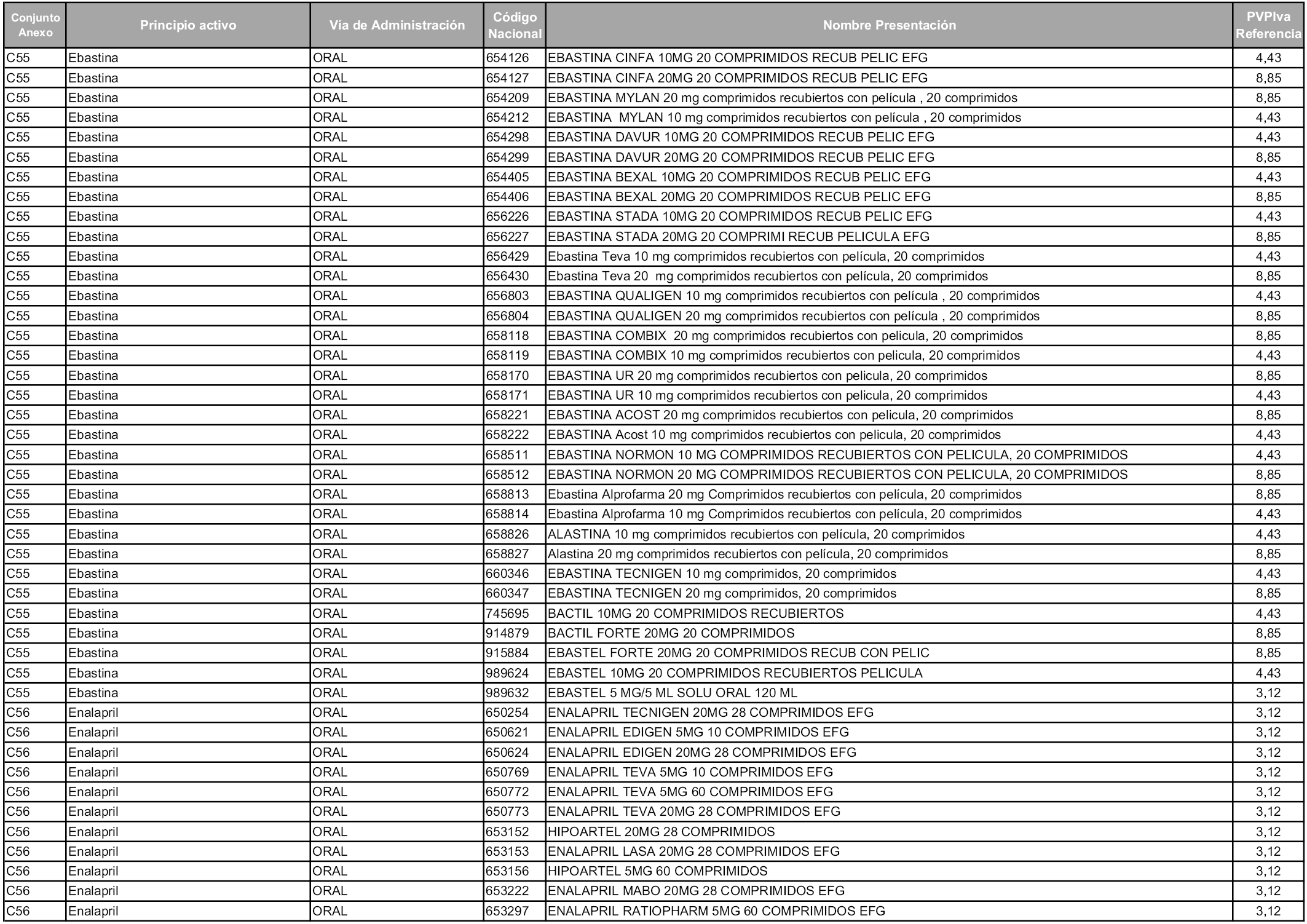
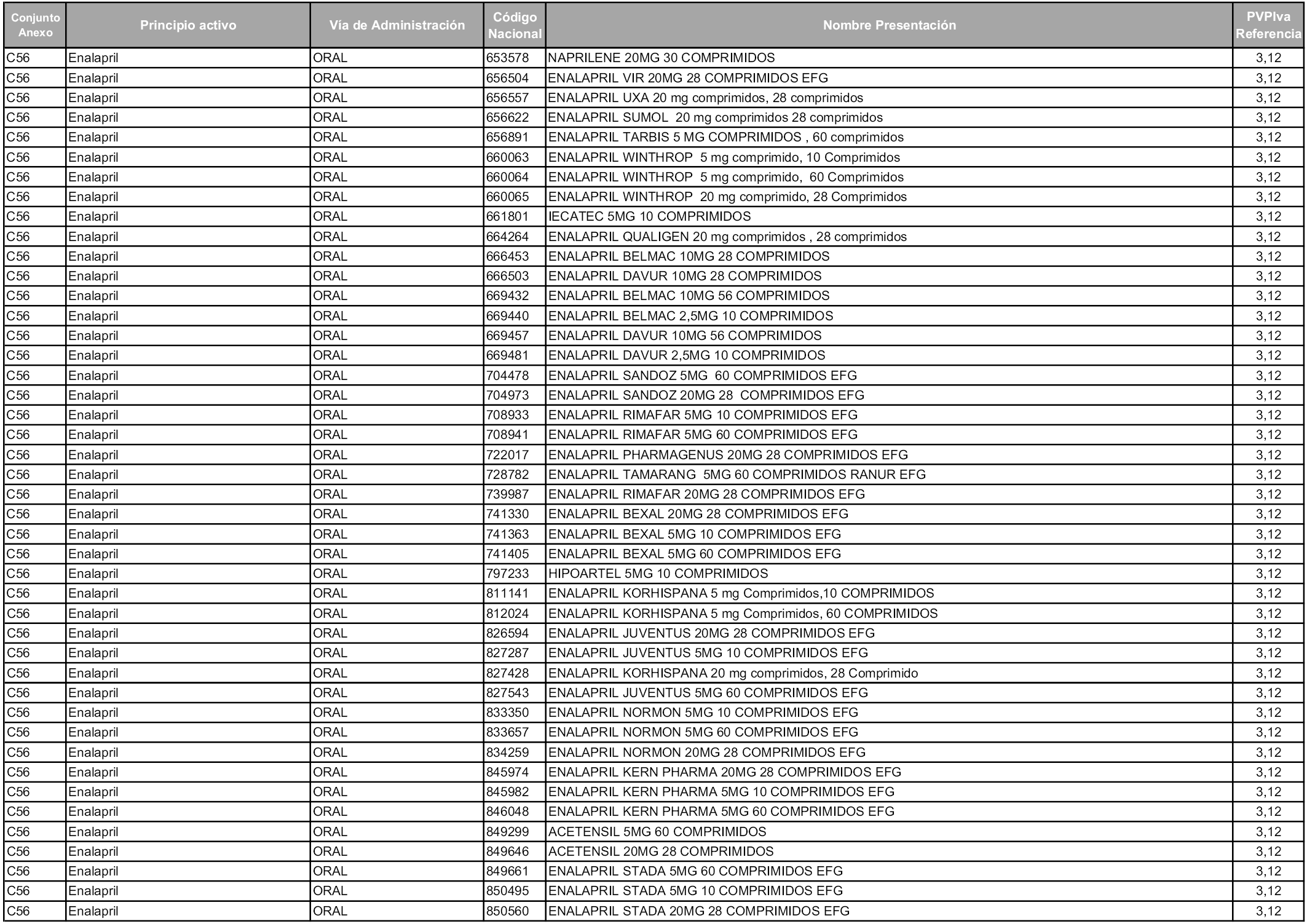
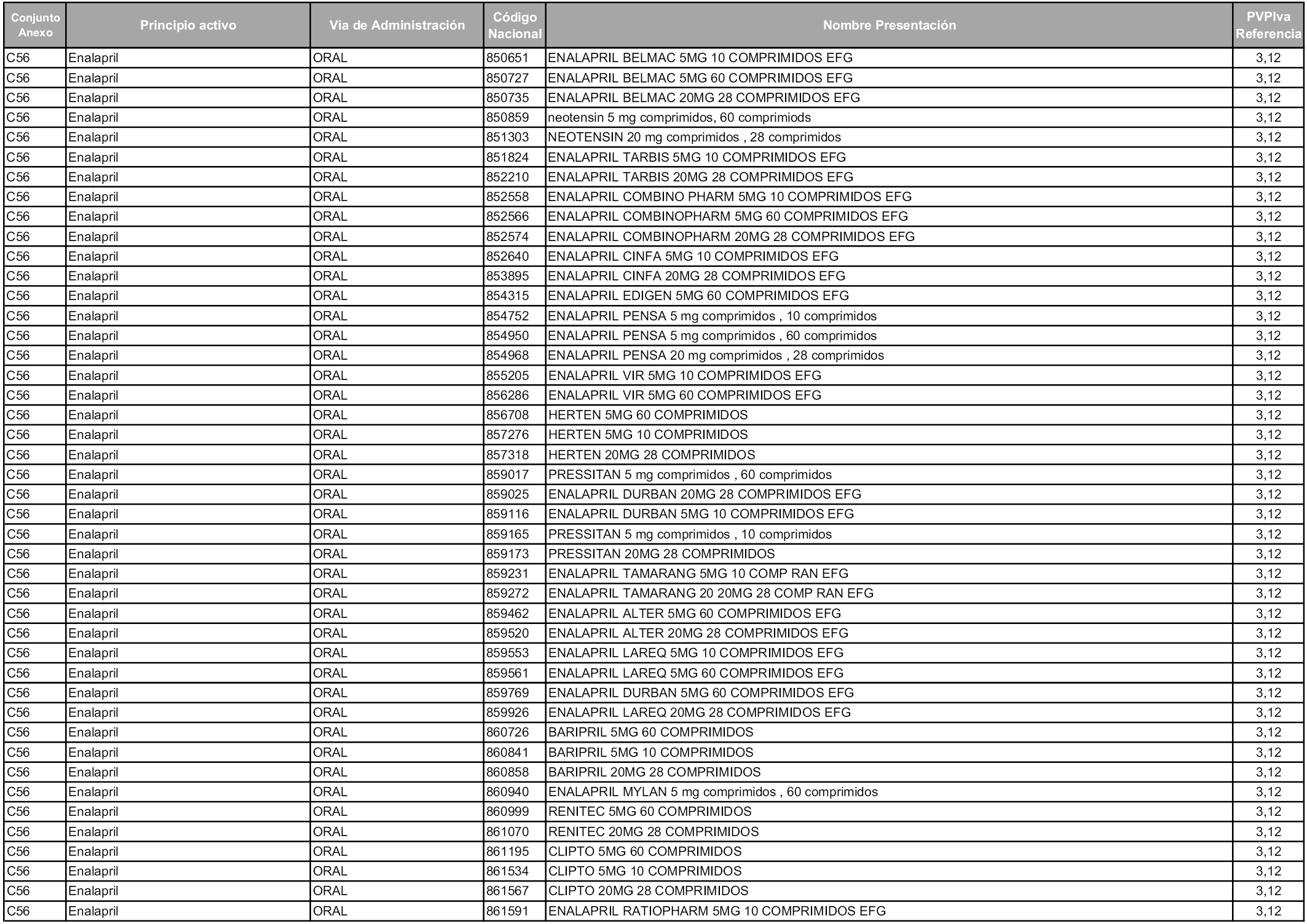
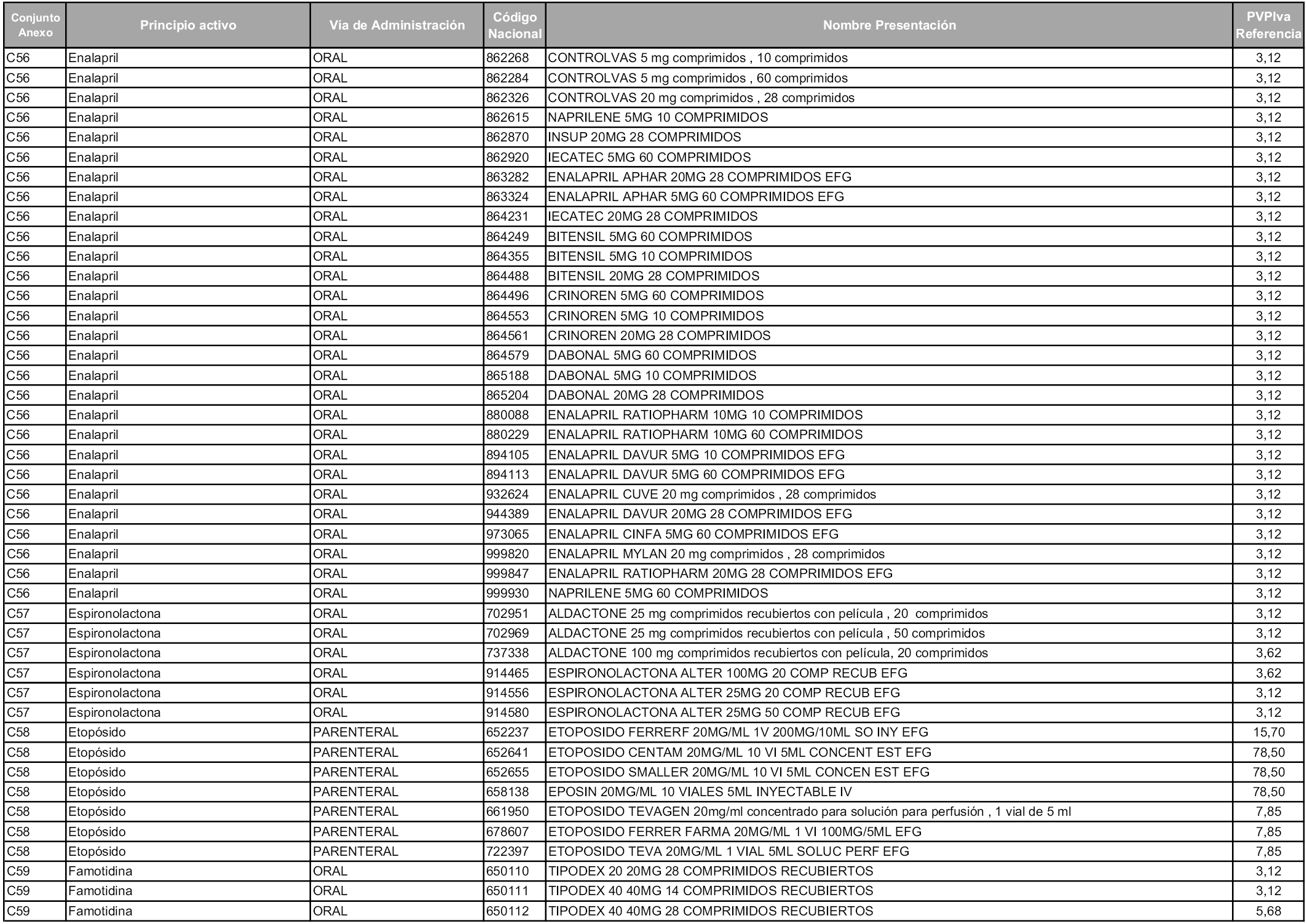
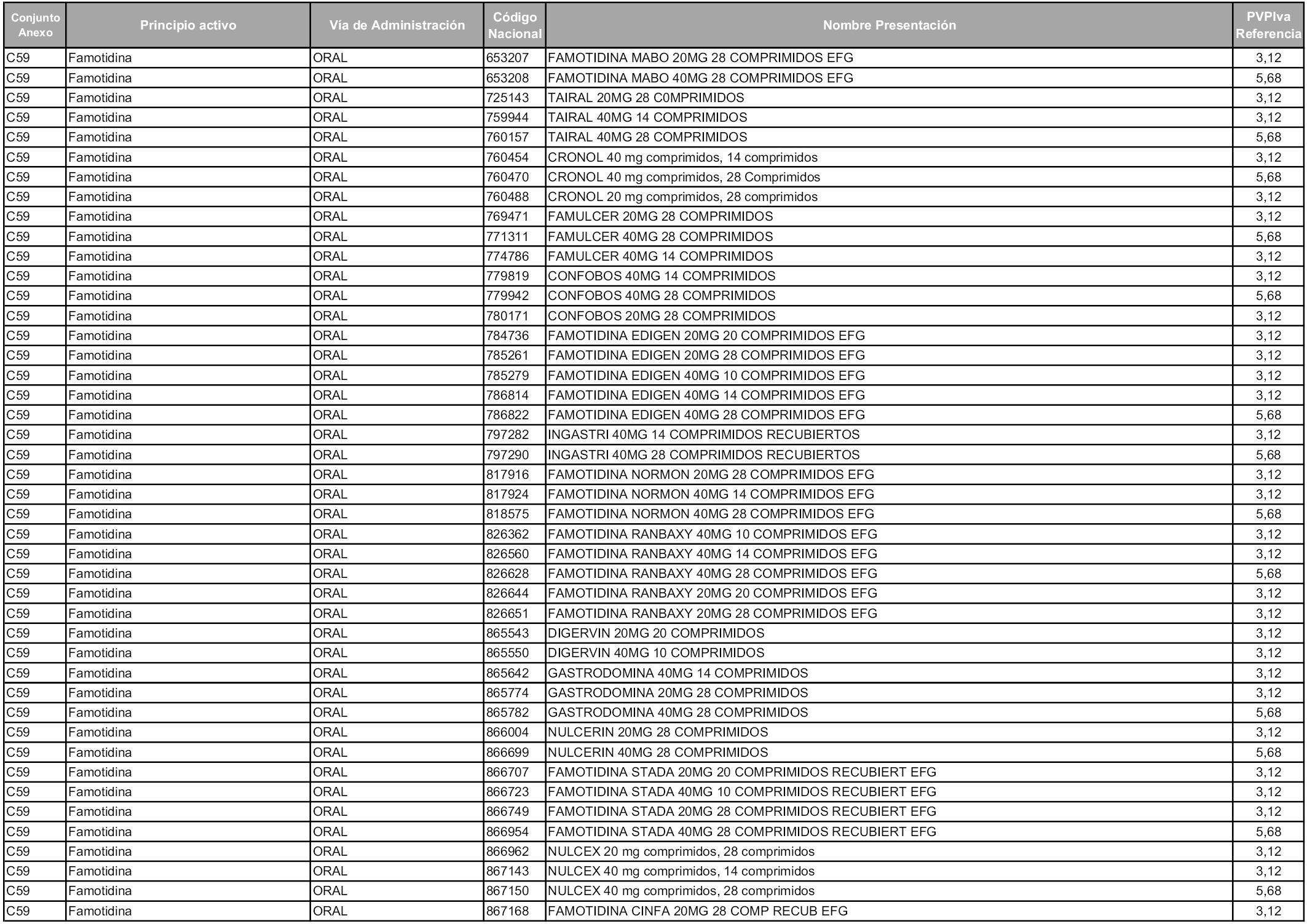
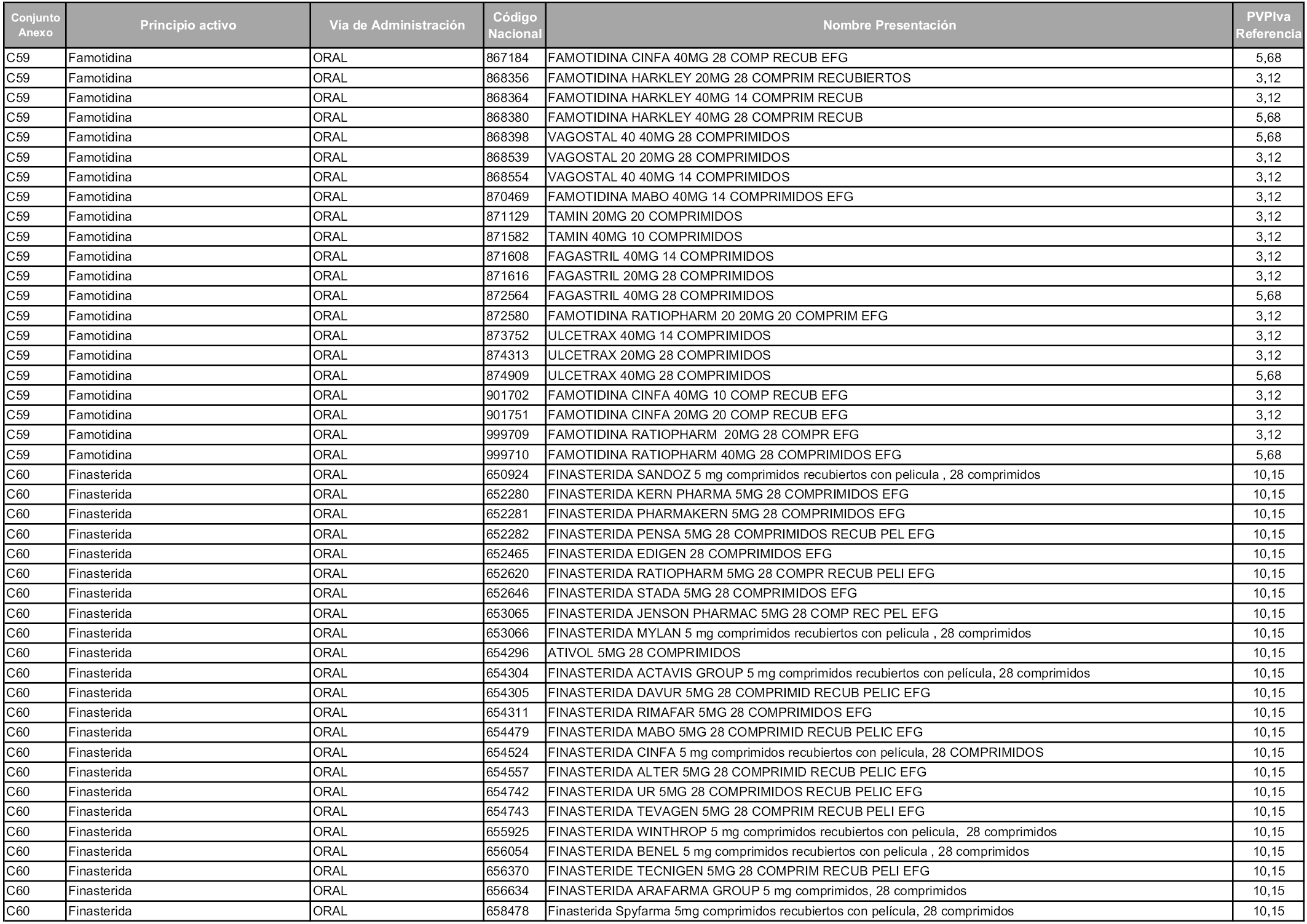
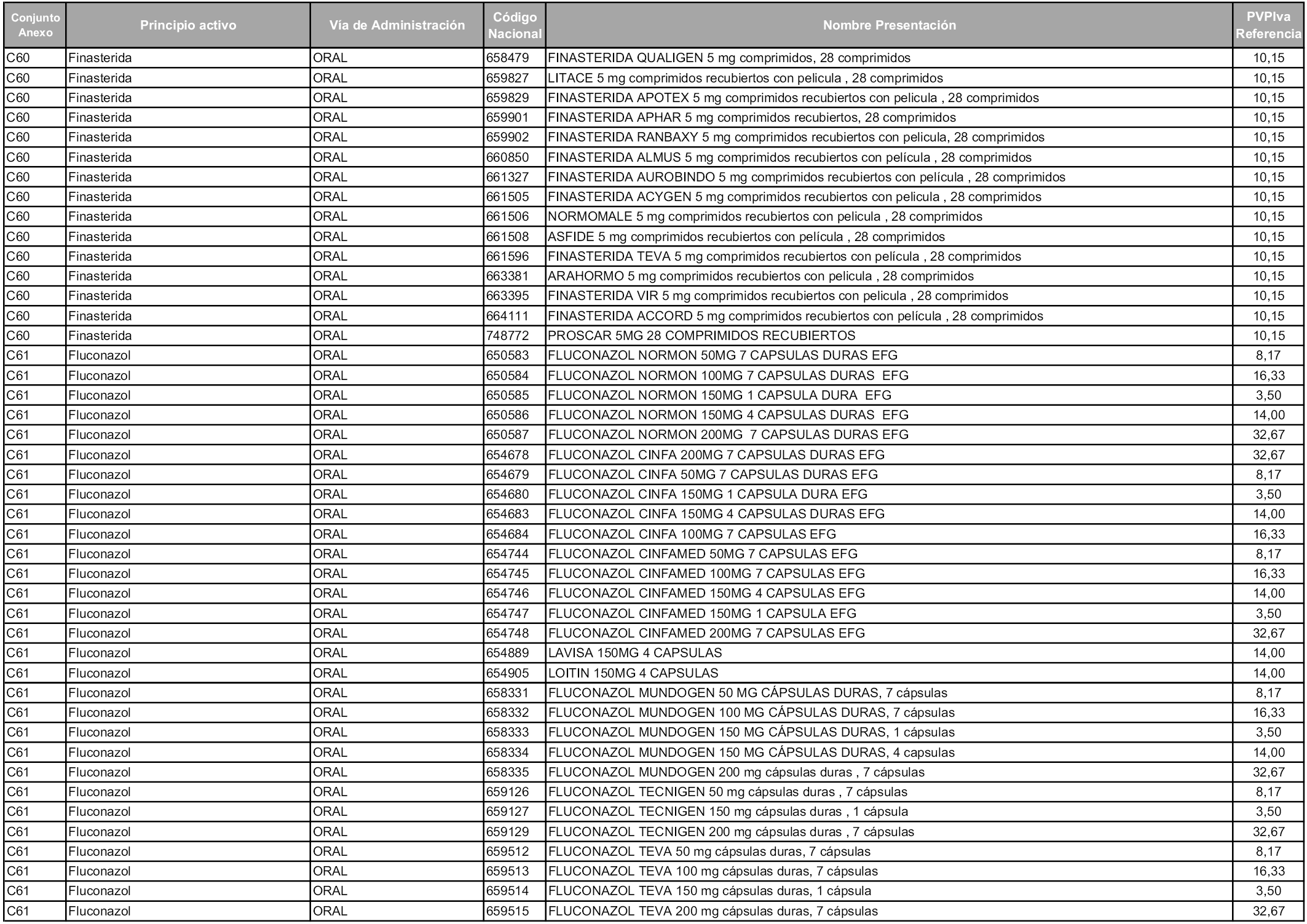
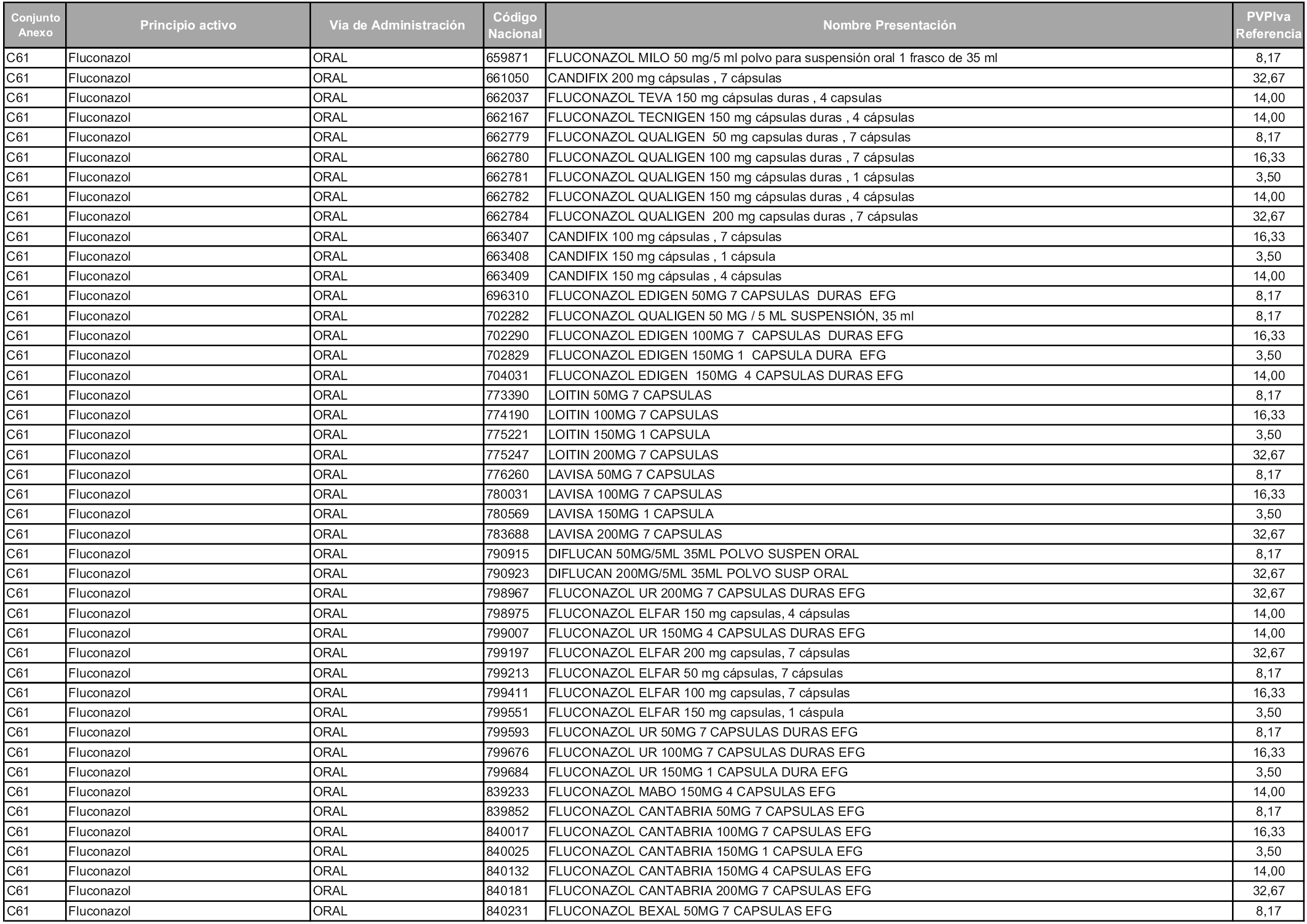
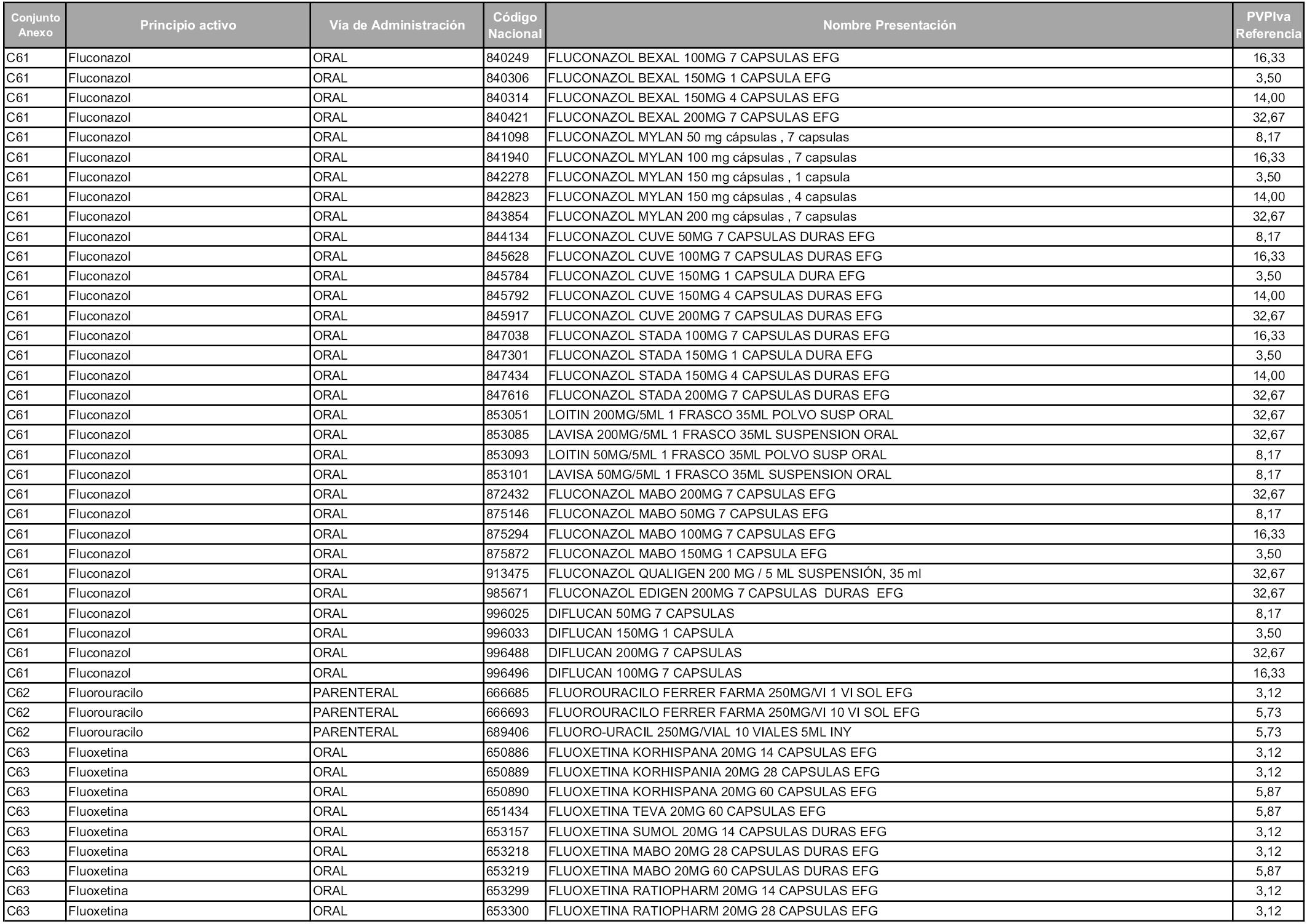
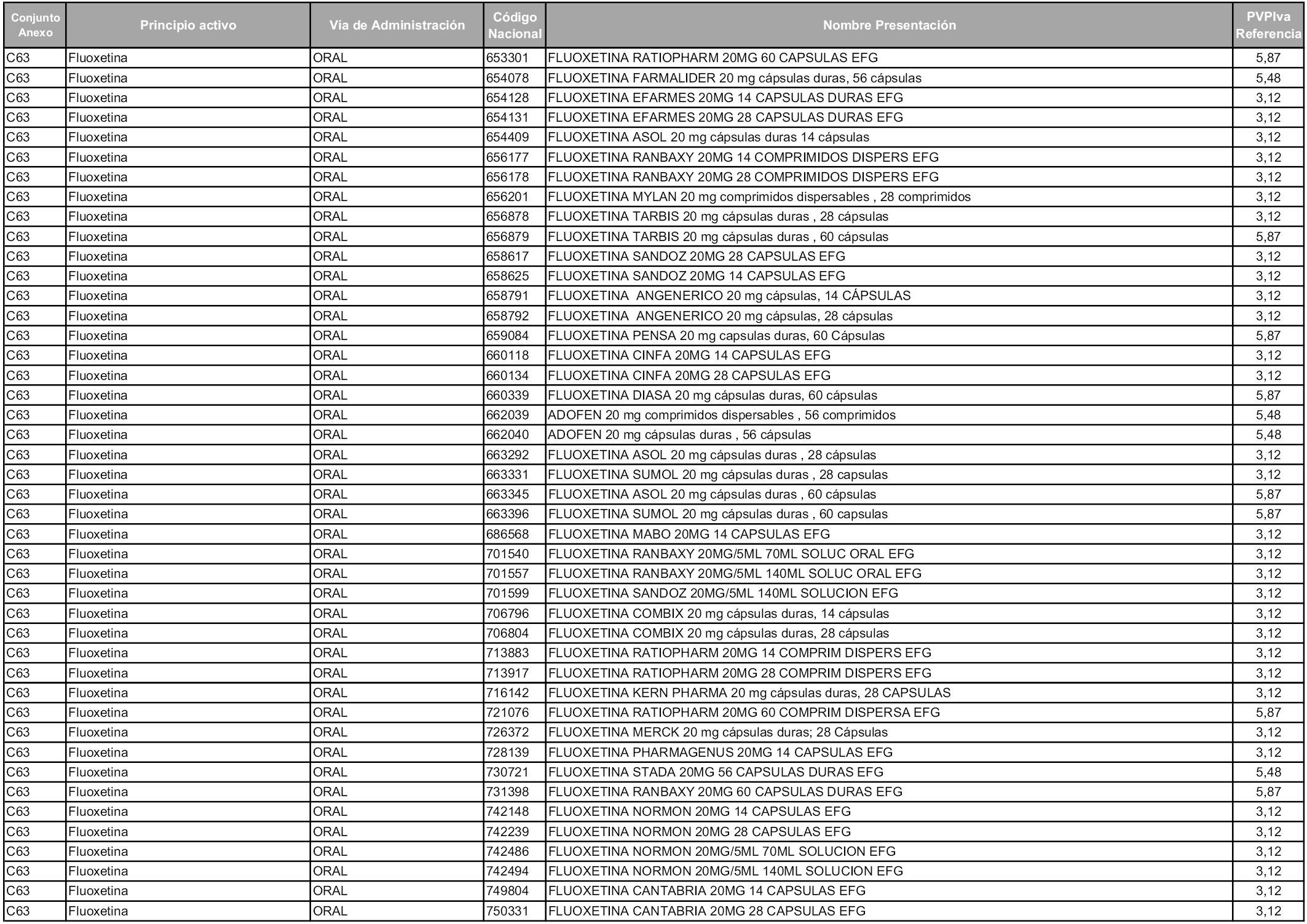
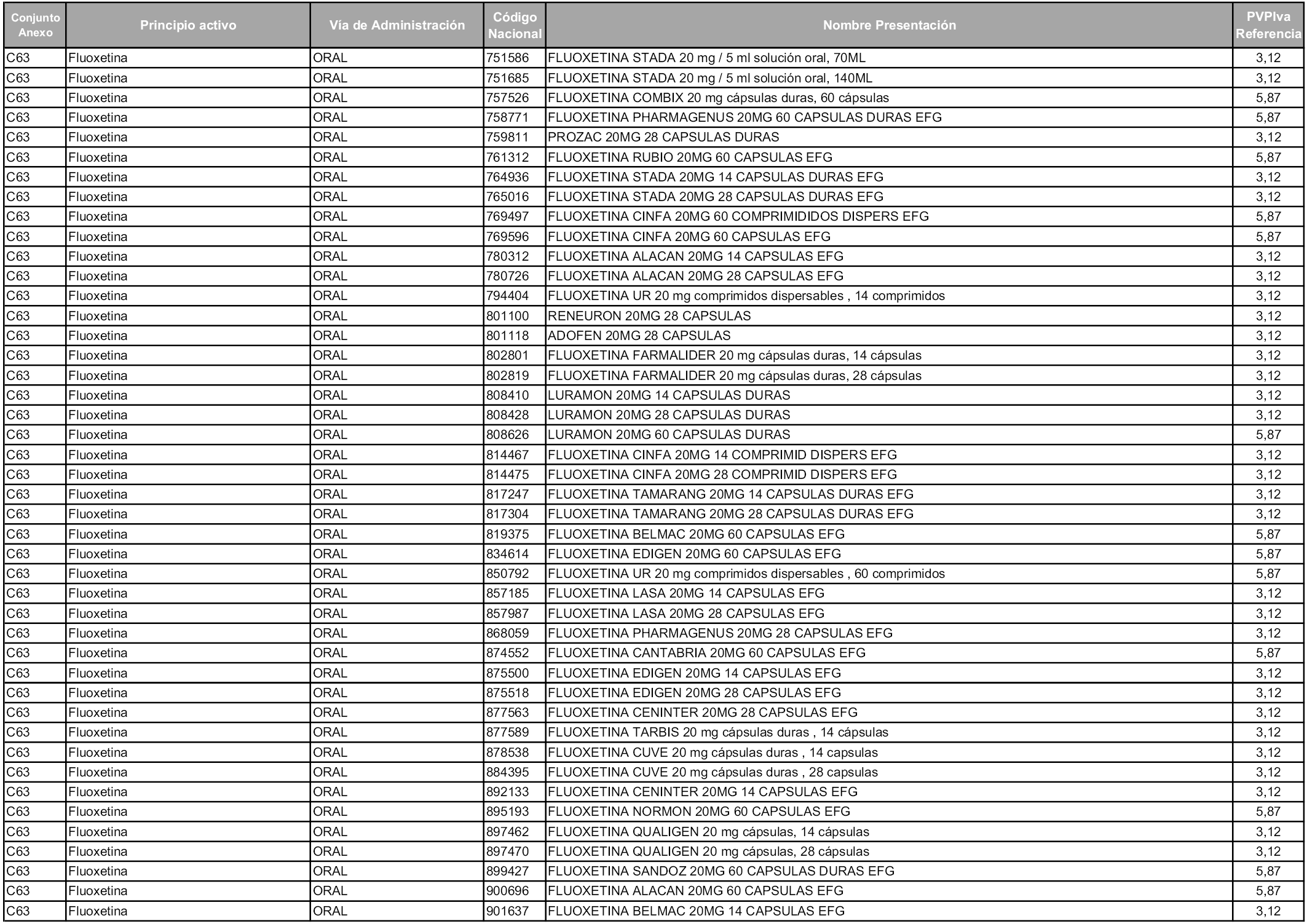
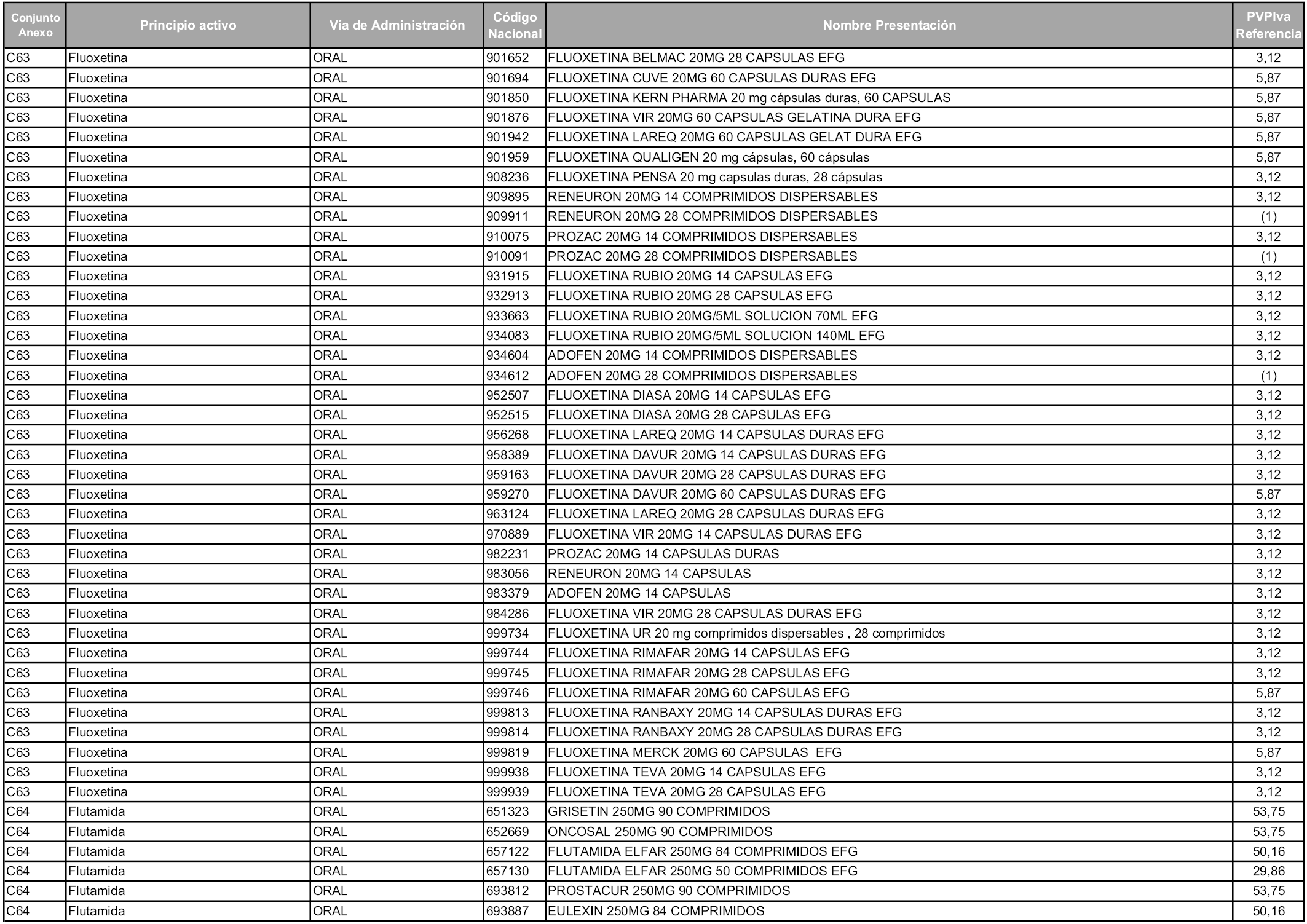
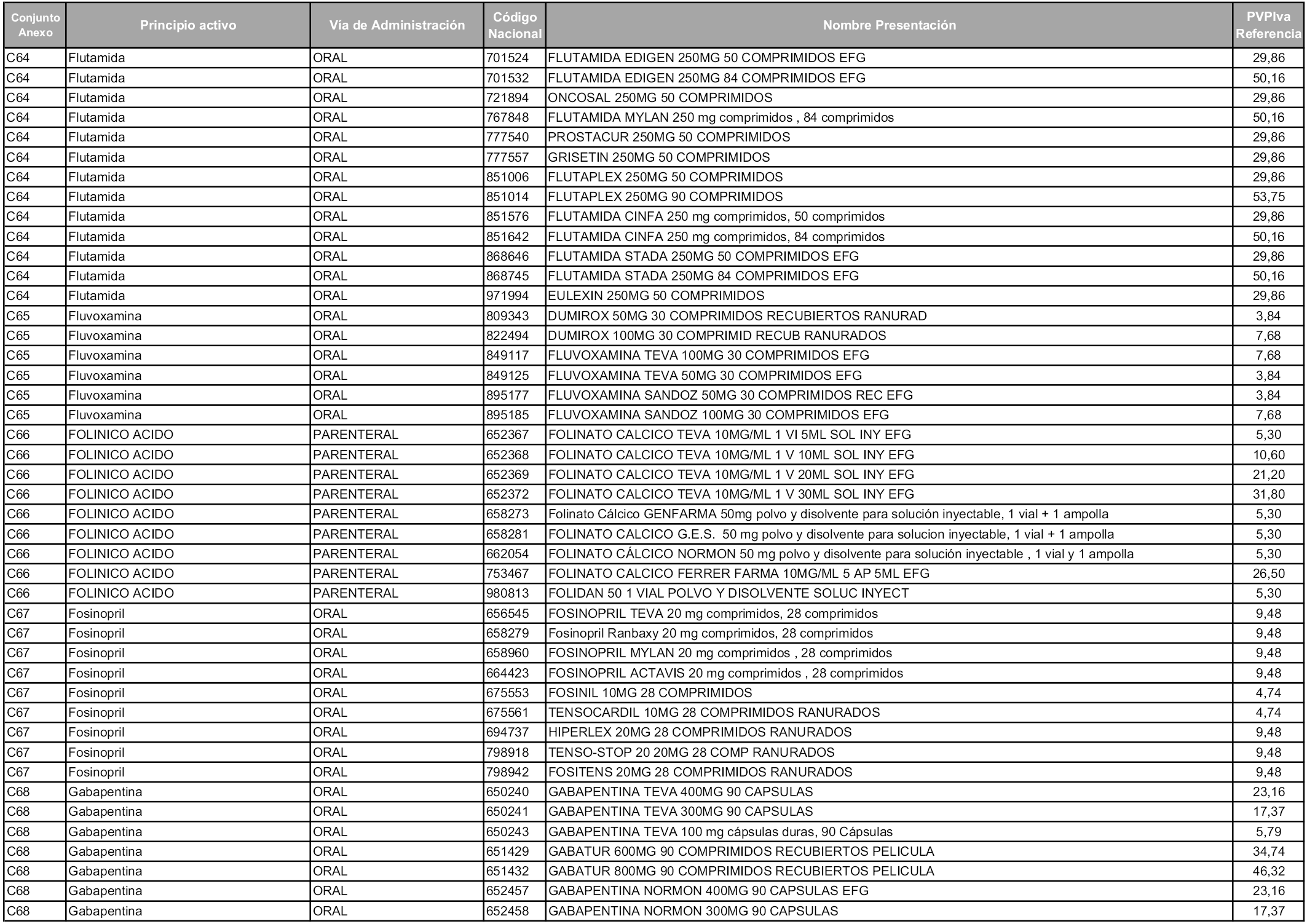
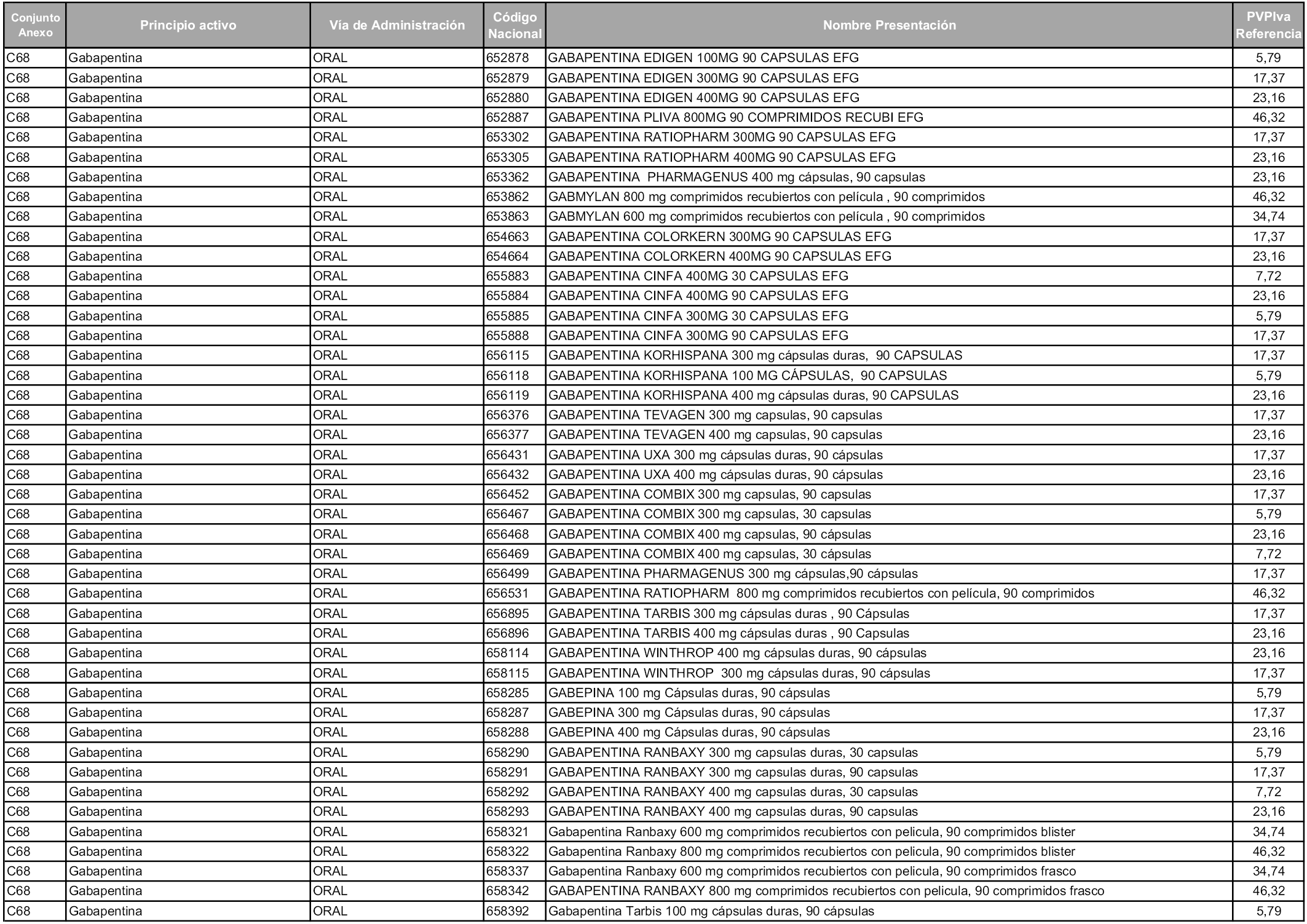
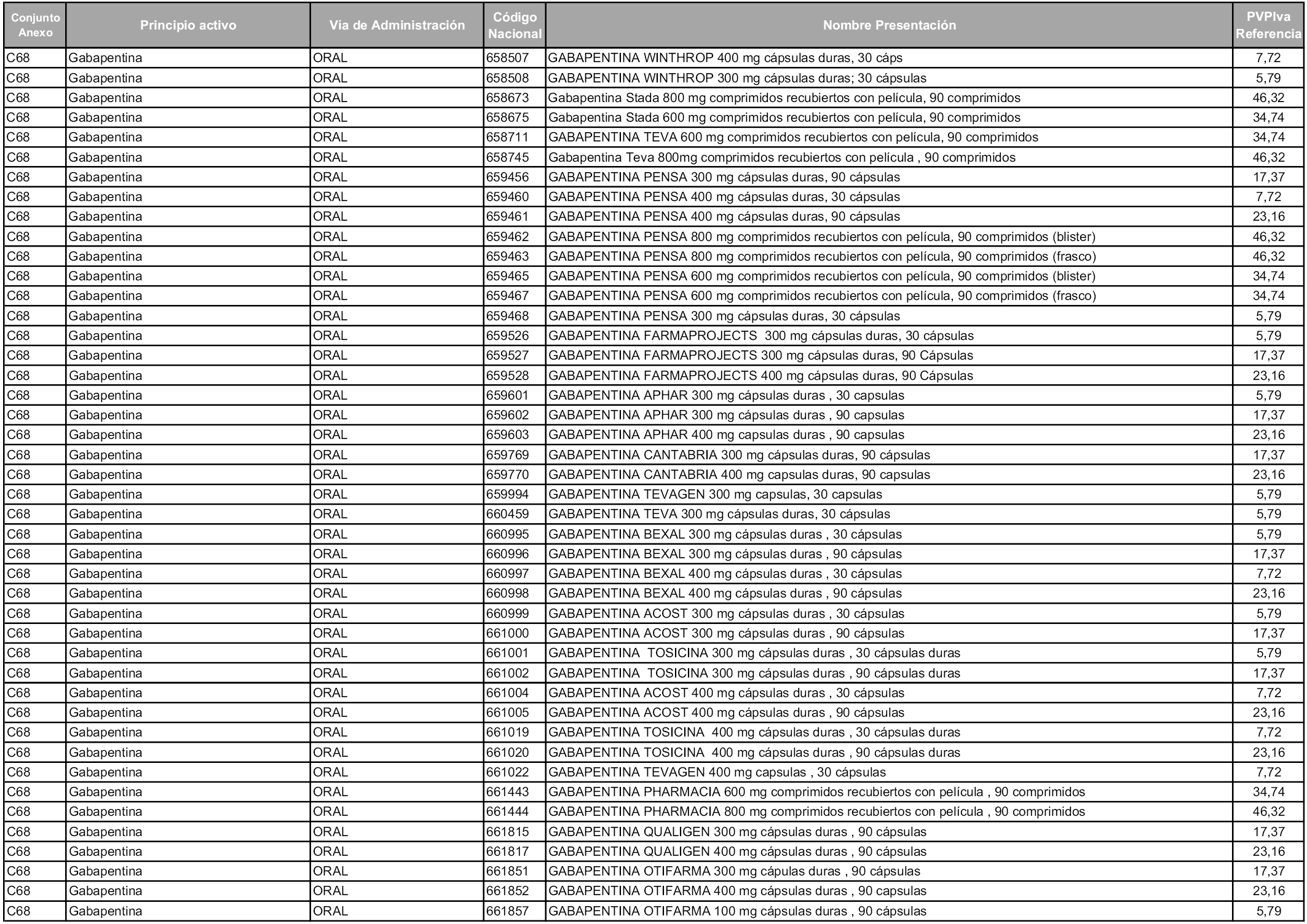
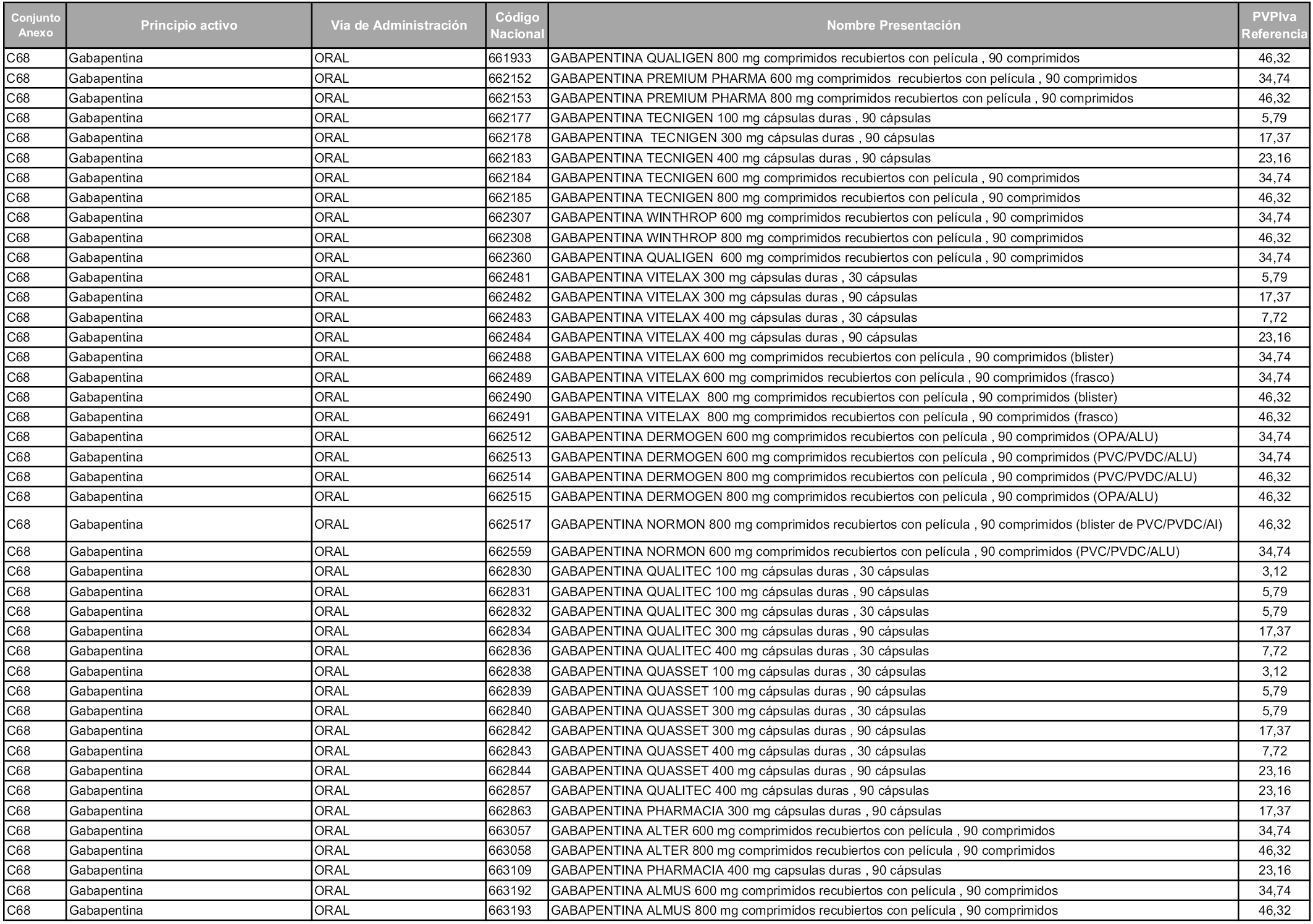
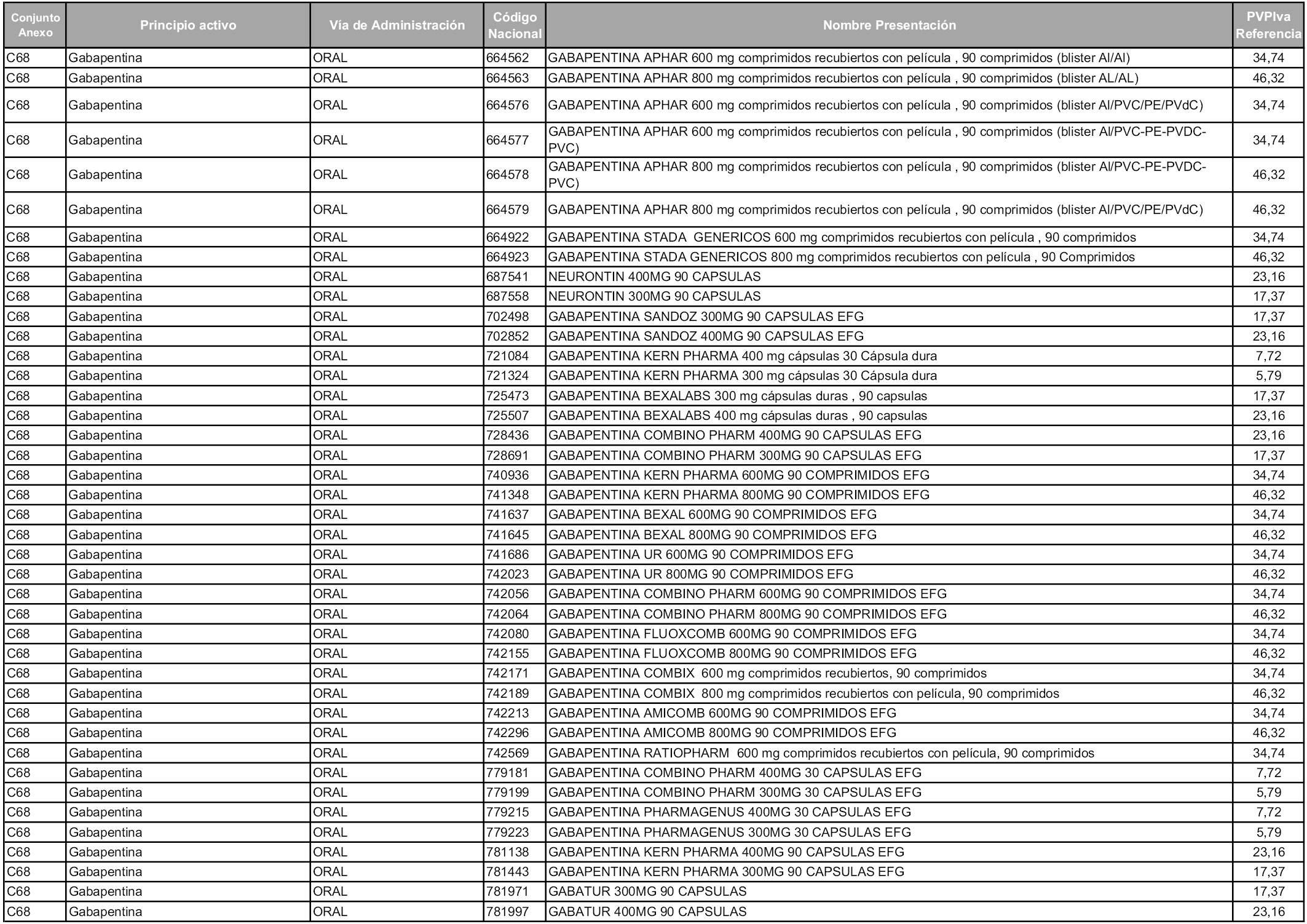
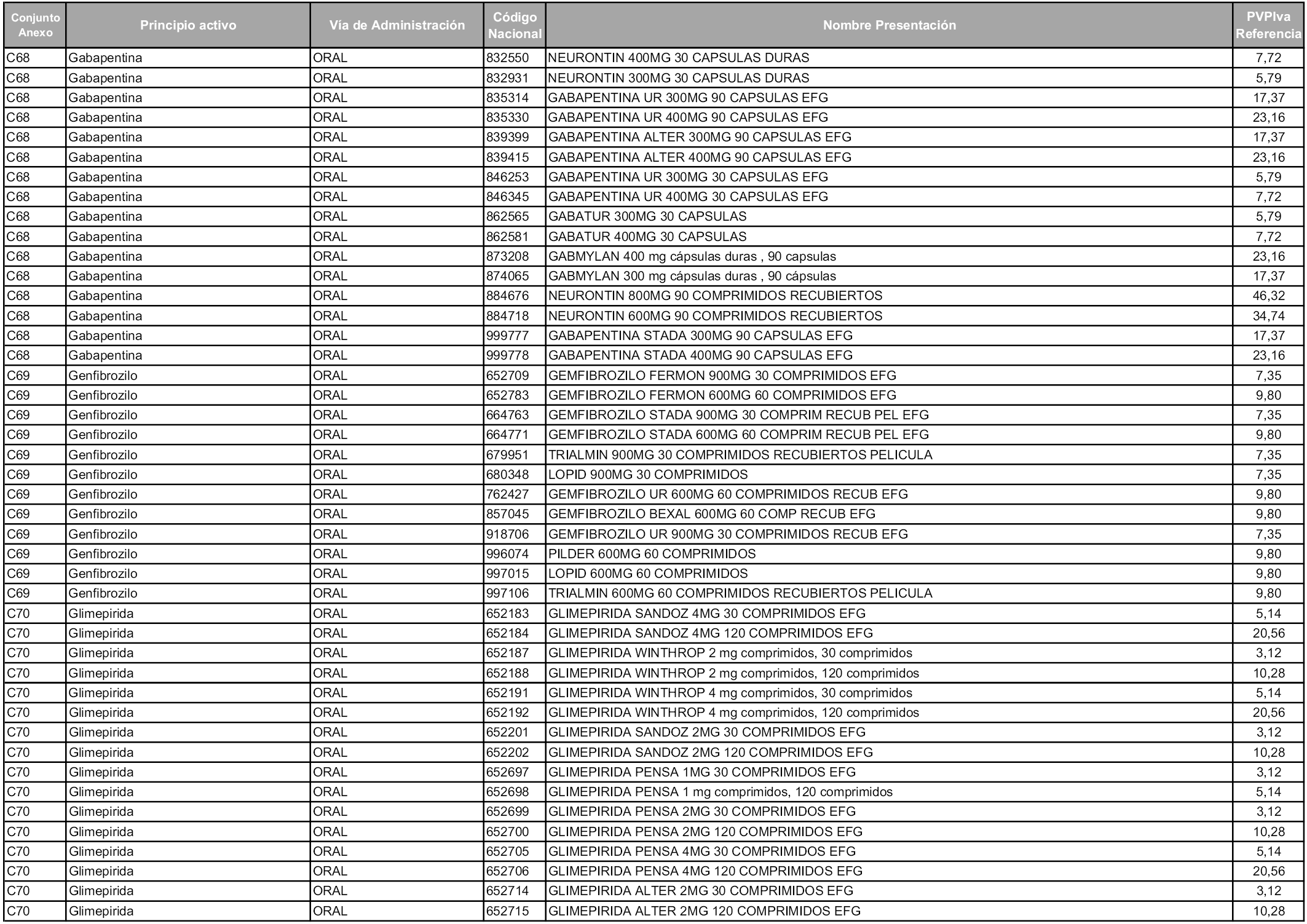
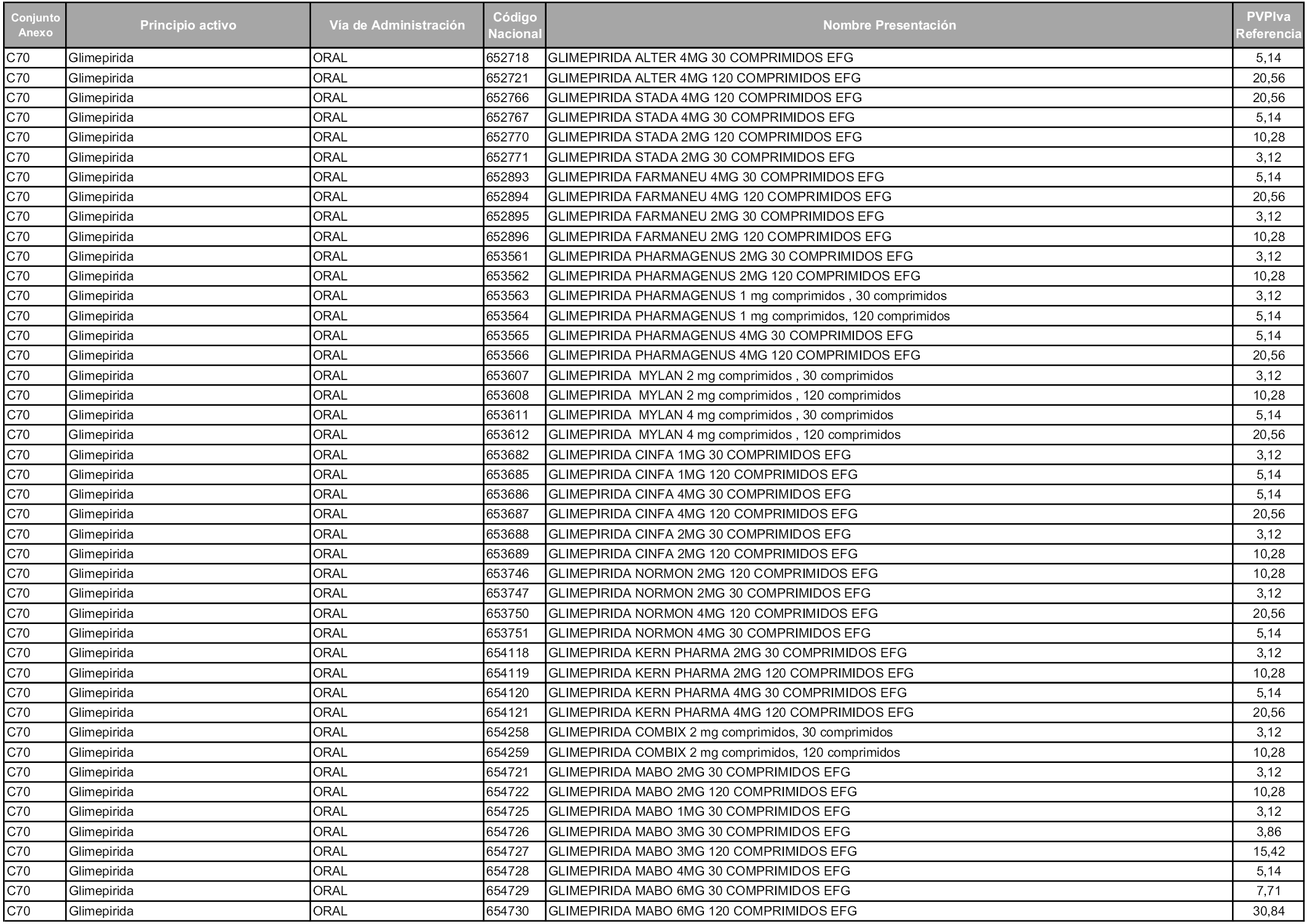
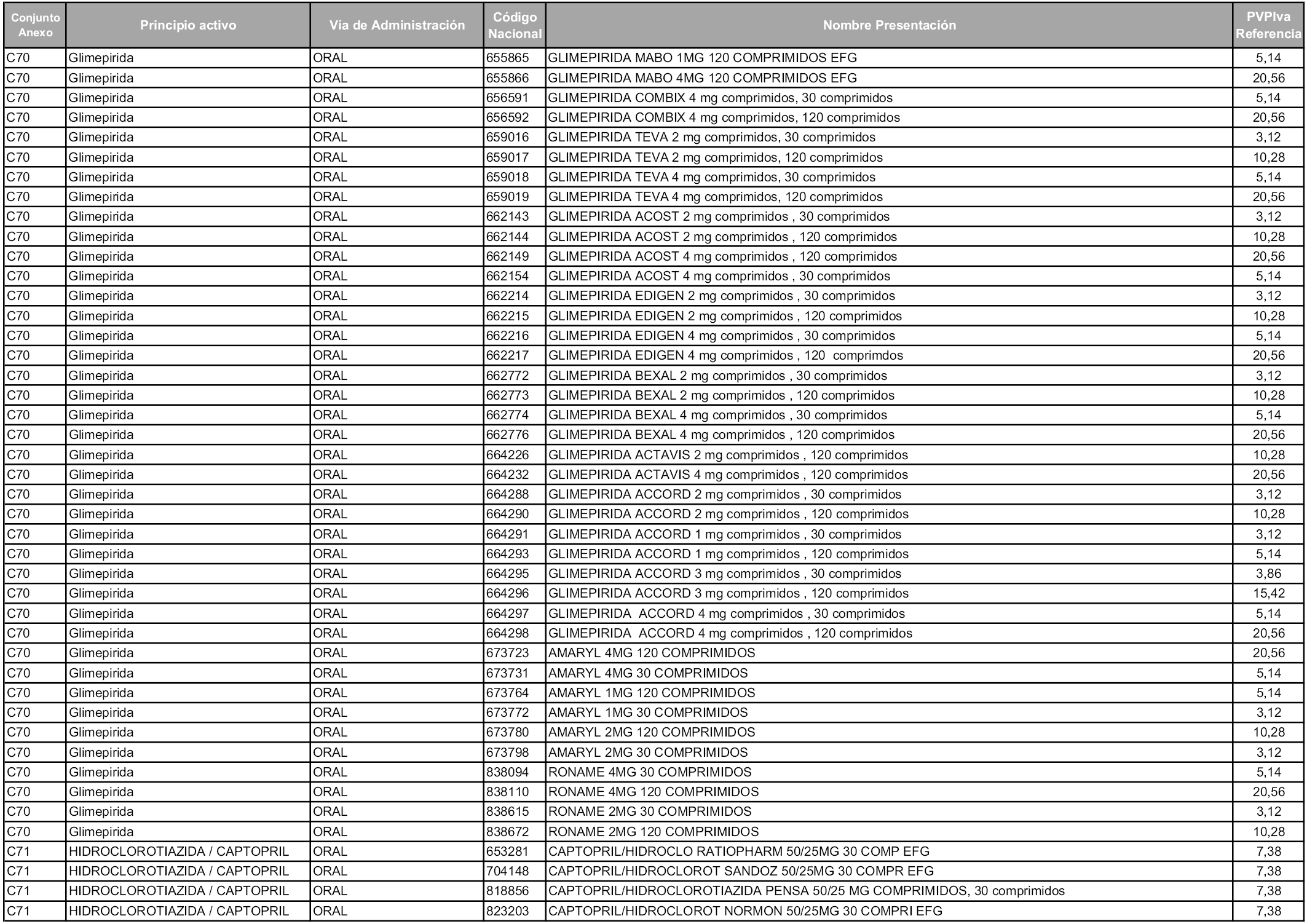
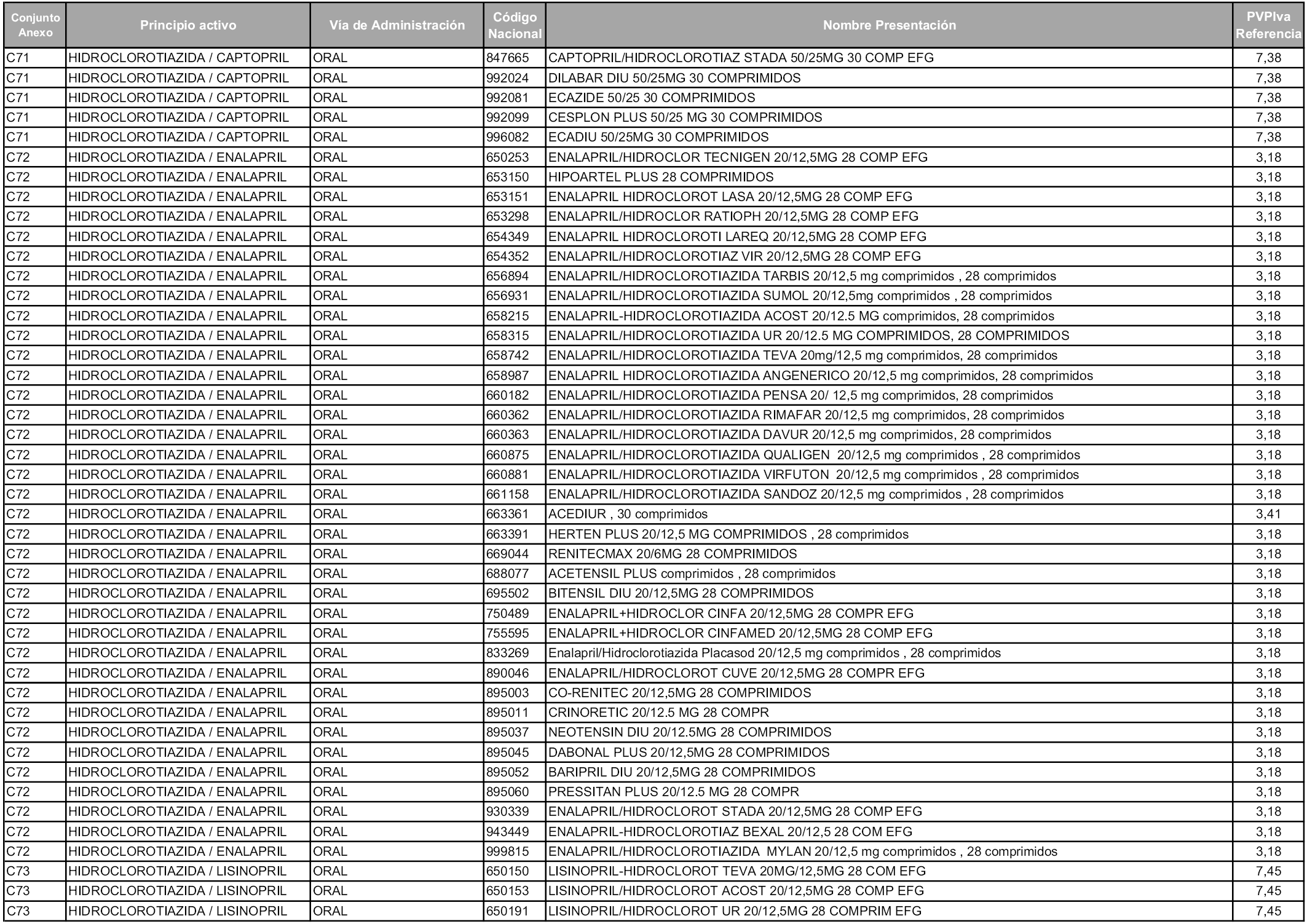
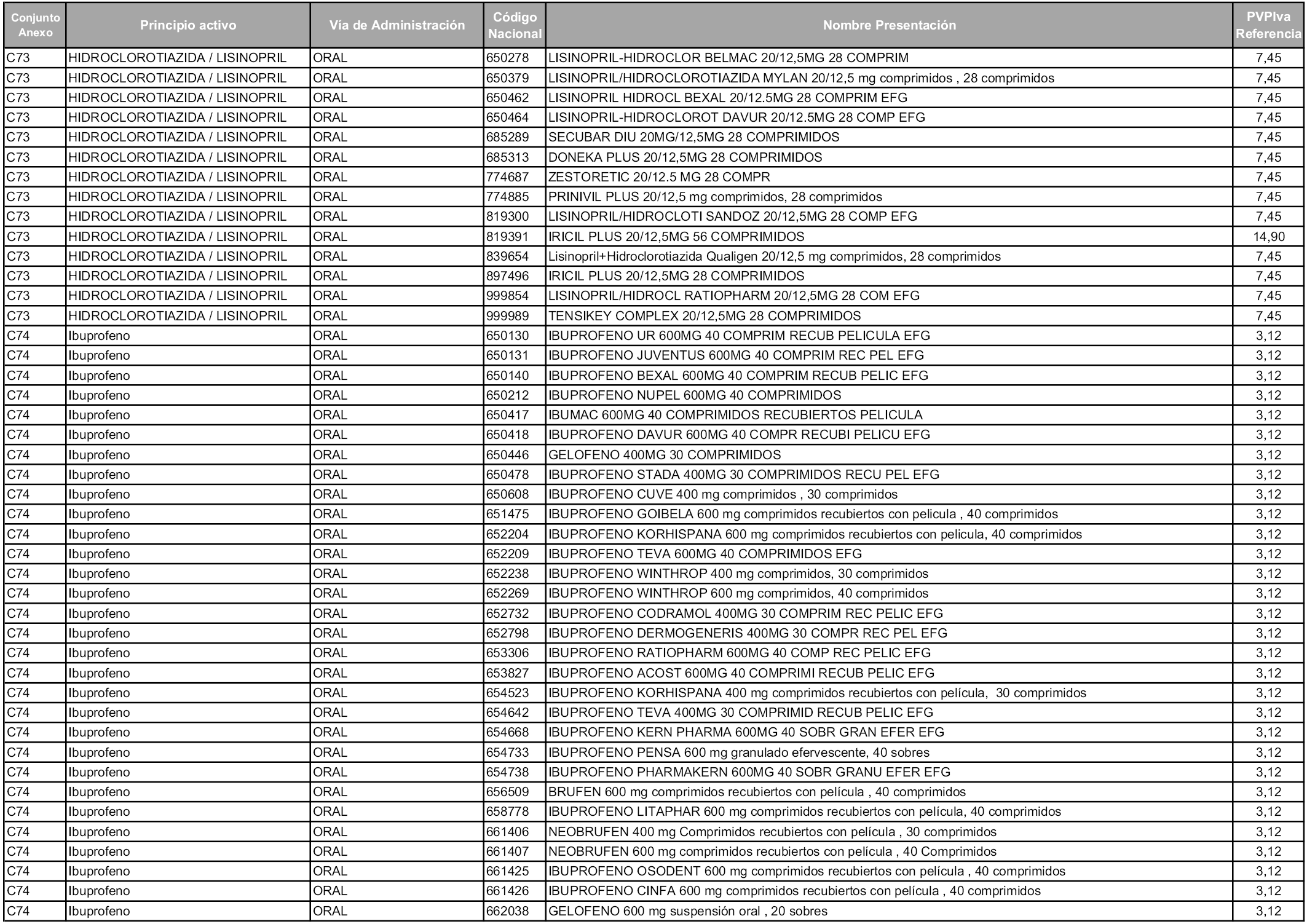
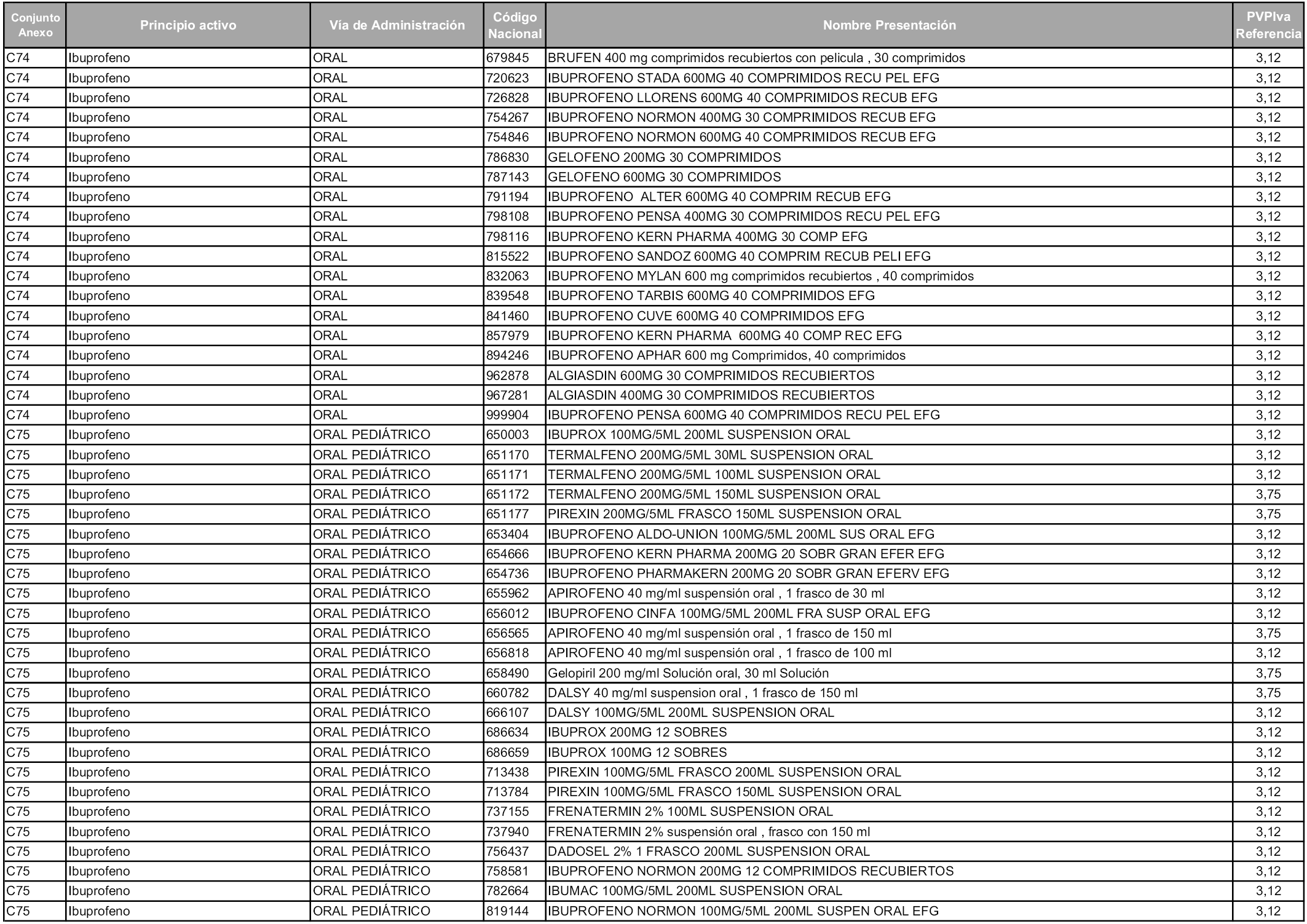
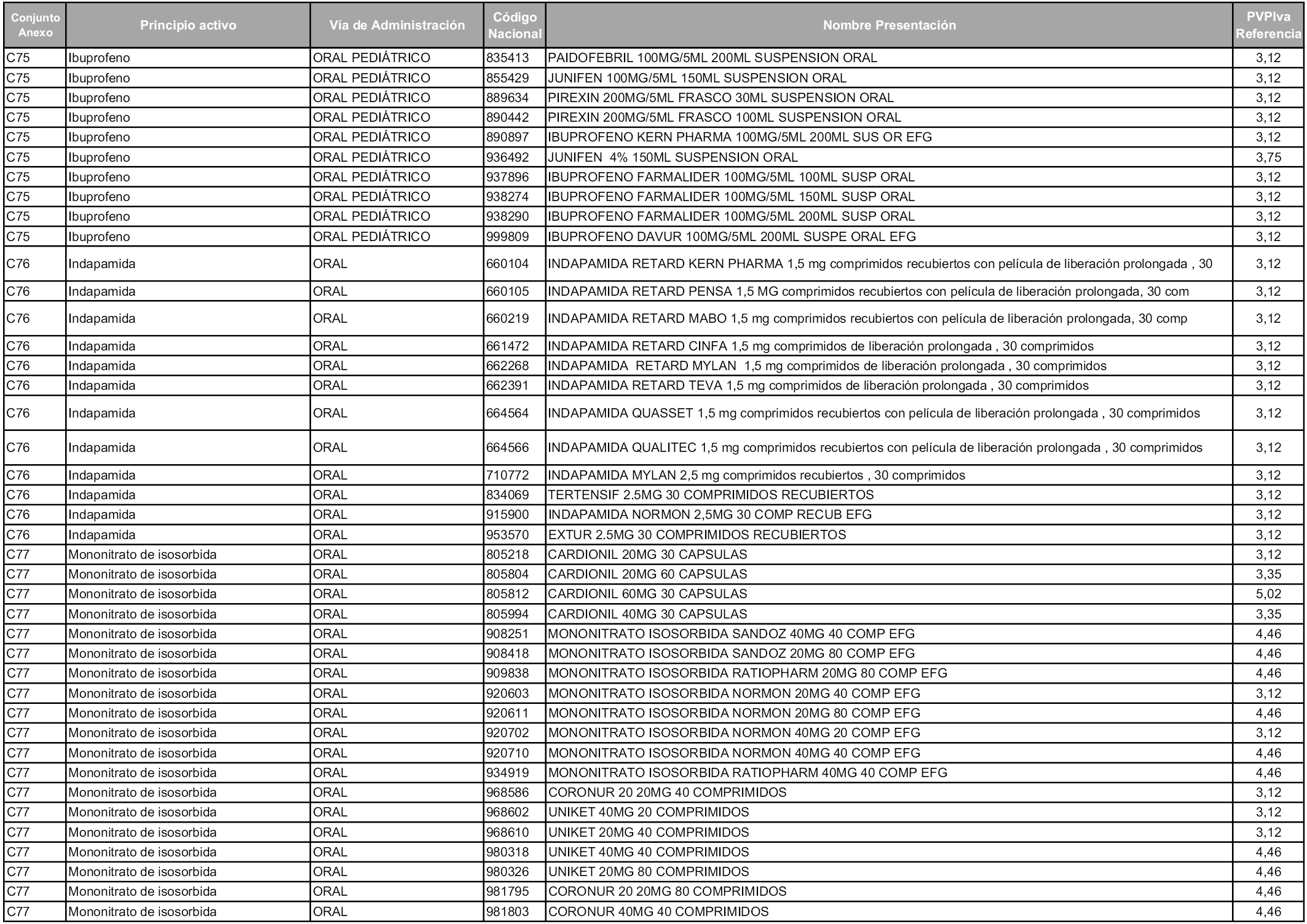
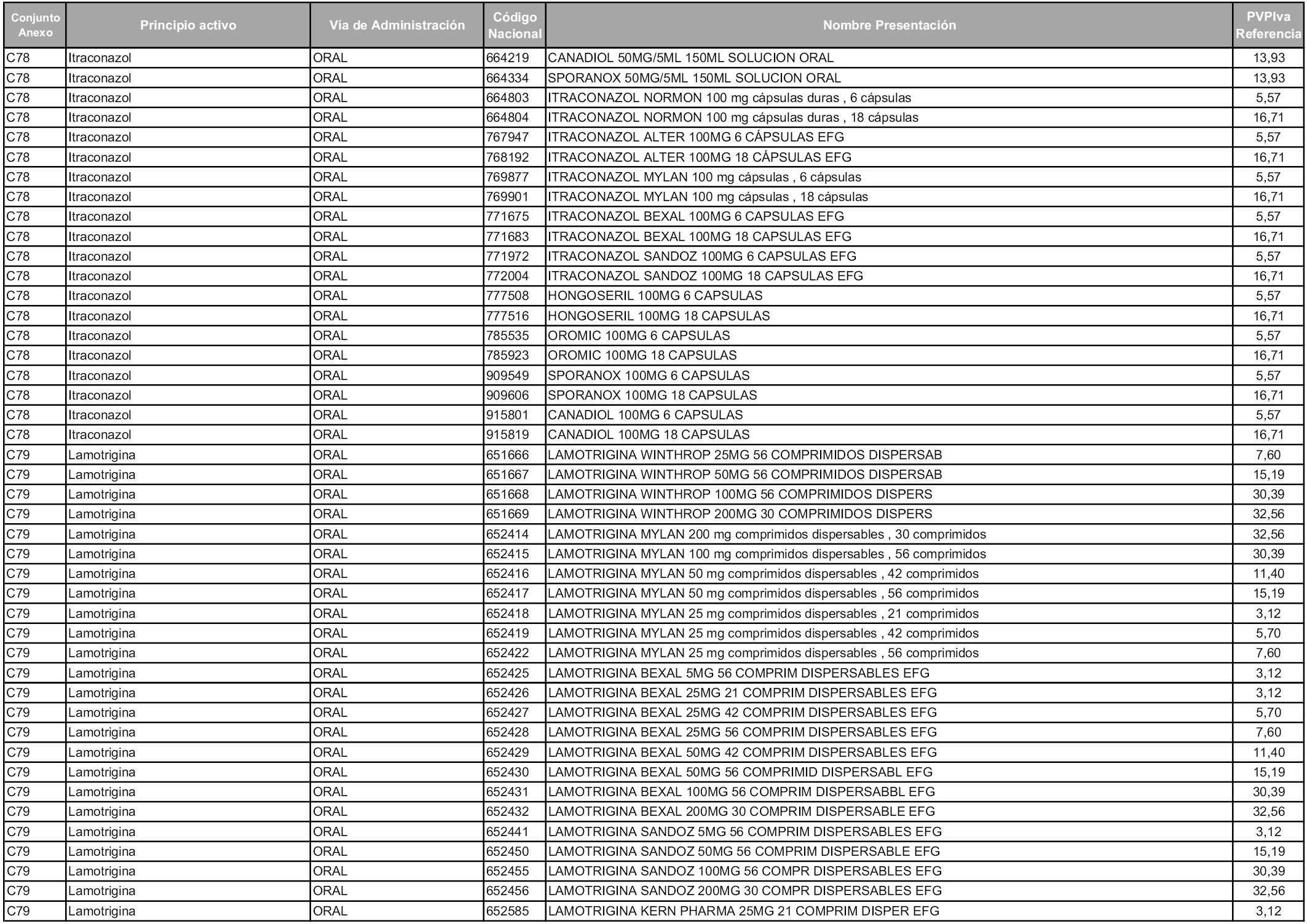
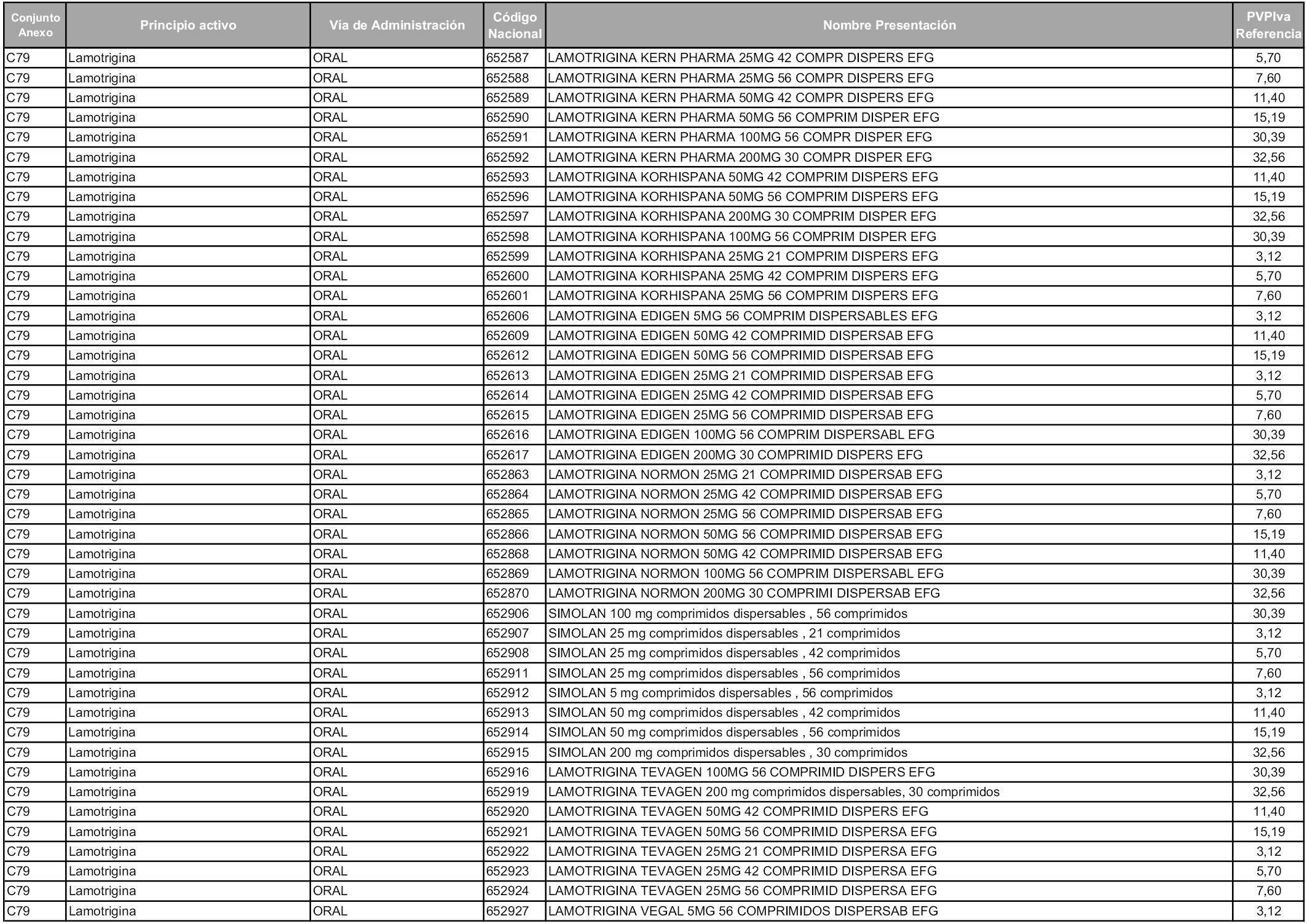
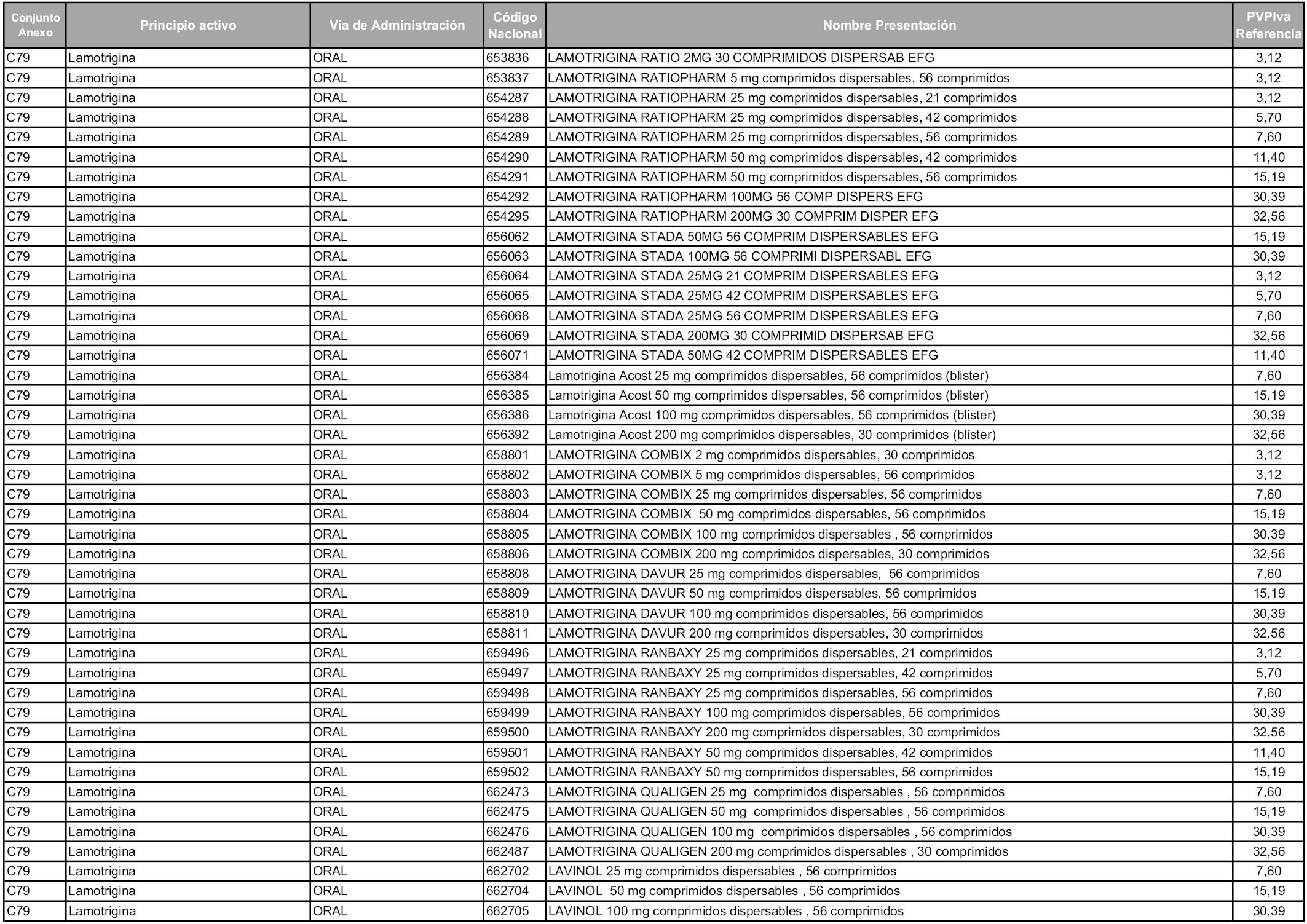
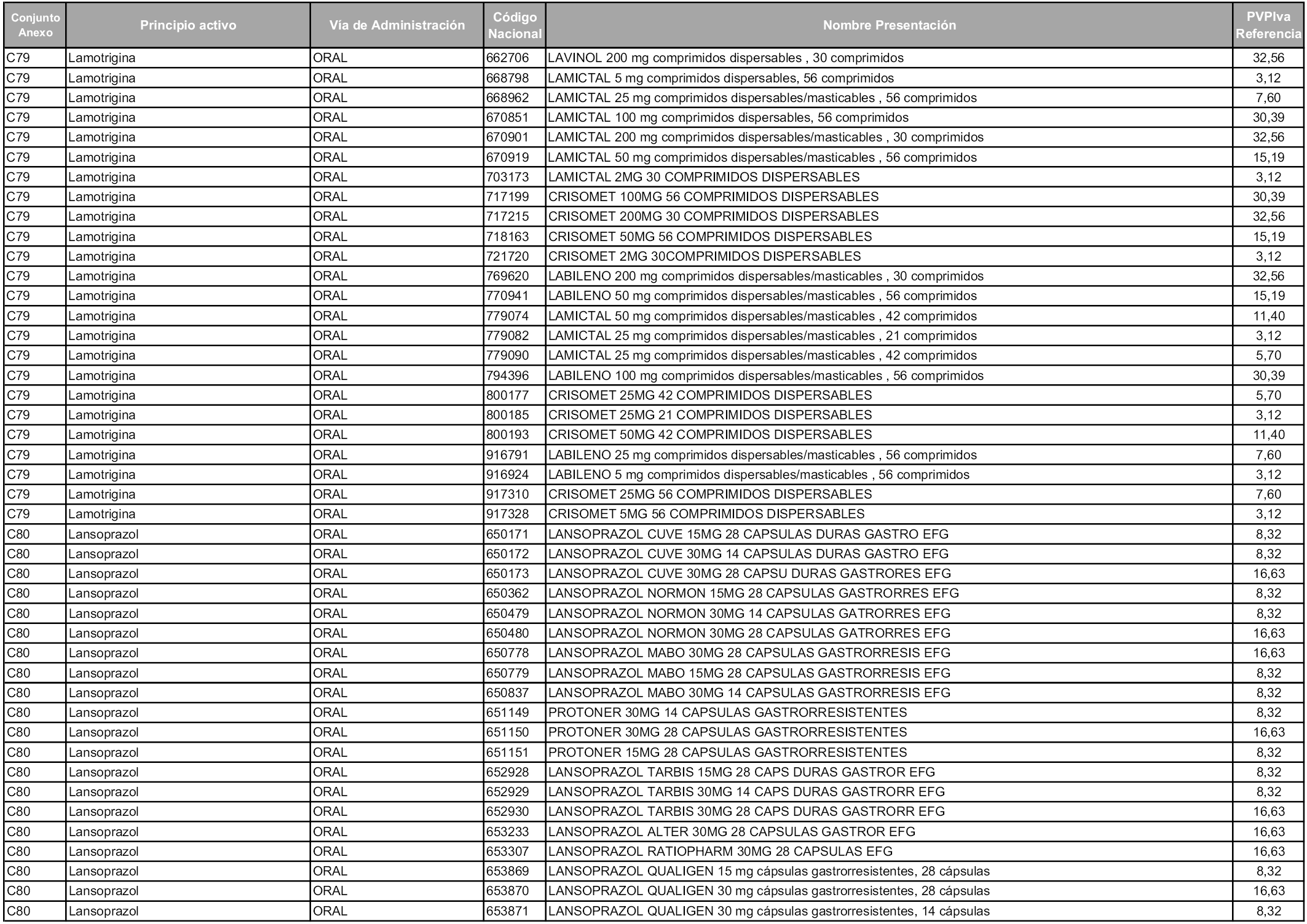
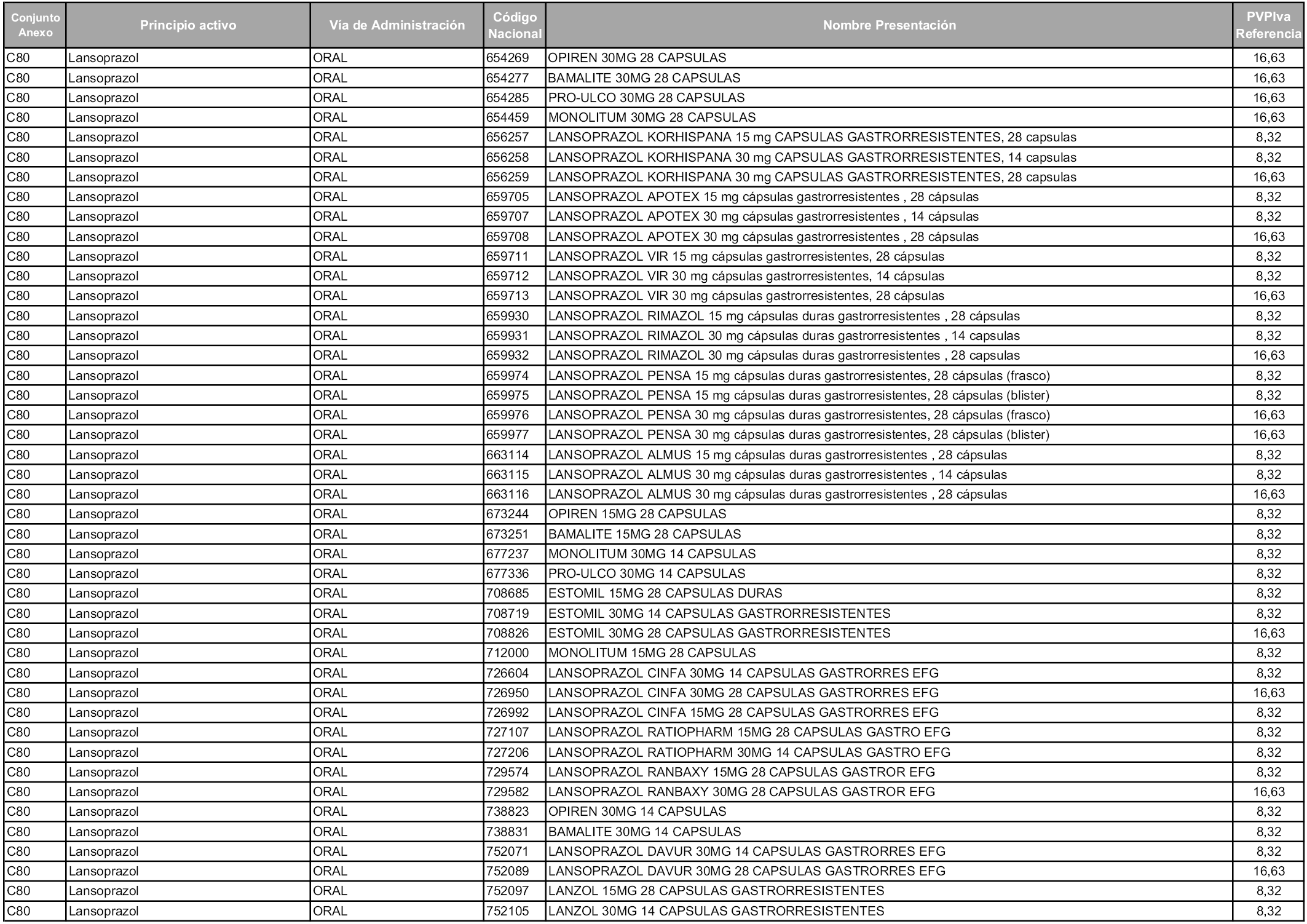
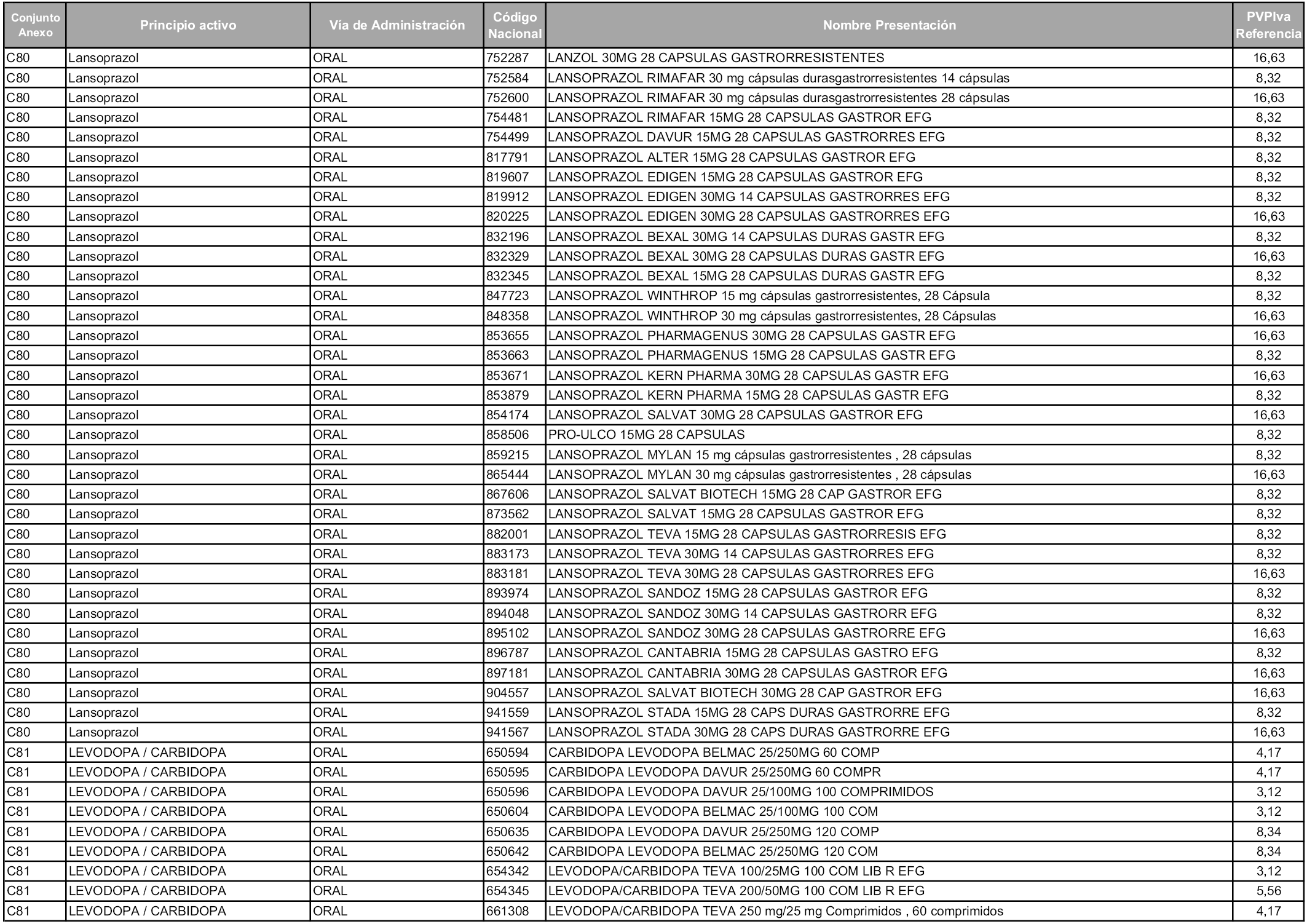
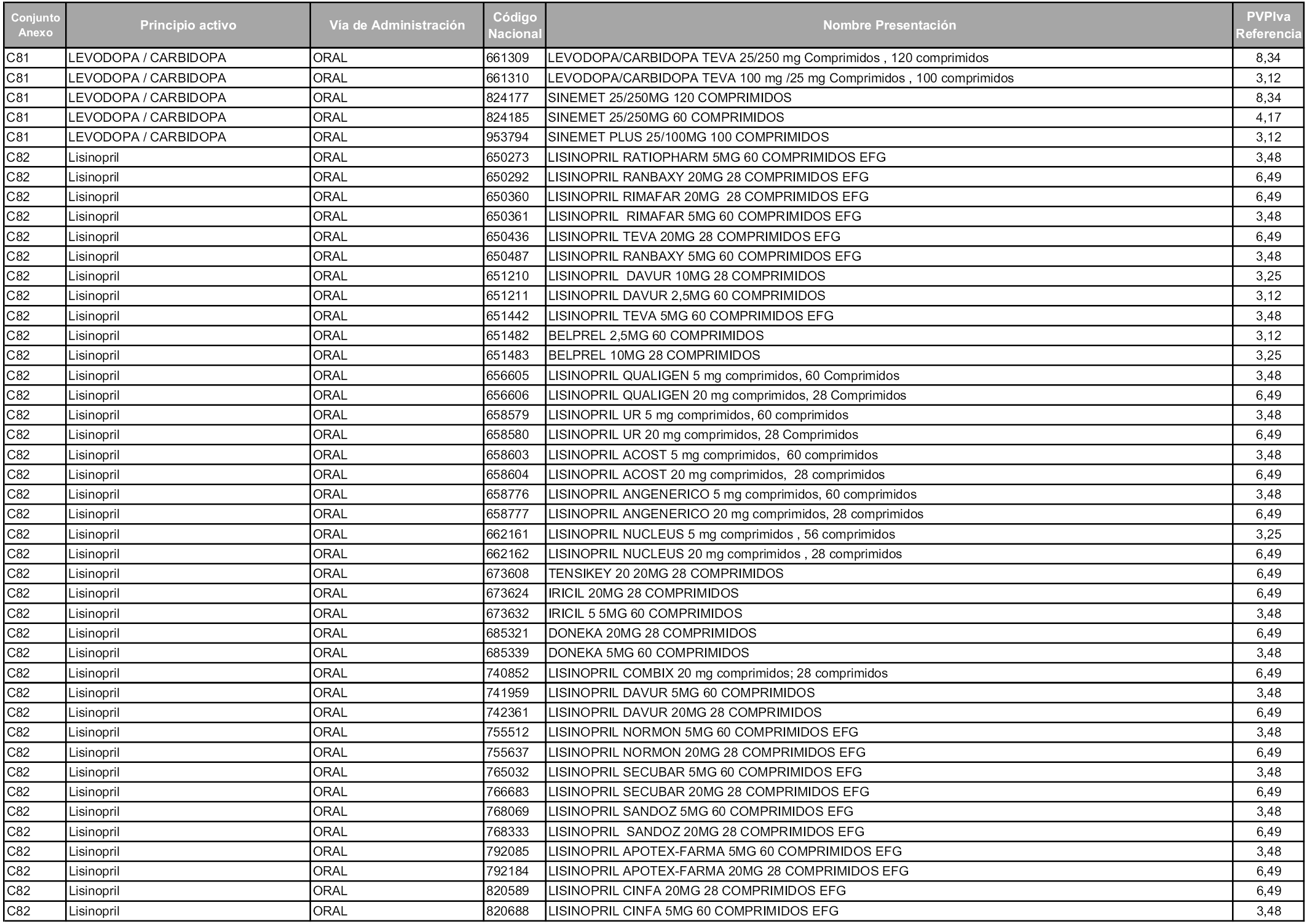
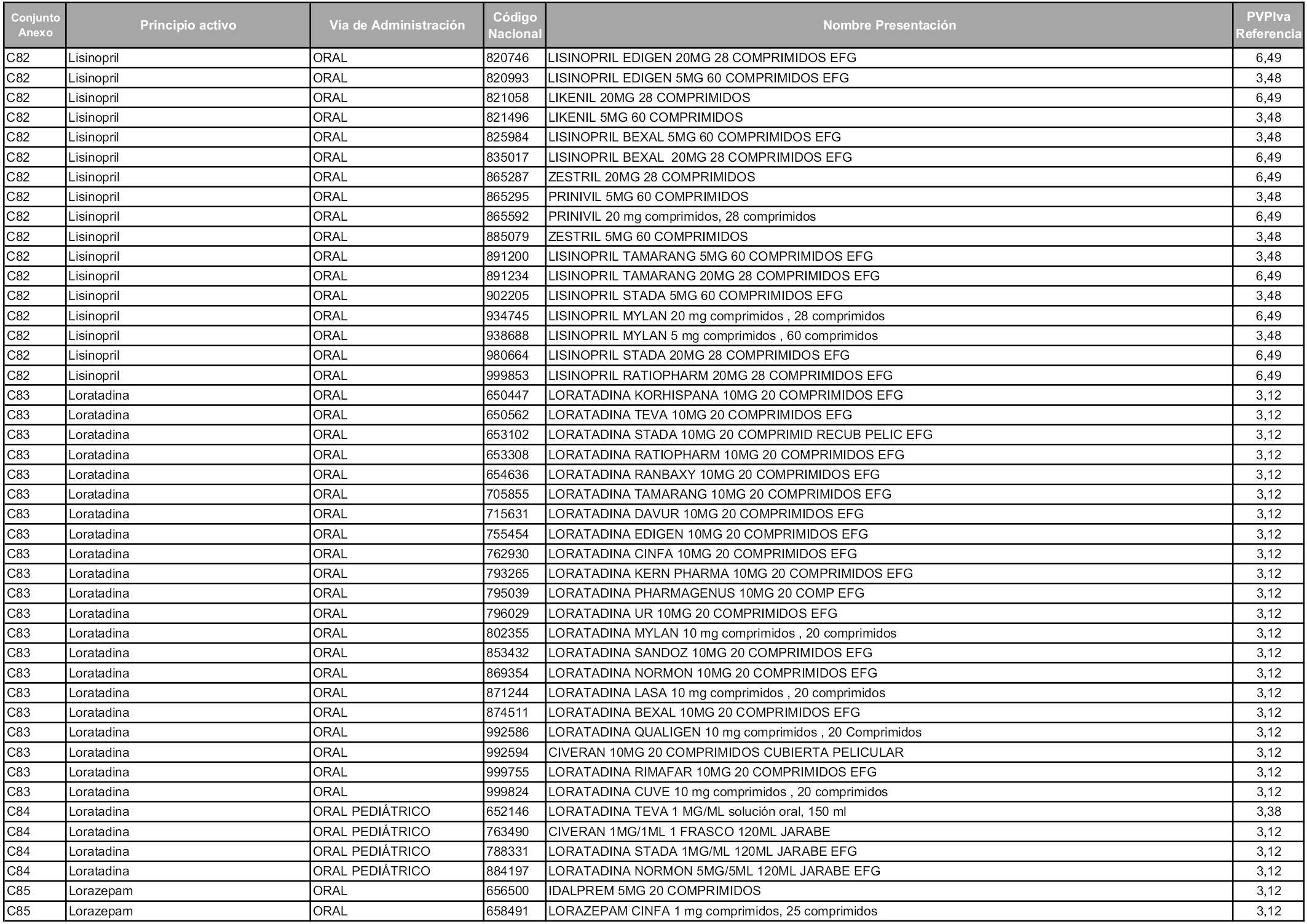
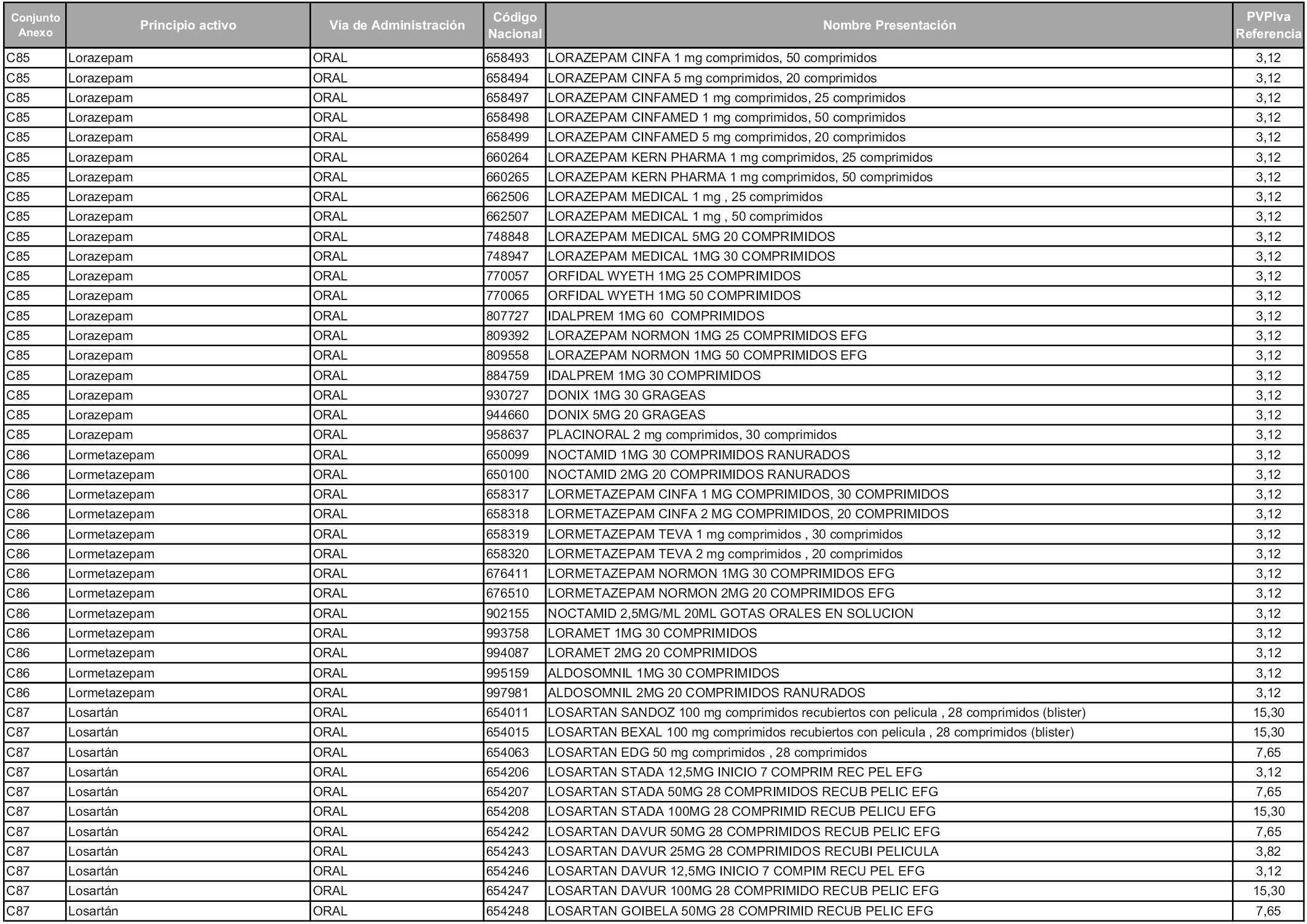
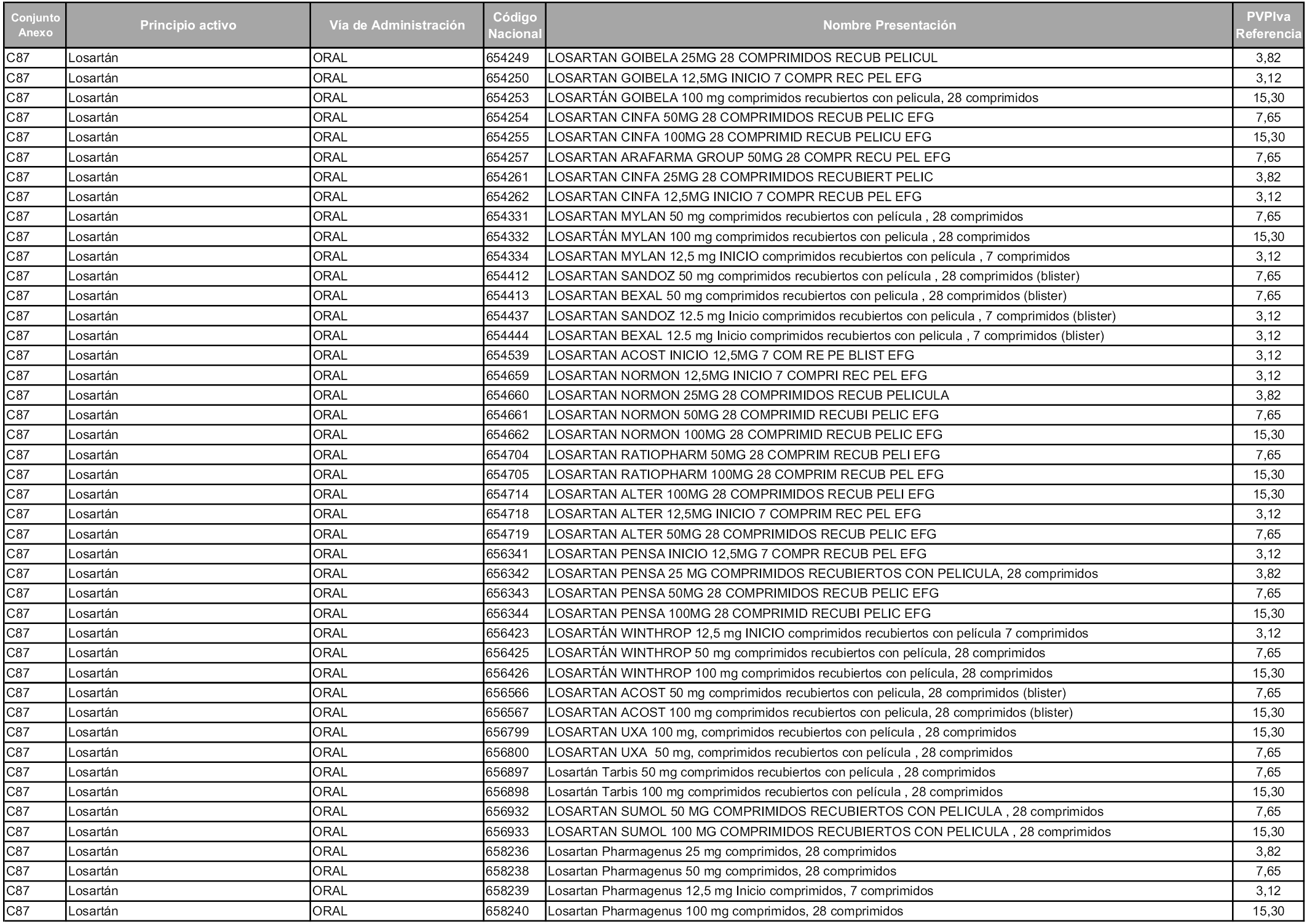
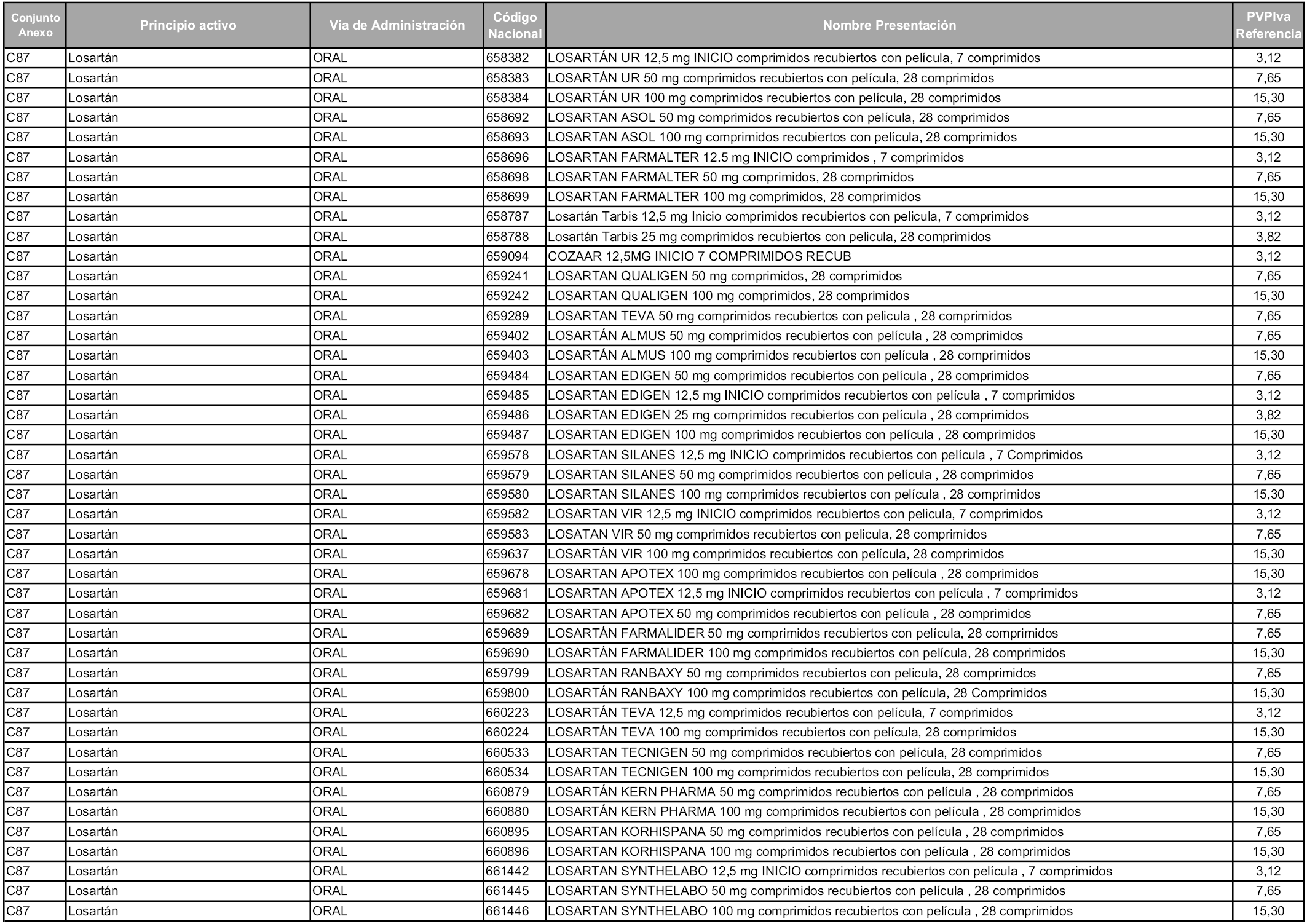
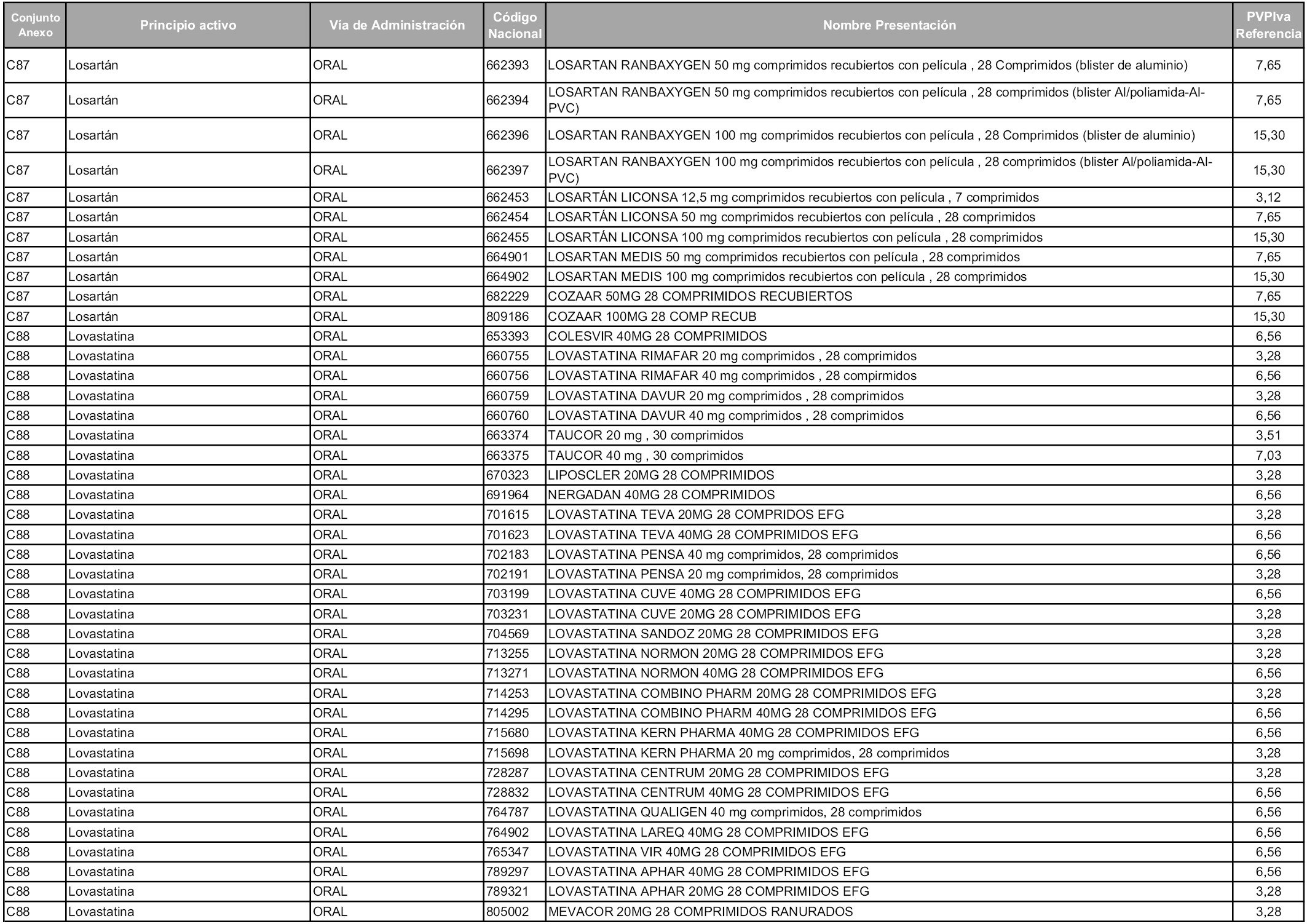
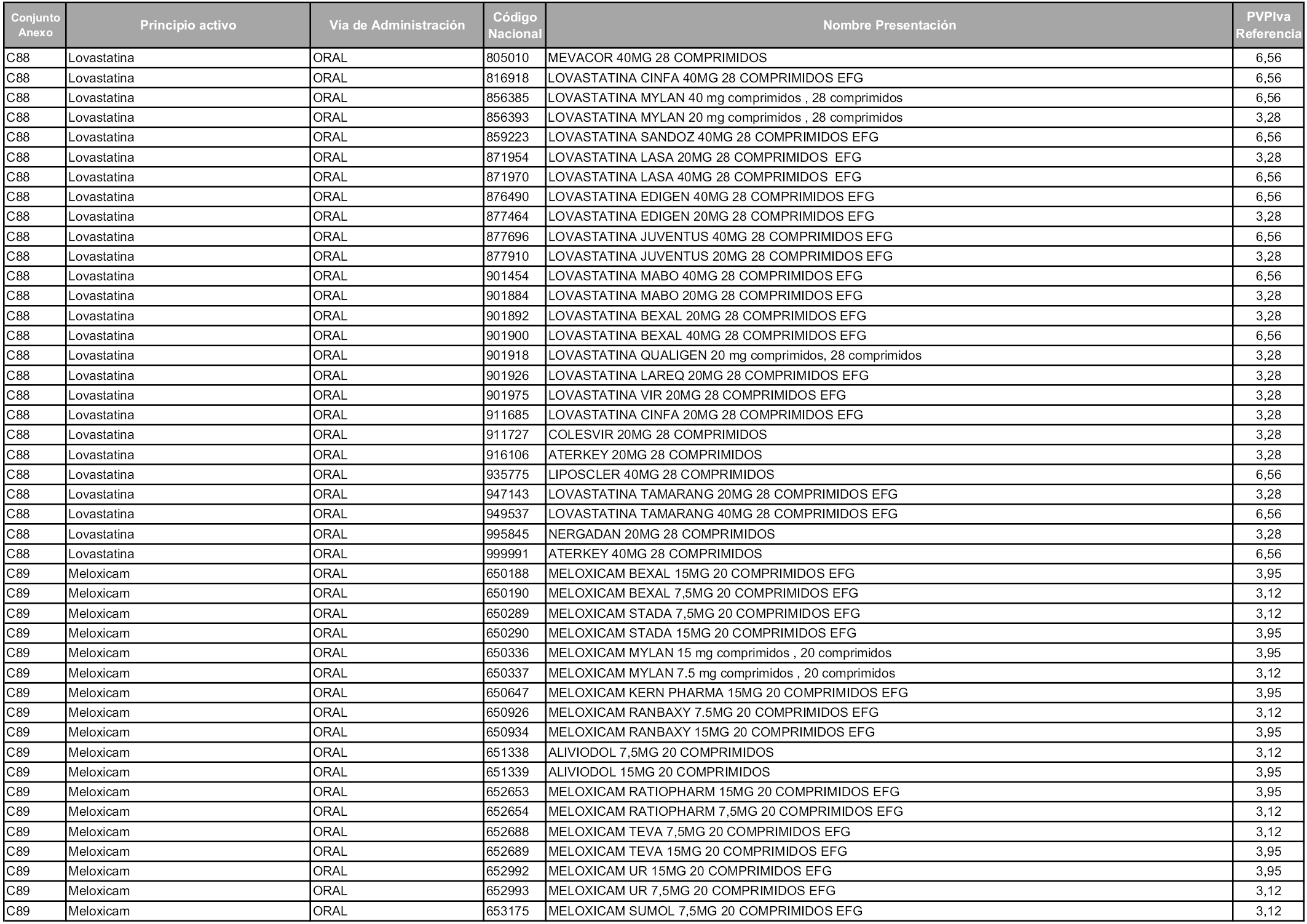
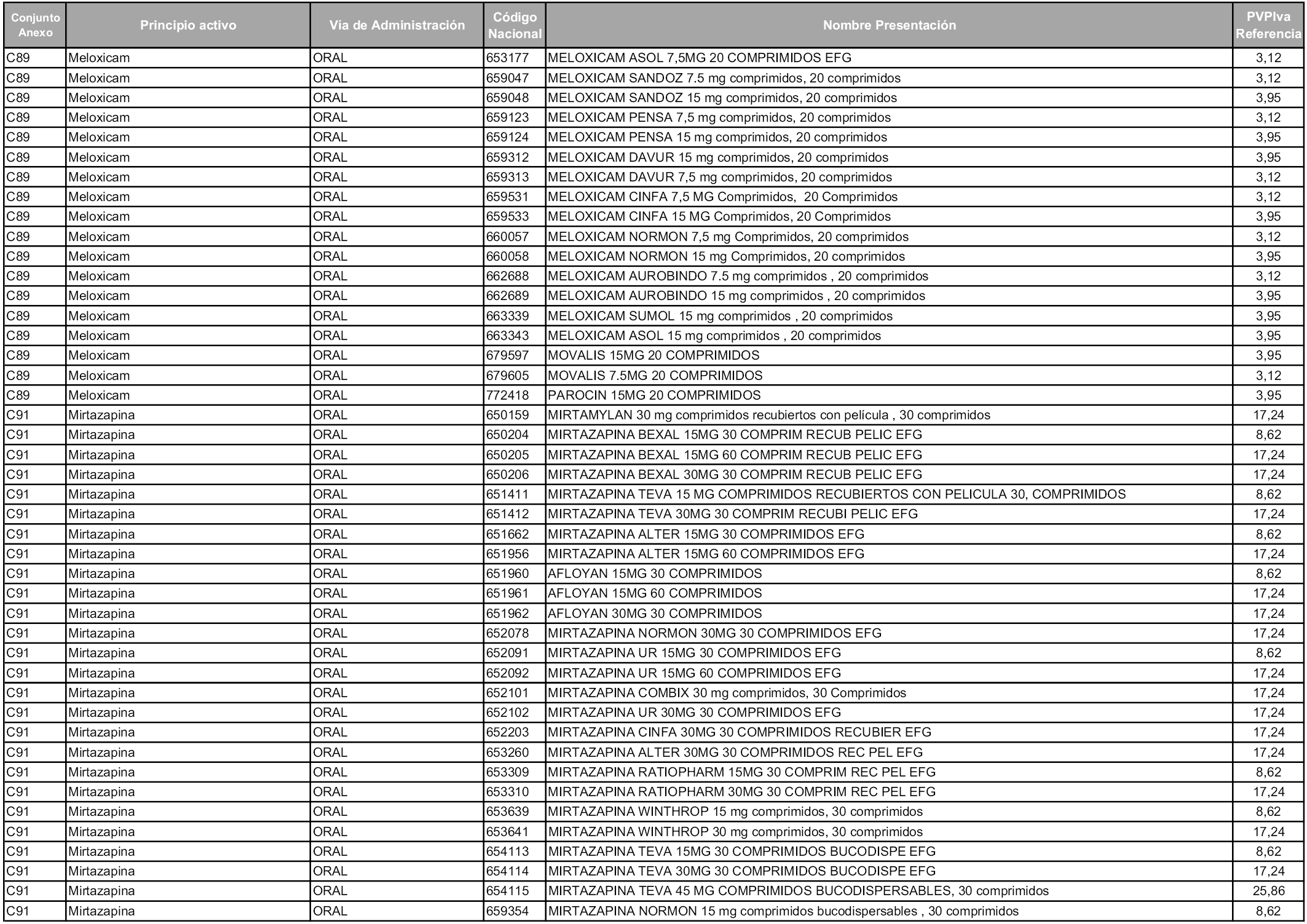
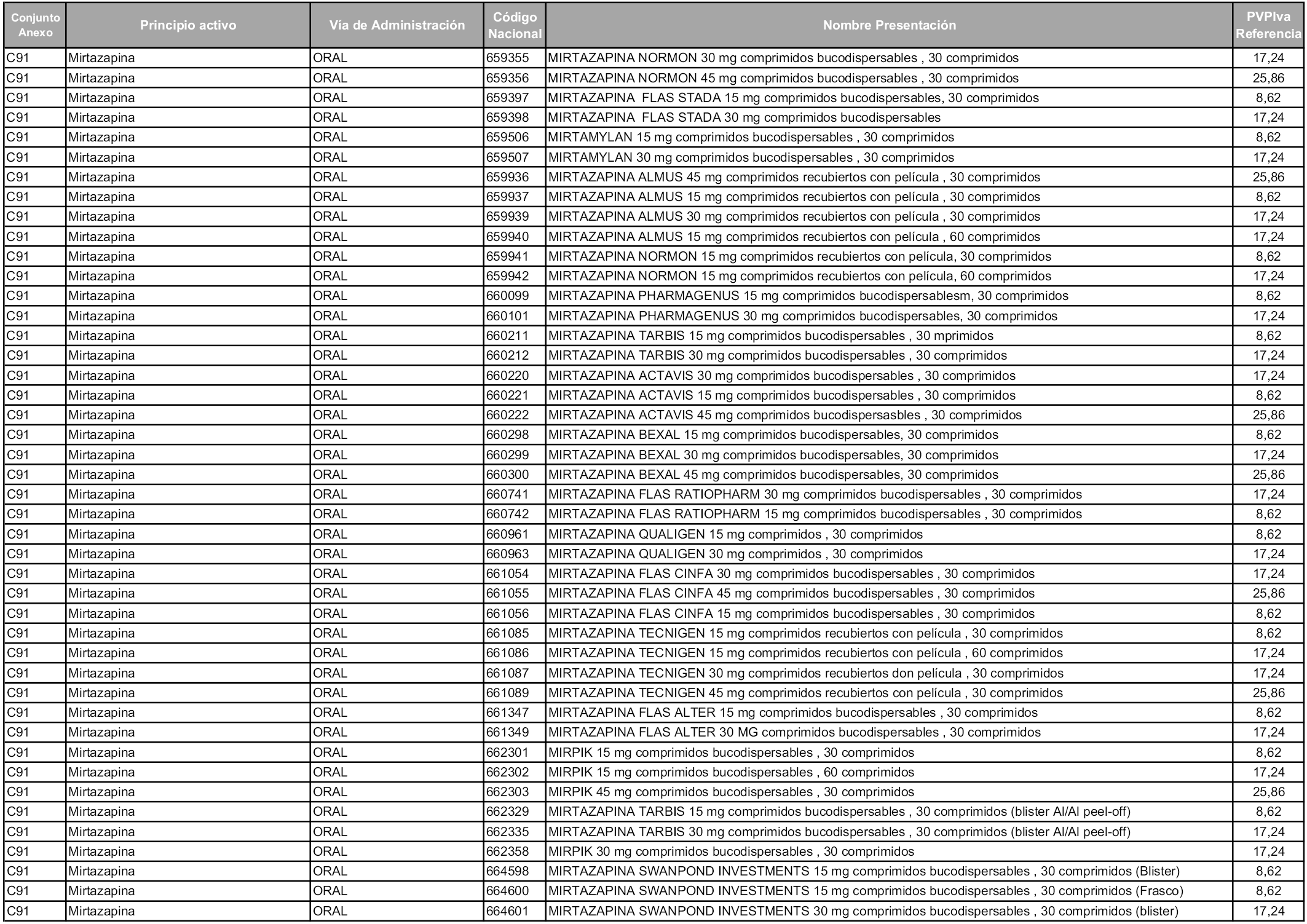
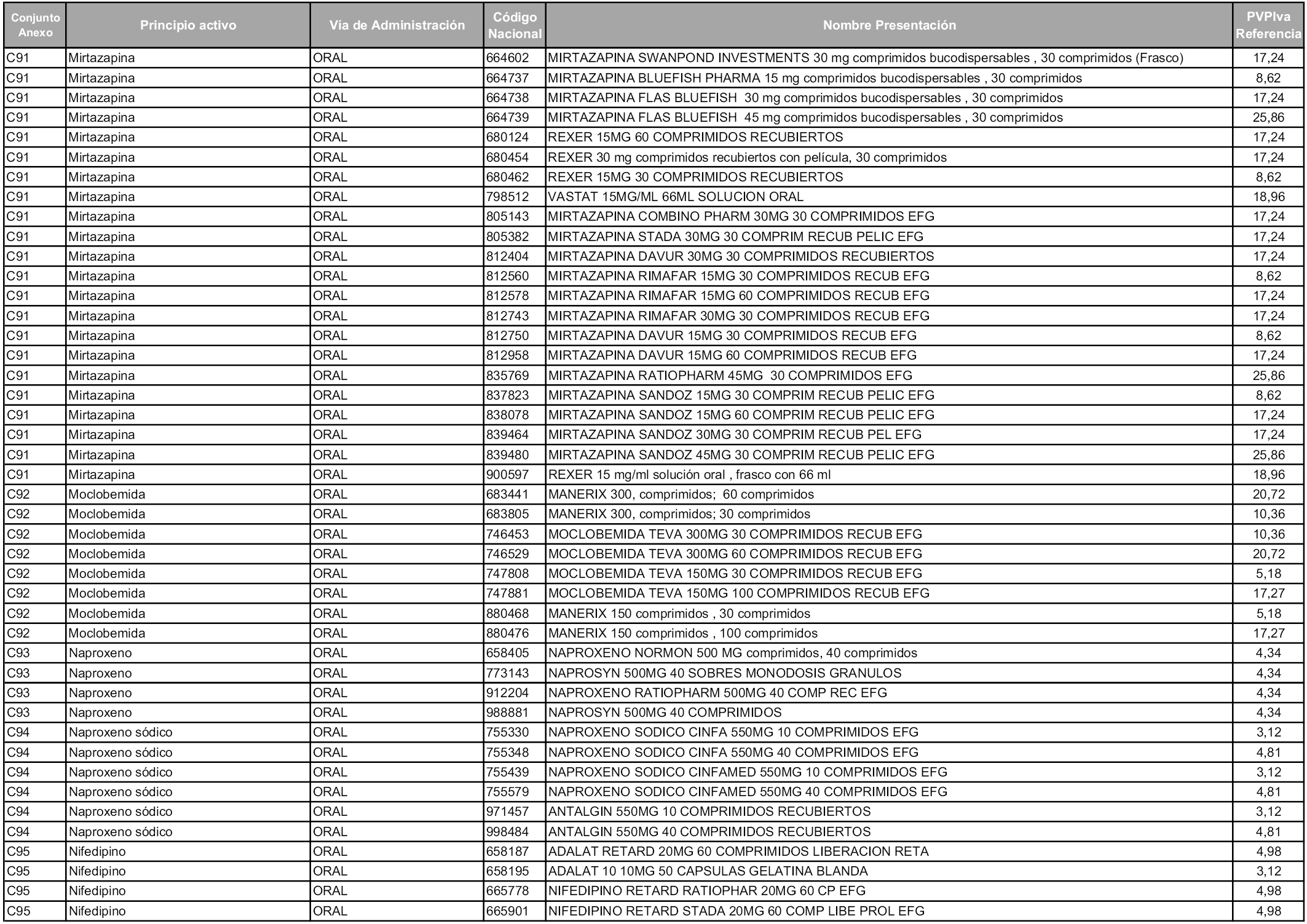
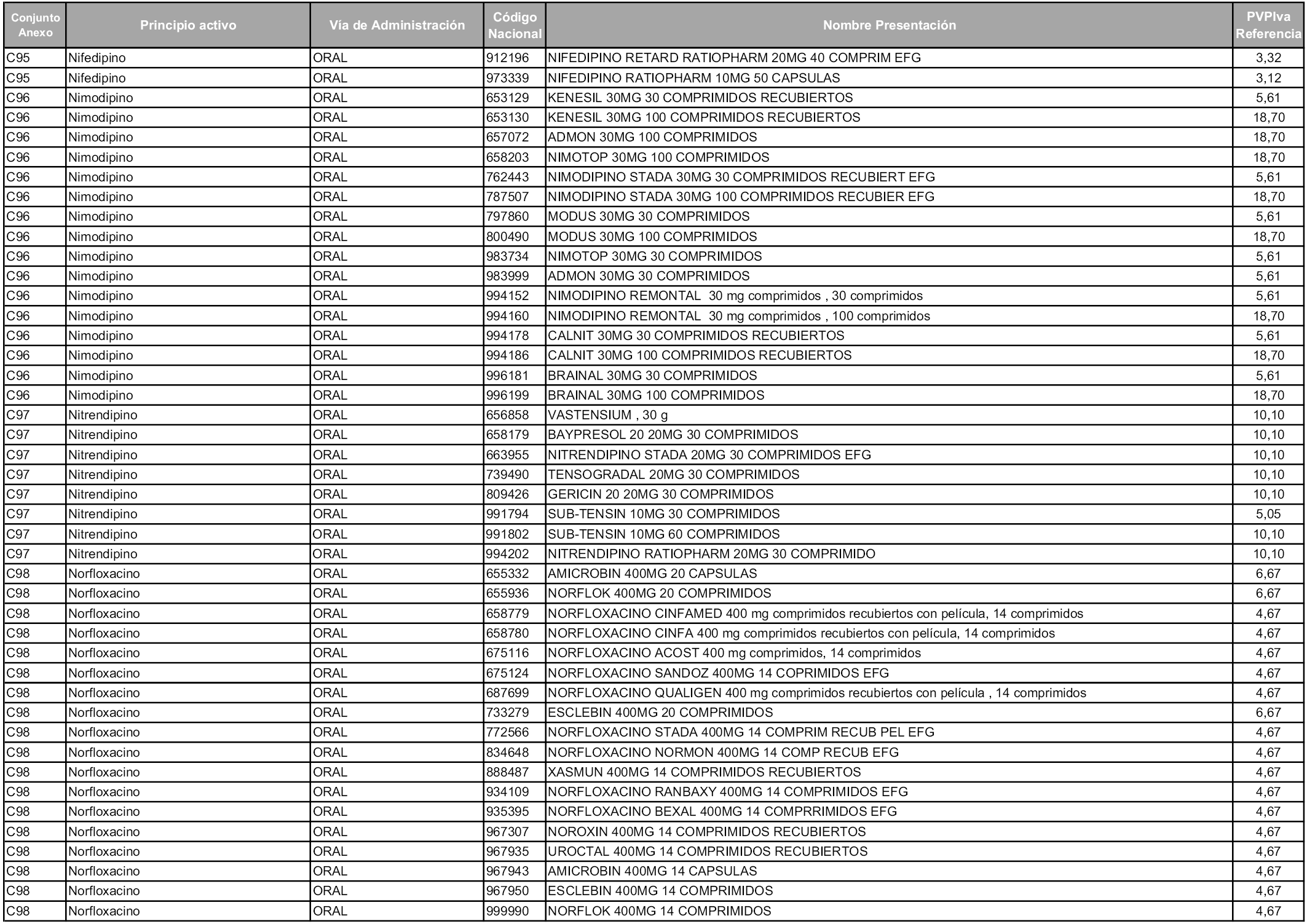
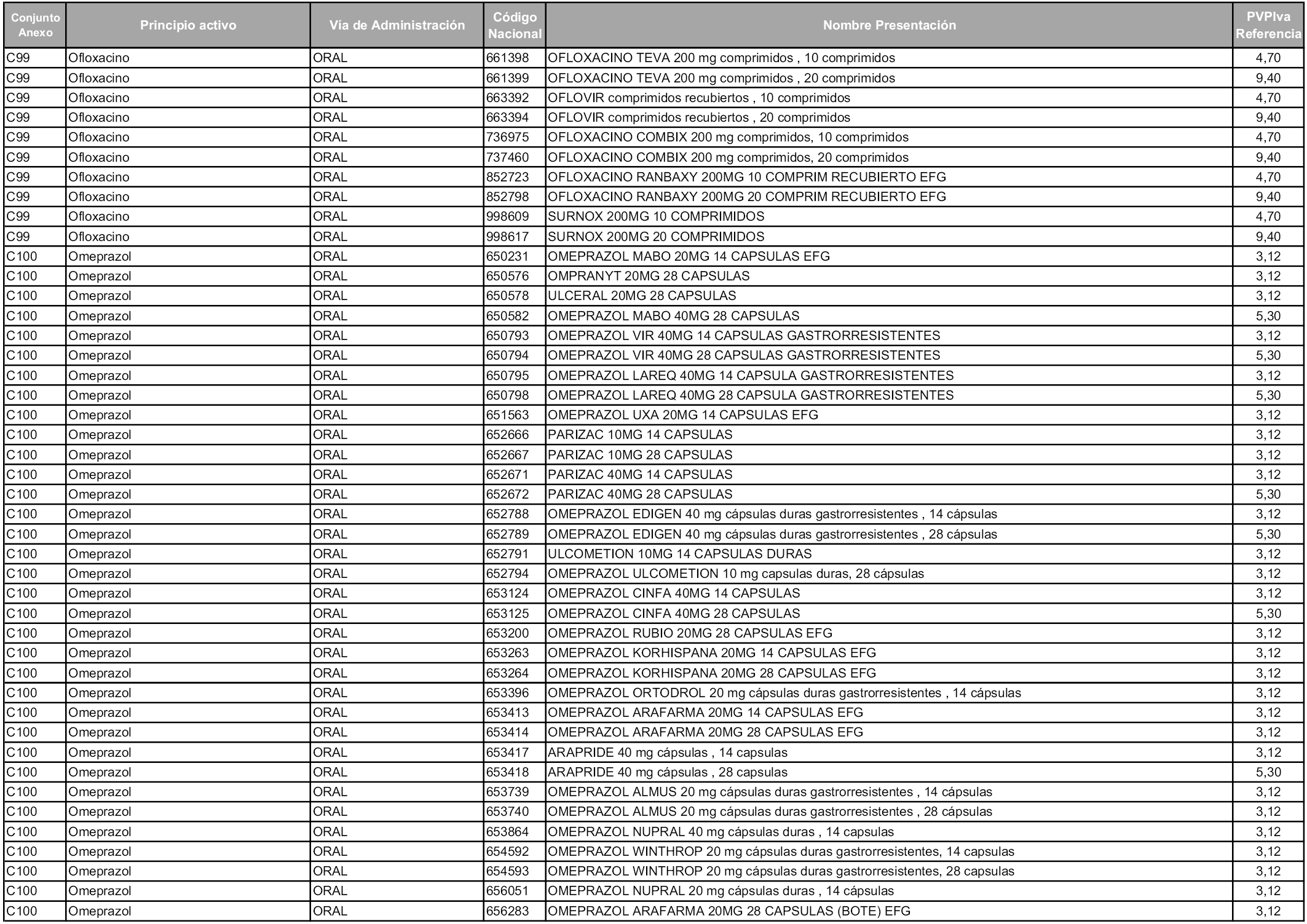
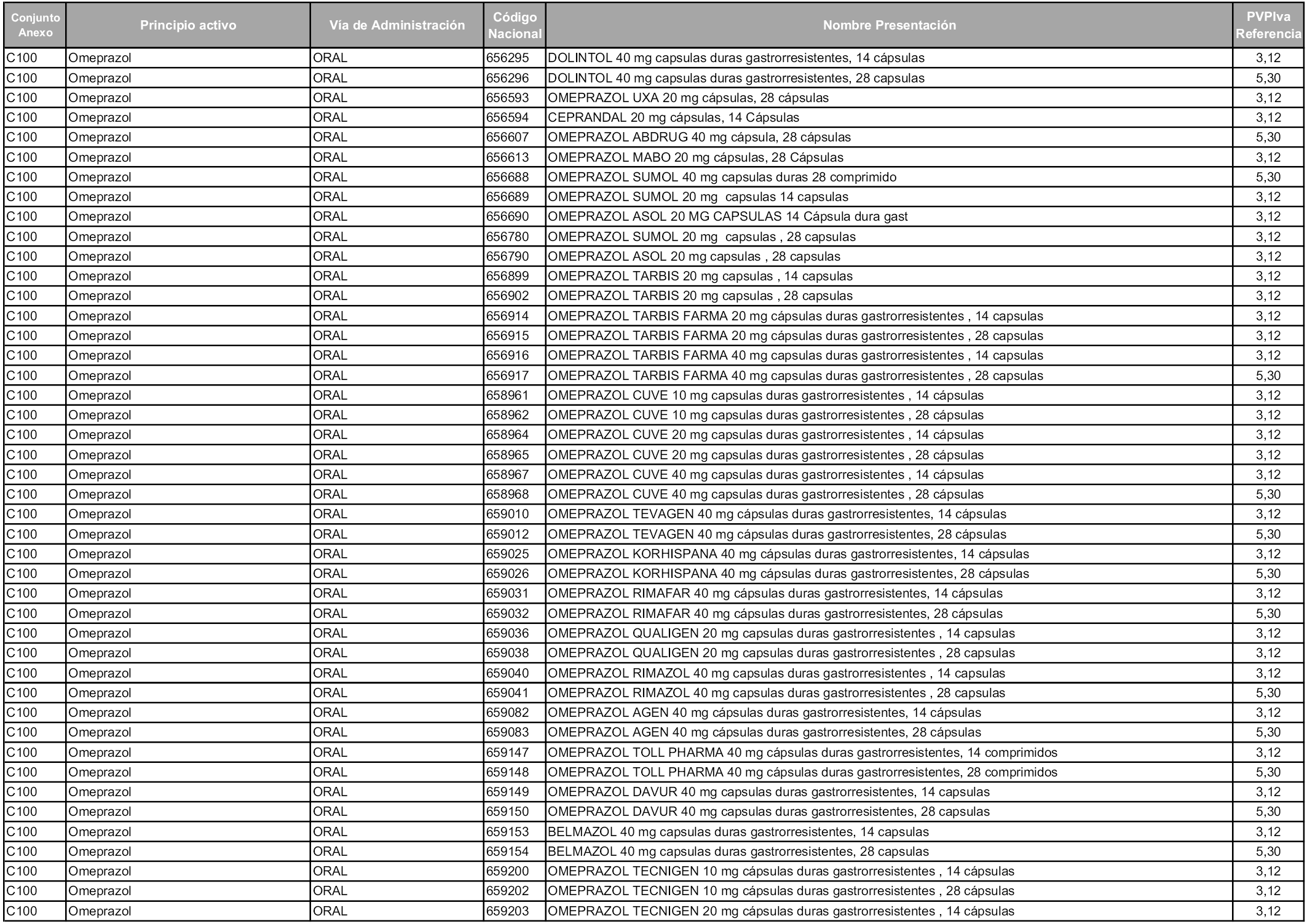
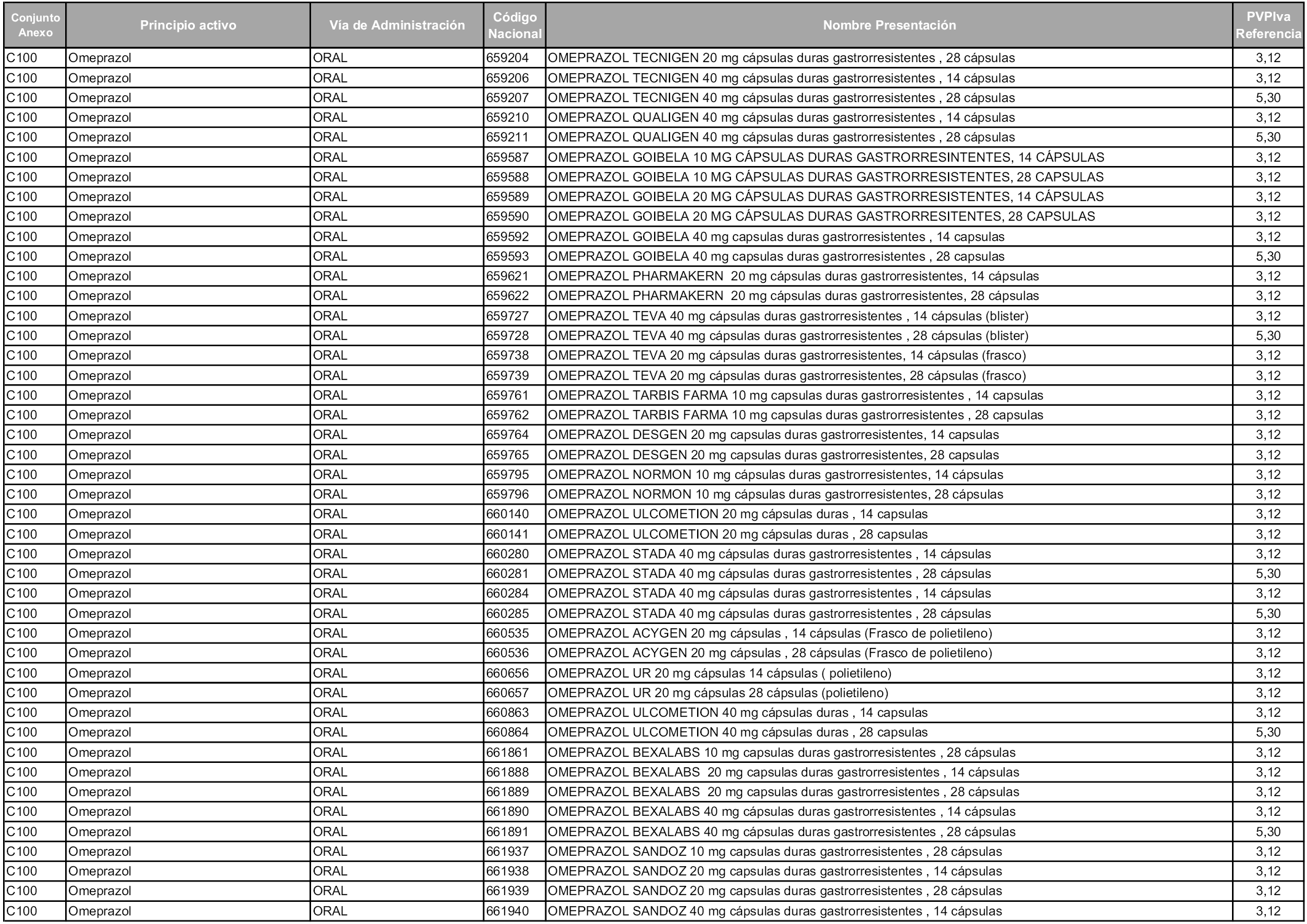
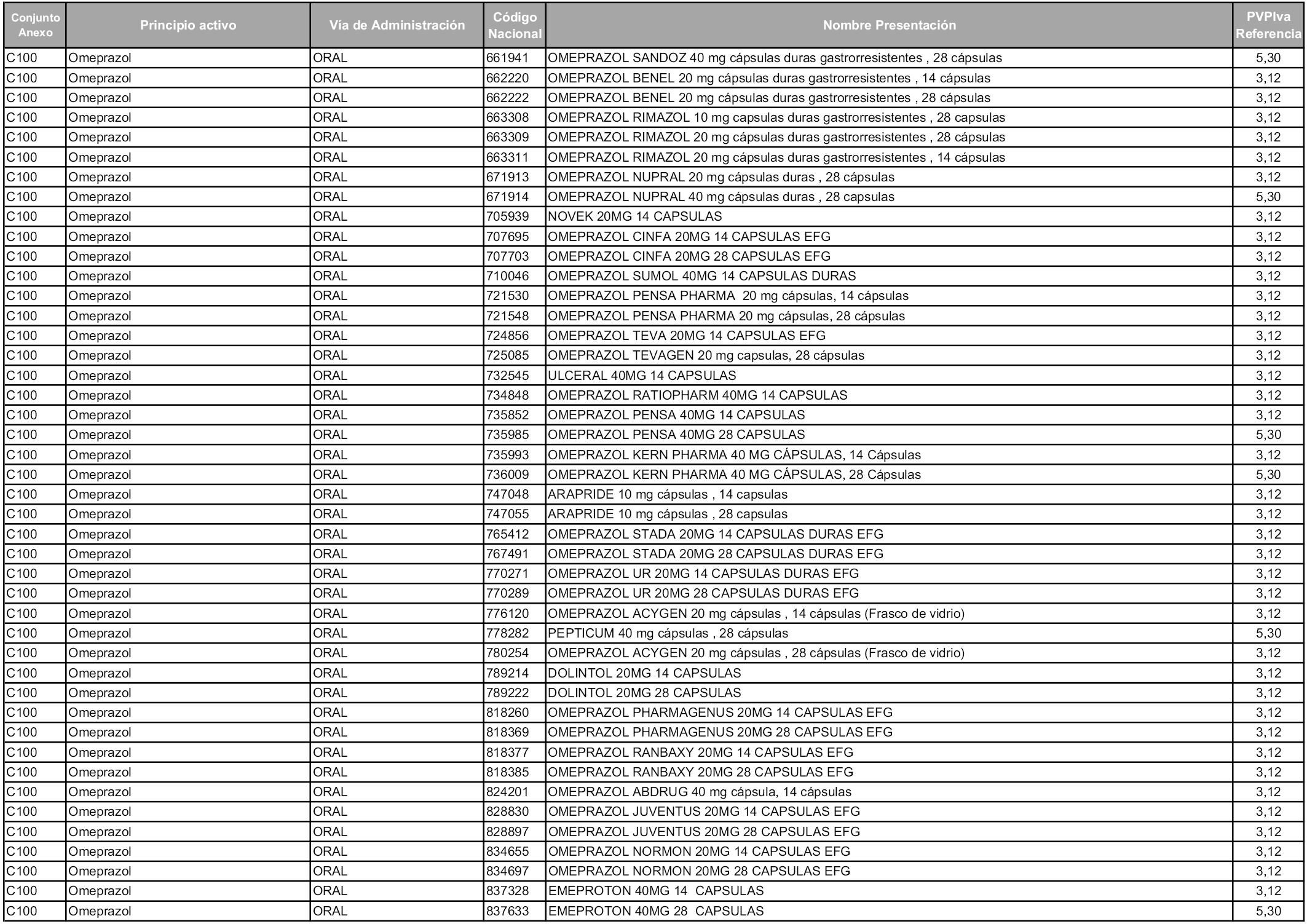
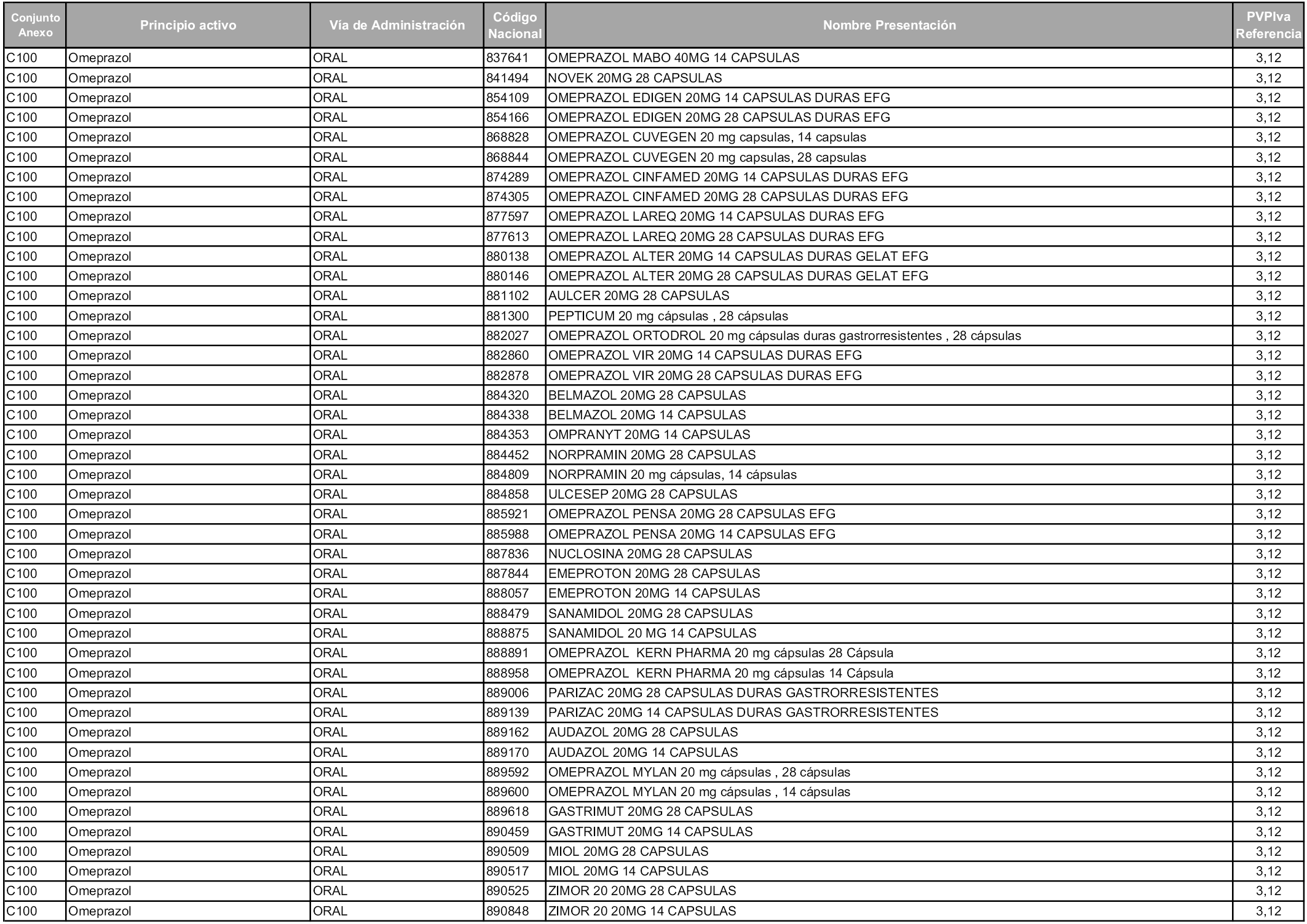
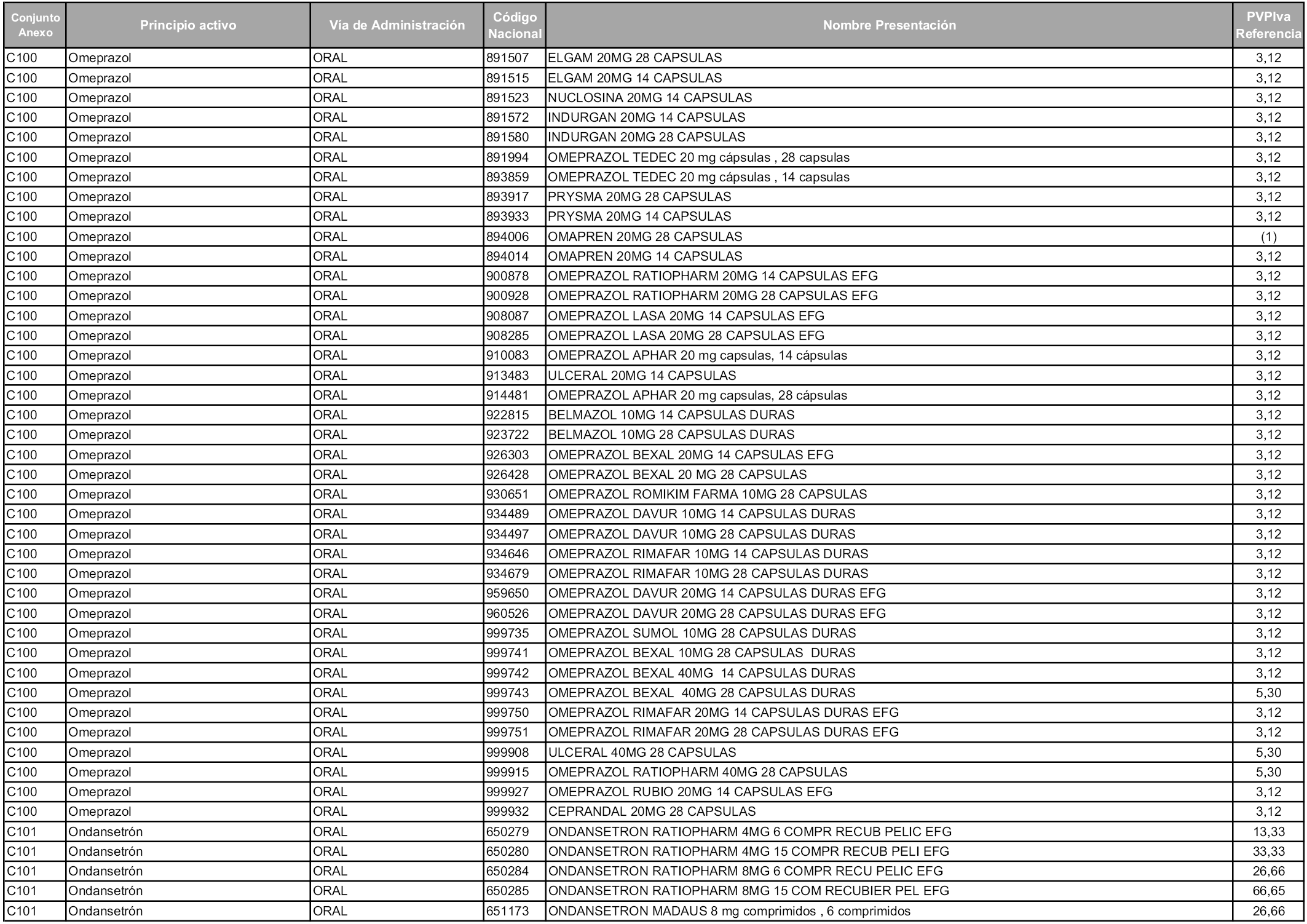
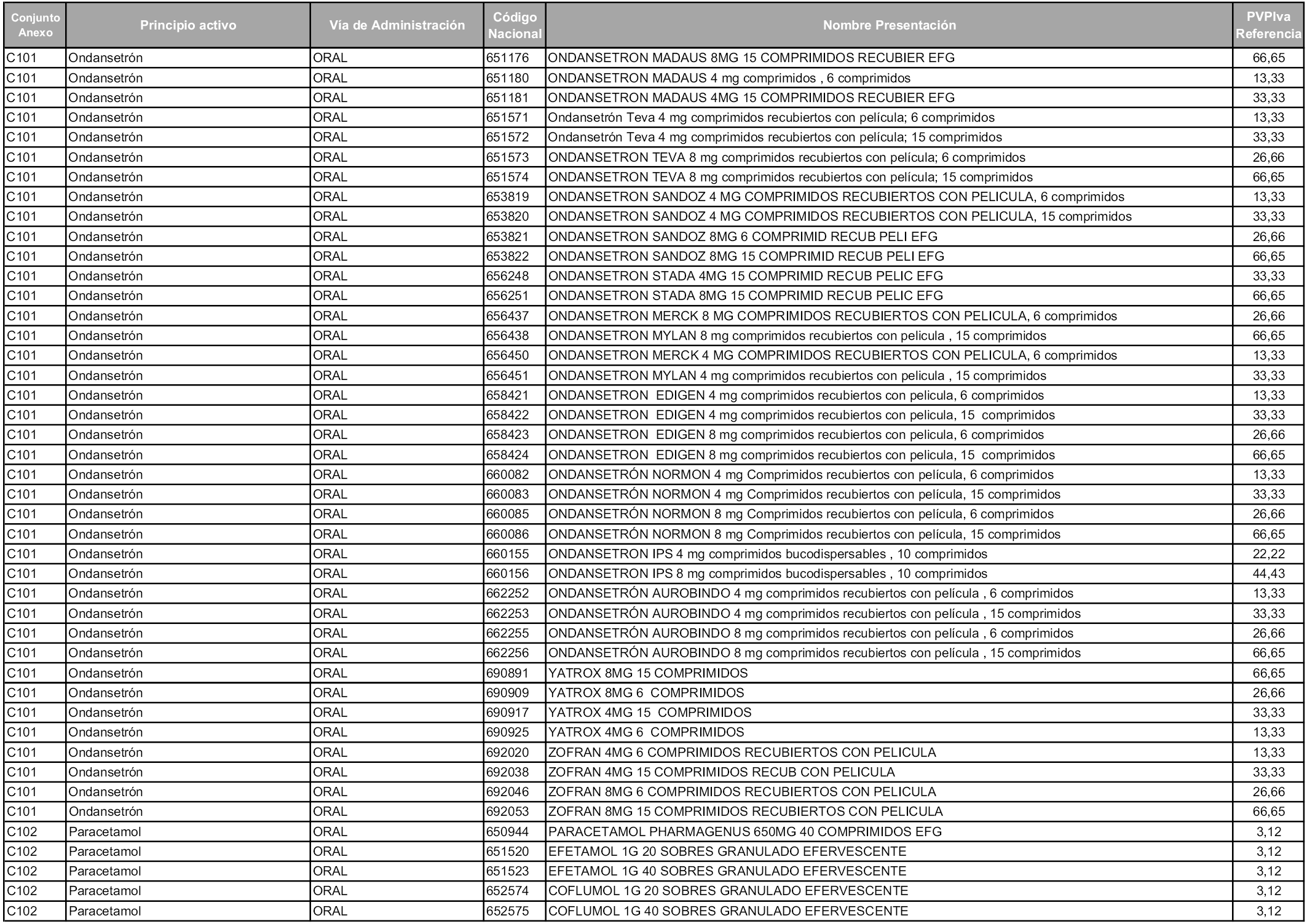
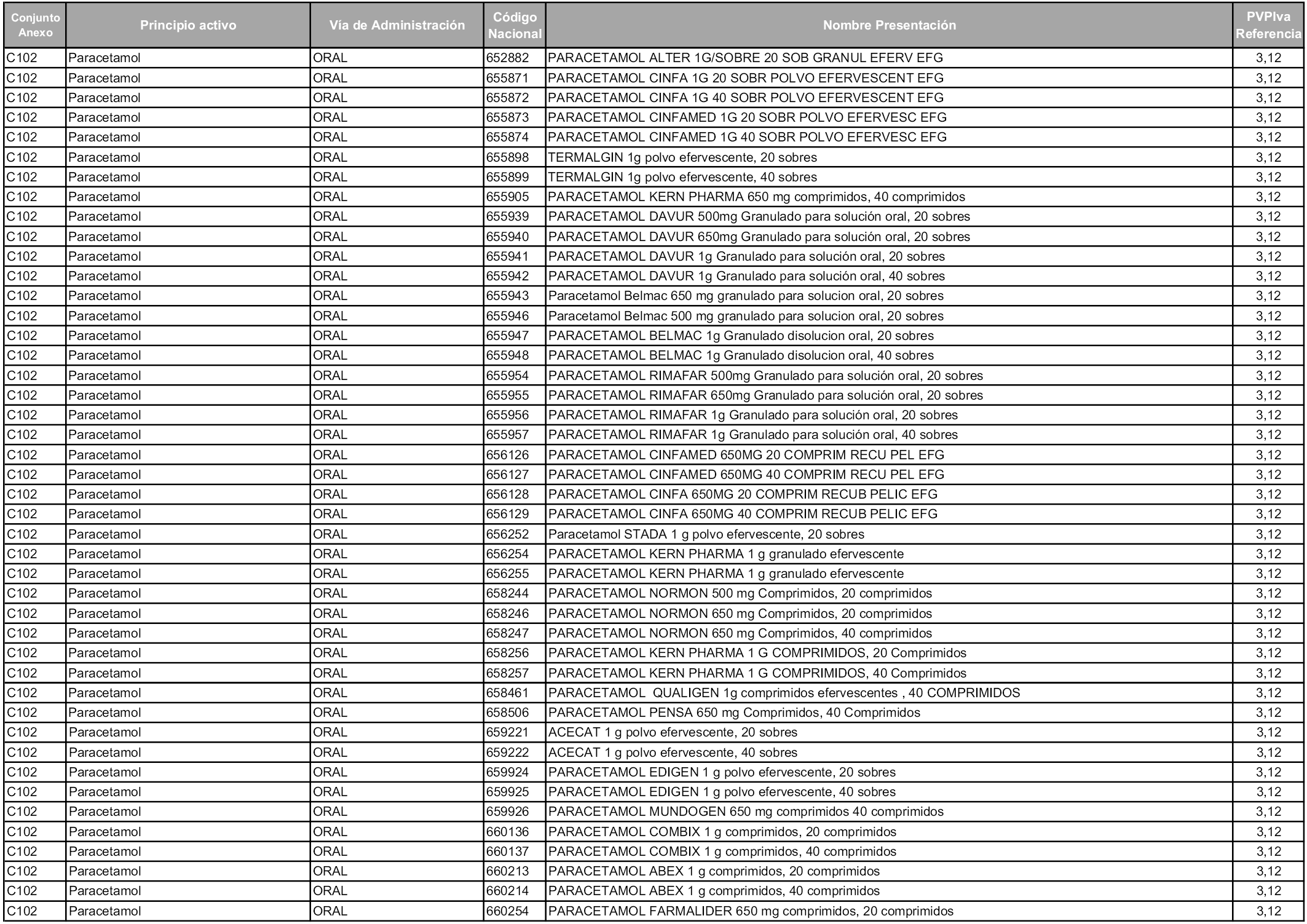
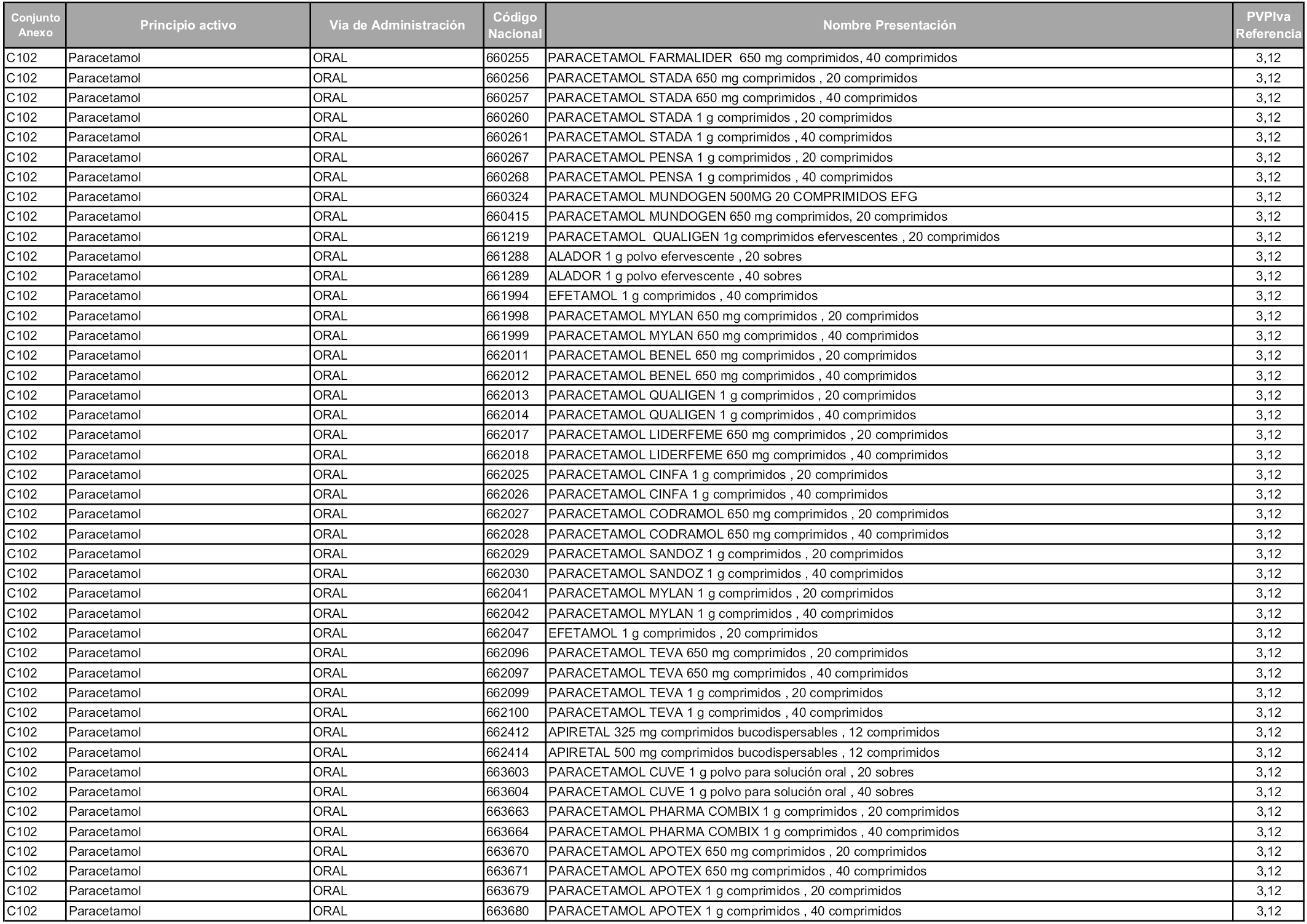
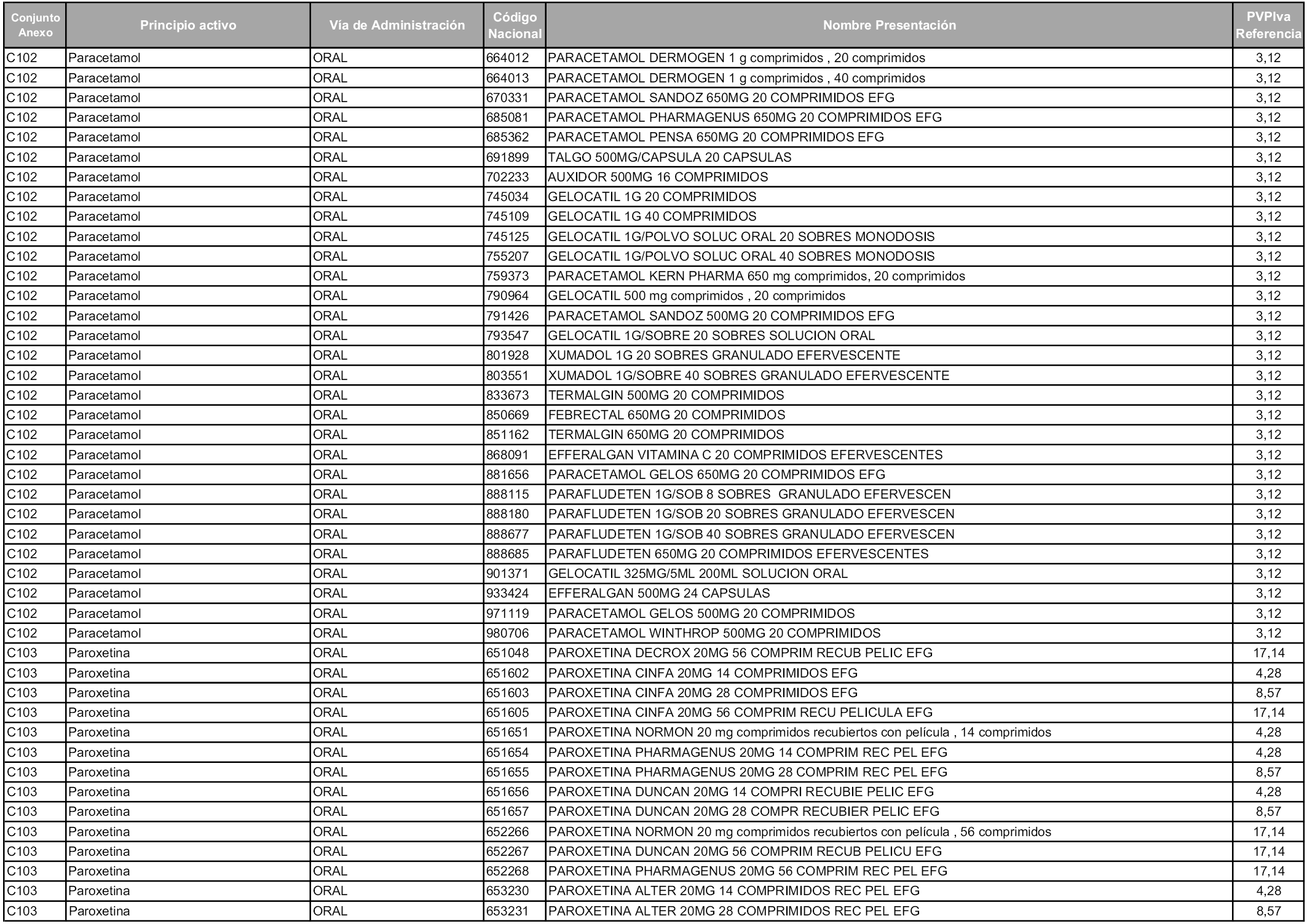
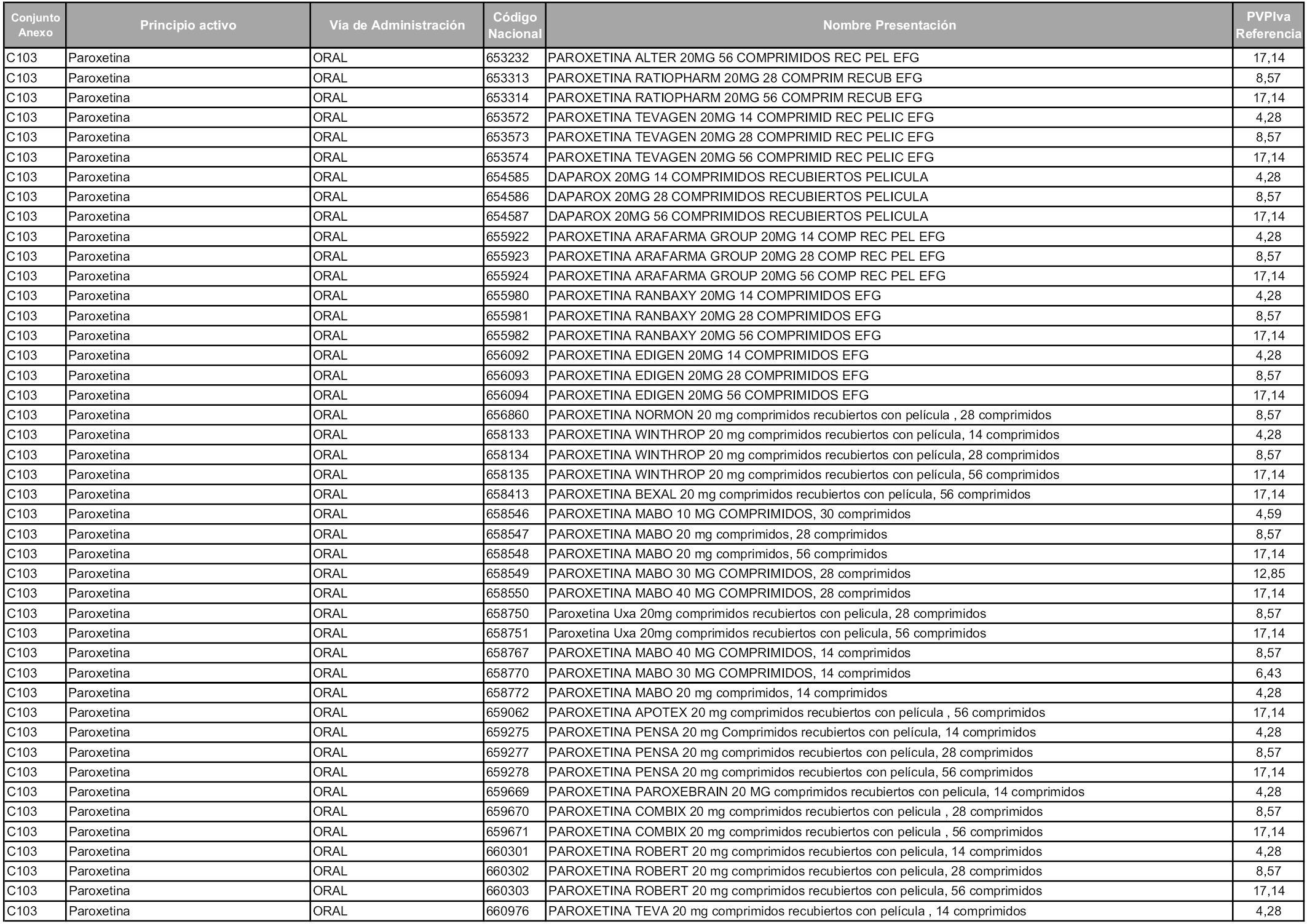
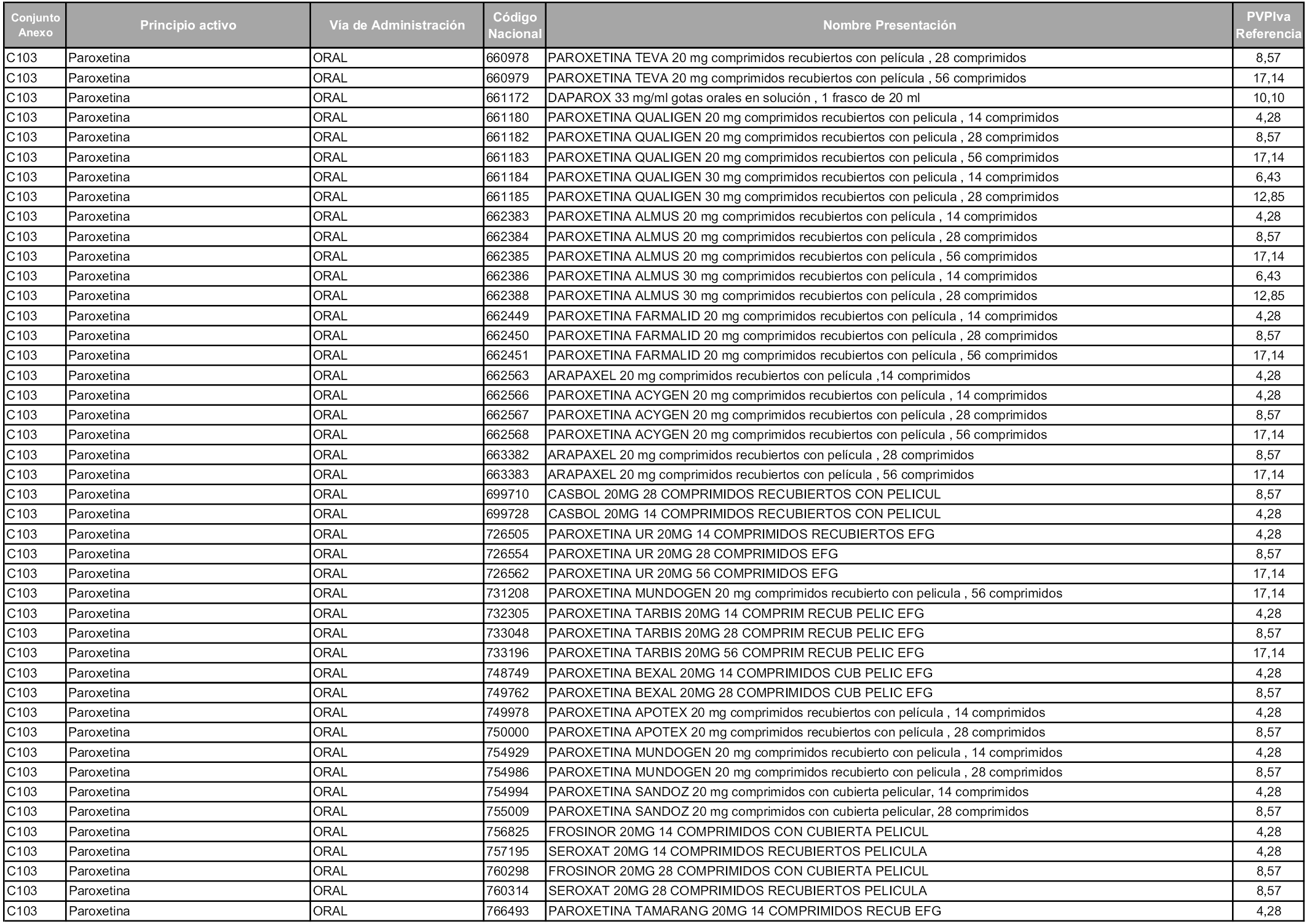
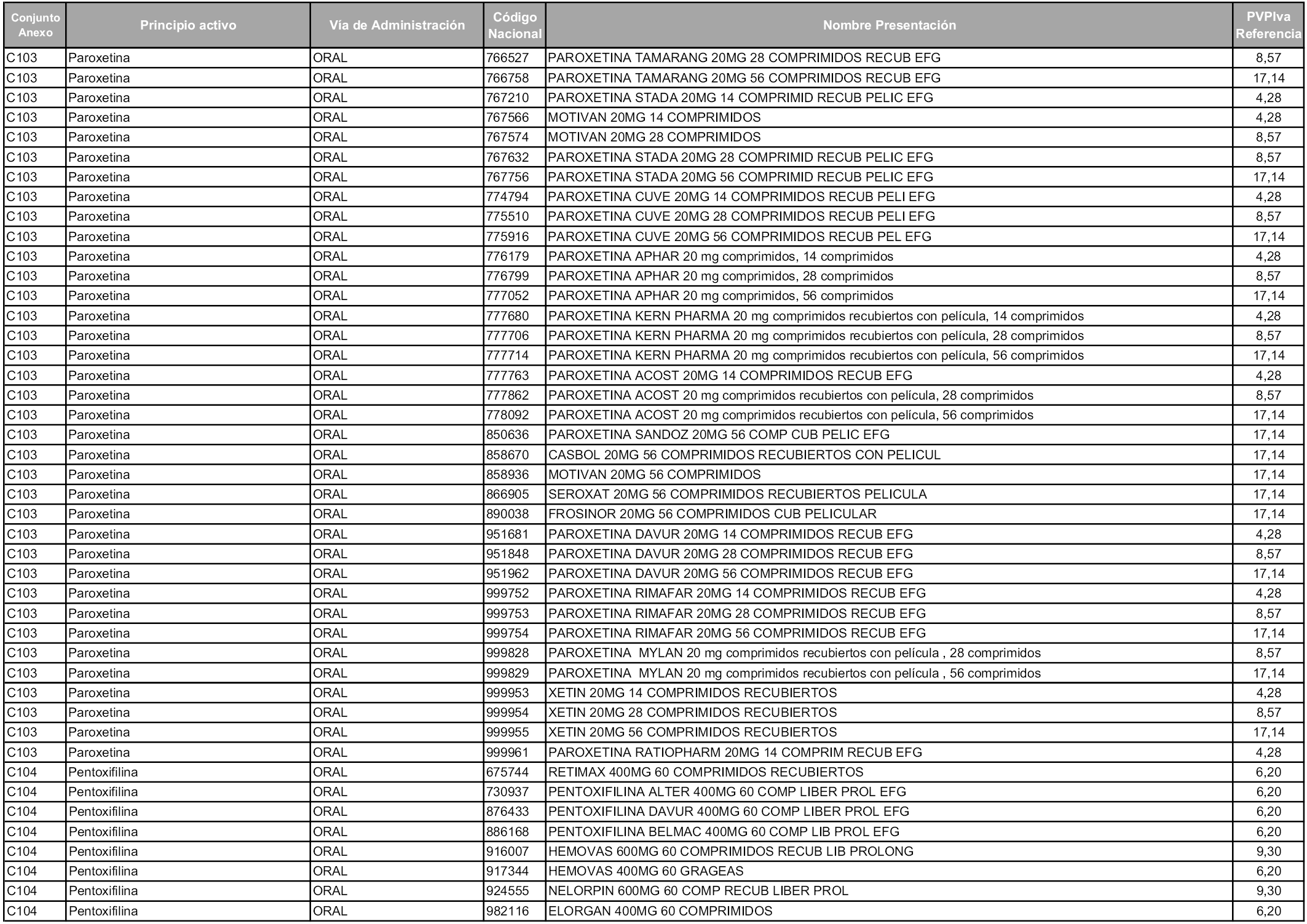
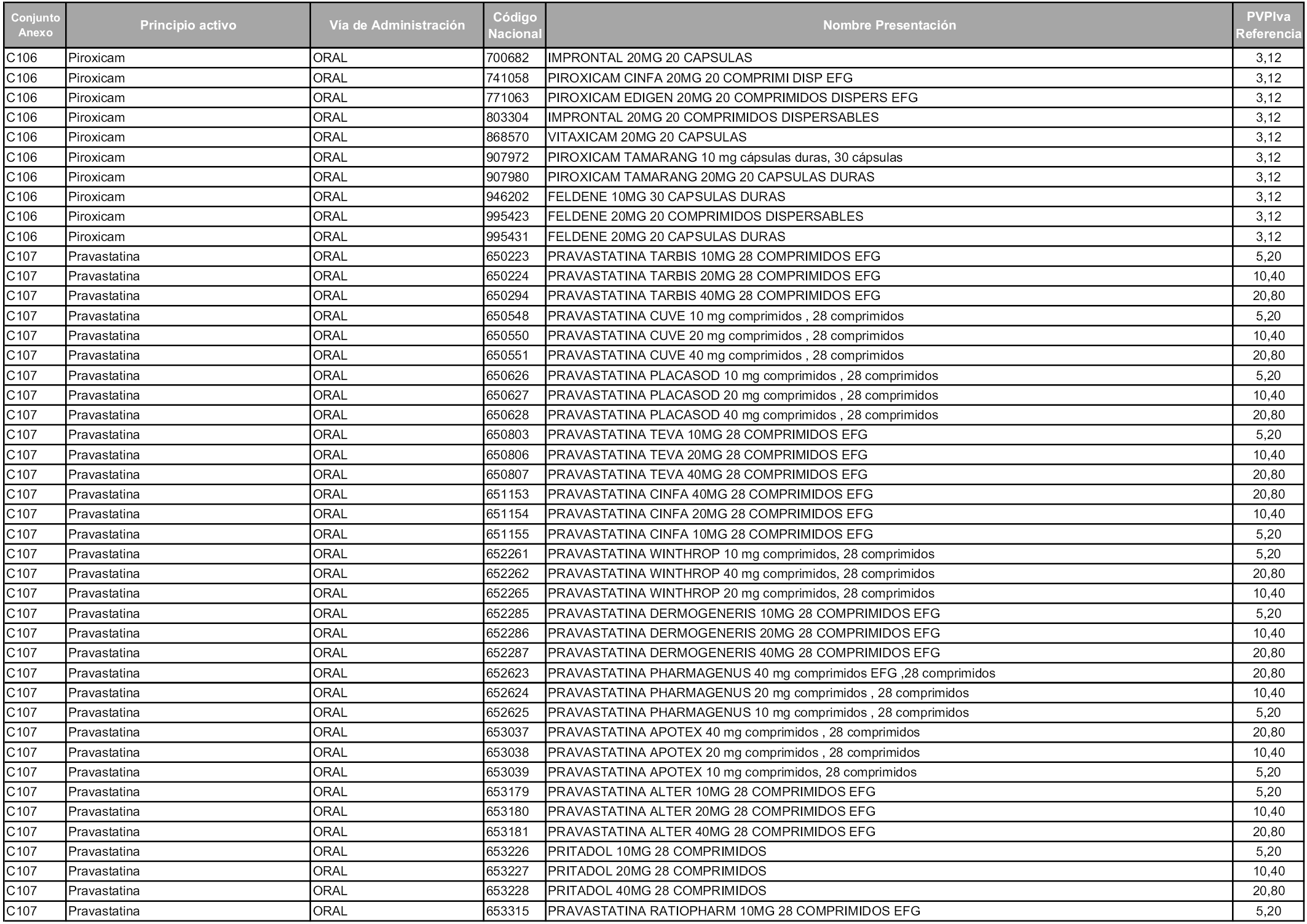
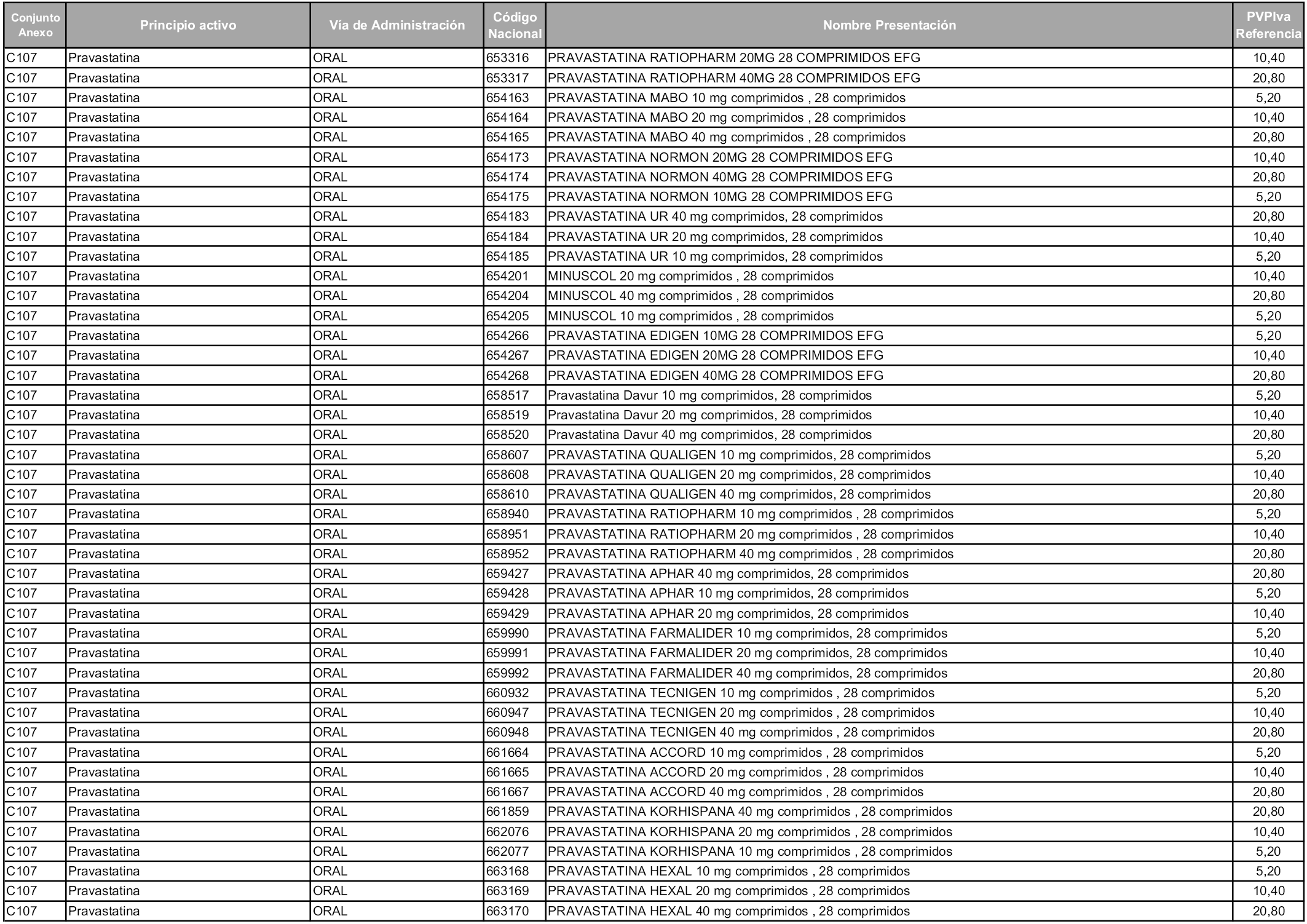
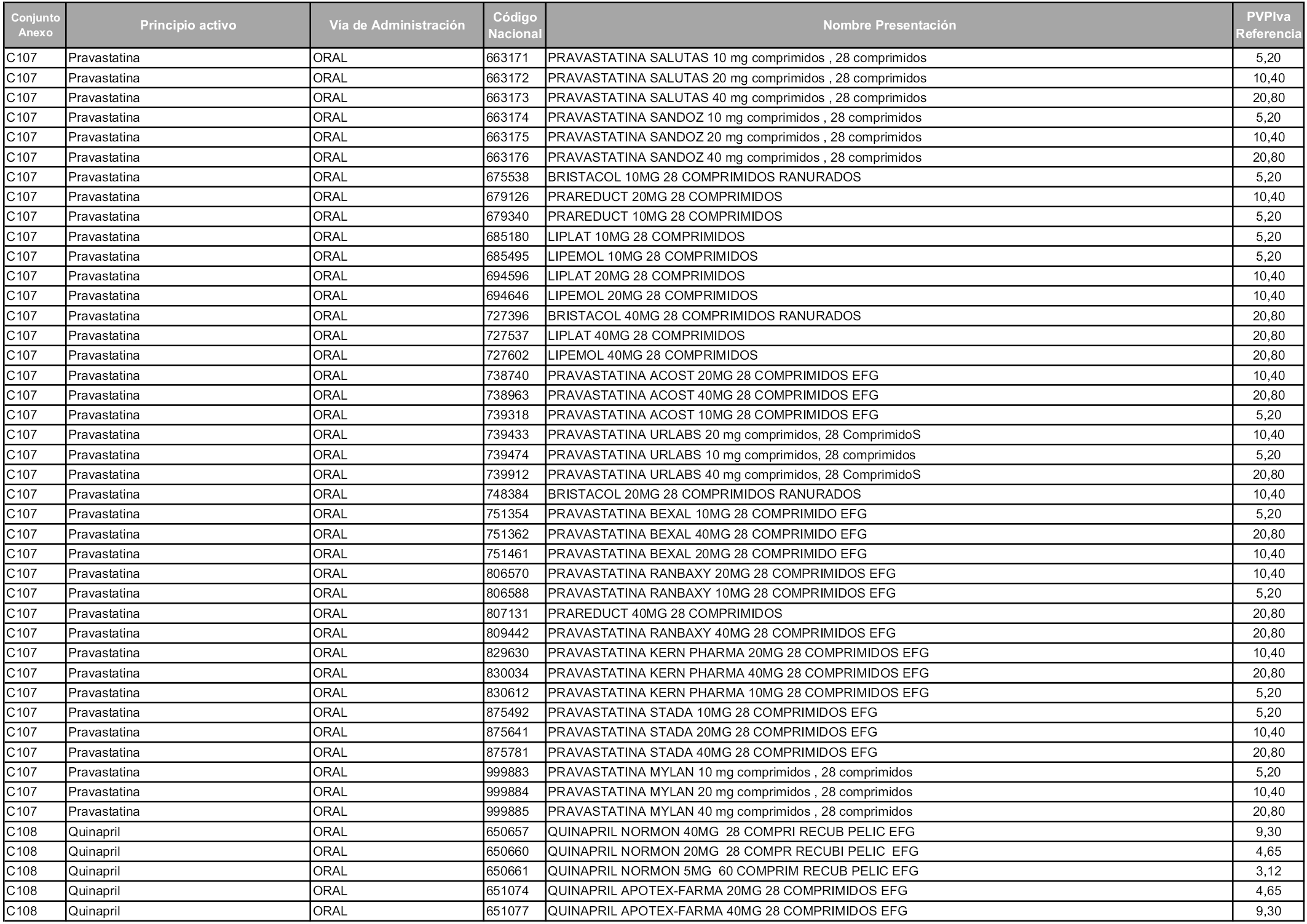
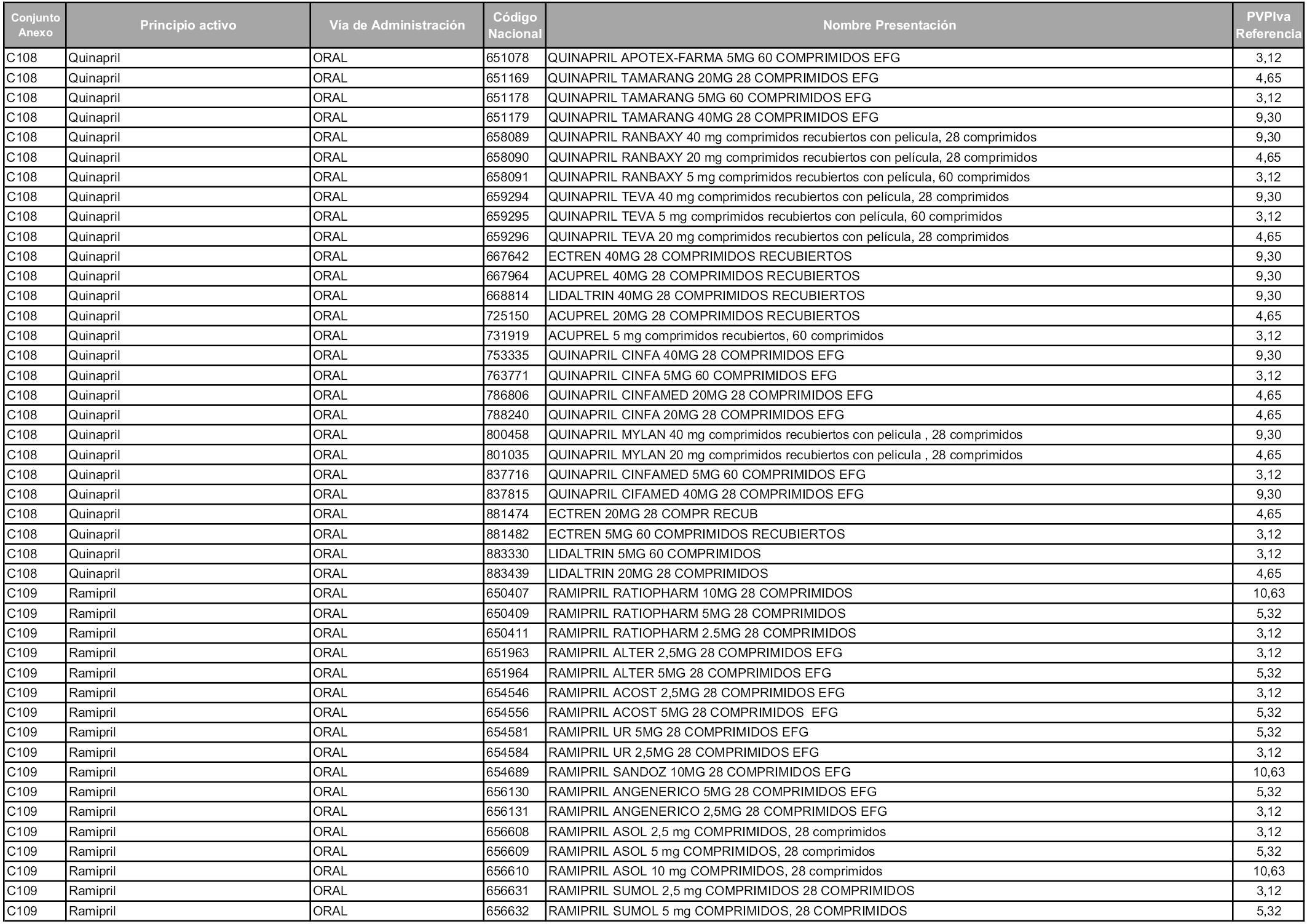
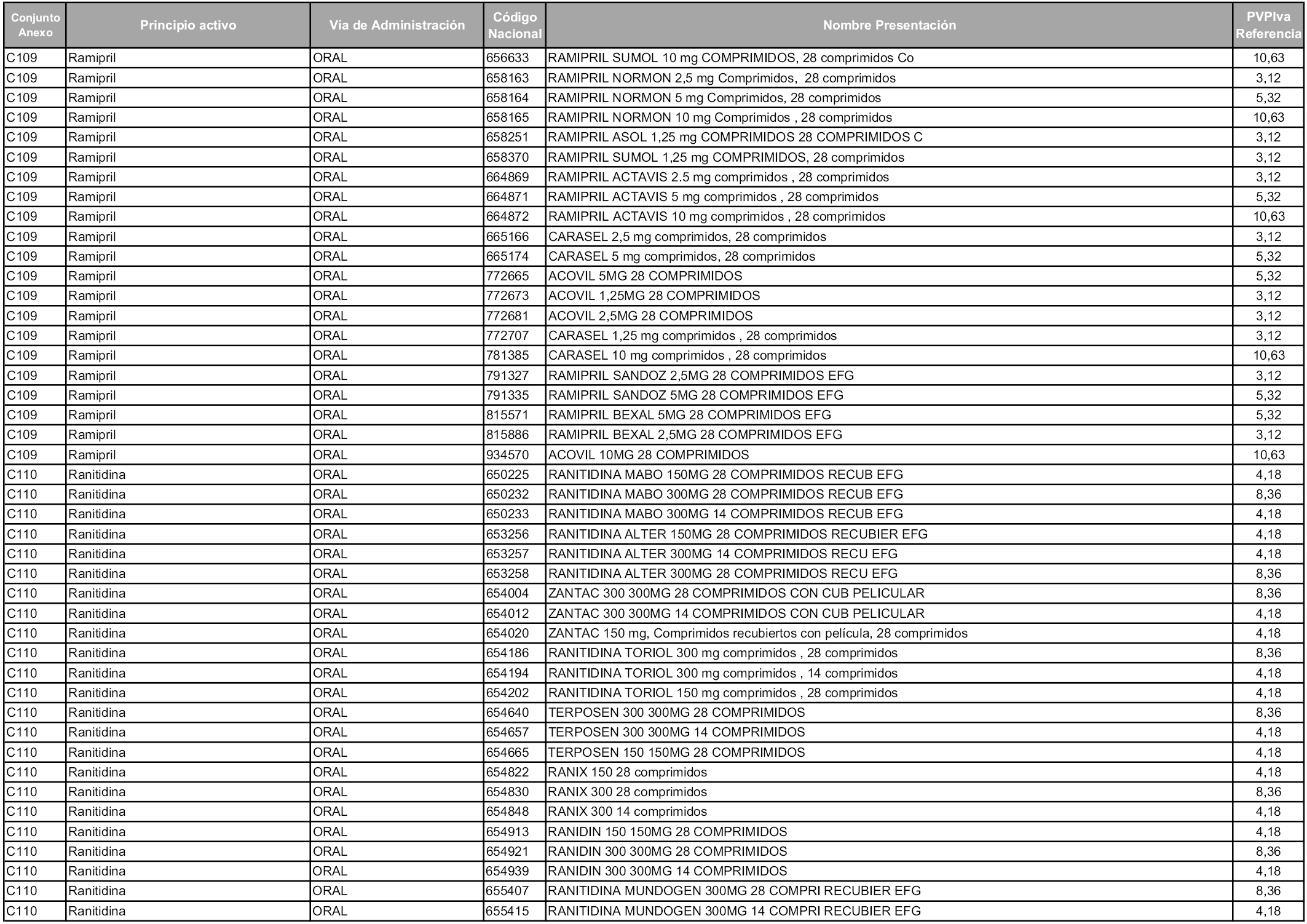
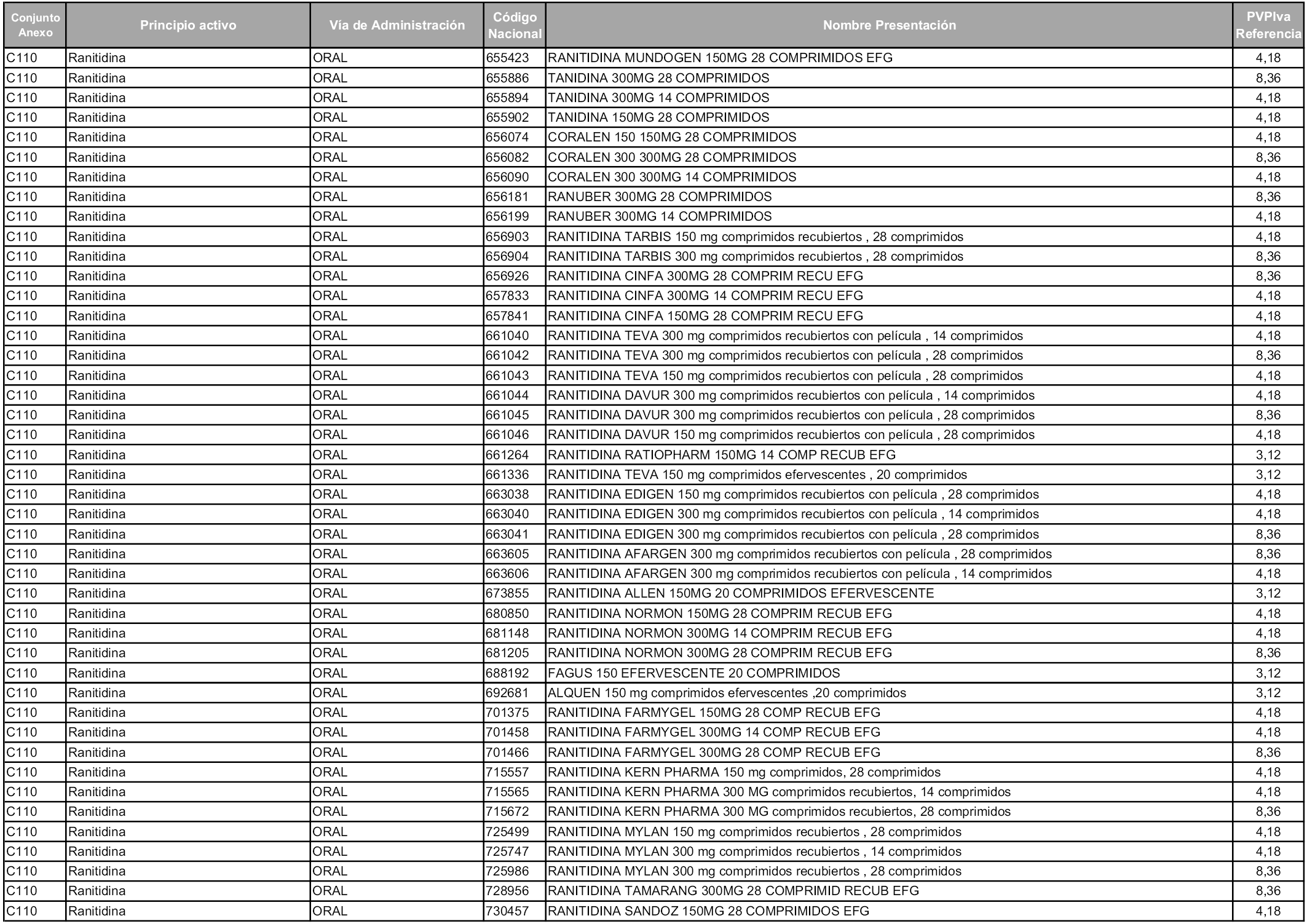
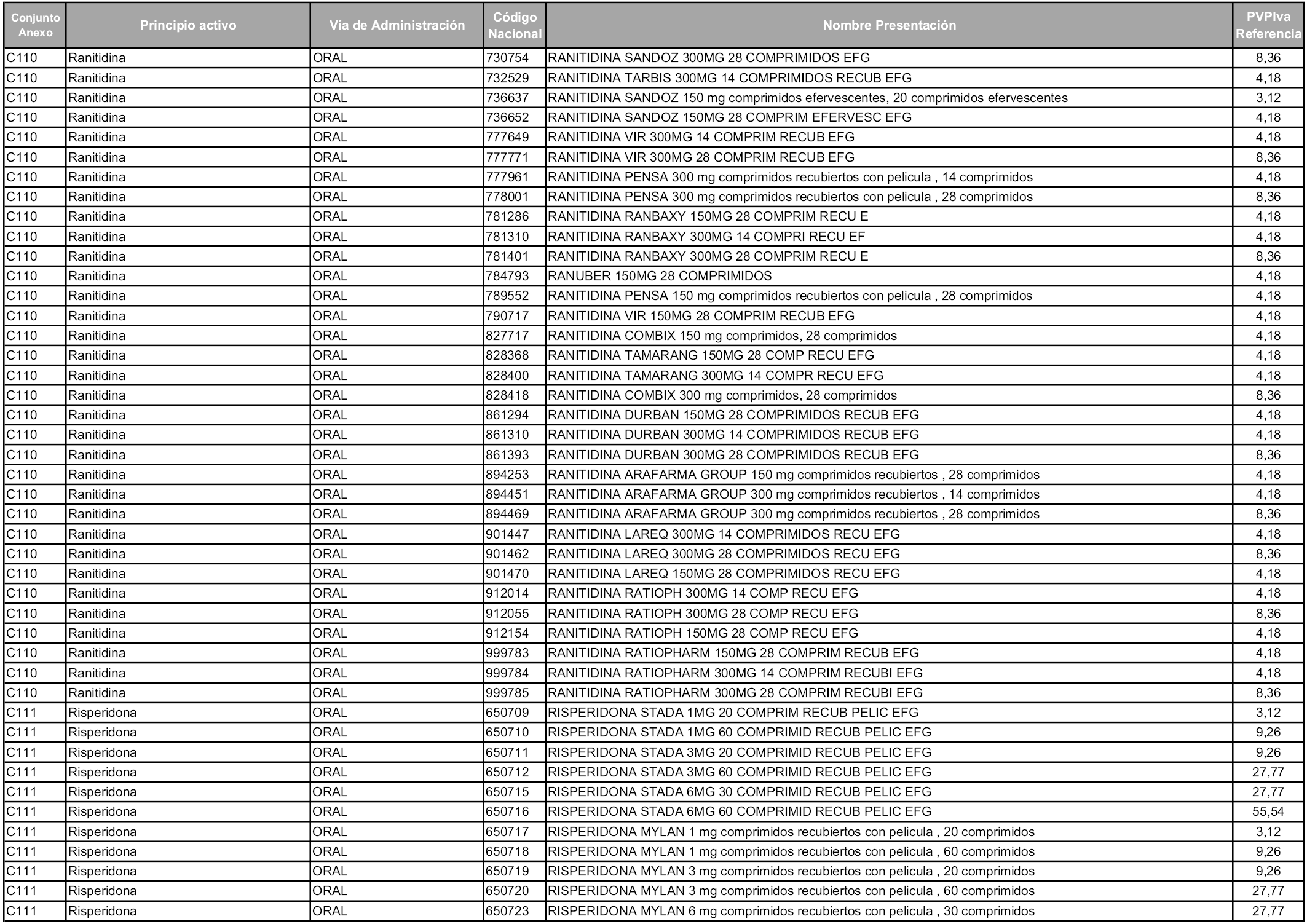
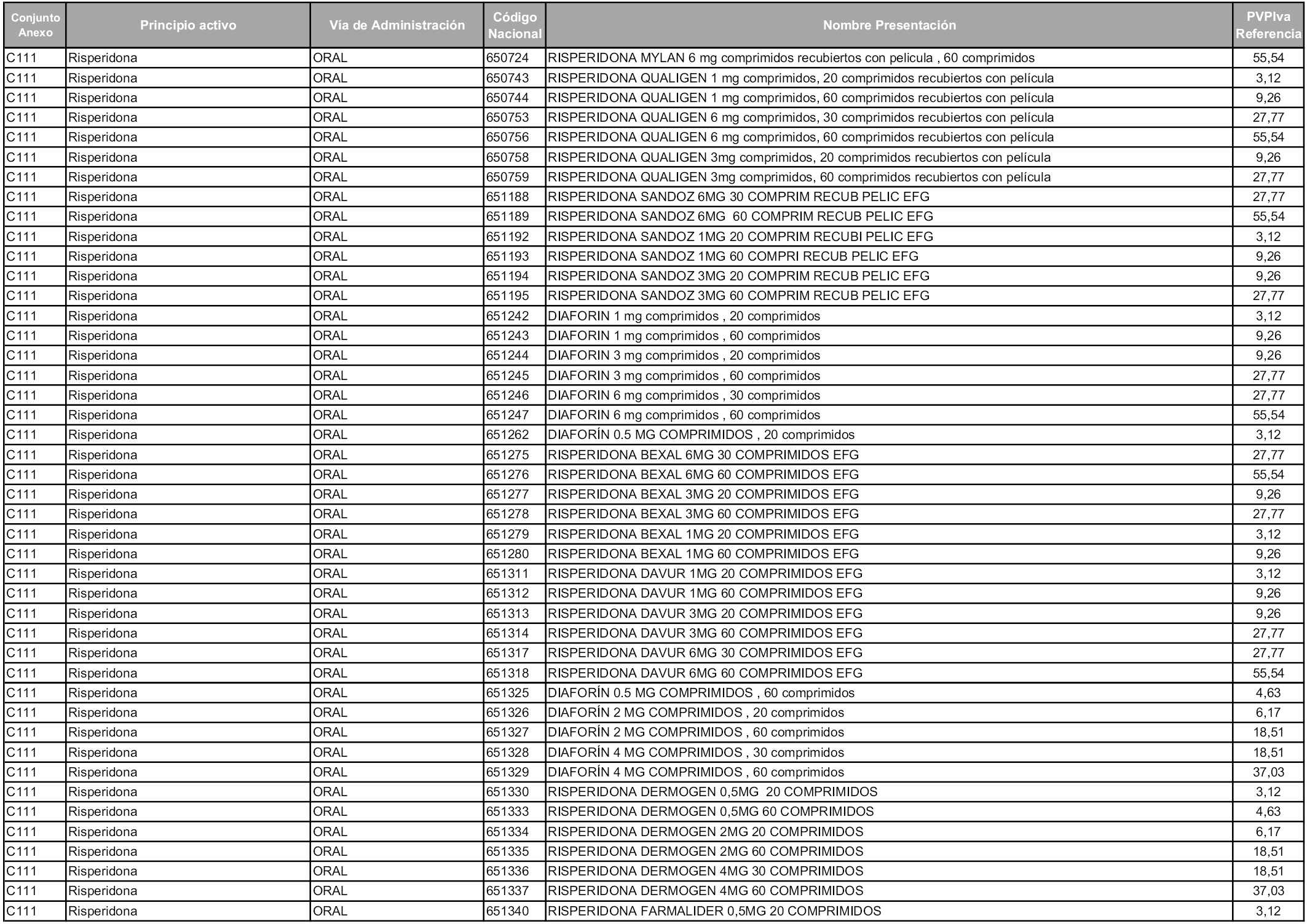
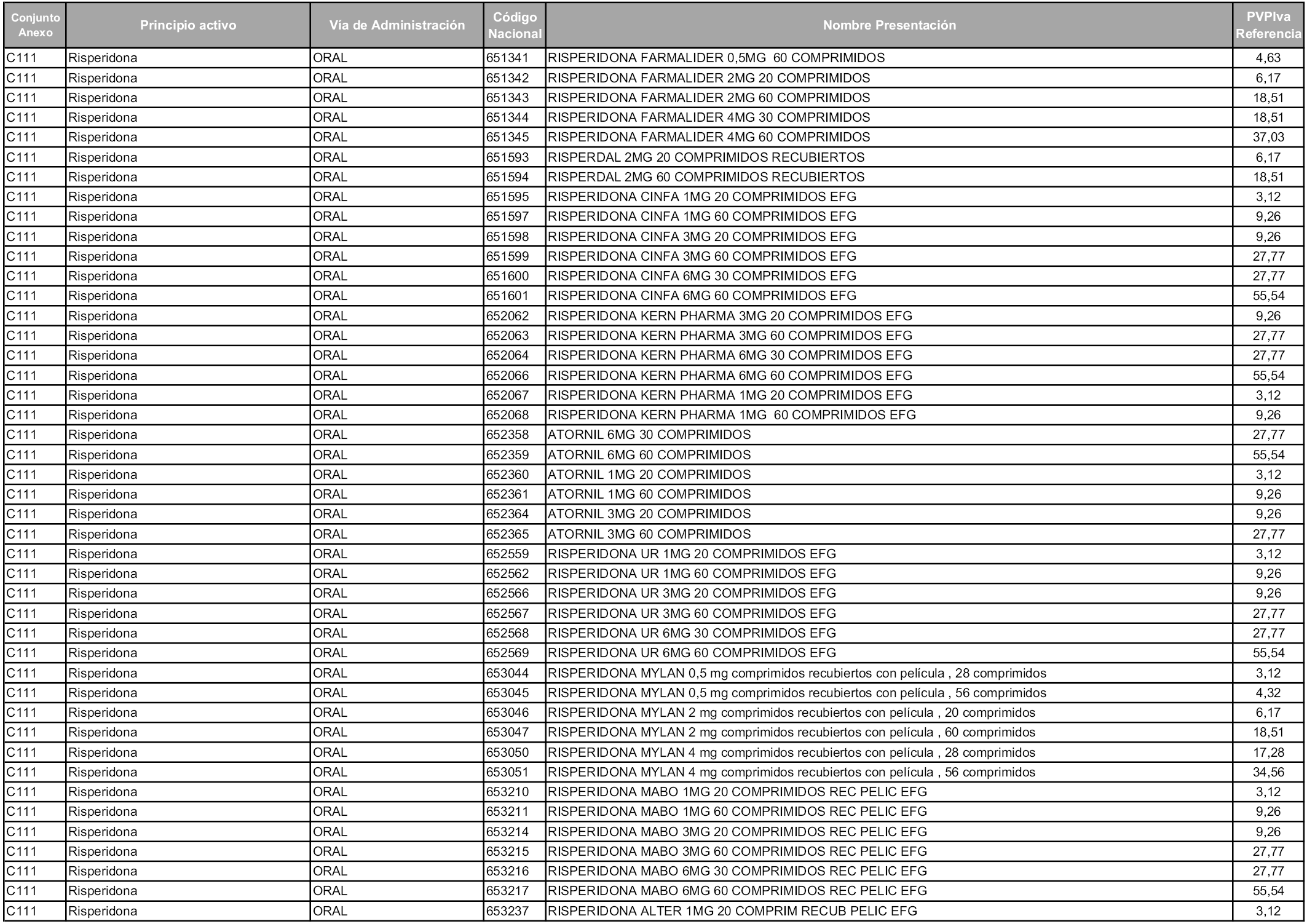
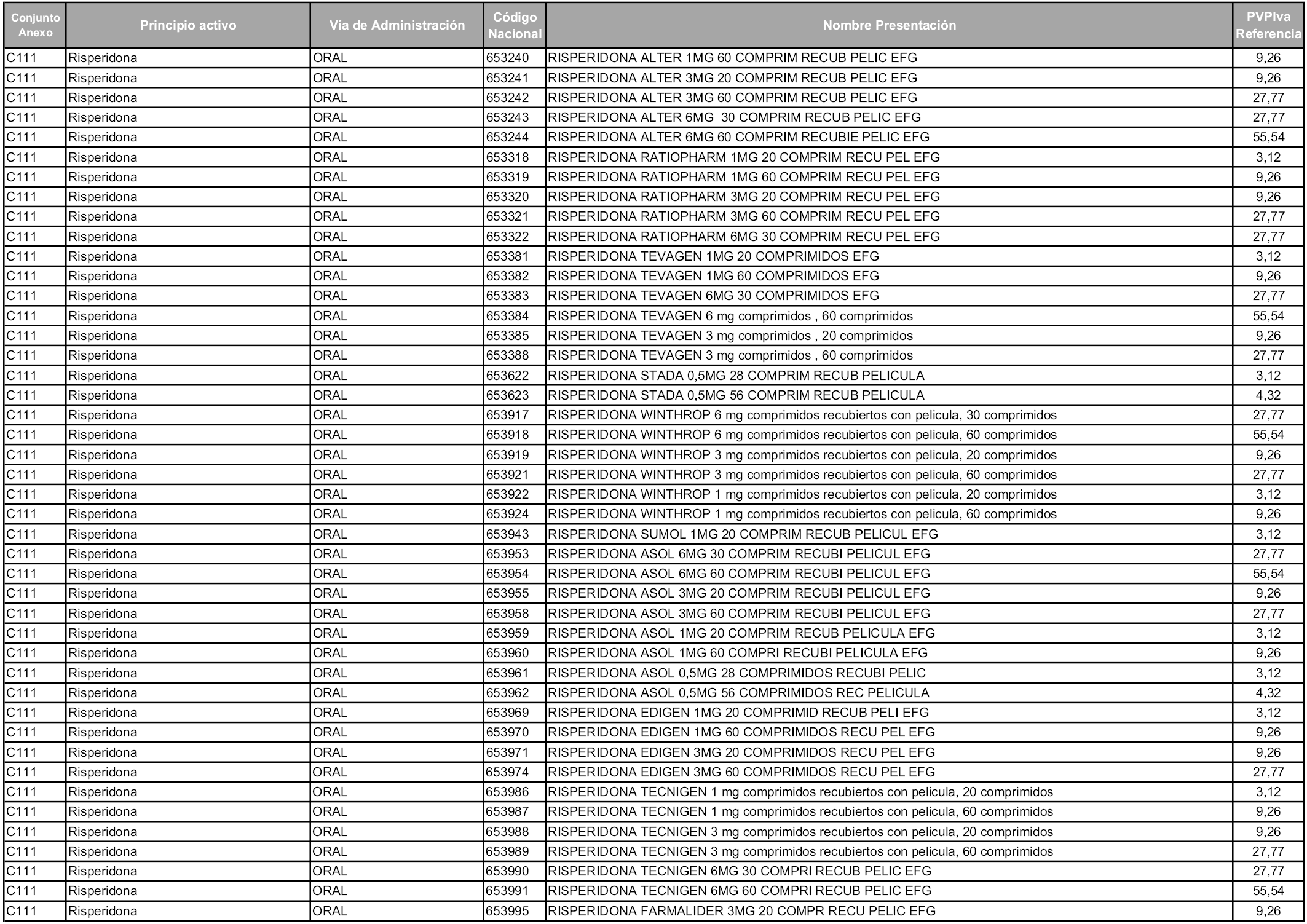
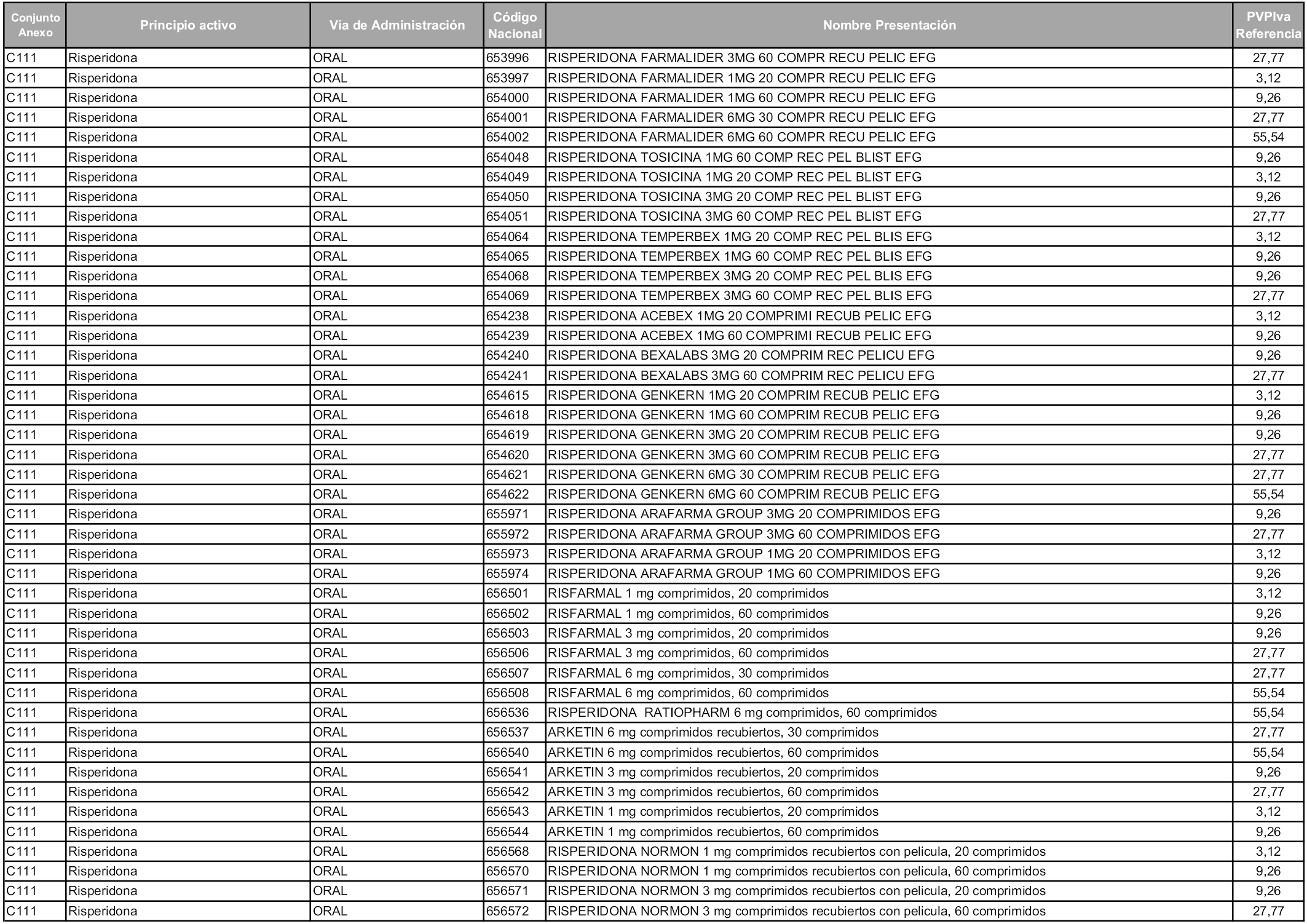
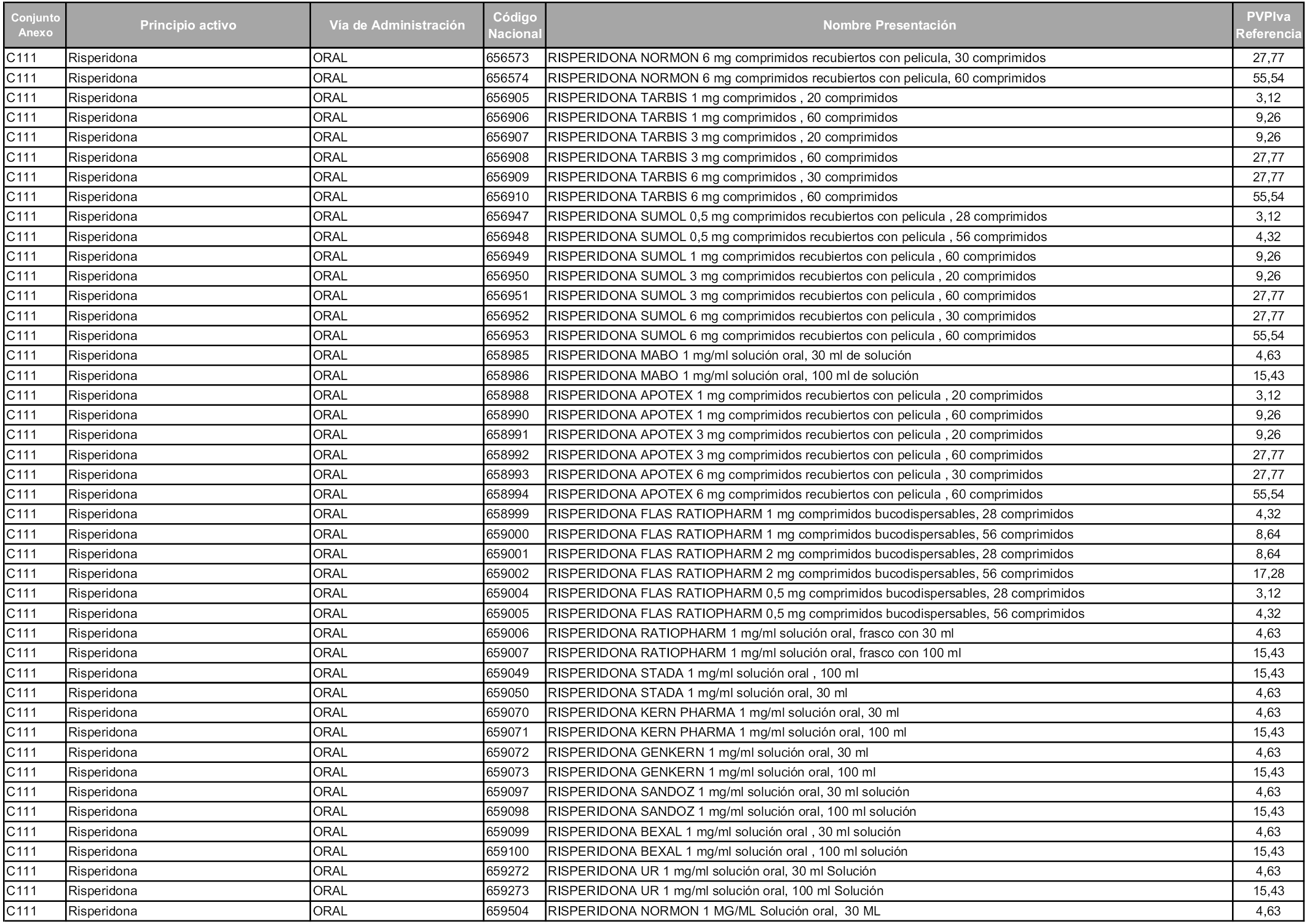
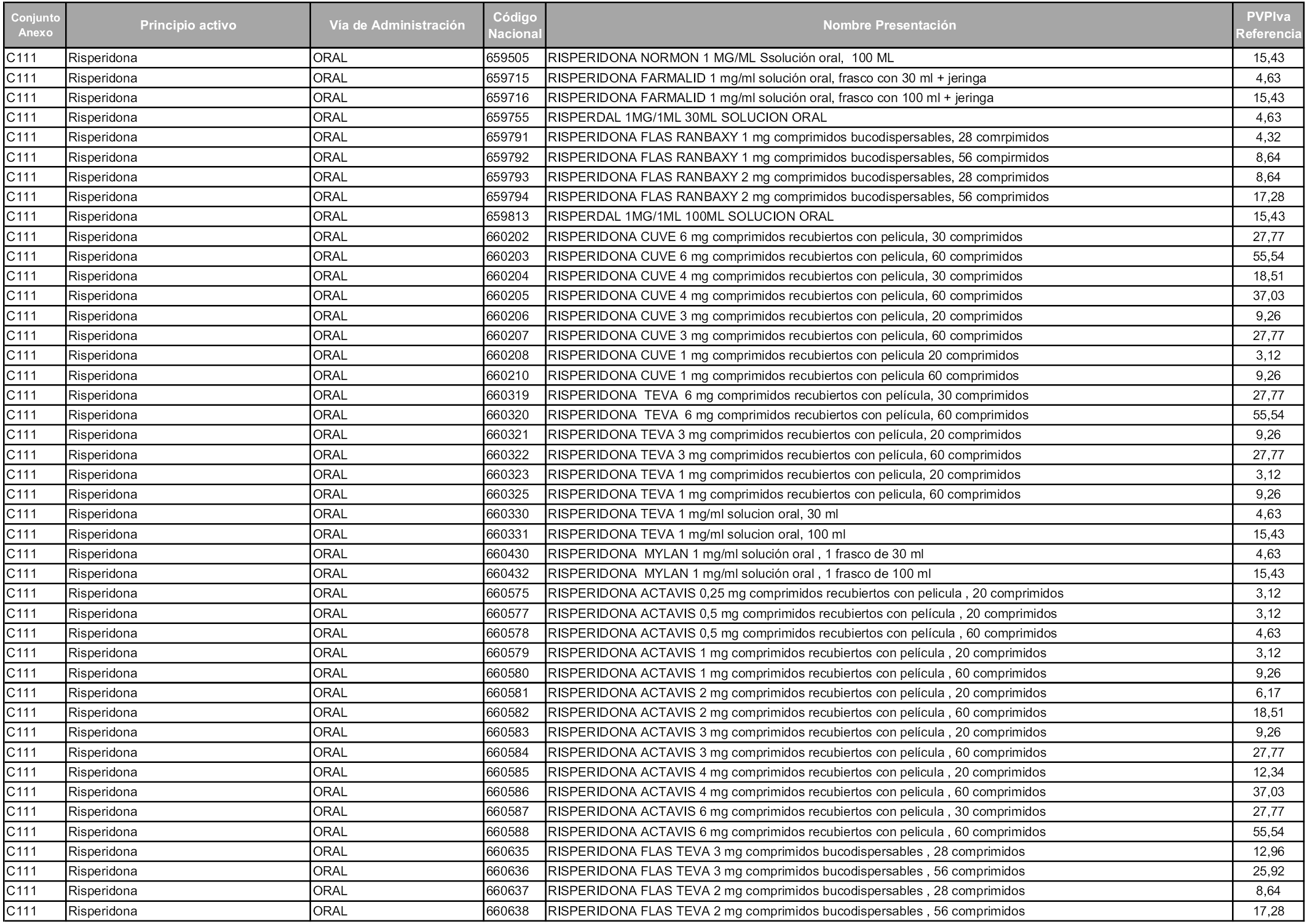
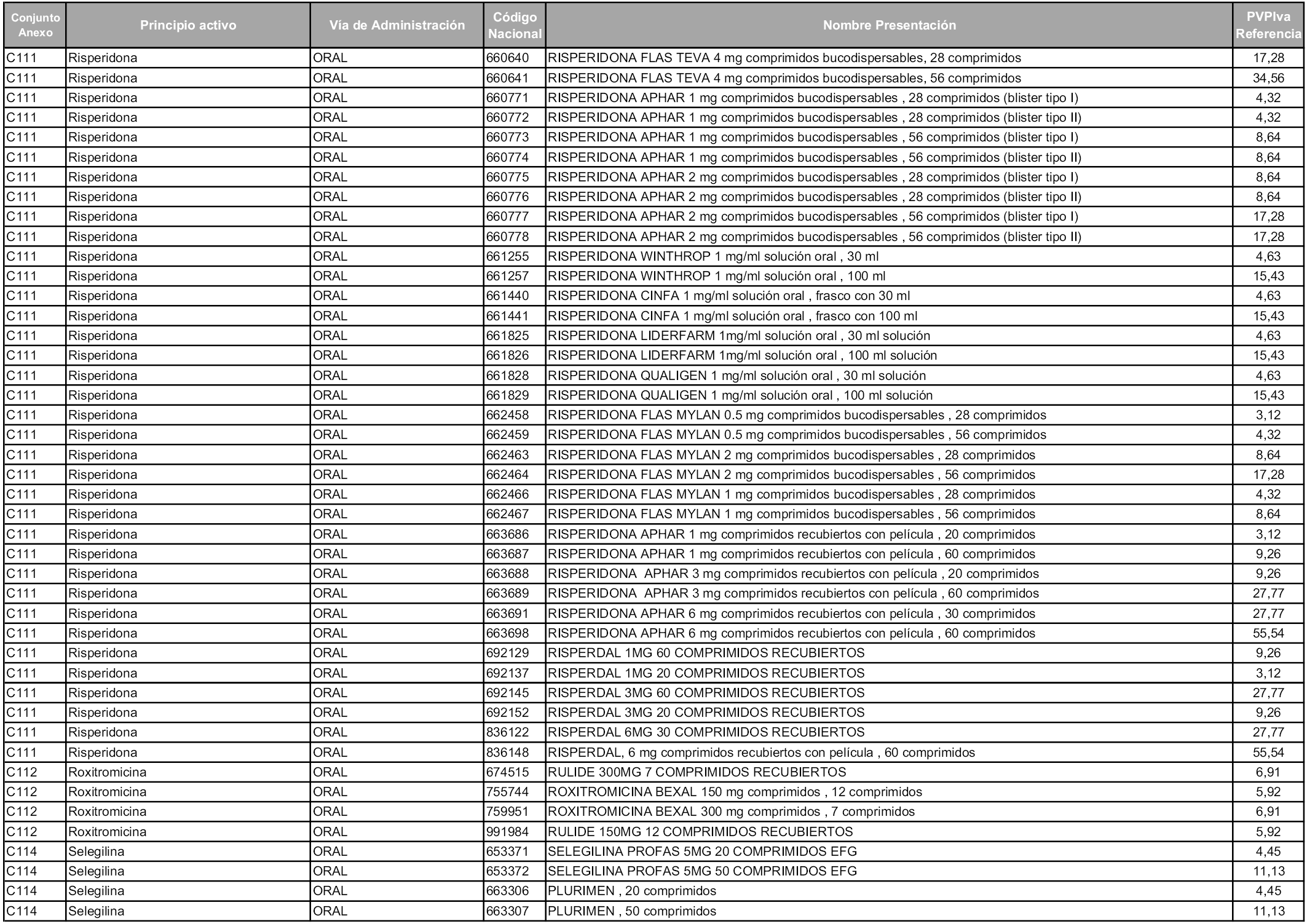
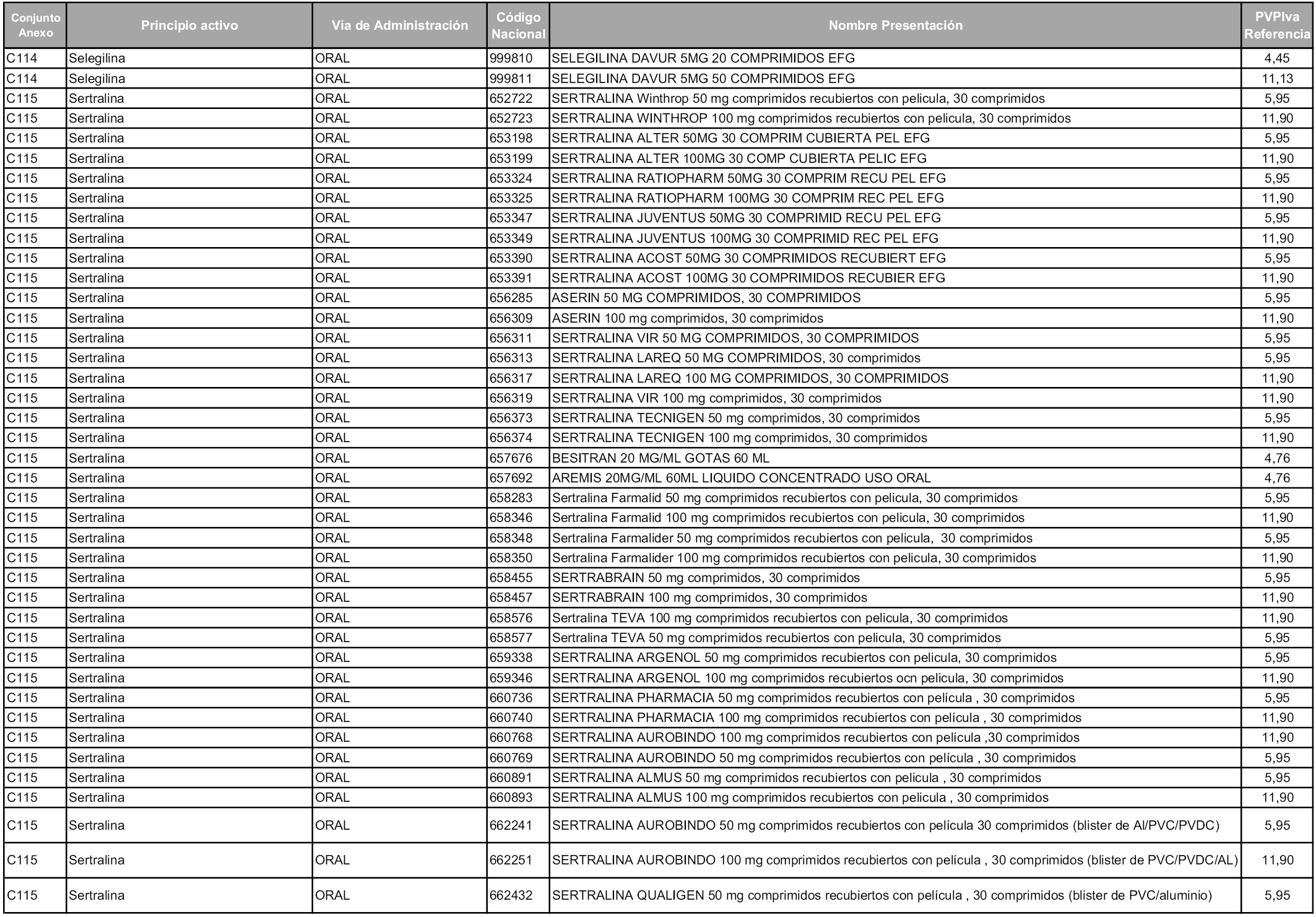
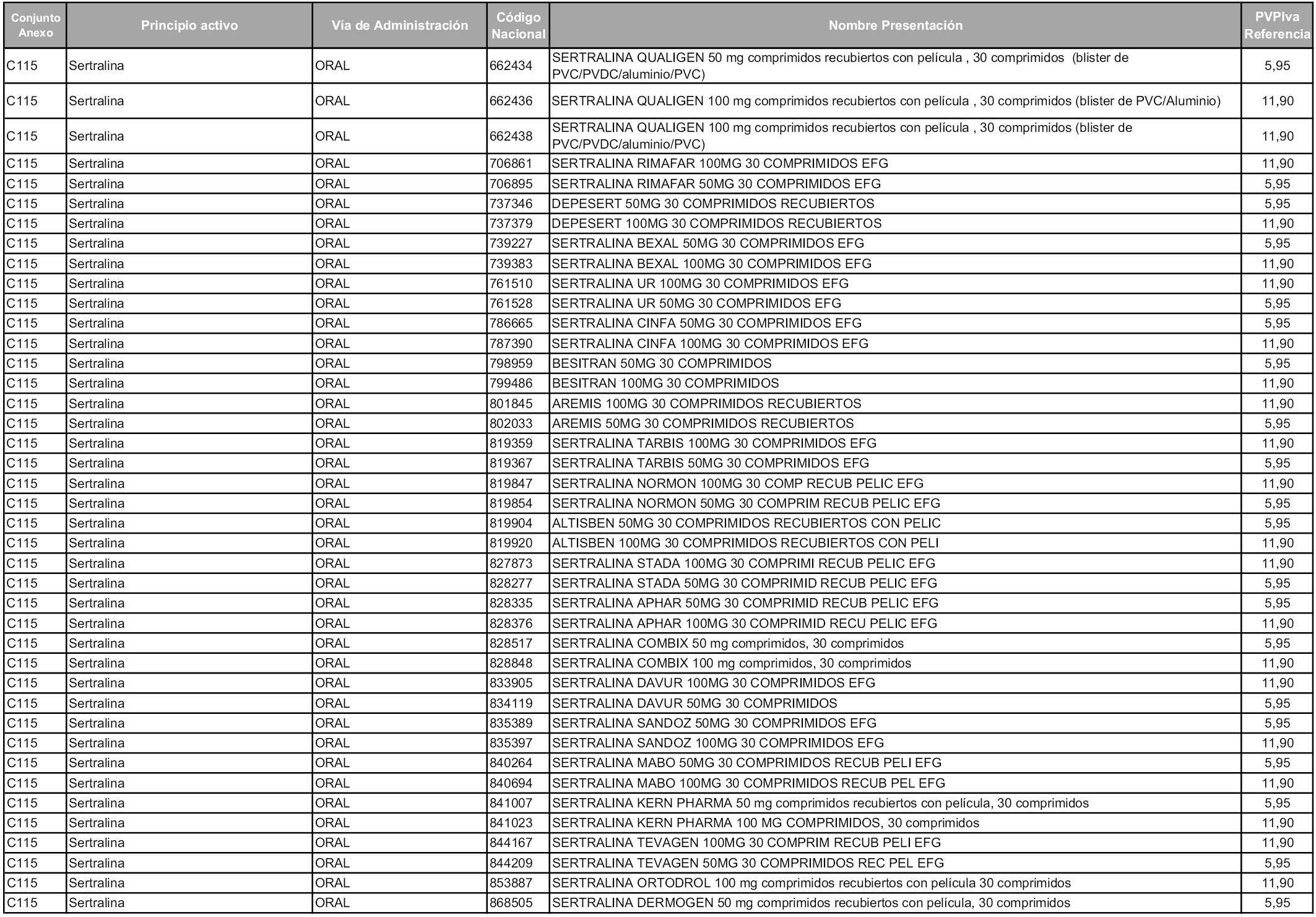
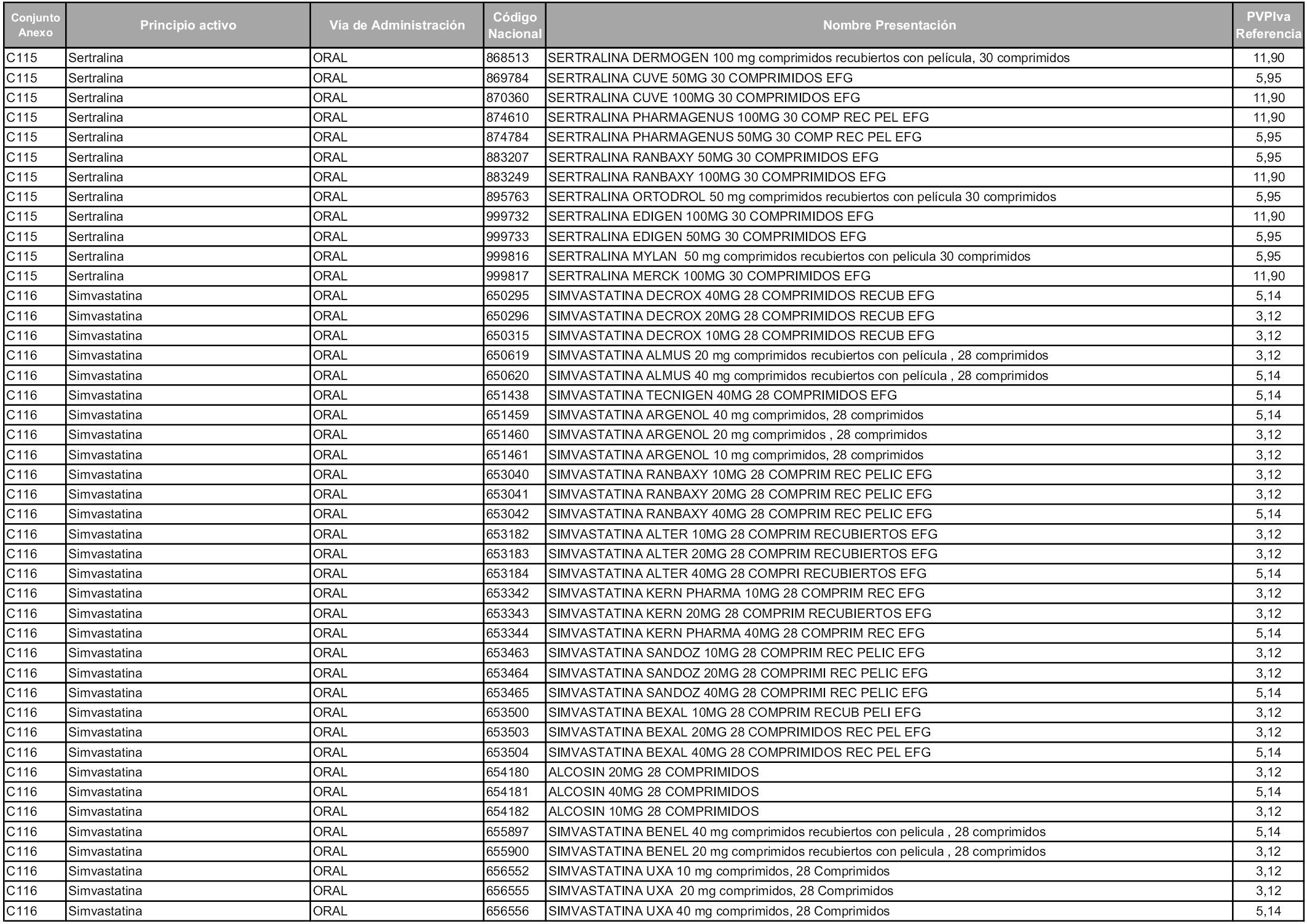
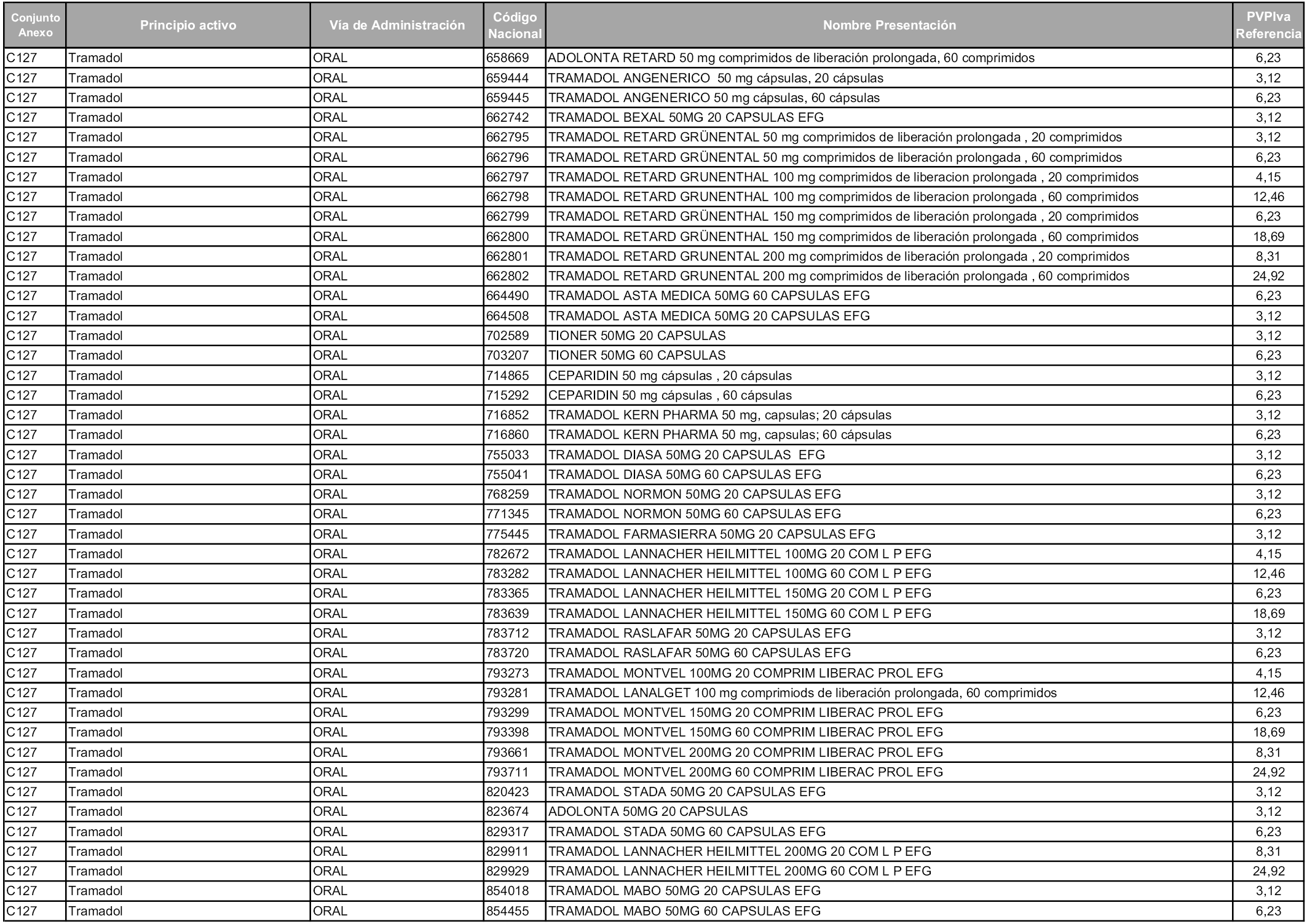
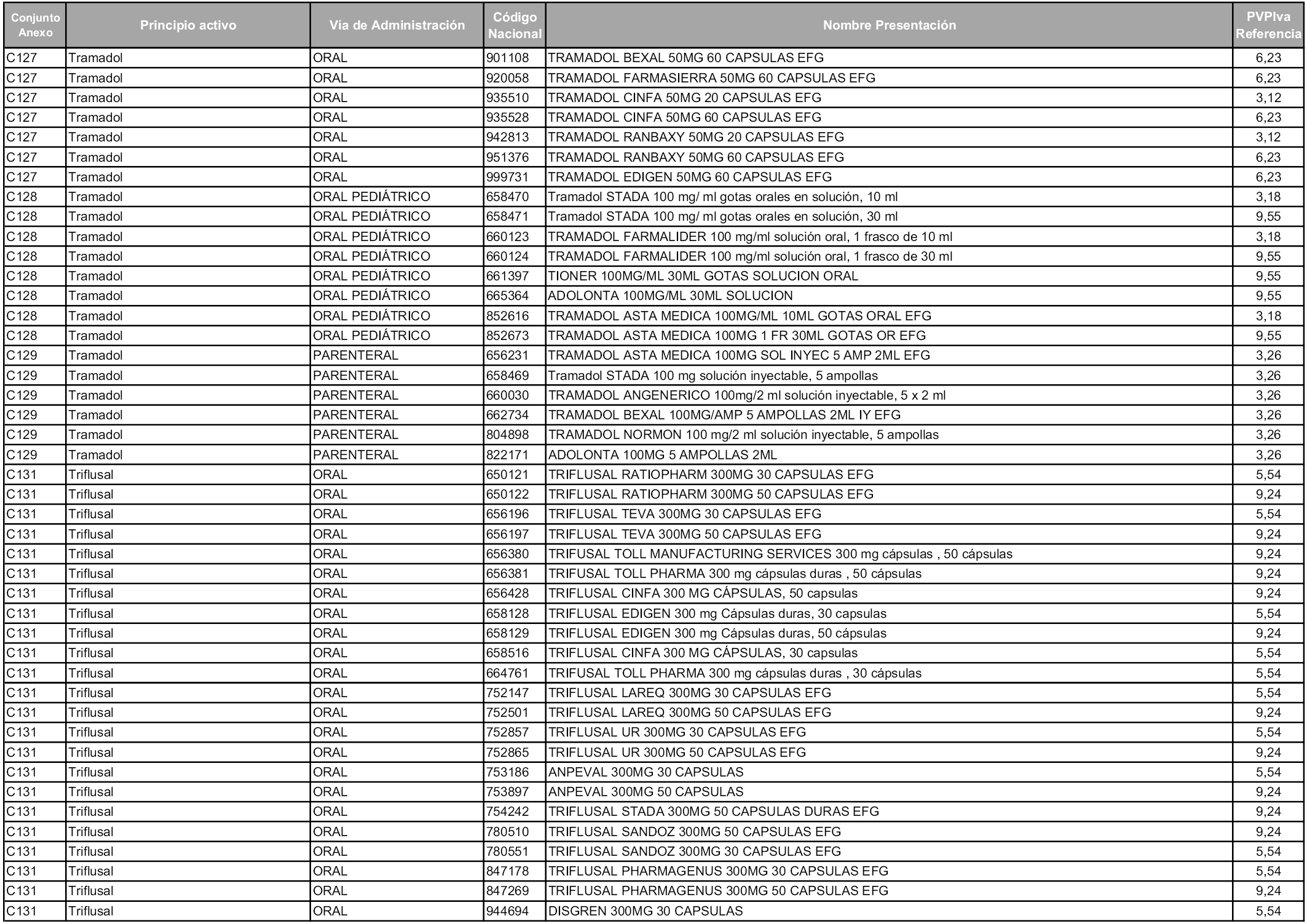
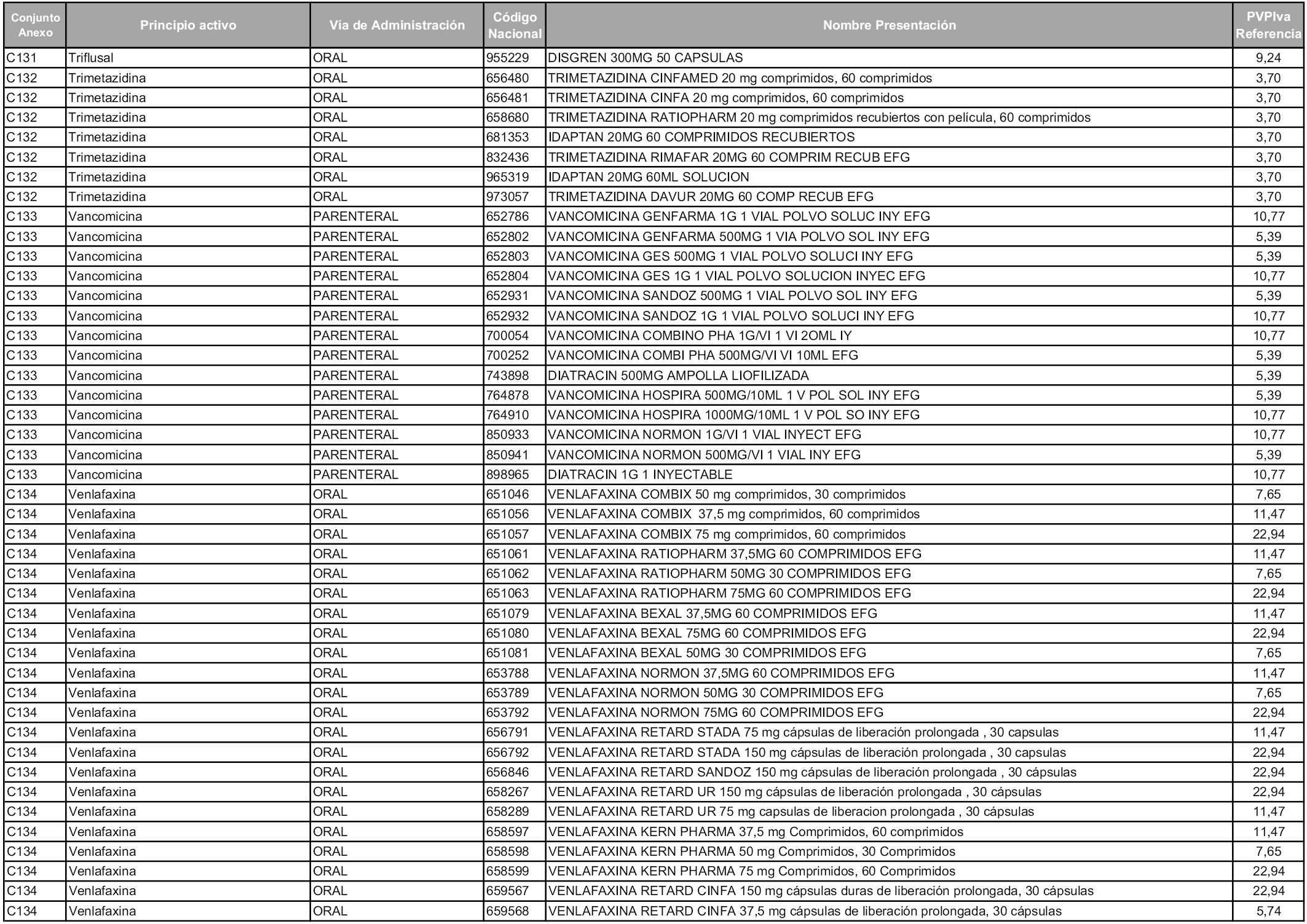
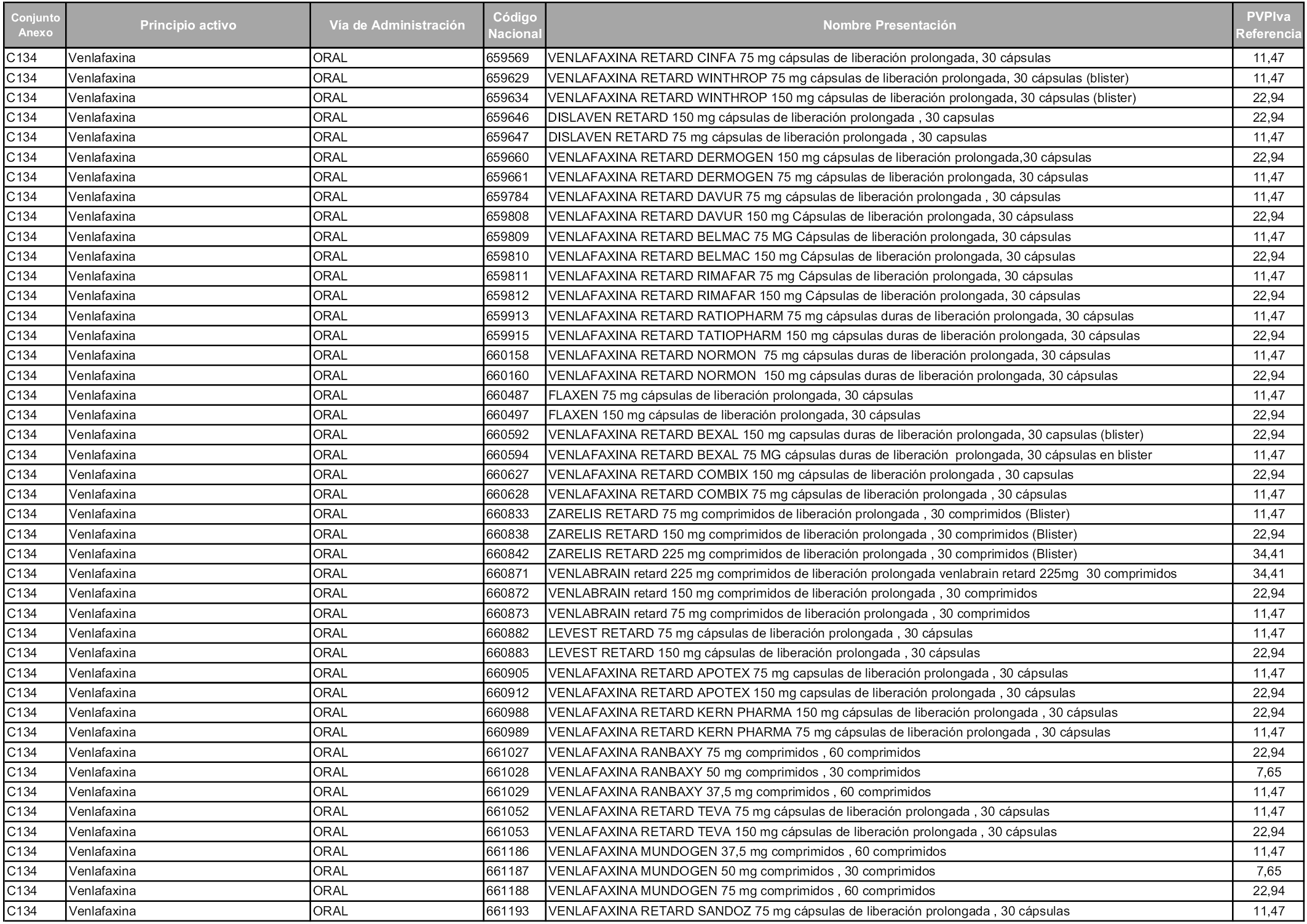
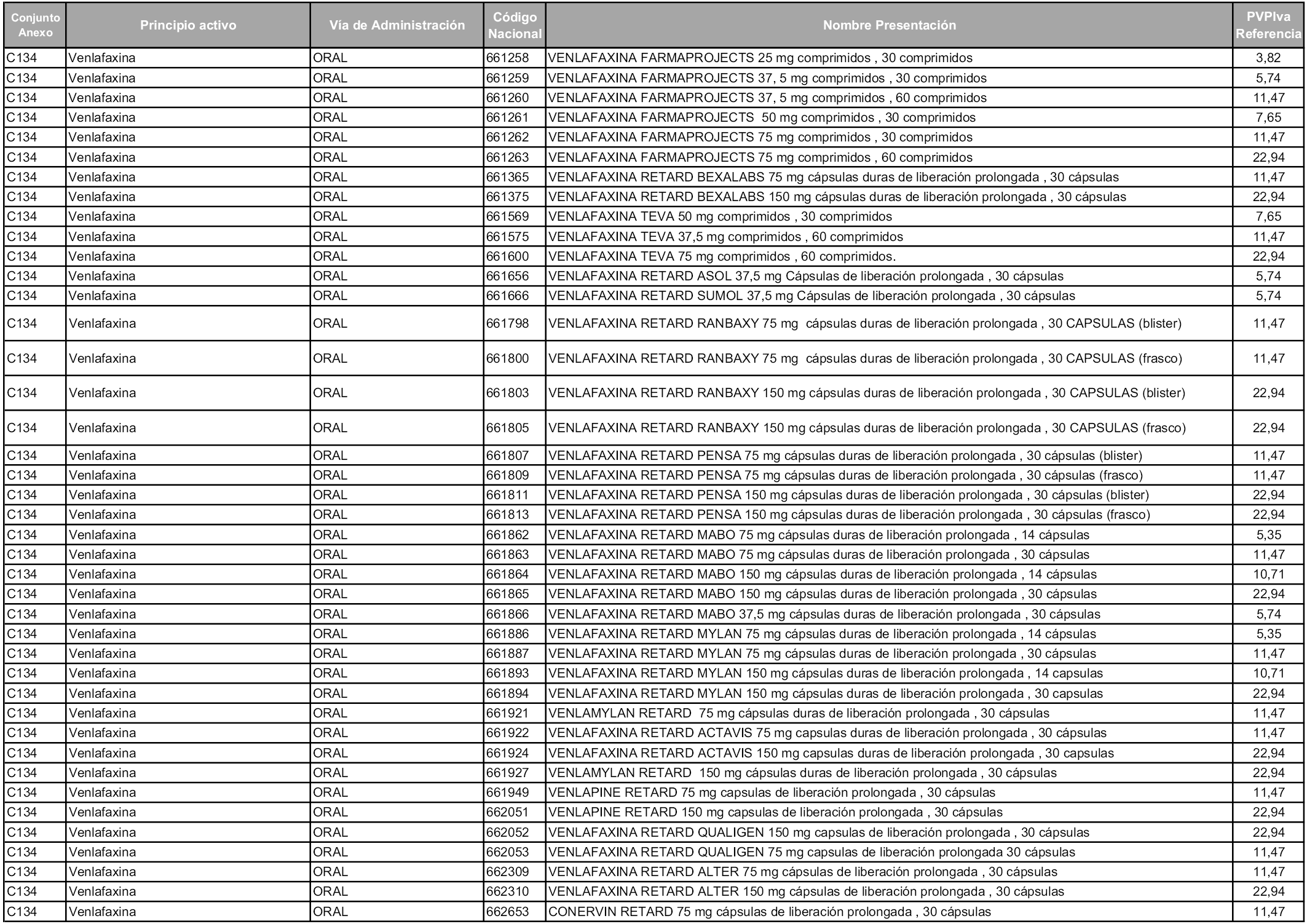
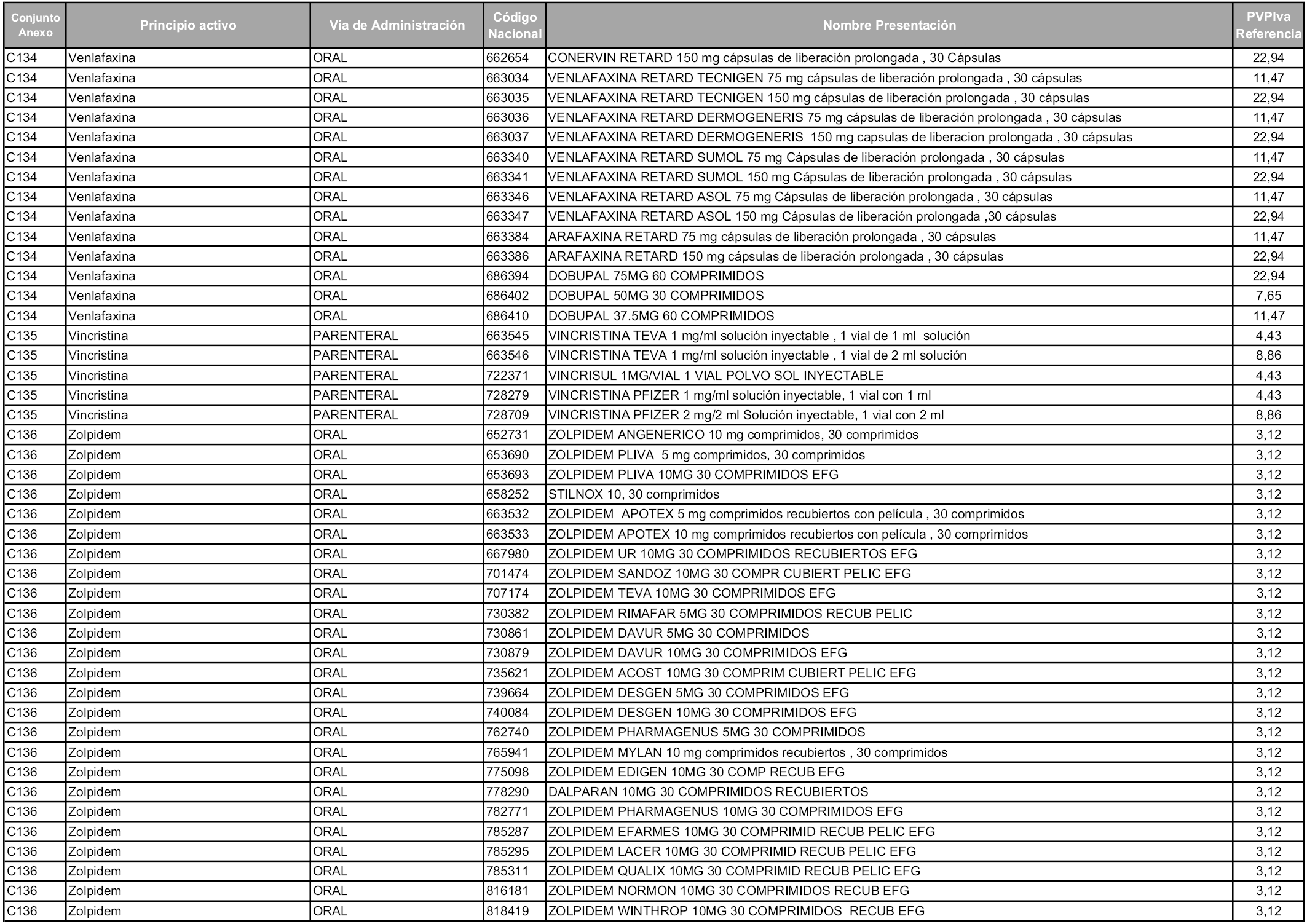
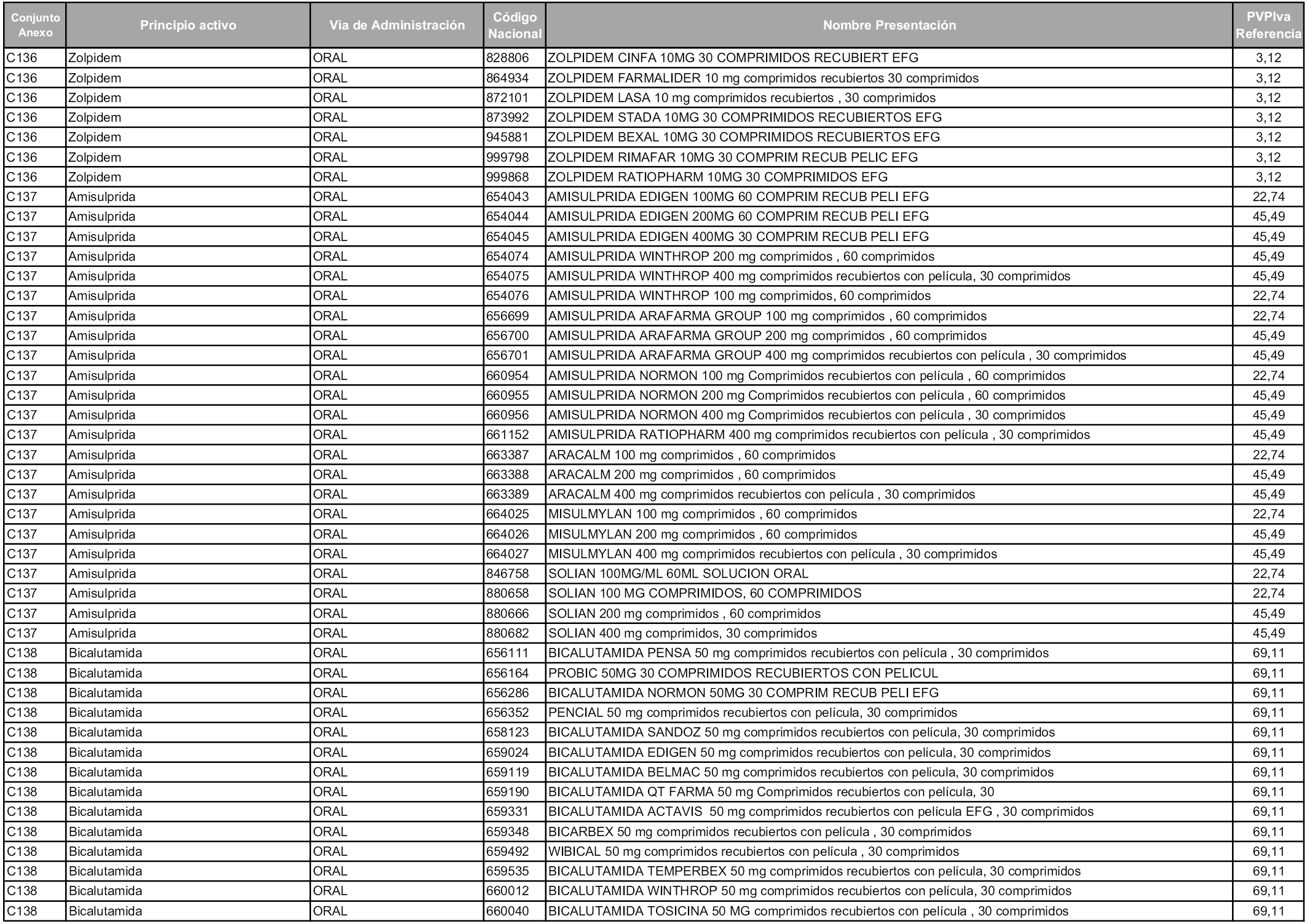
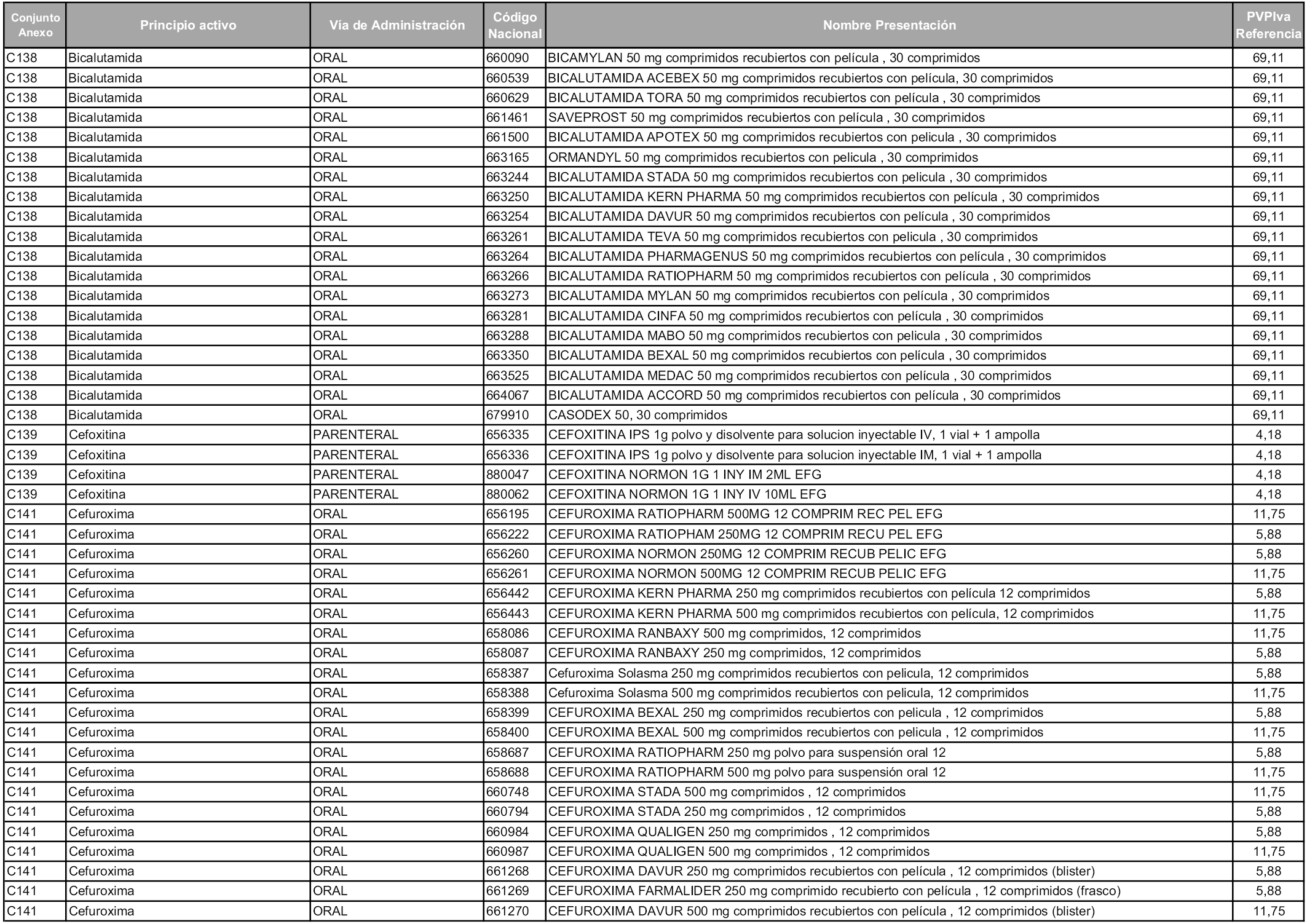
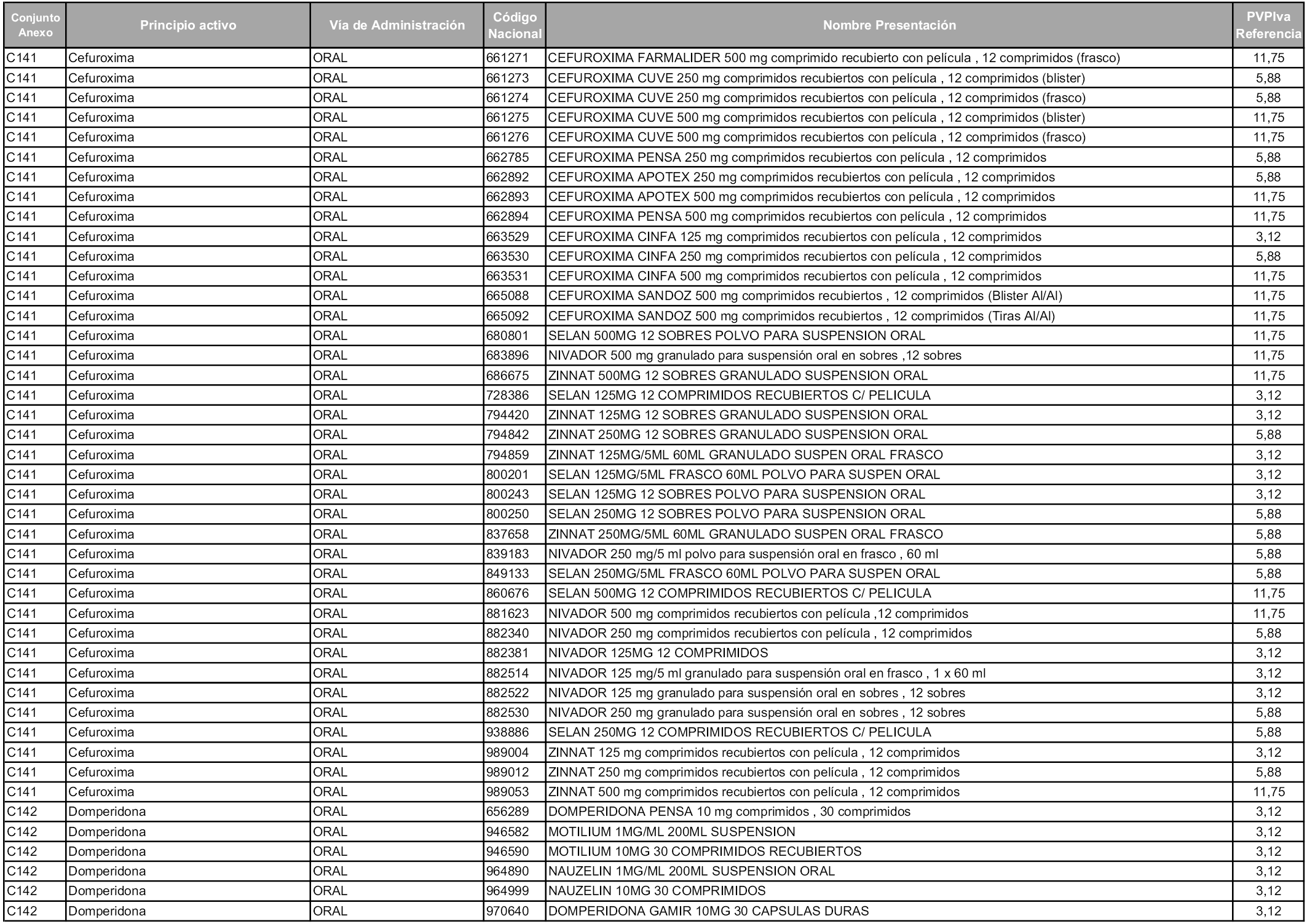
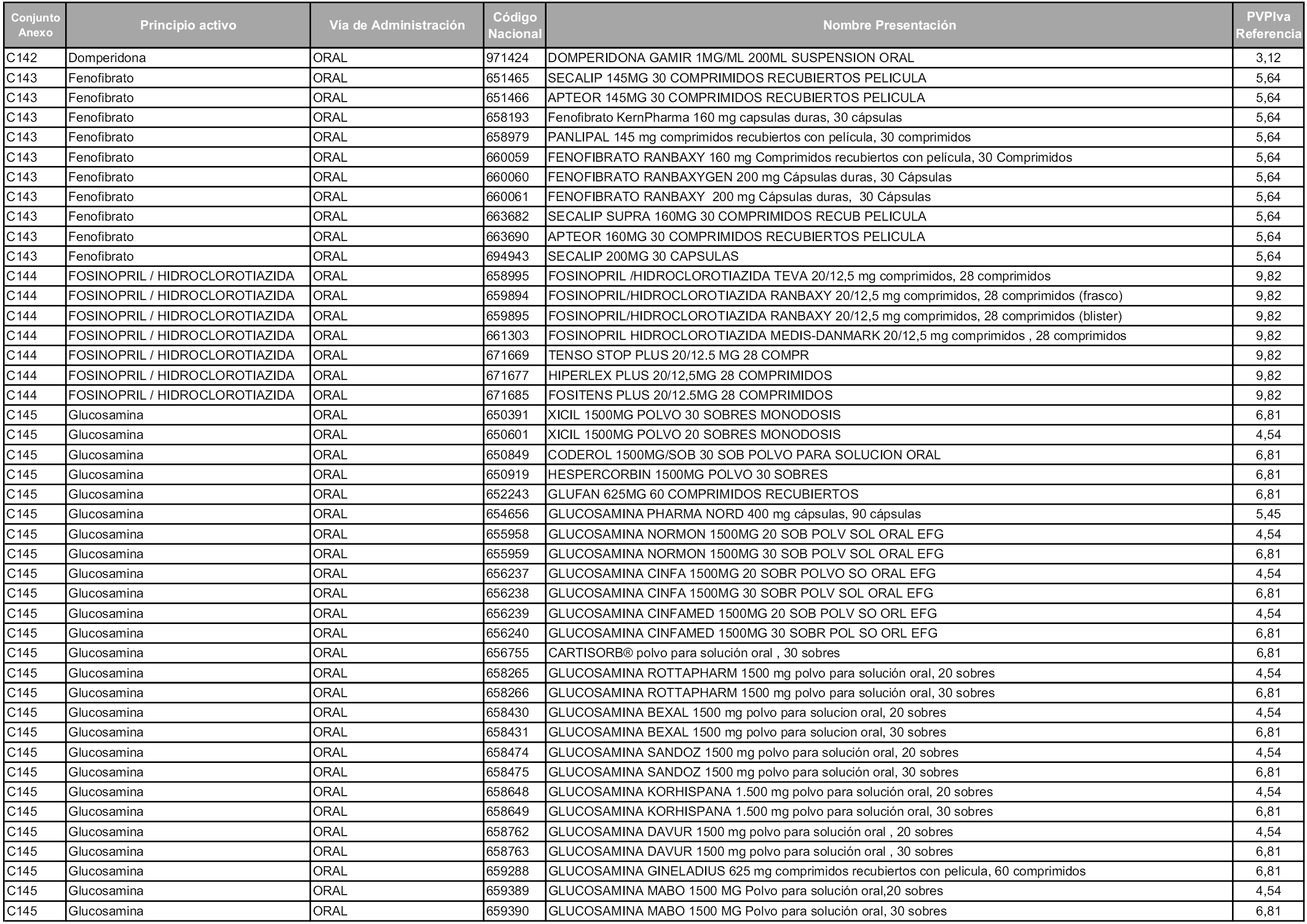
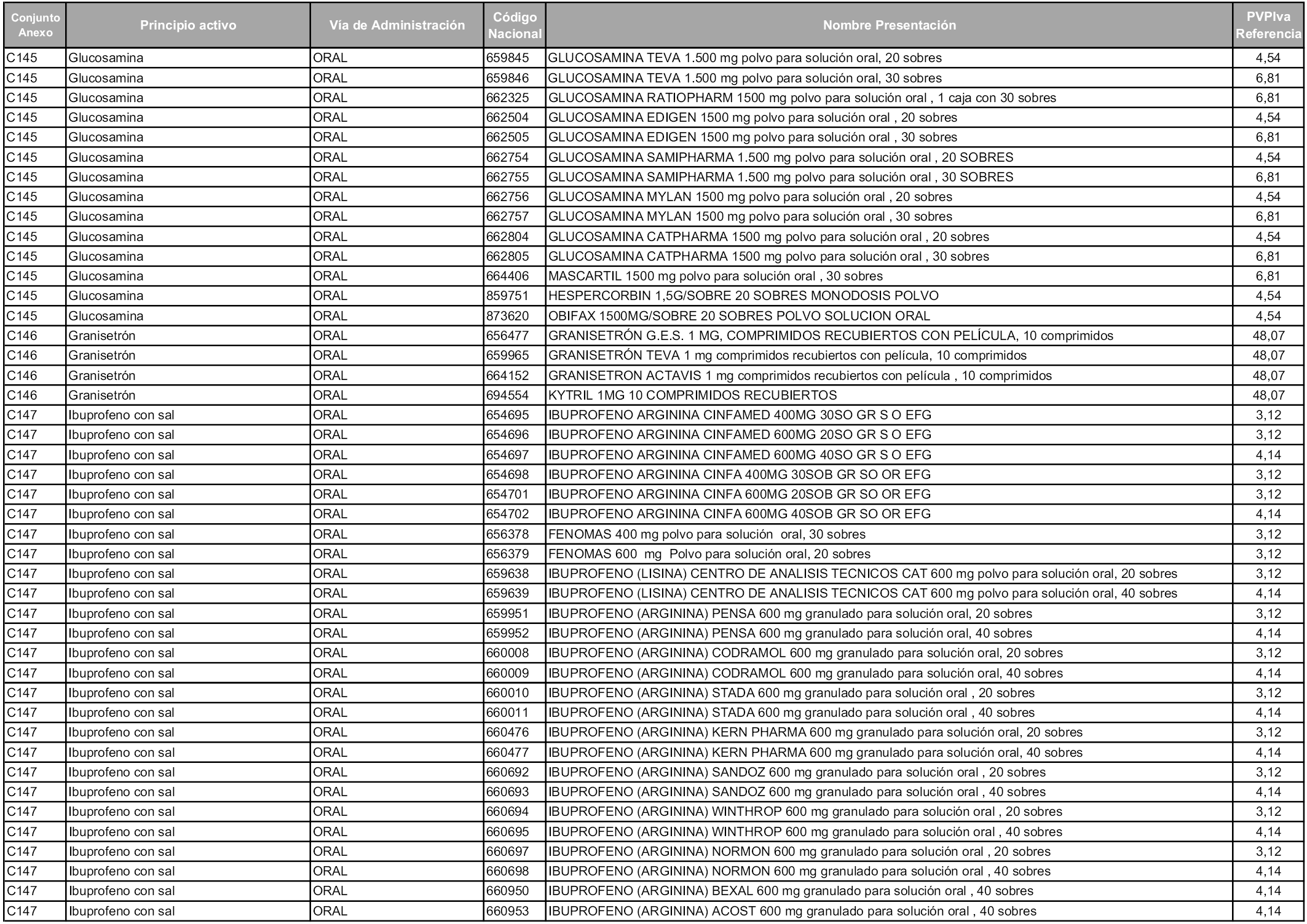
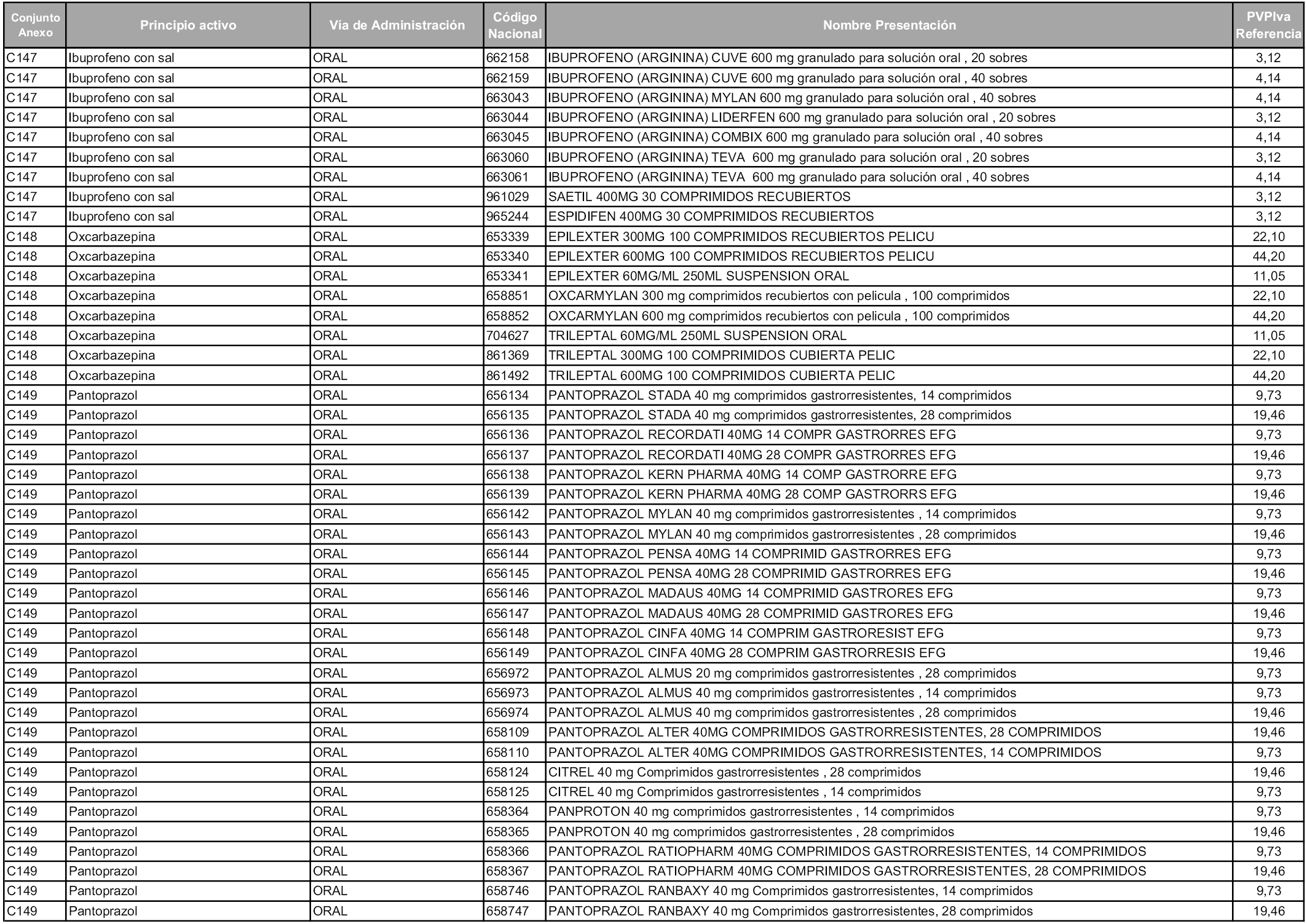
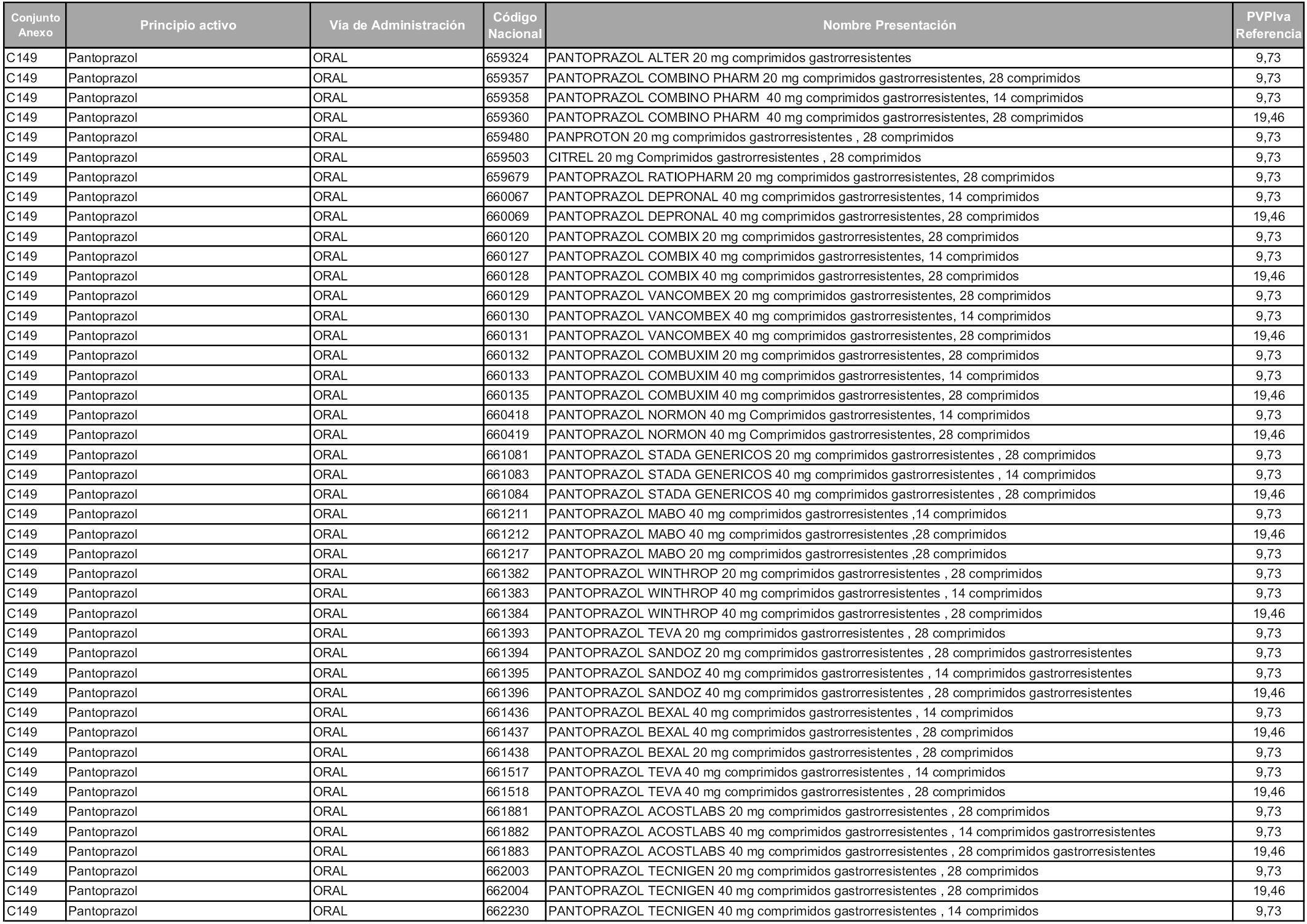
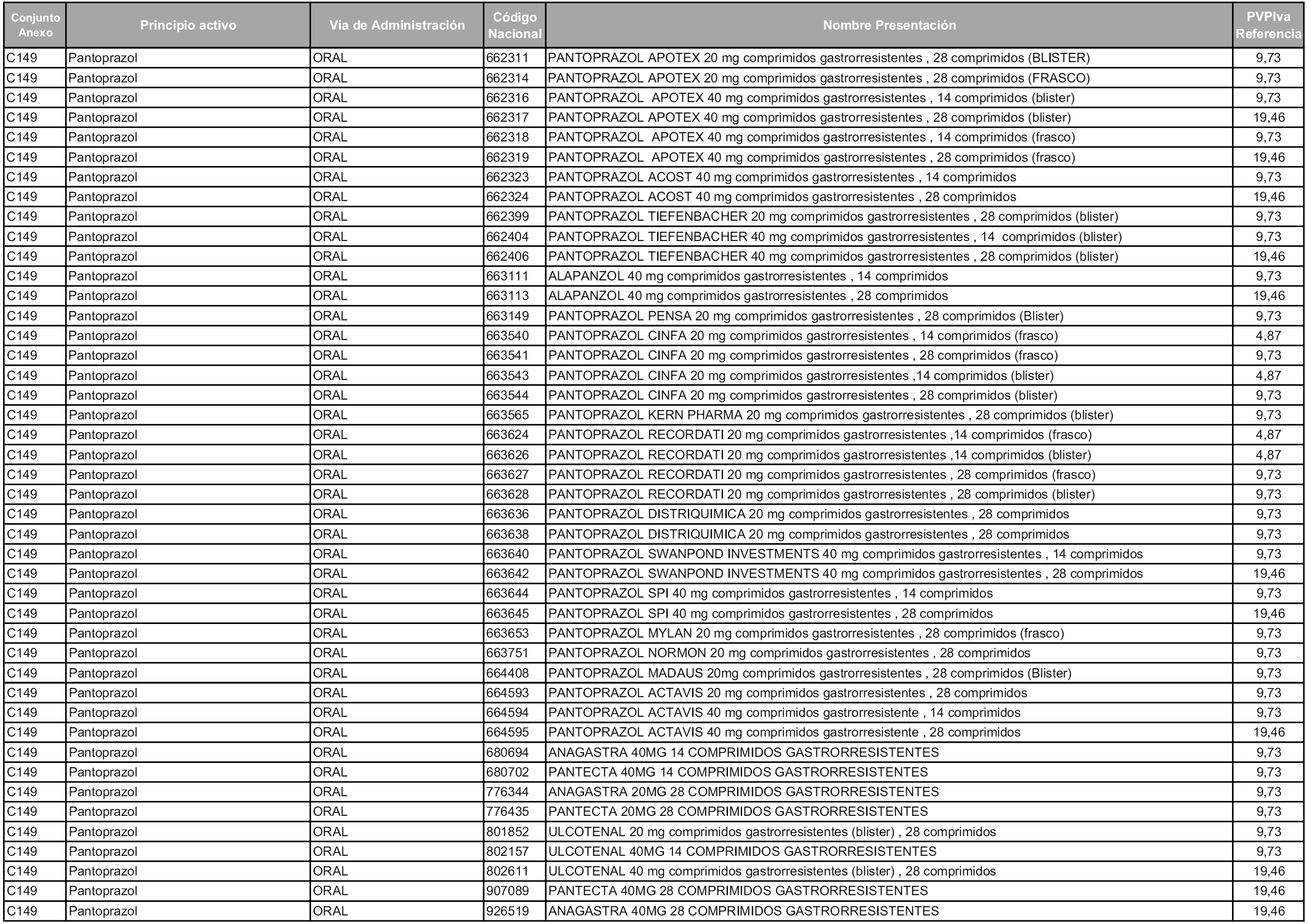
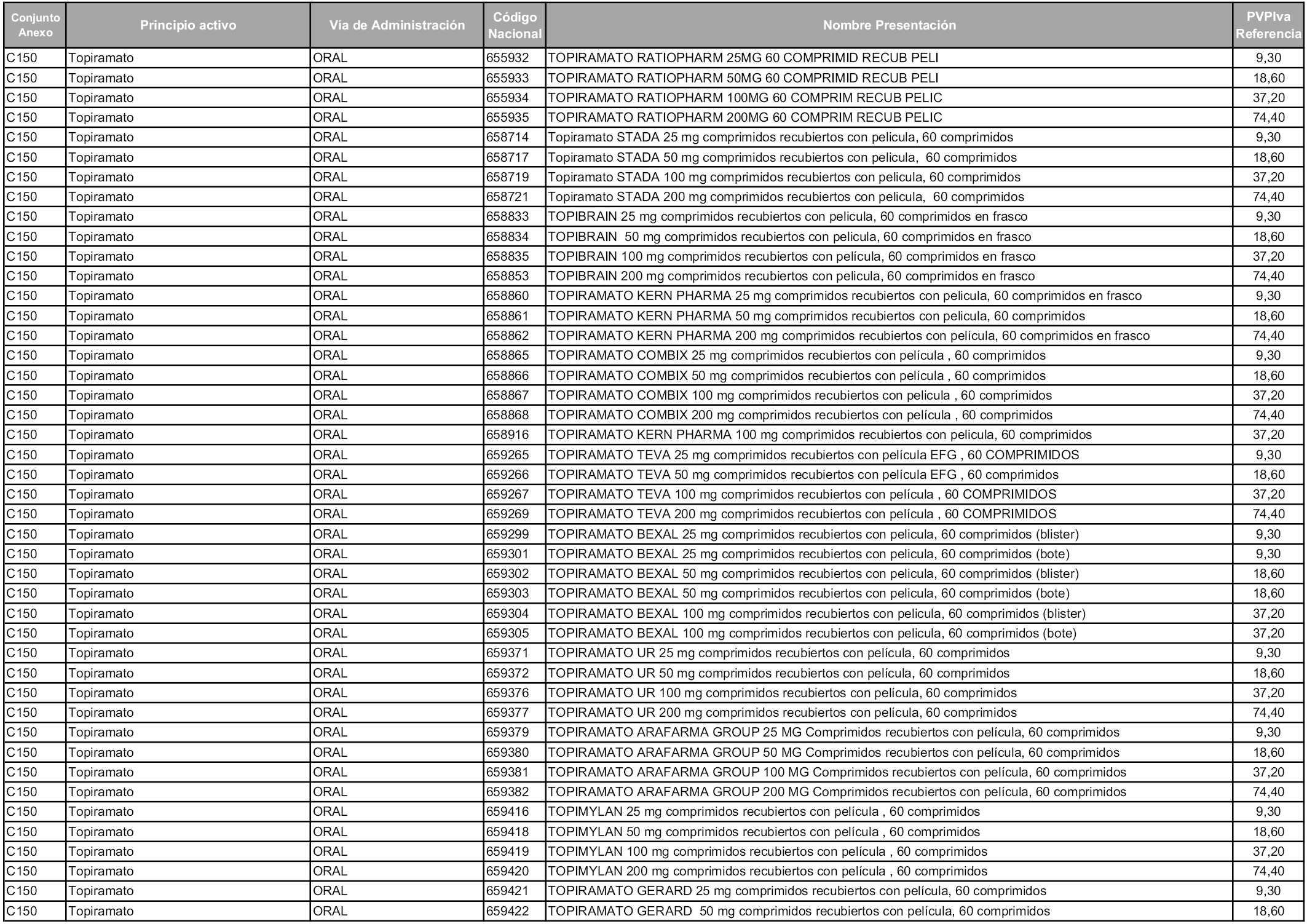
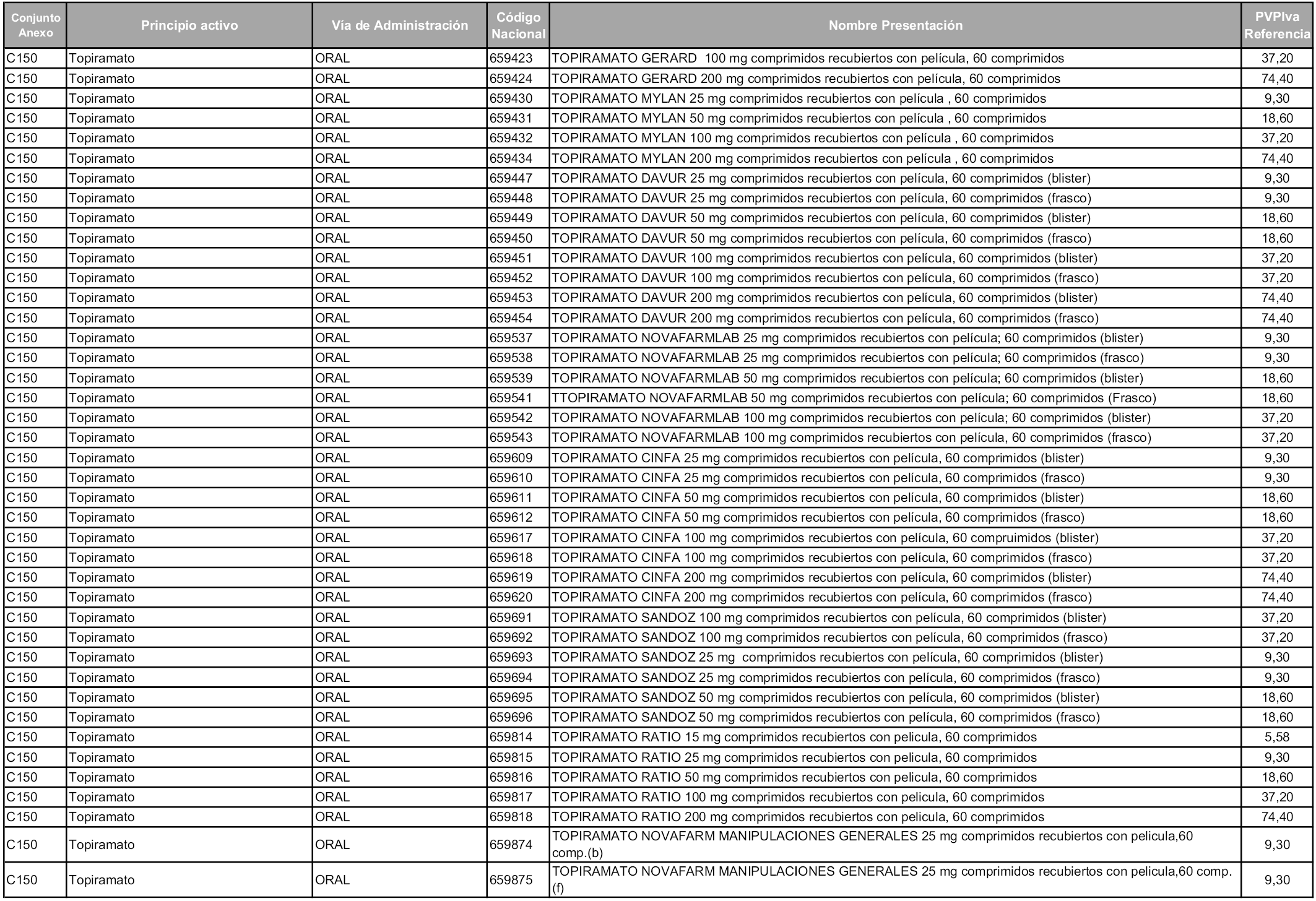
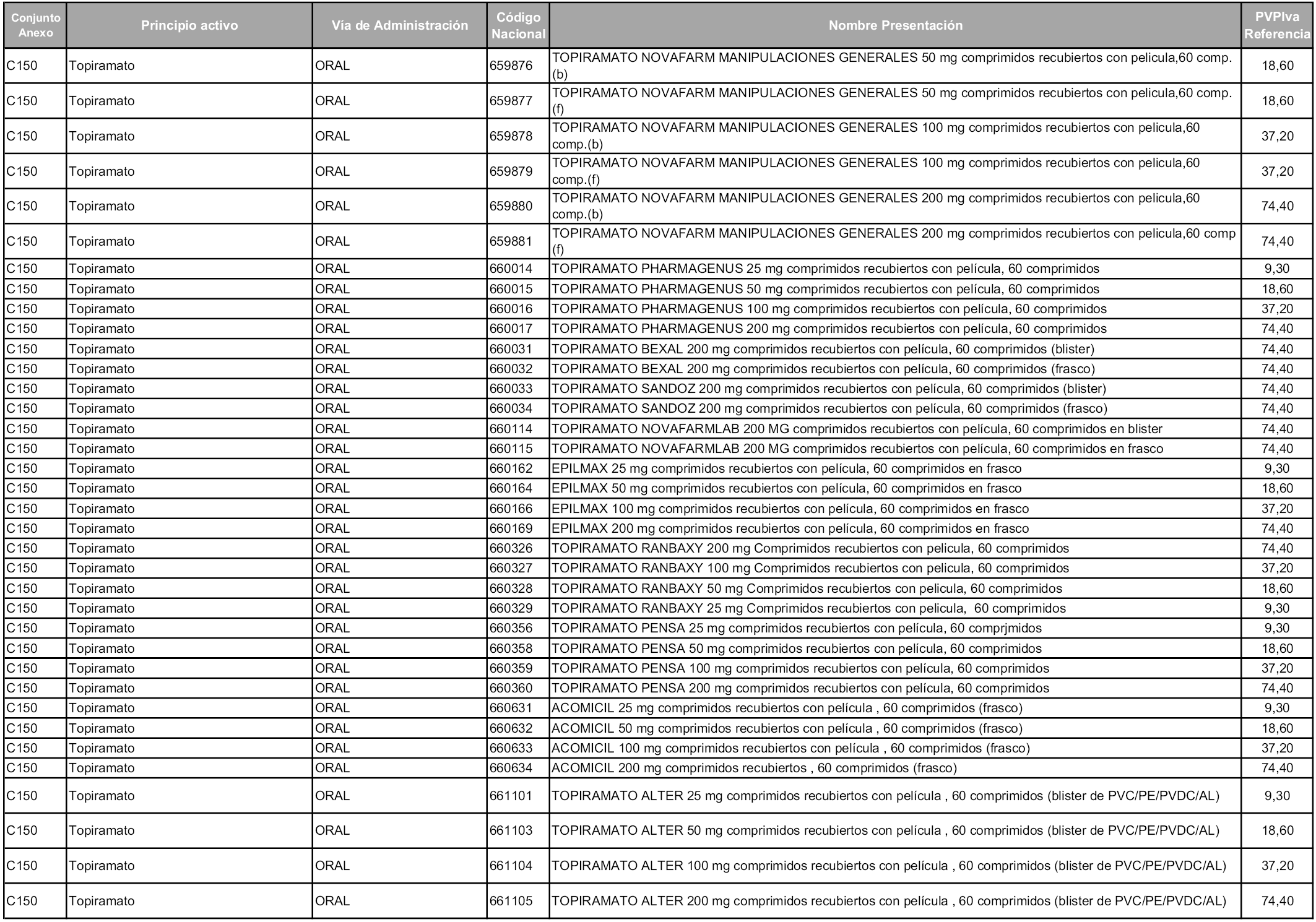
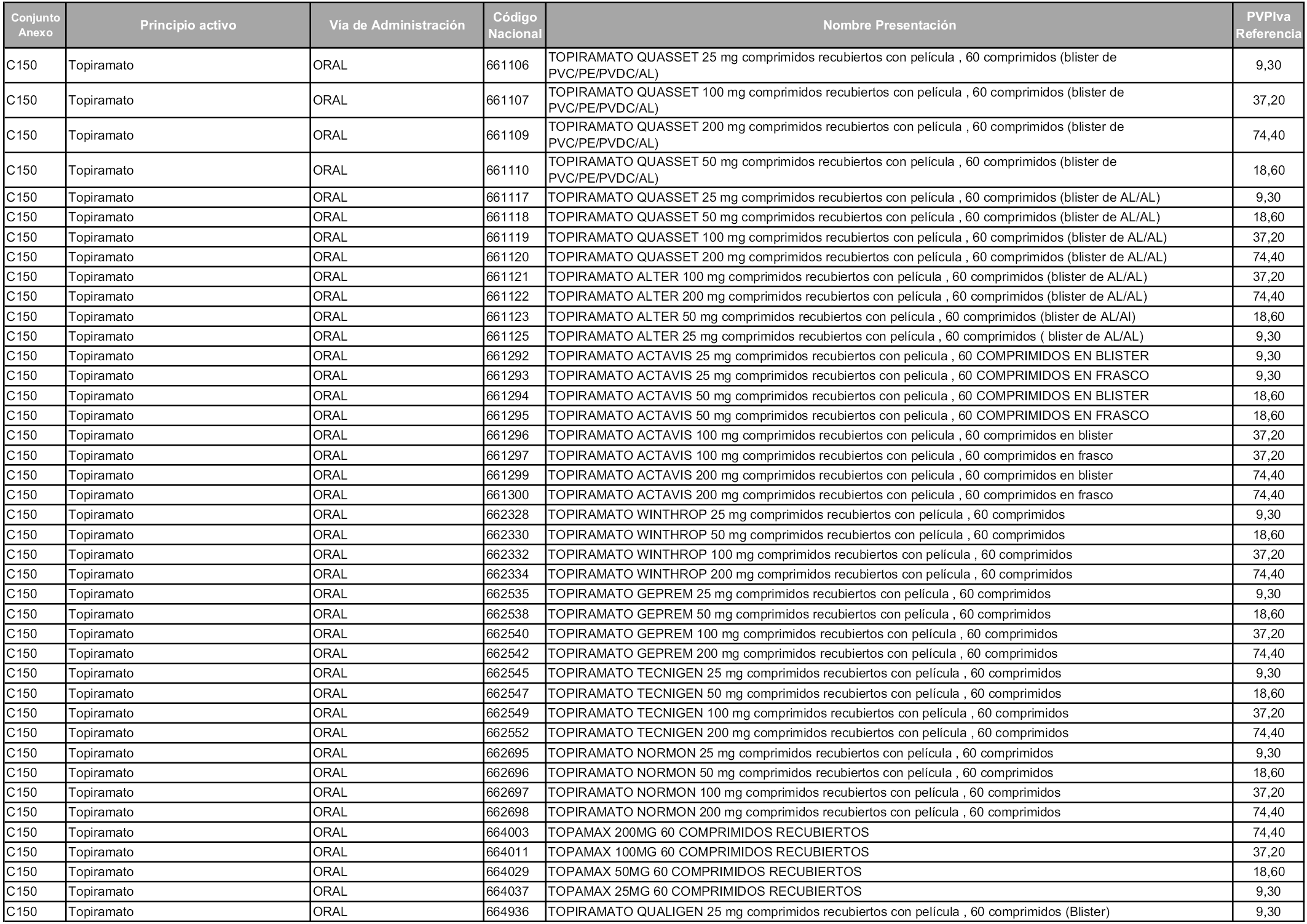
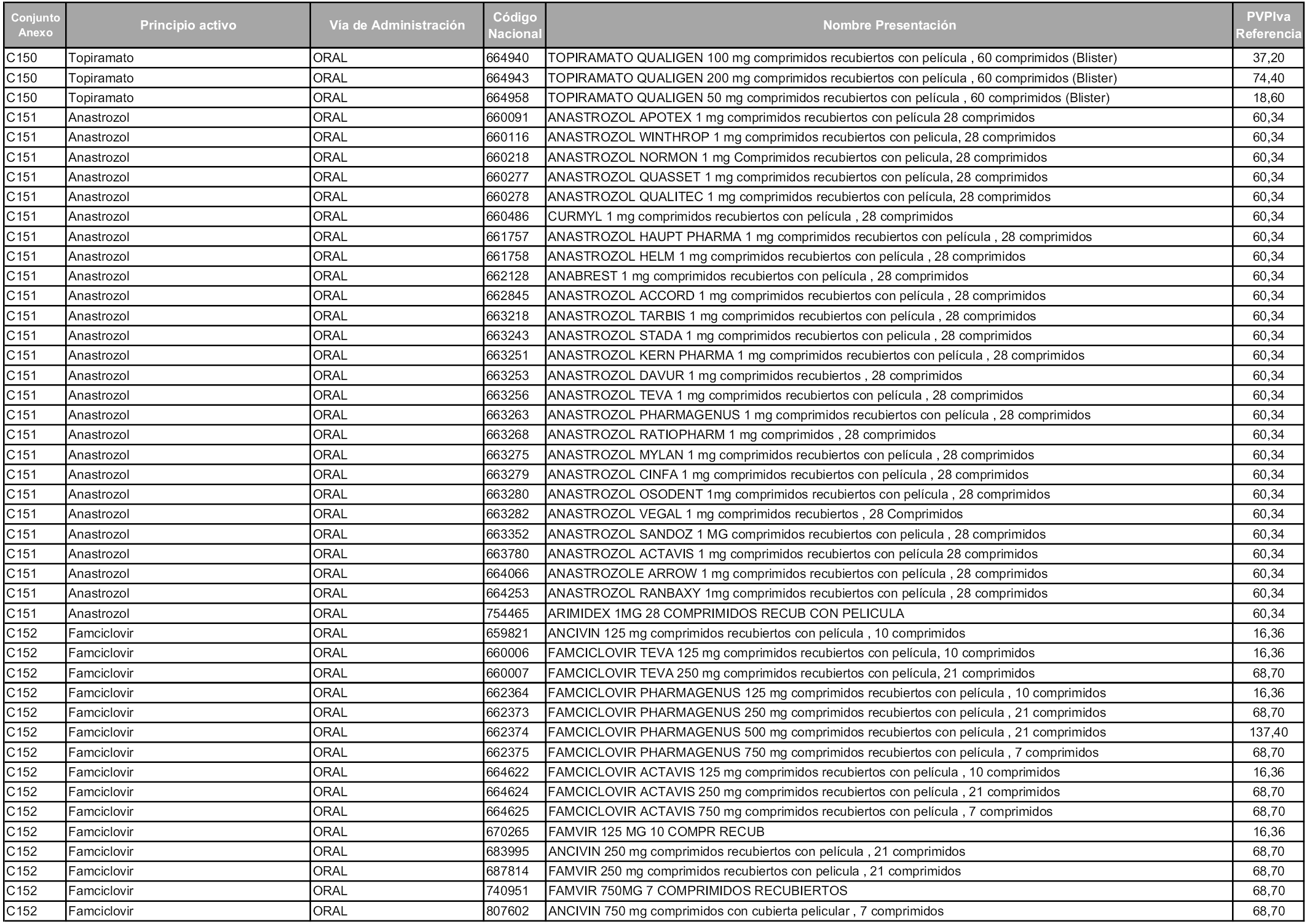
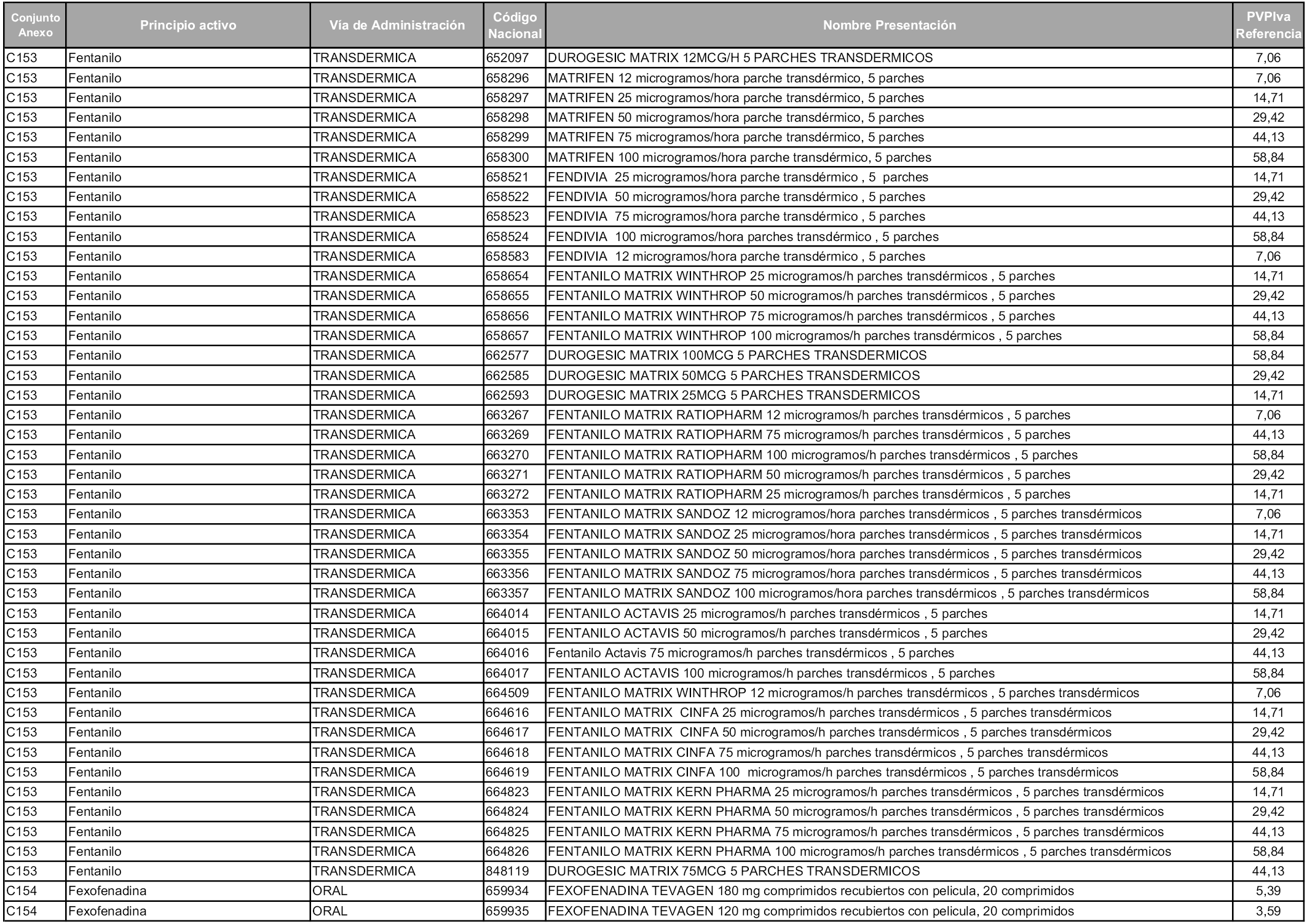
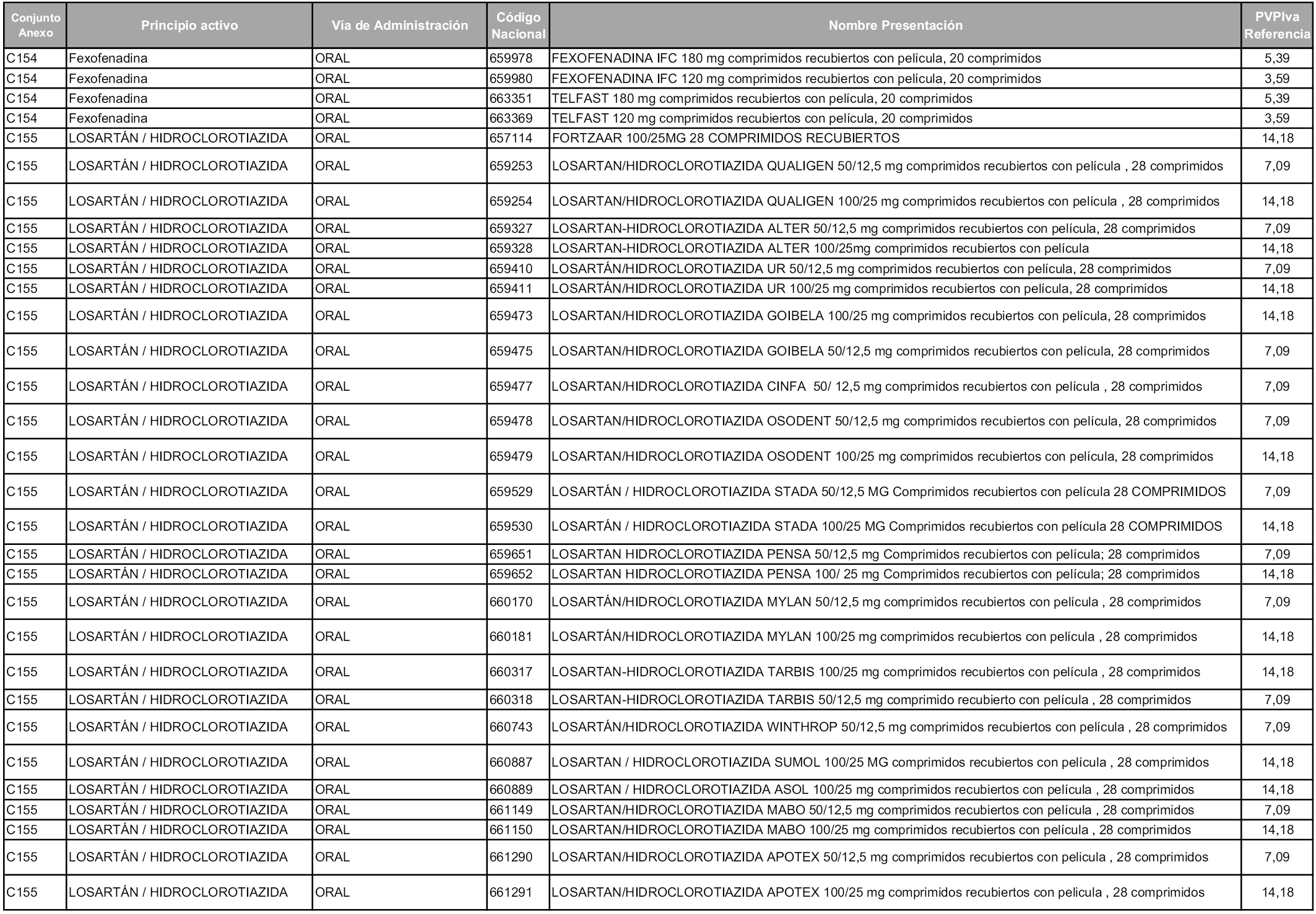
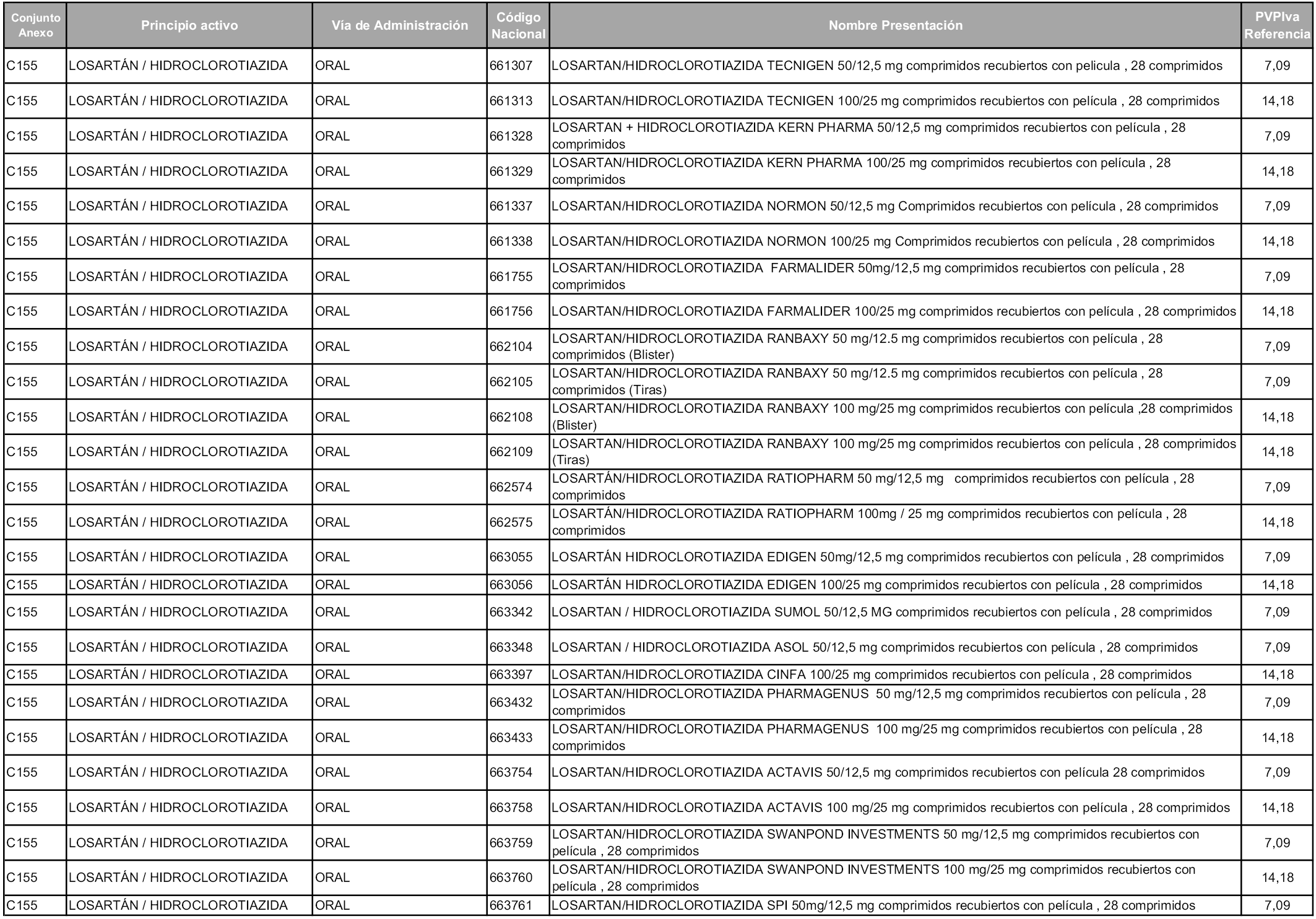
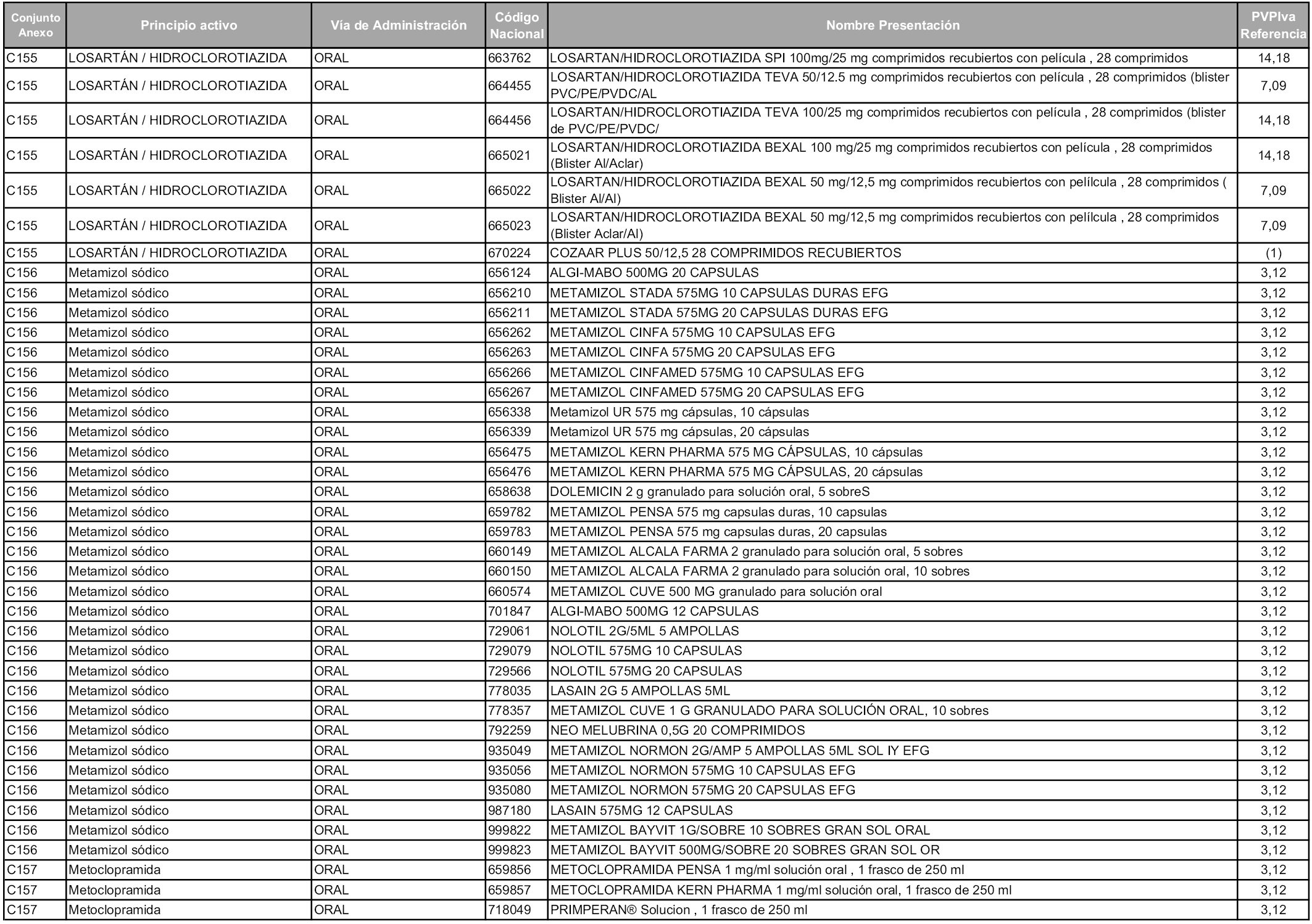
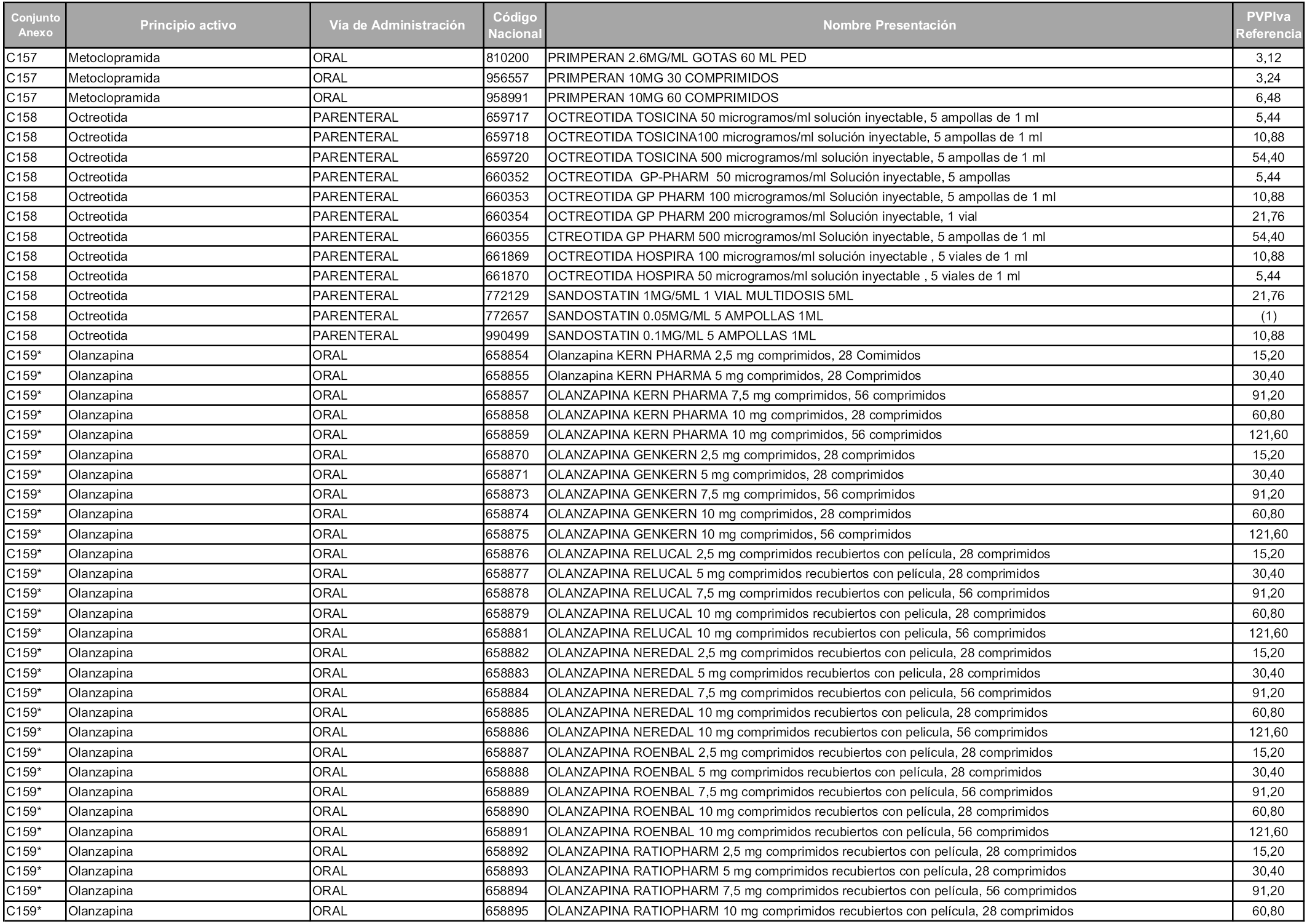
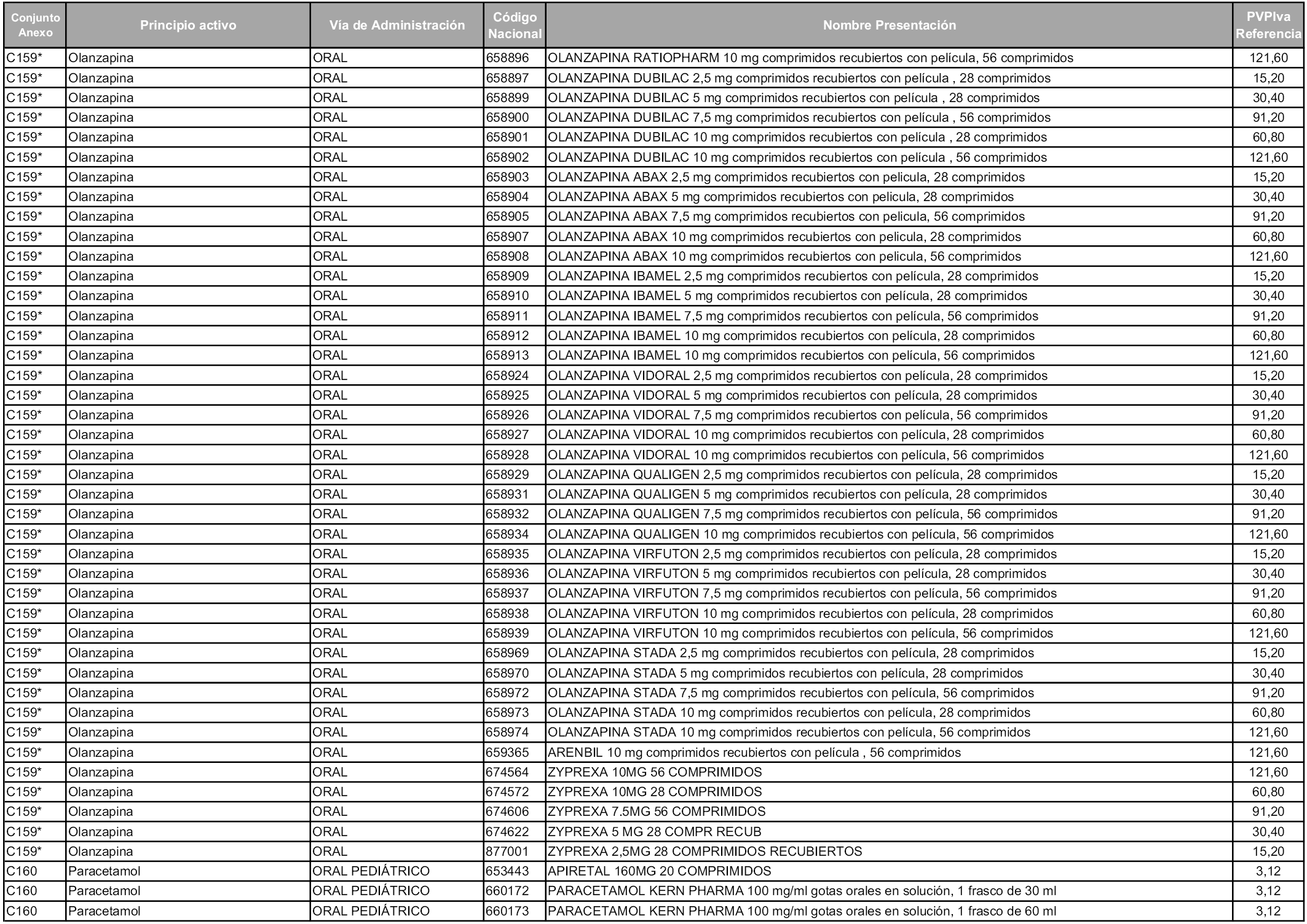
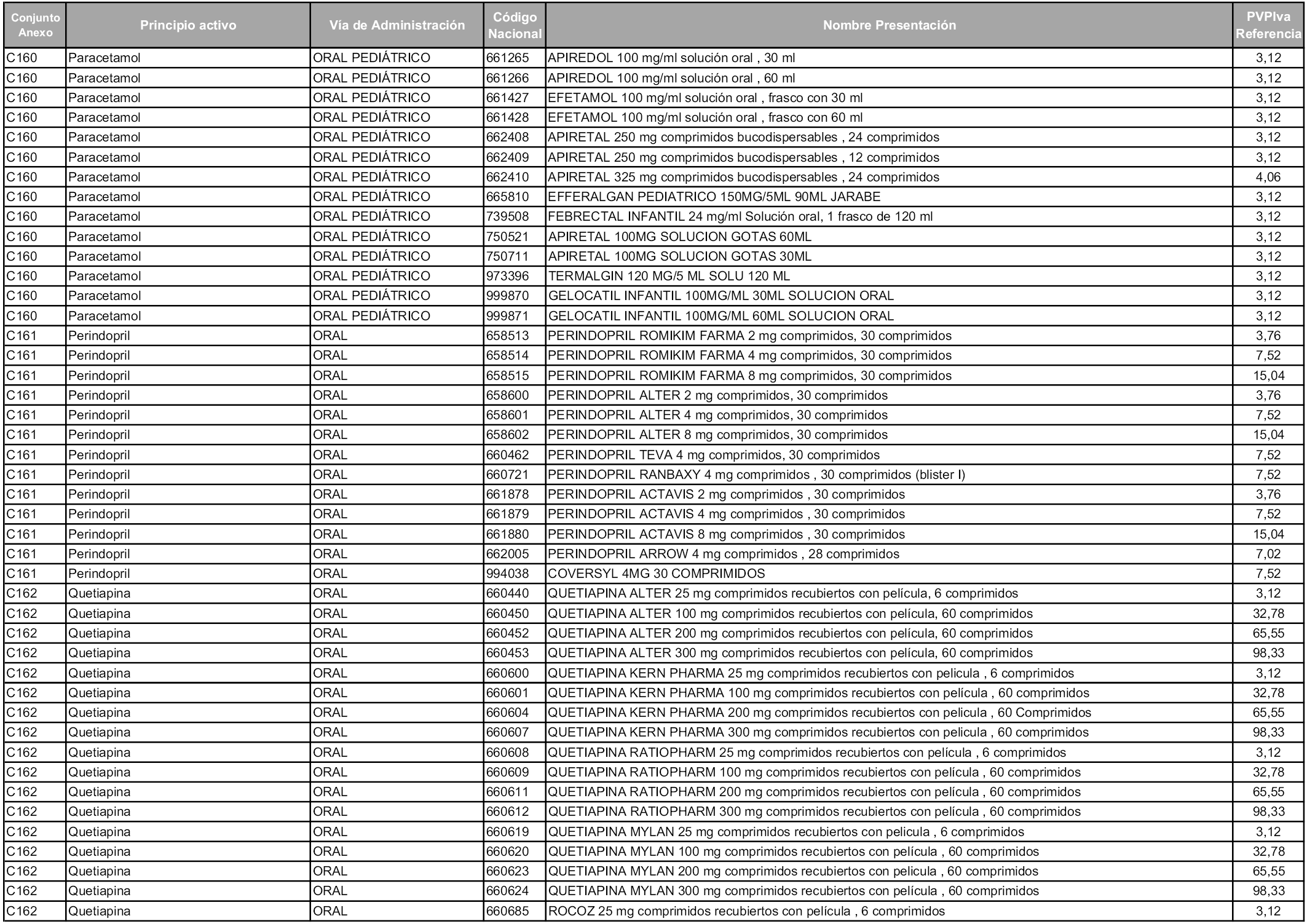
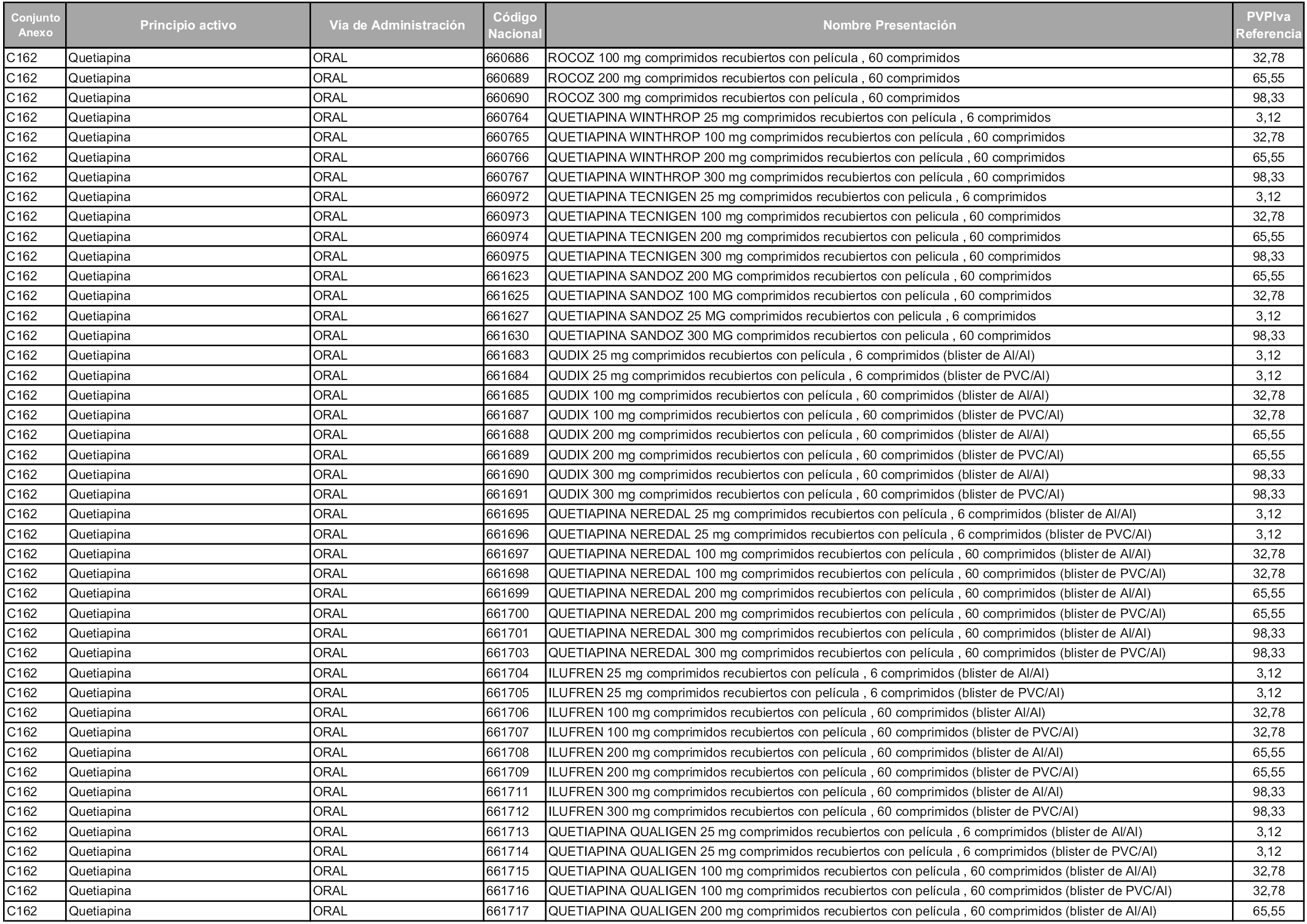
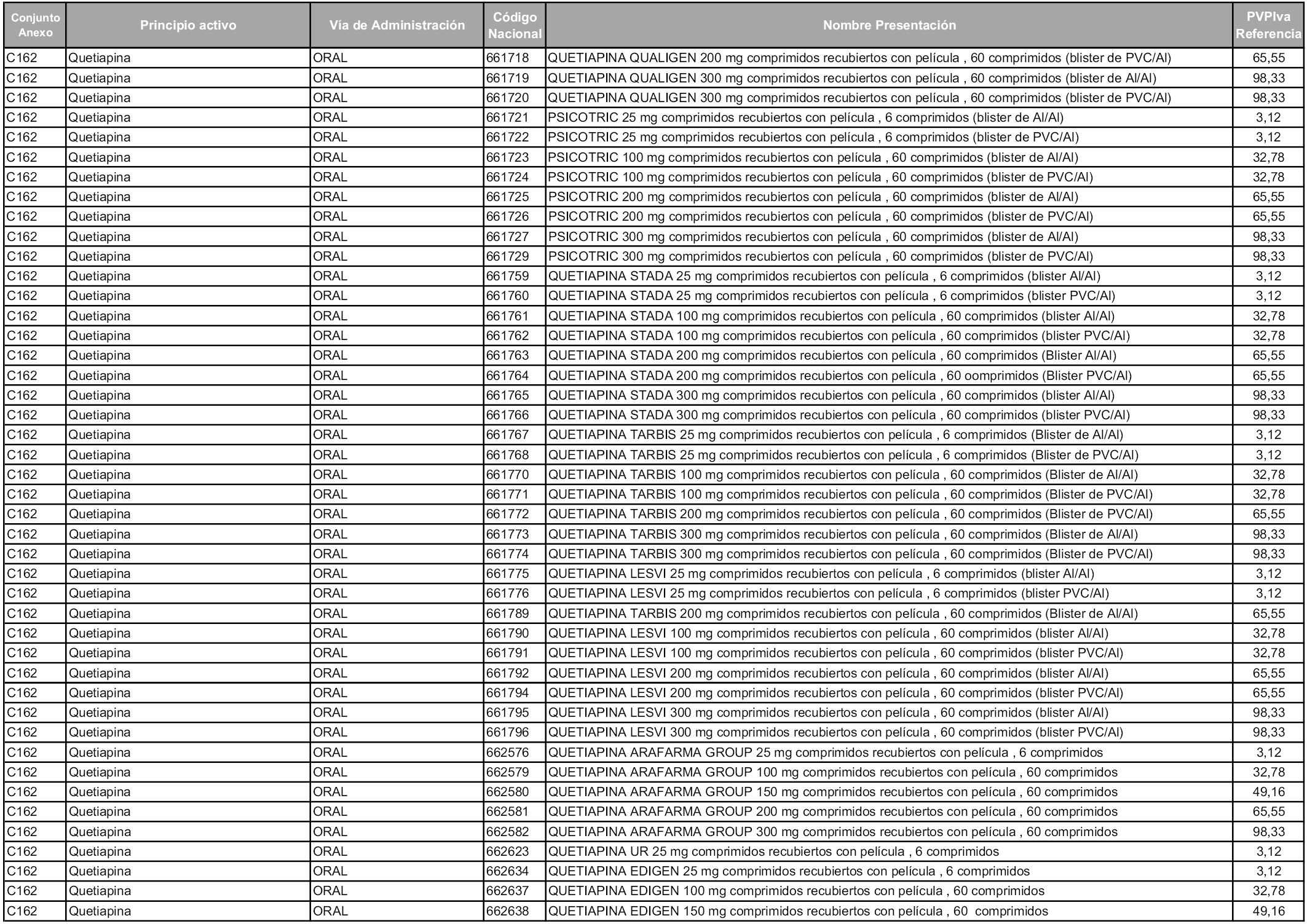
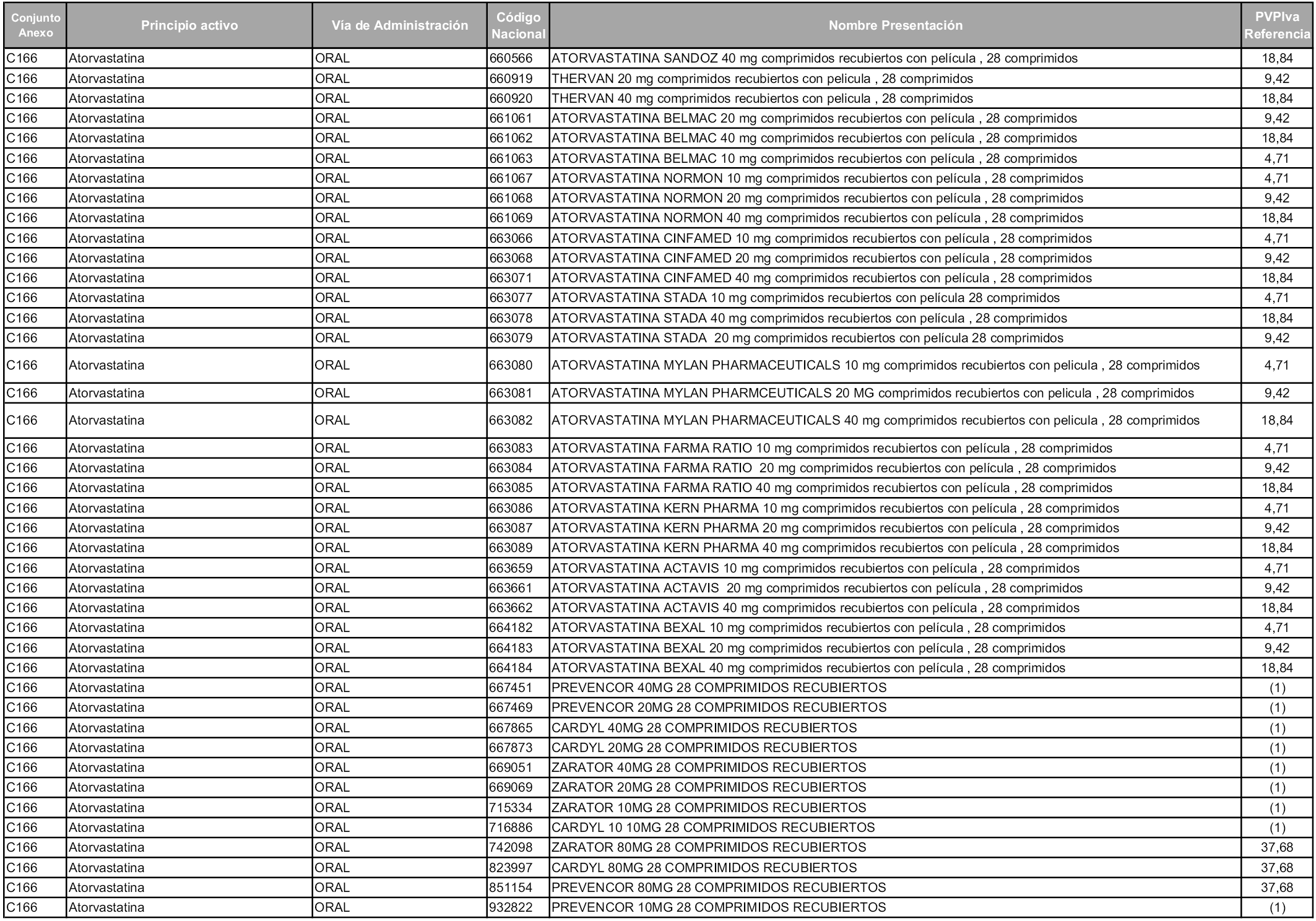
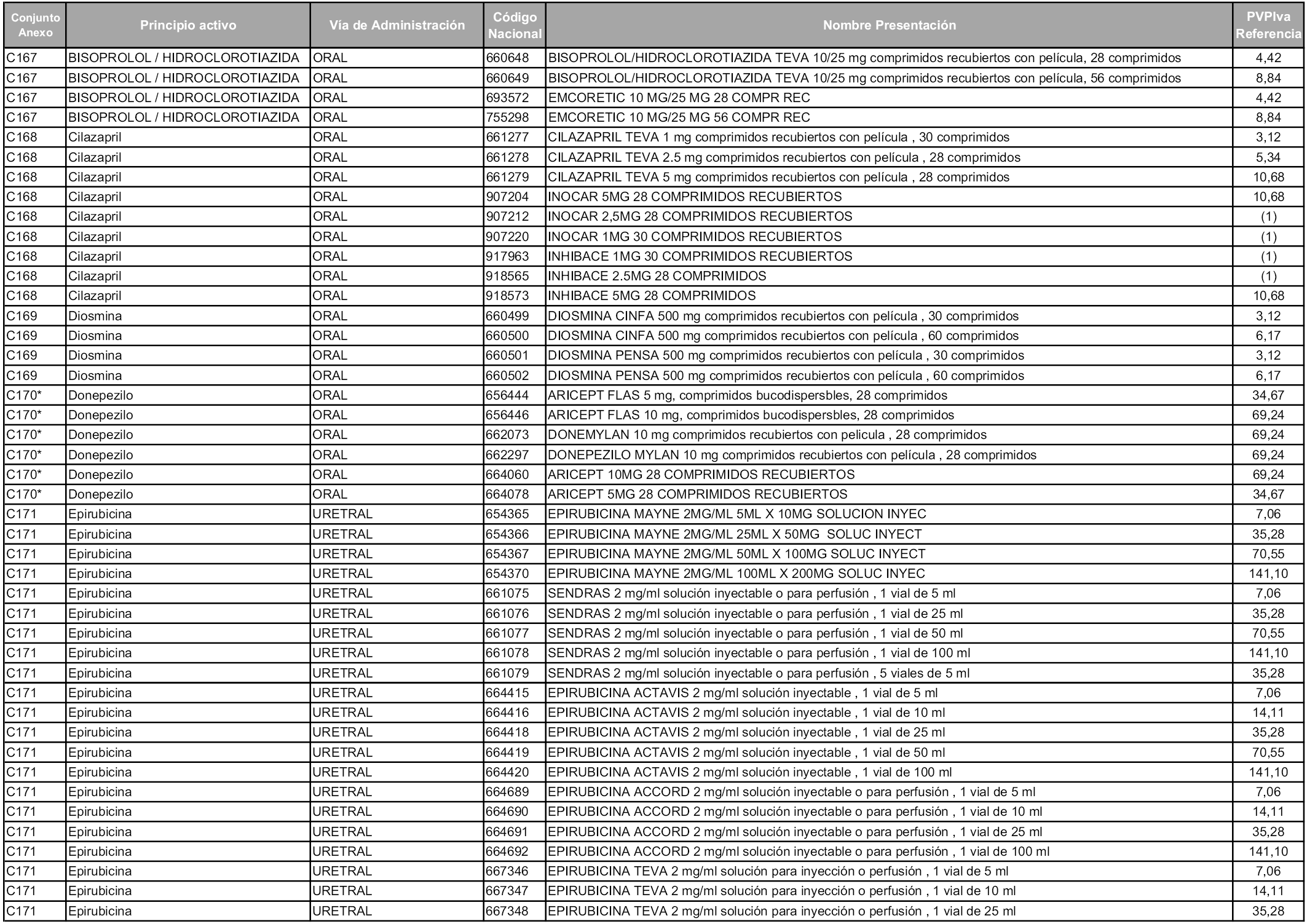
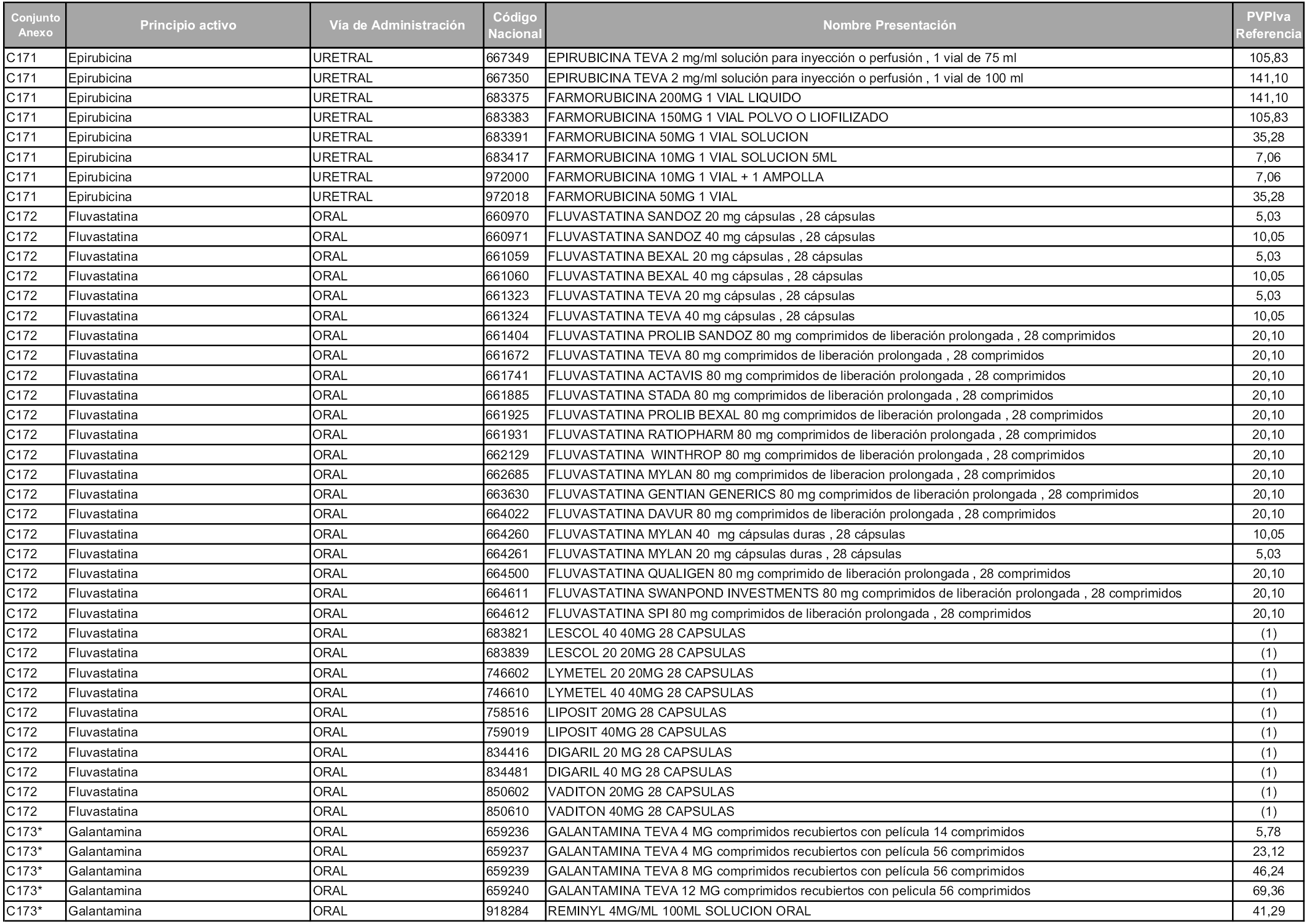
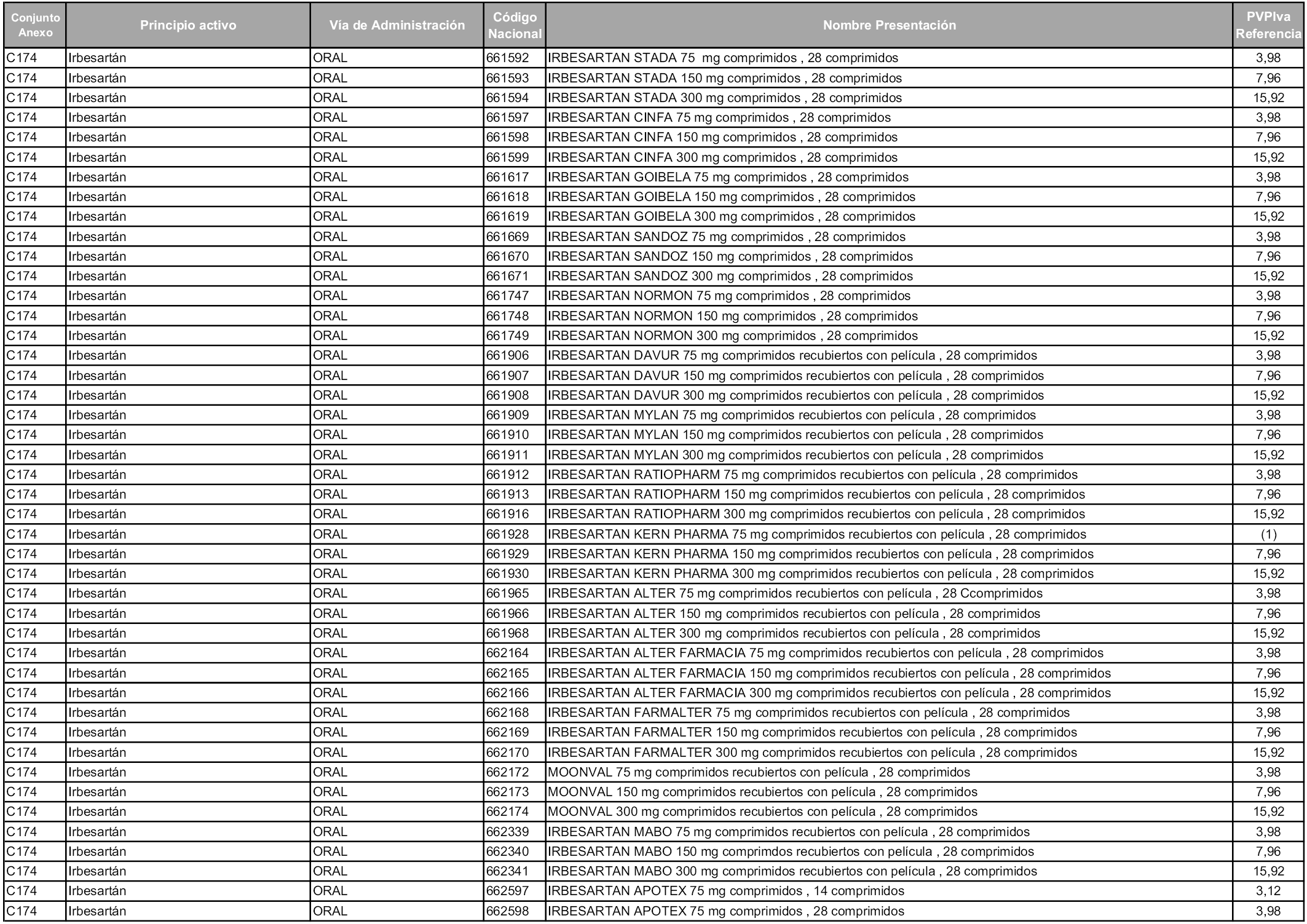
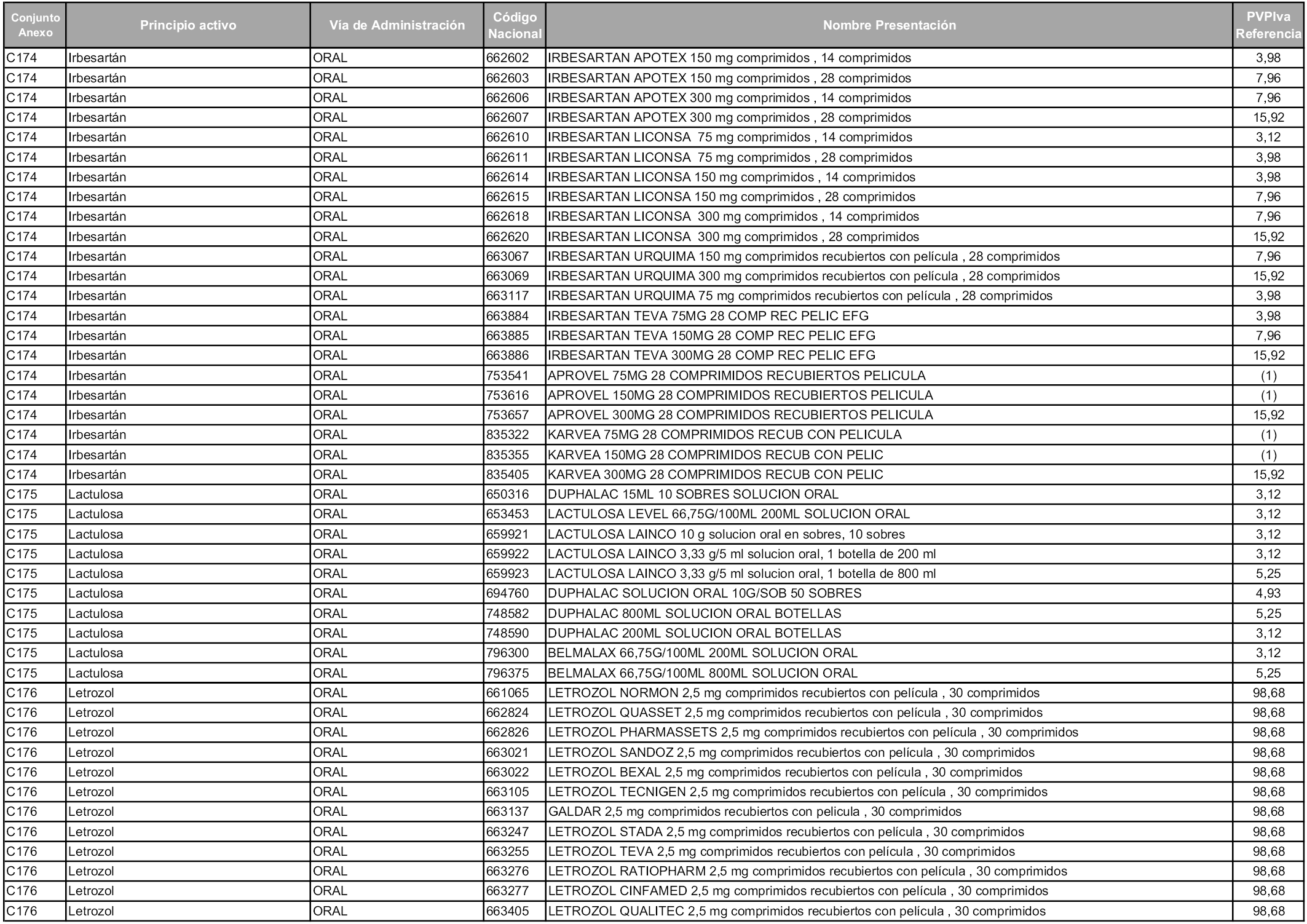
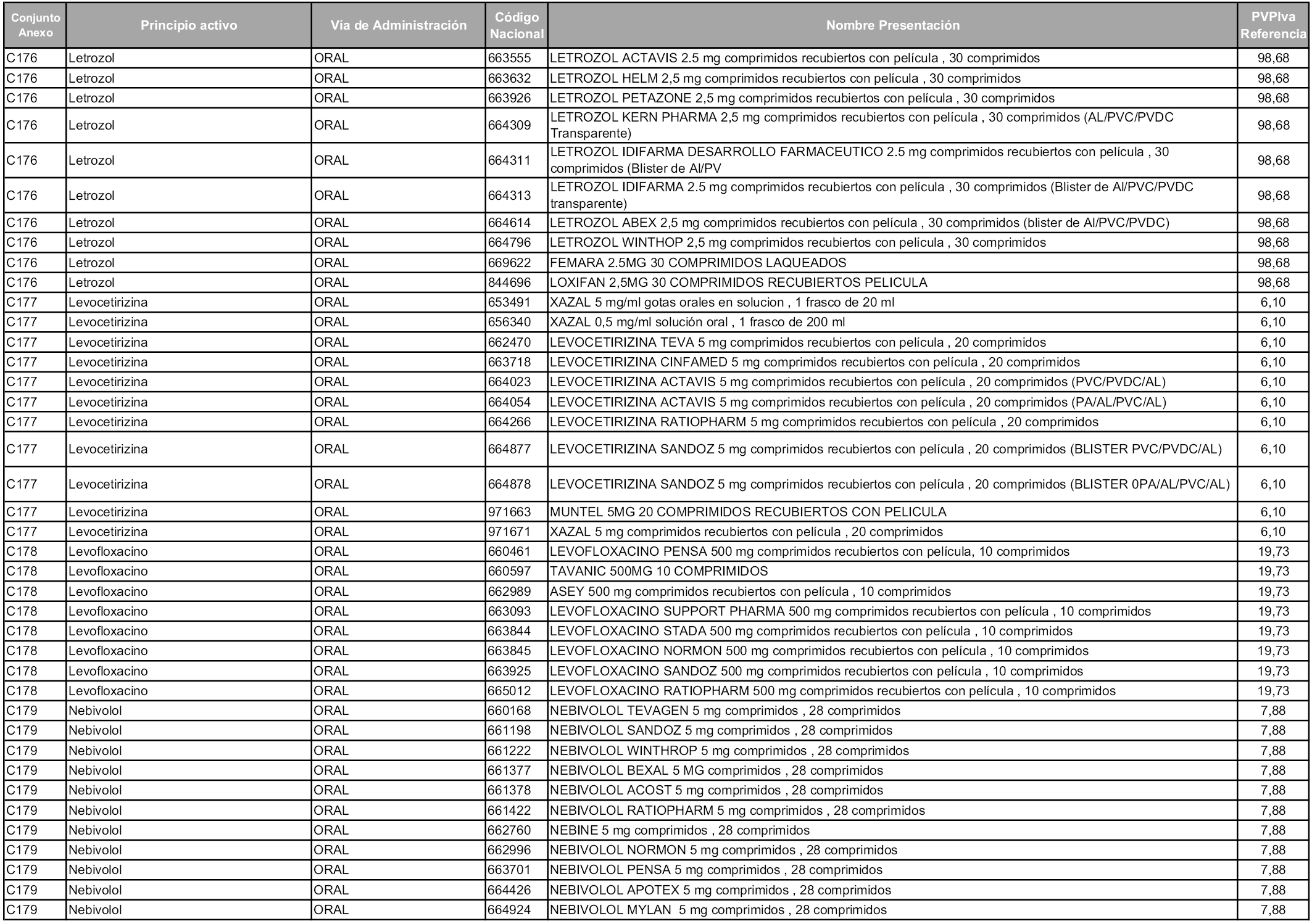
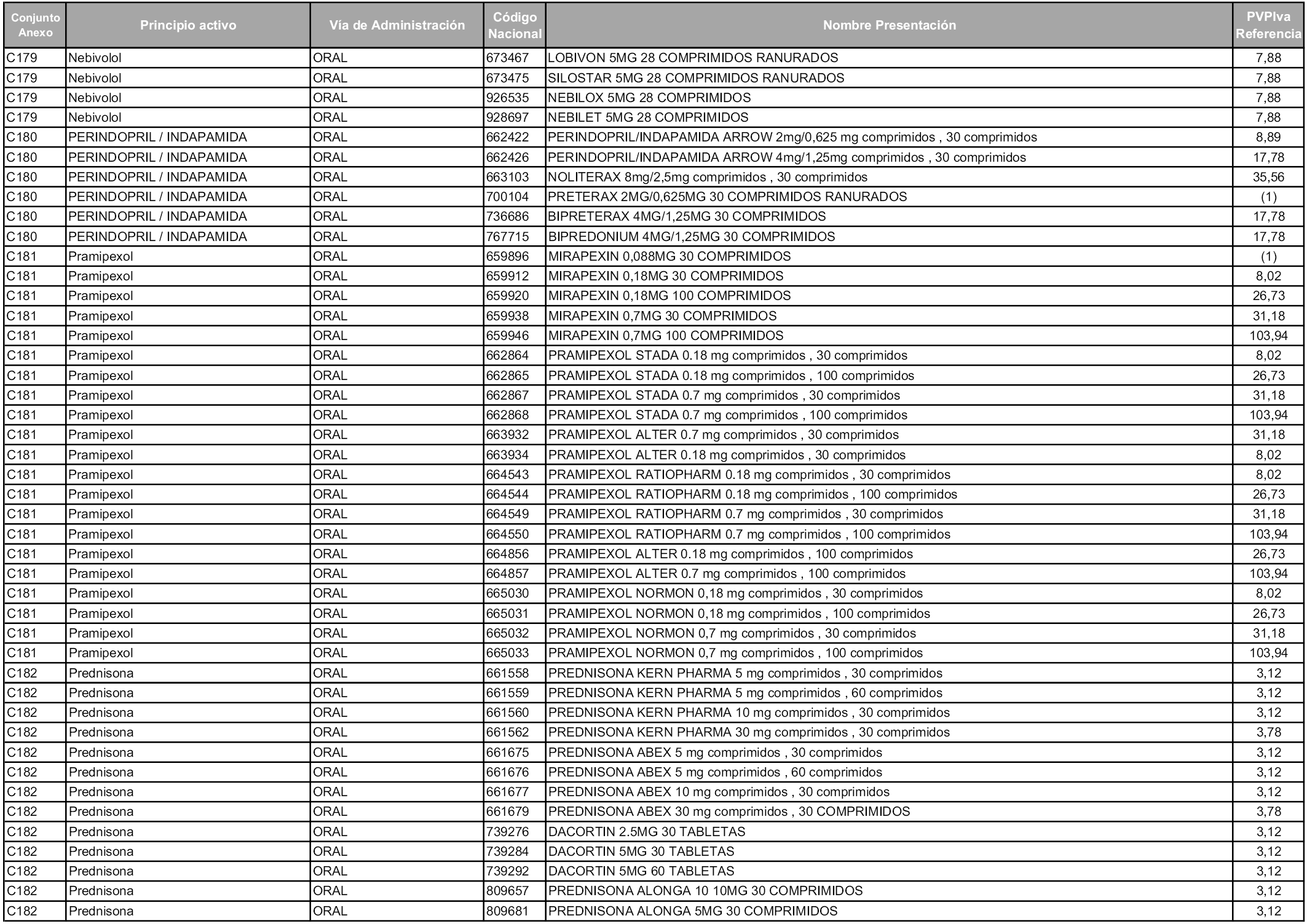
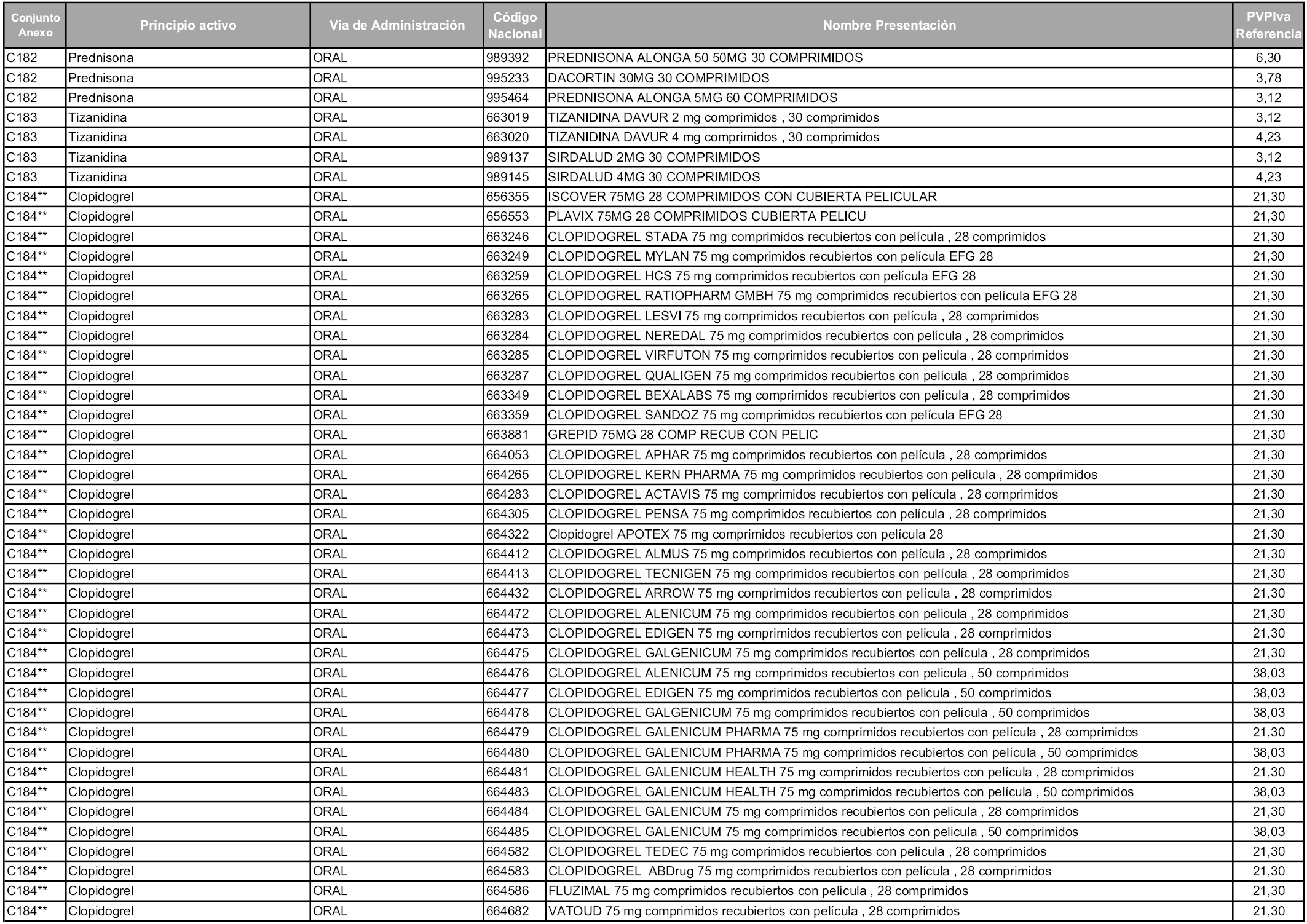
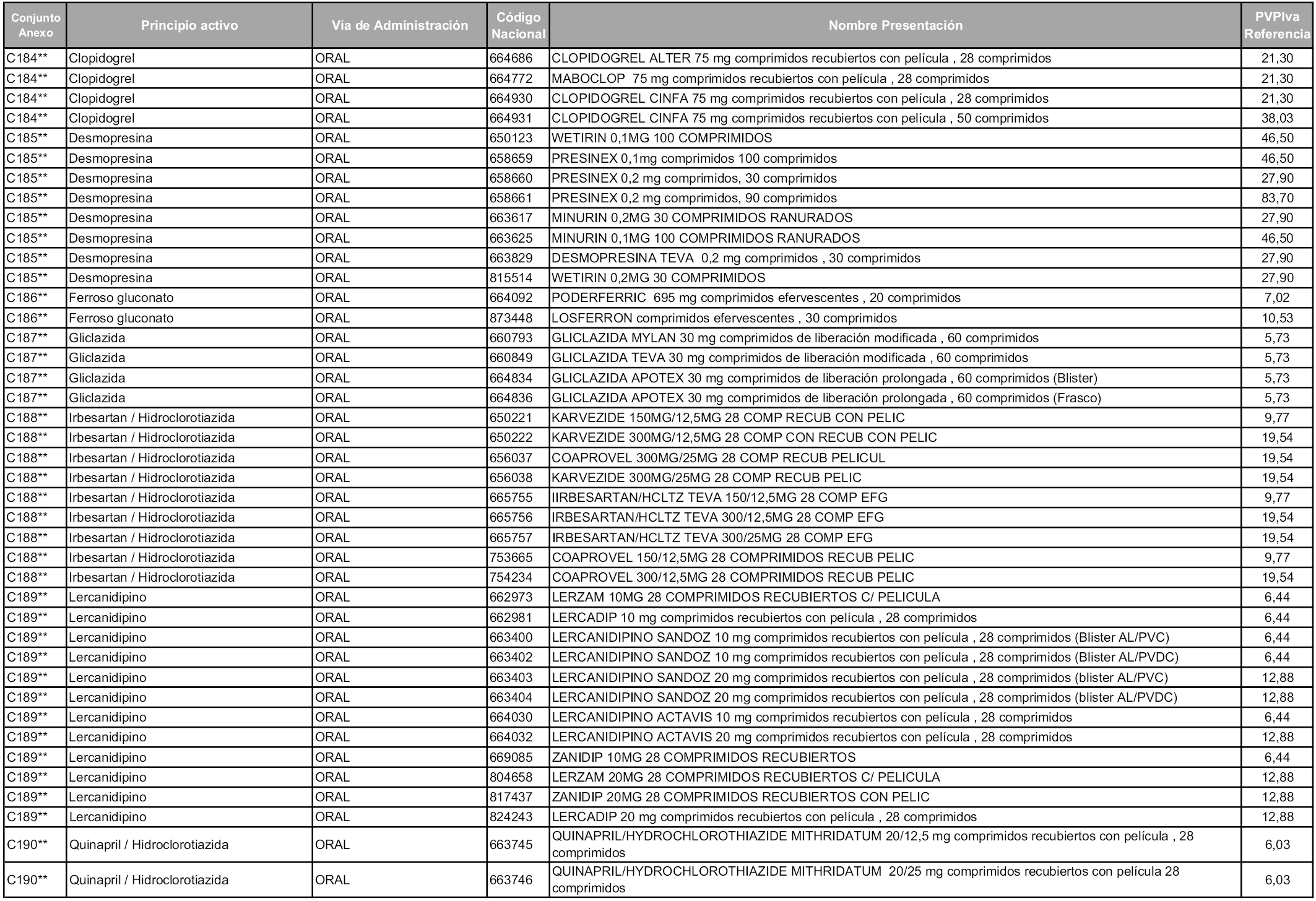
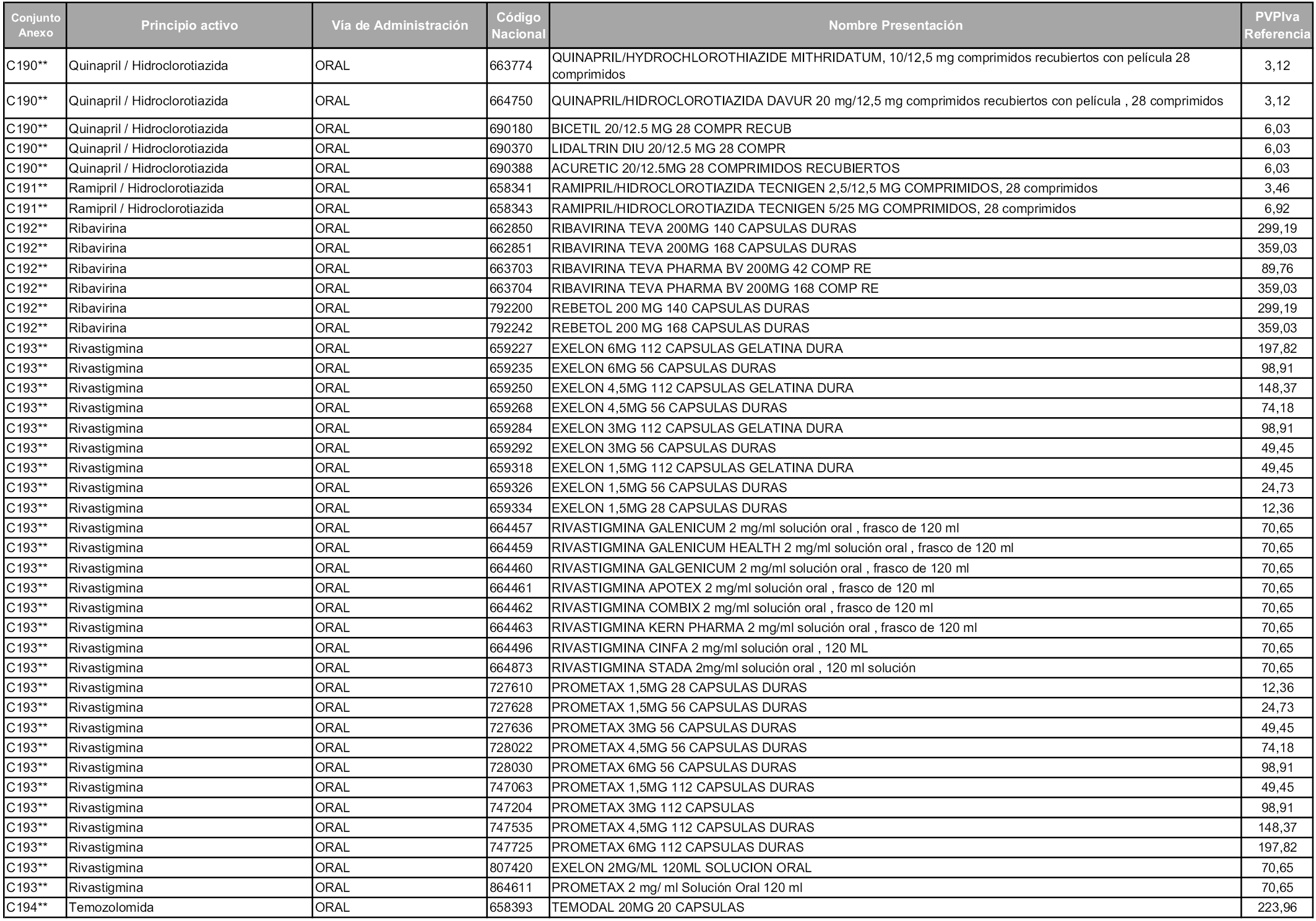
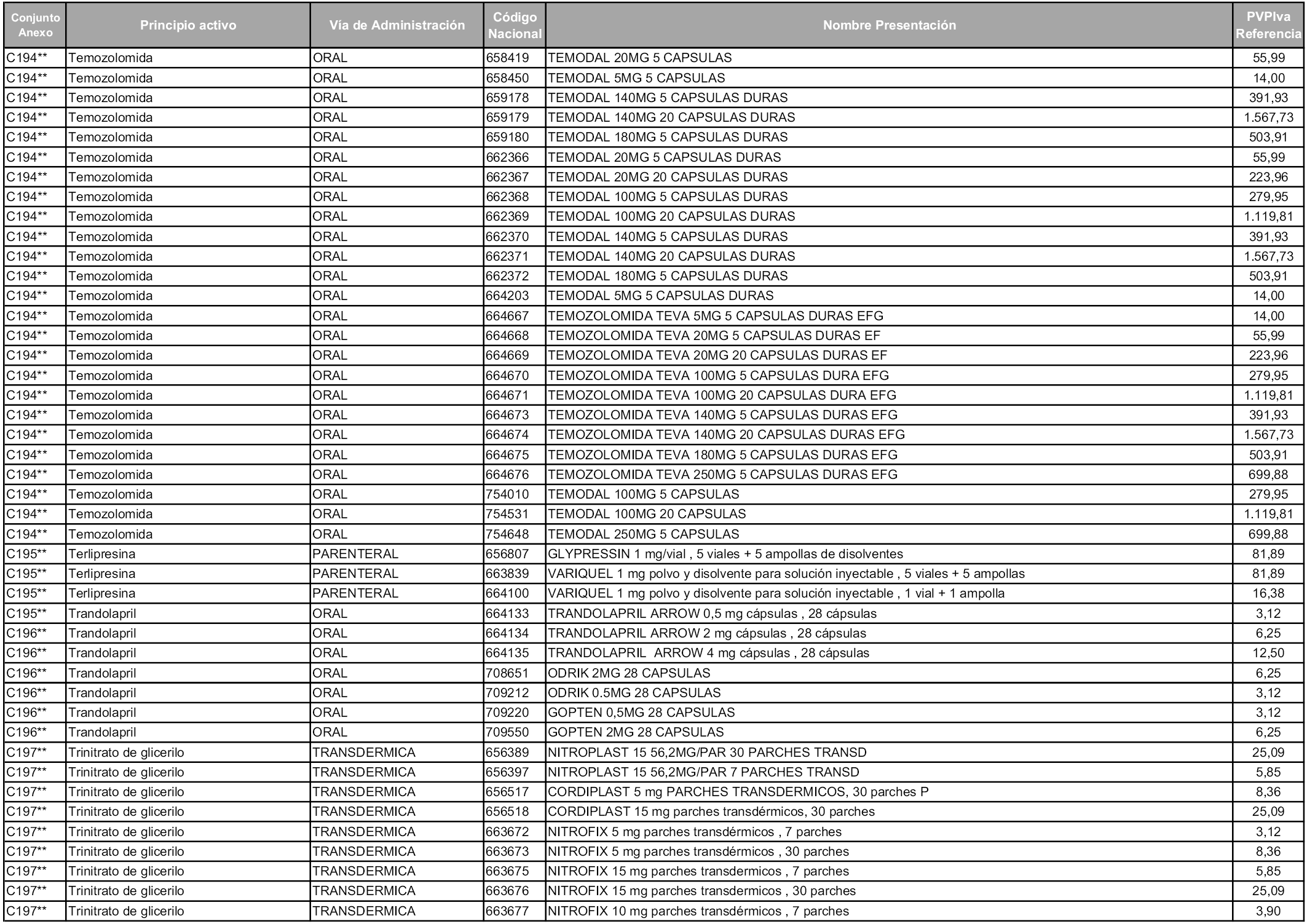
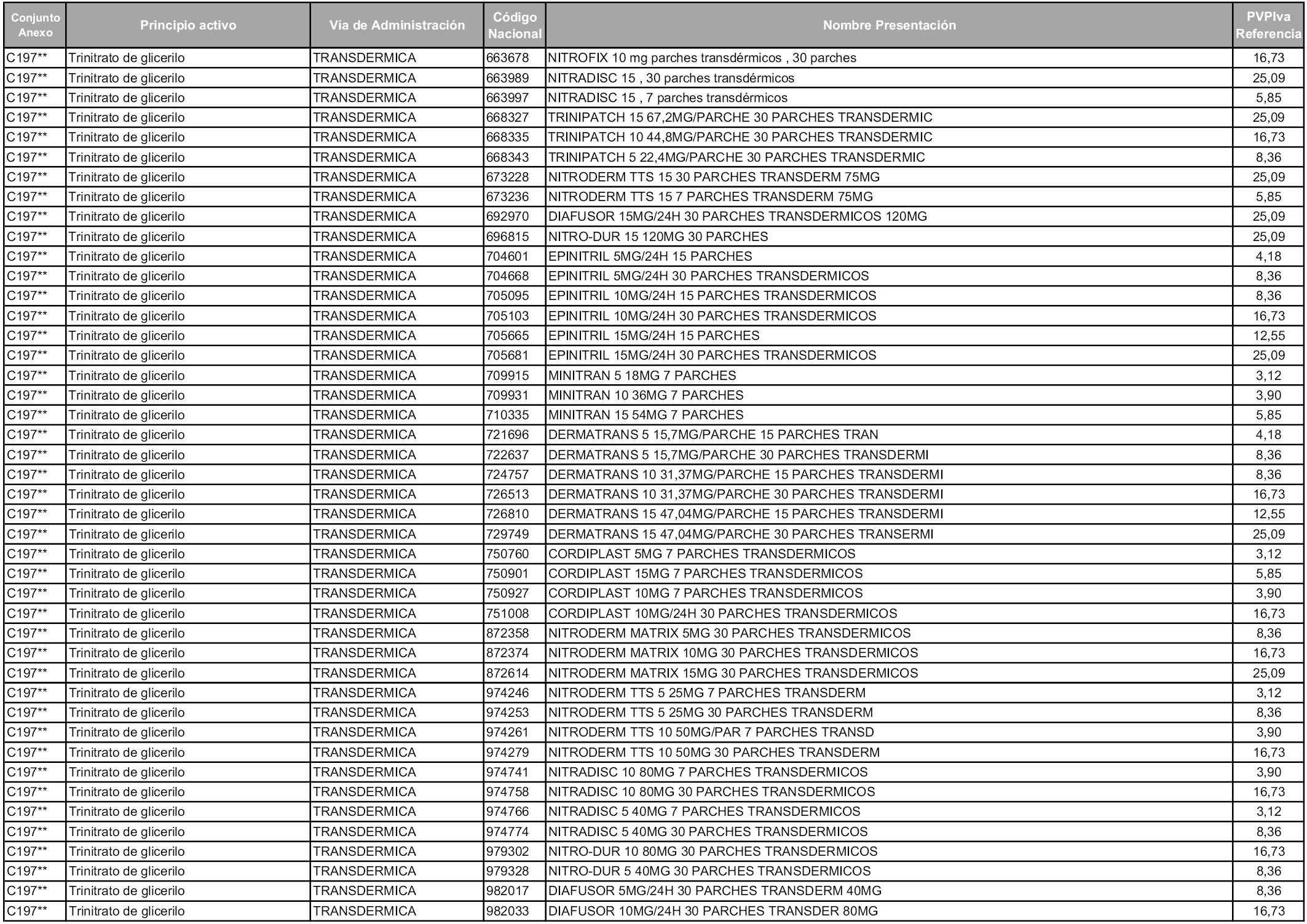
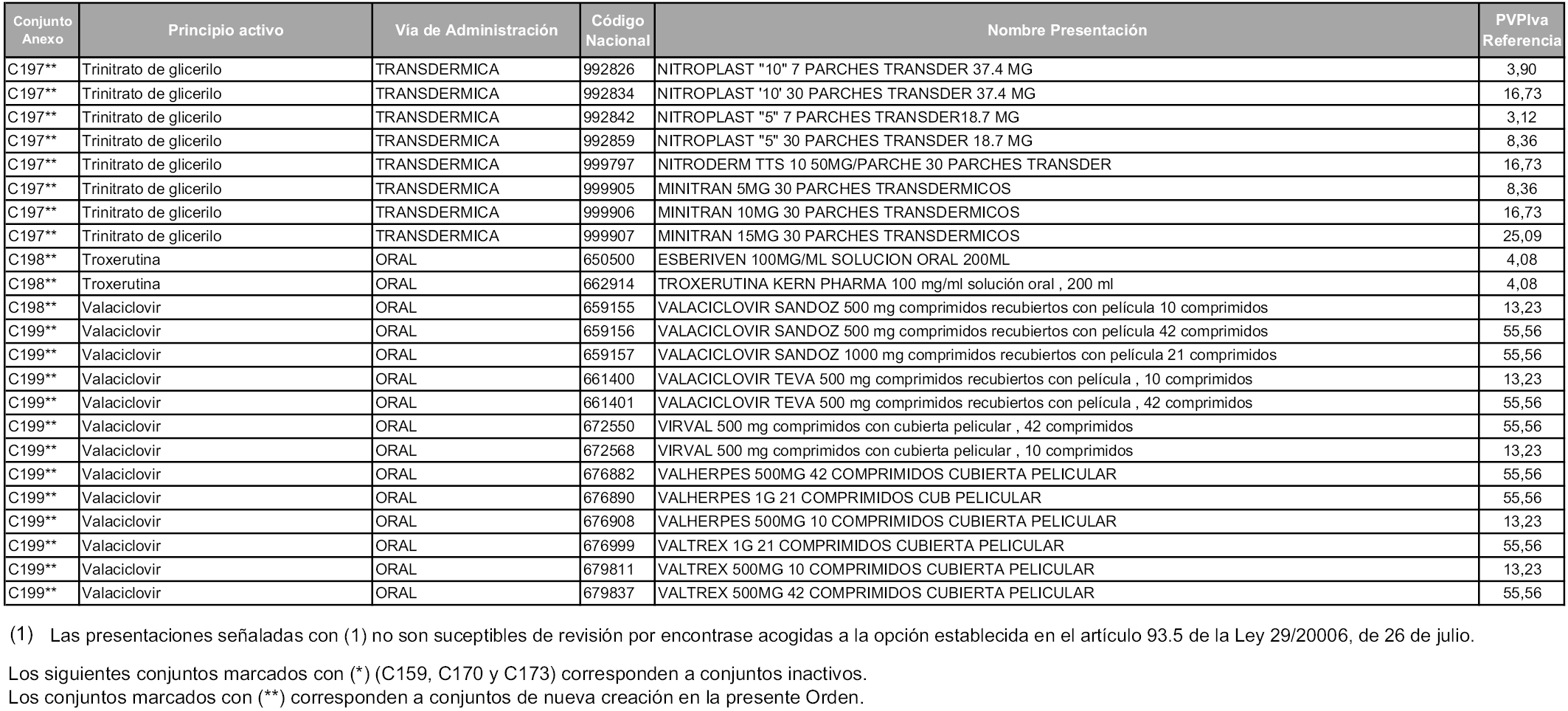
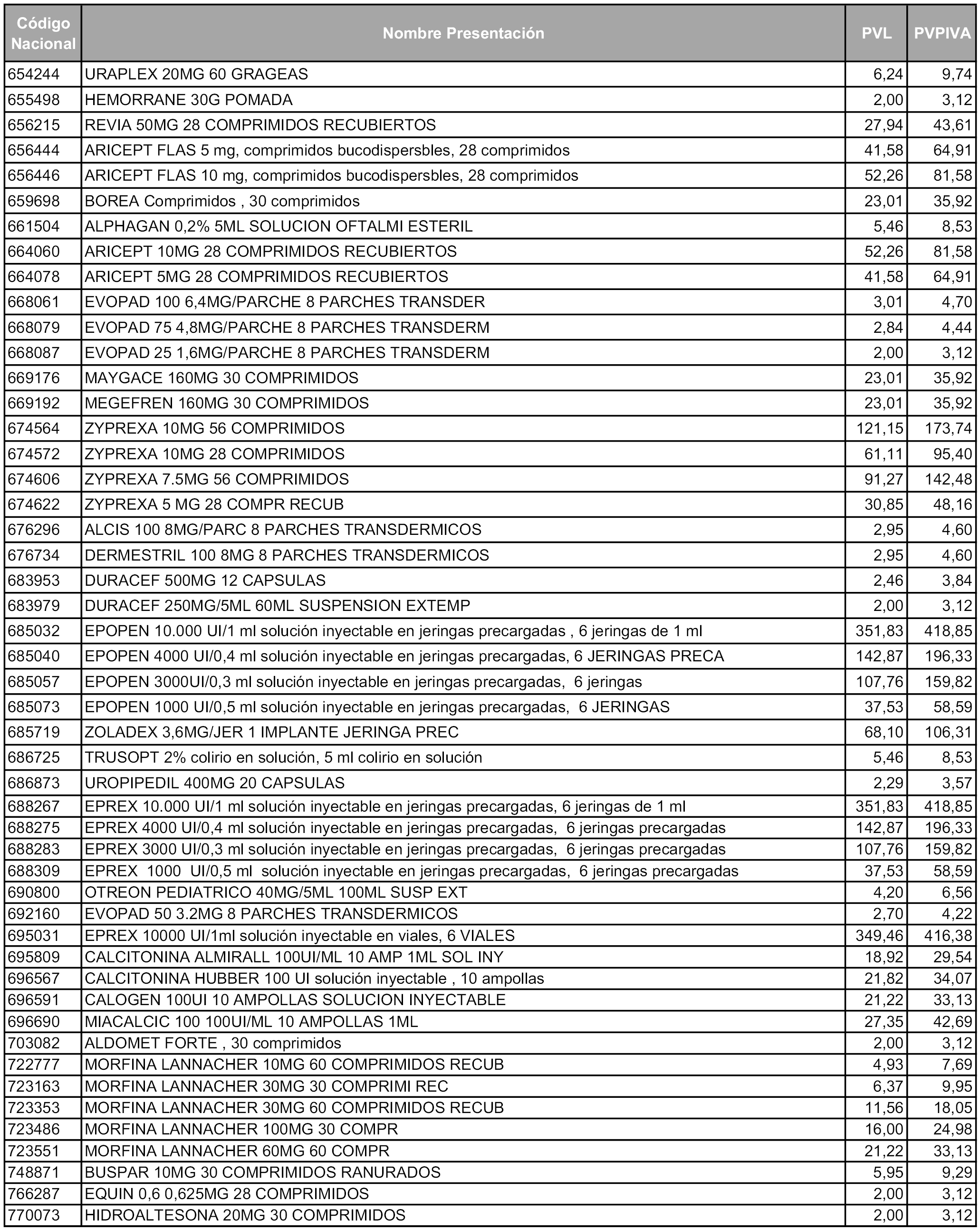
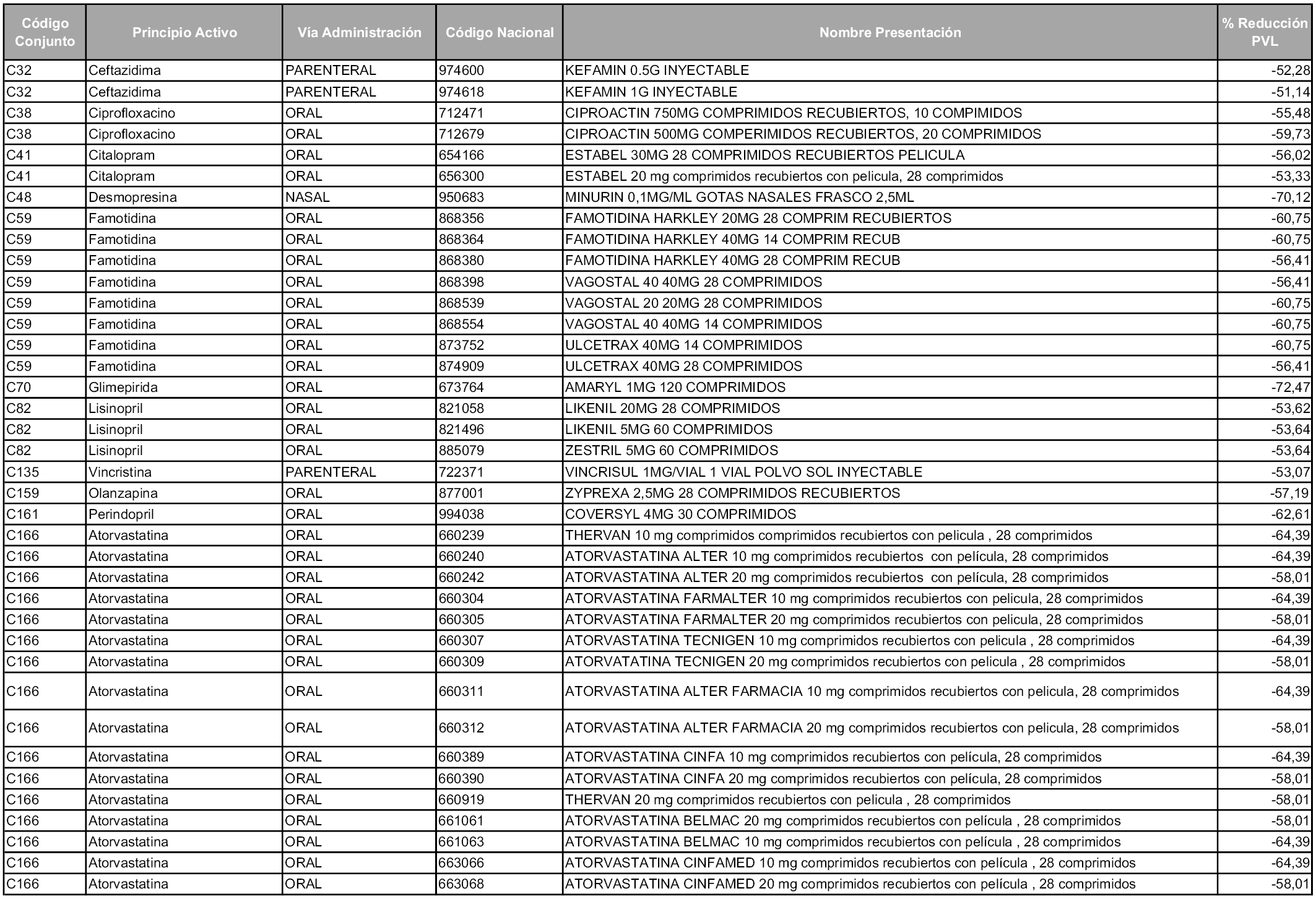
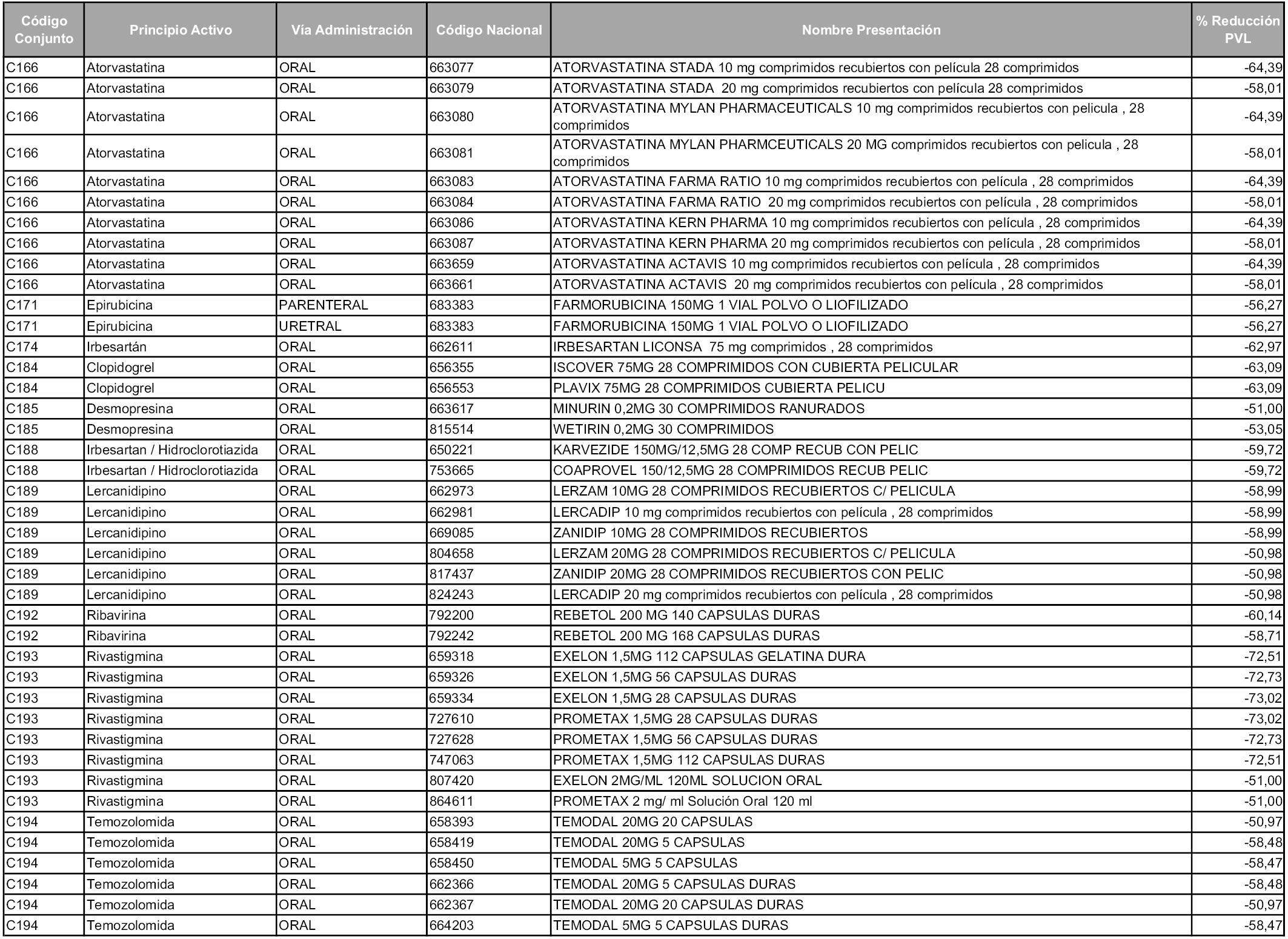
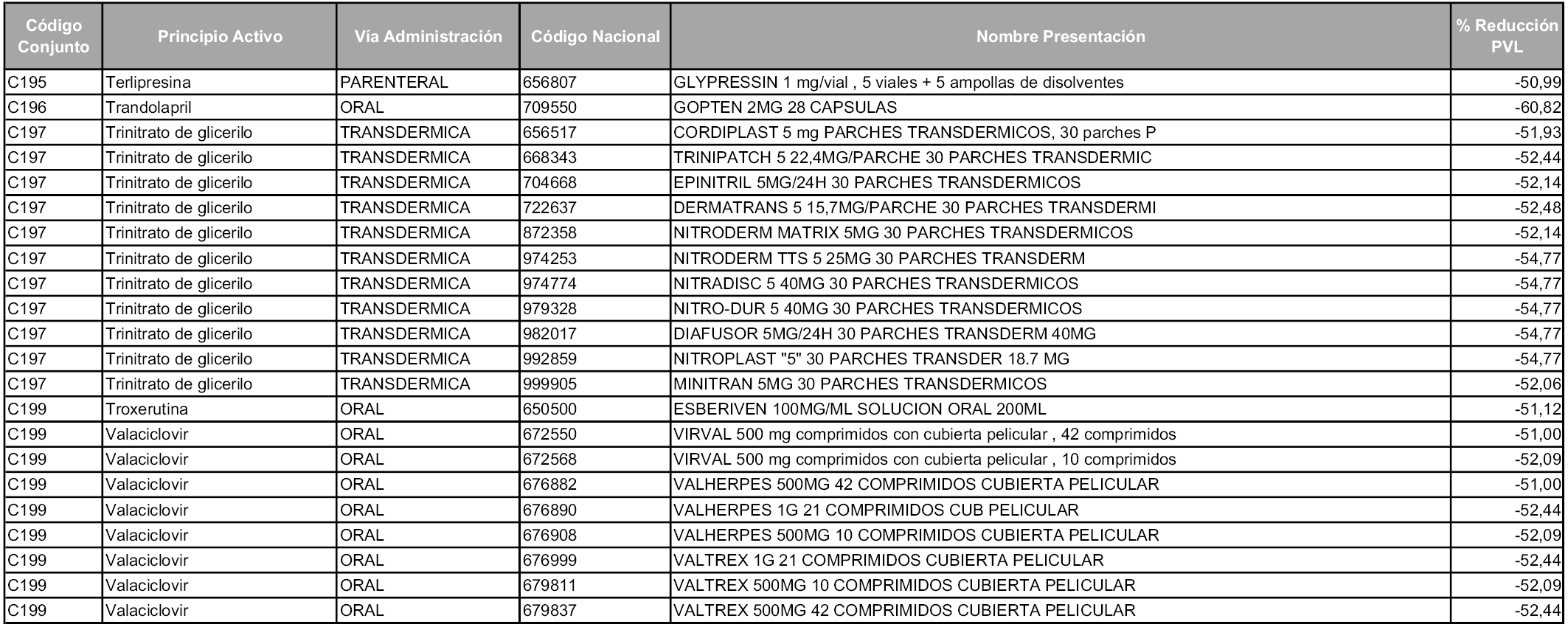
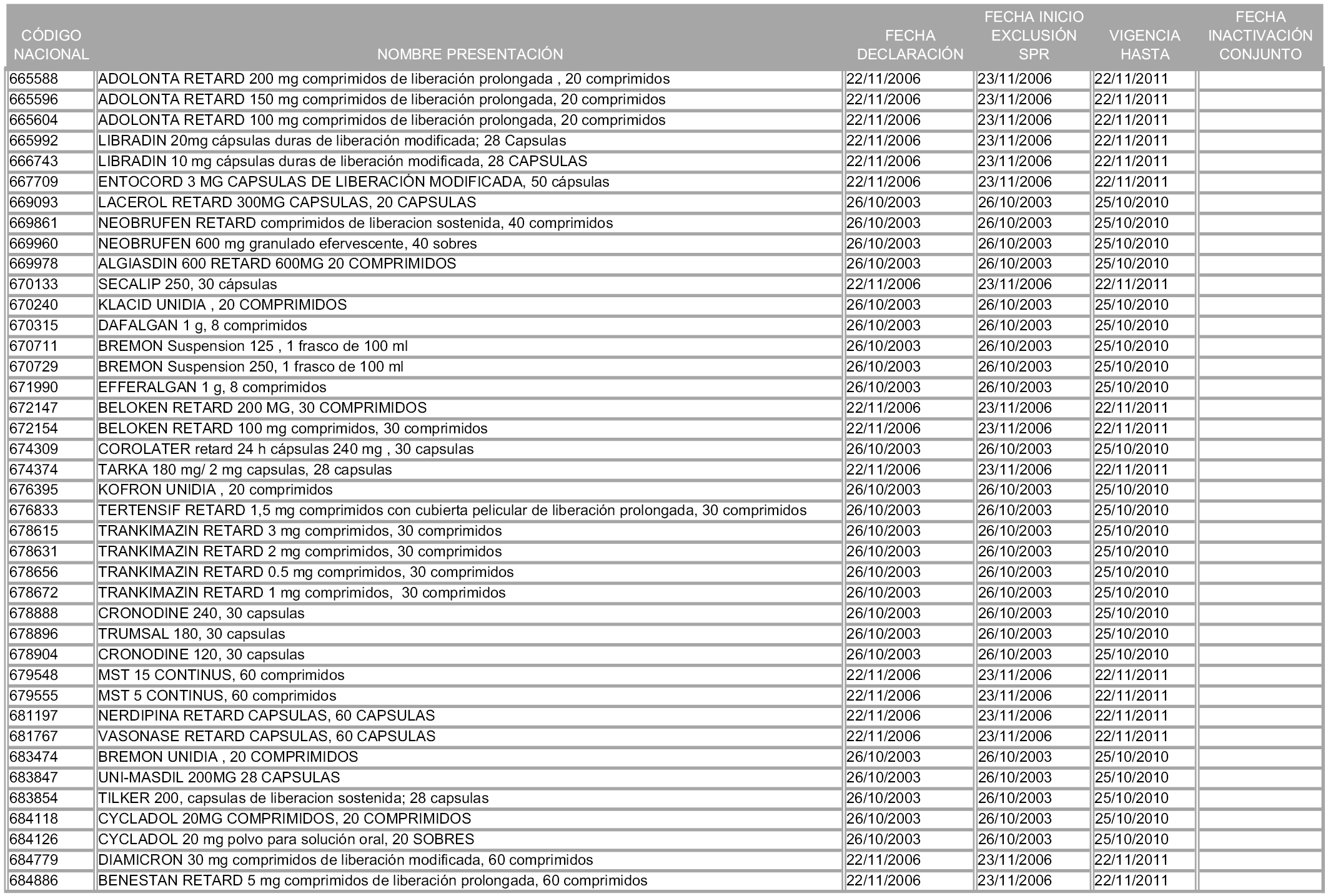
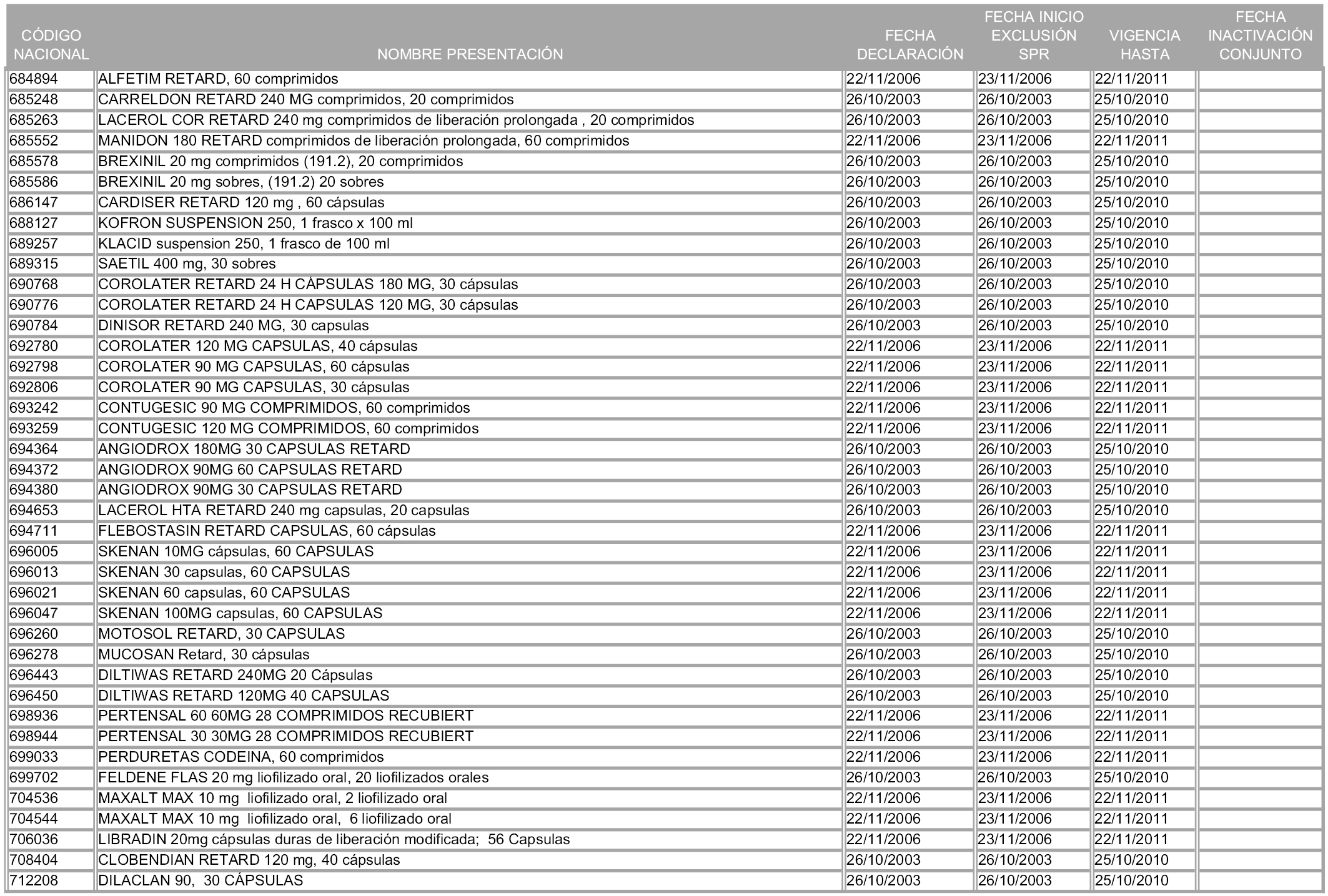
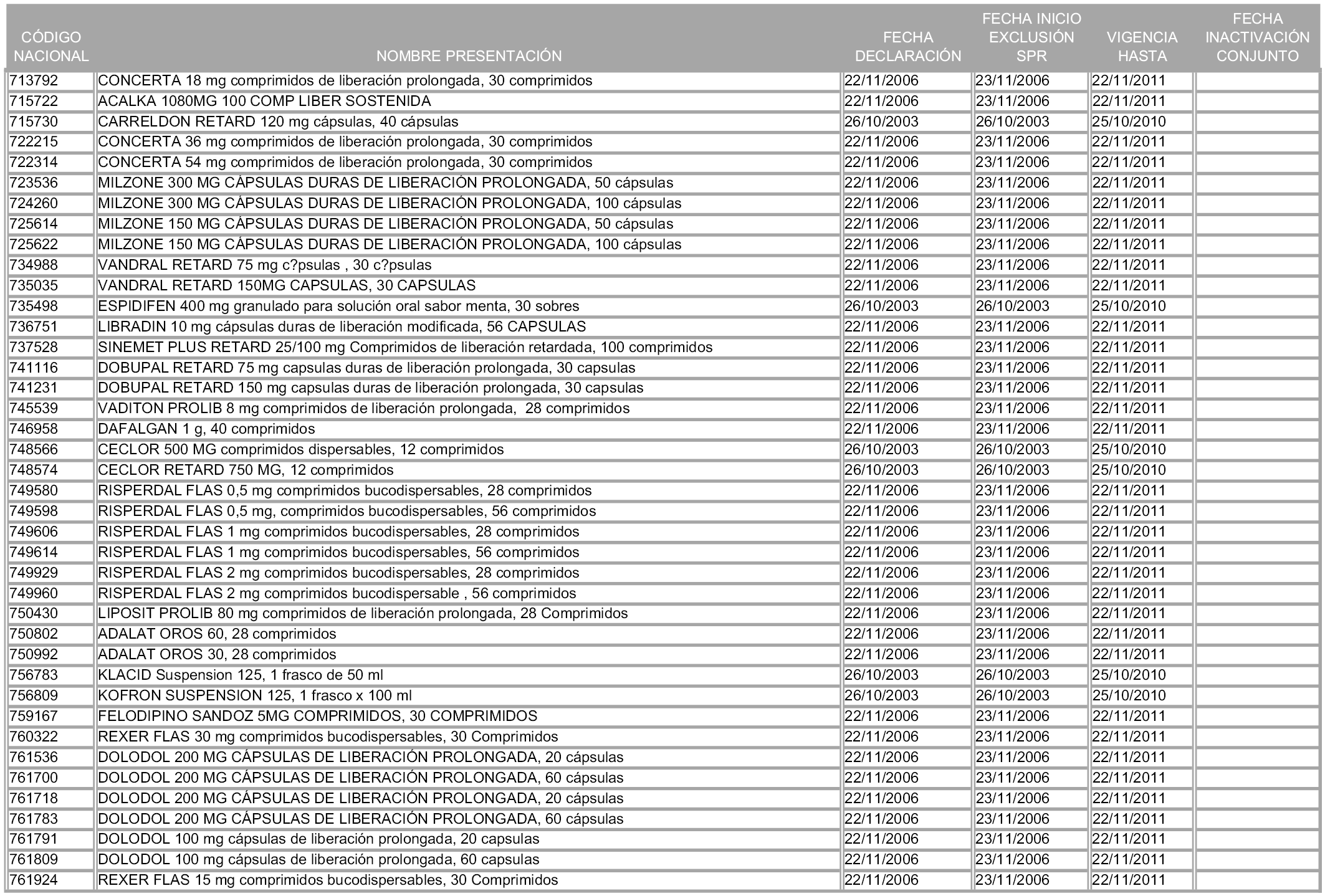
En aplicación del artículo 93.2 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, los conjuntos y sus precios de referencia son los que se relacionan en esta orden, enumerándose en el anexo 1 tanto los conjuntos ya existentes, con los nuevos precios obtenidos tras su revisión, como los conjuntos de nueva creación.
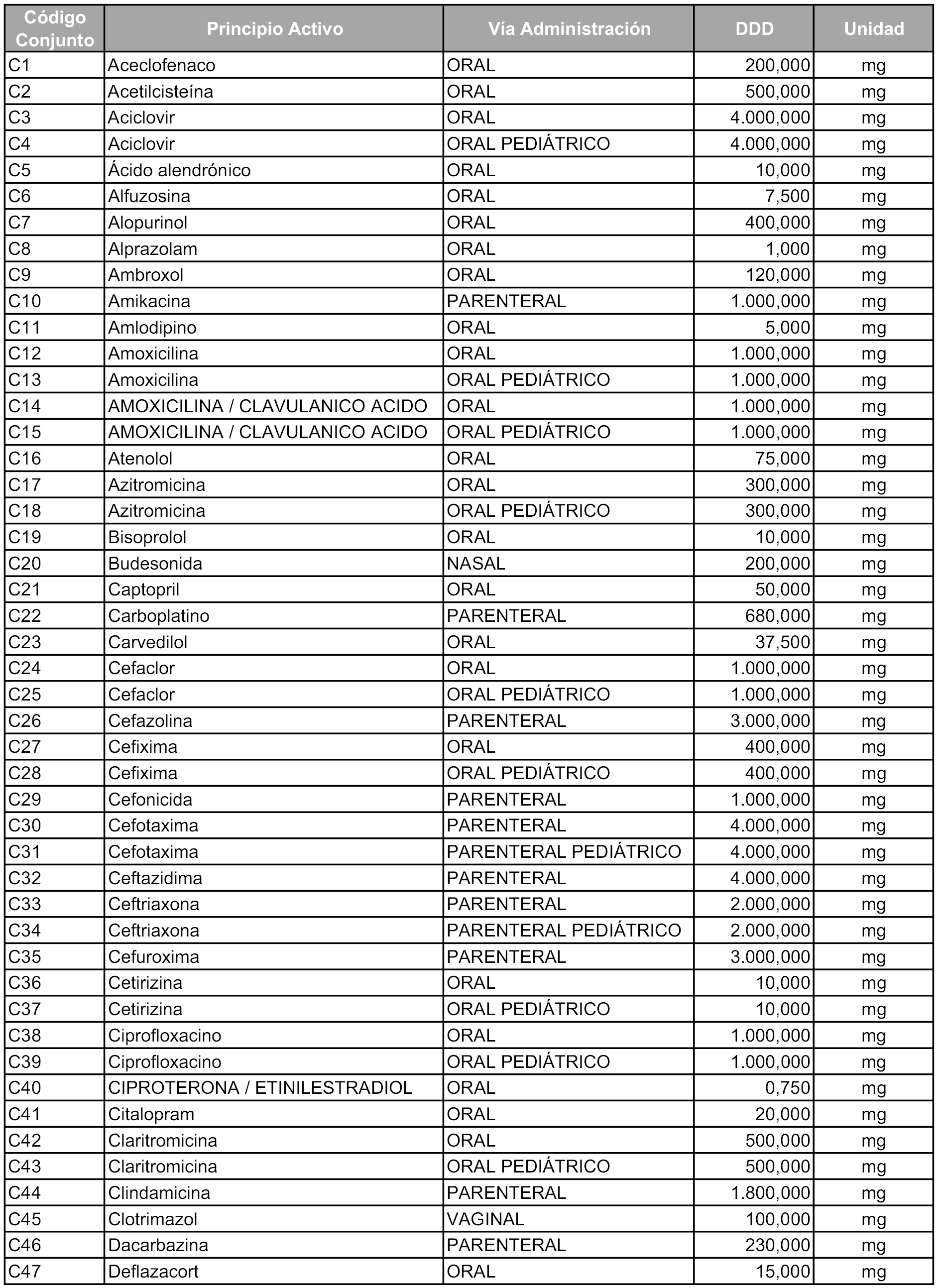
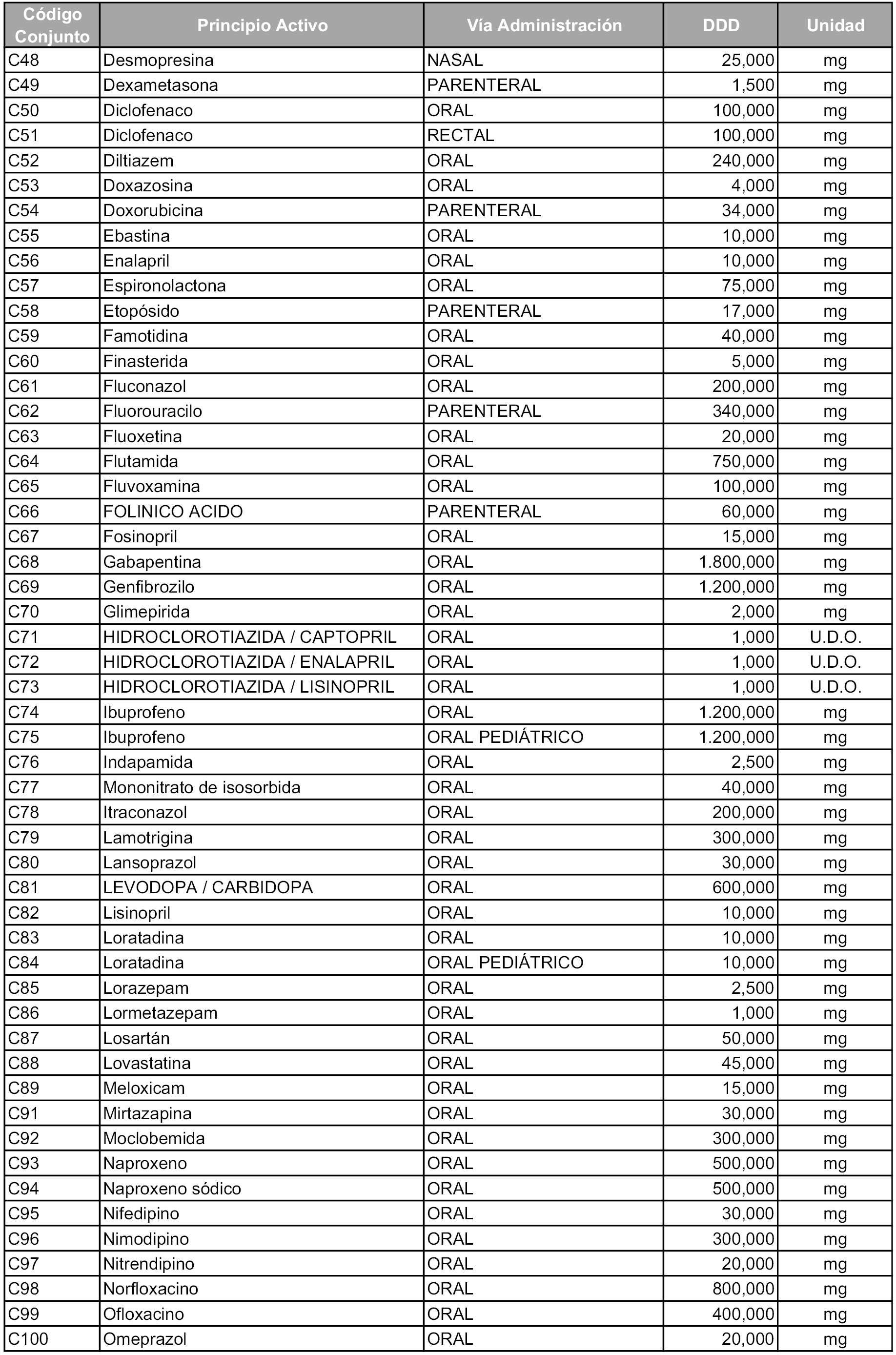
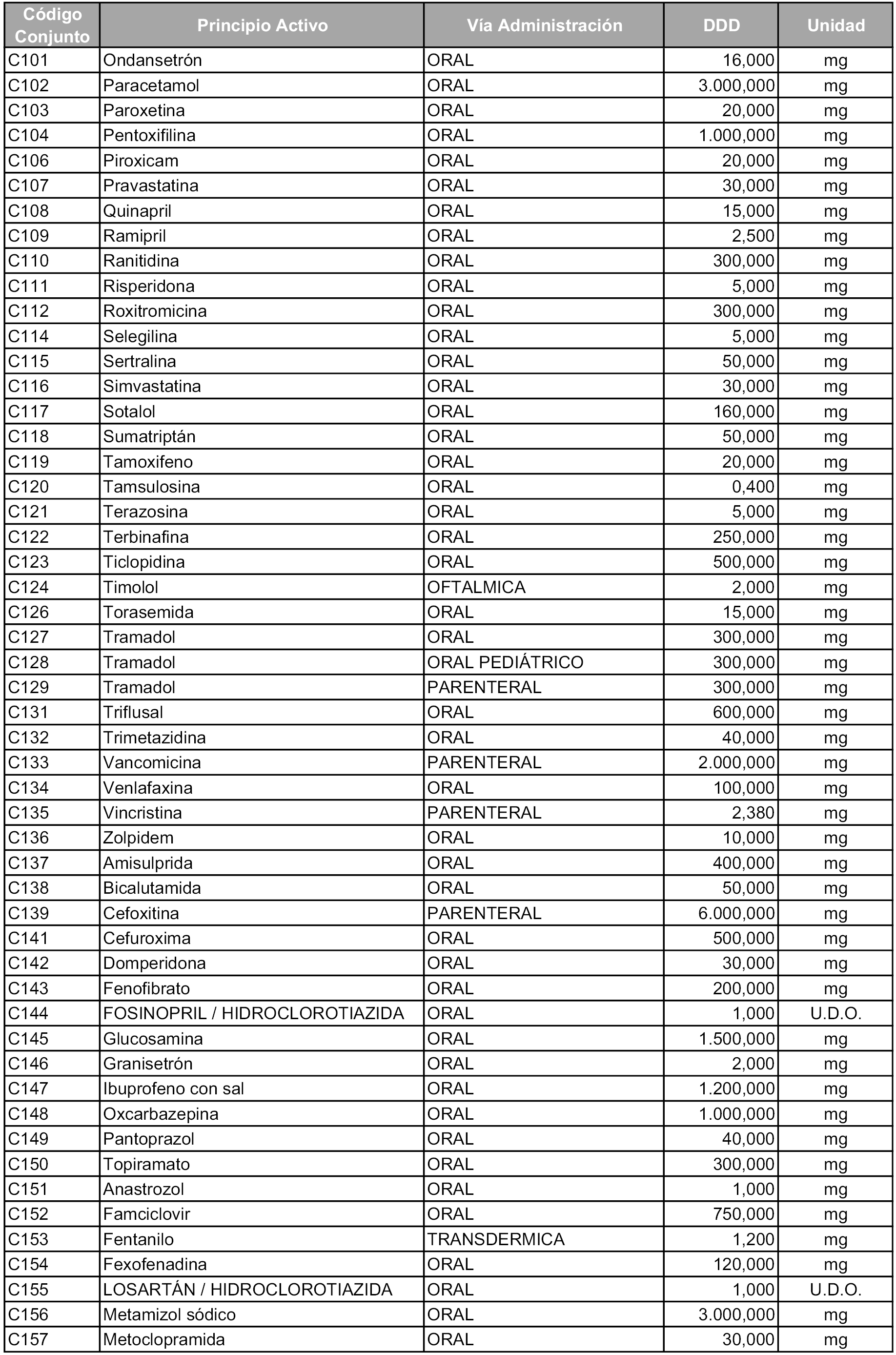
Para el cálculo de la cuantía del precio de referencia en cada conjunto se tendrá en cuenta lo siguiente:
a) Se seleccionará la presentación del medicamento con el coste/tratamiento/día menor.
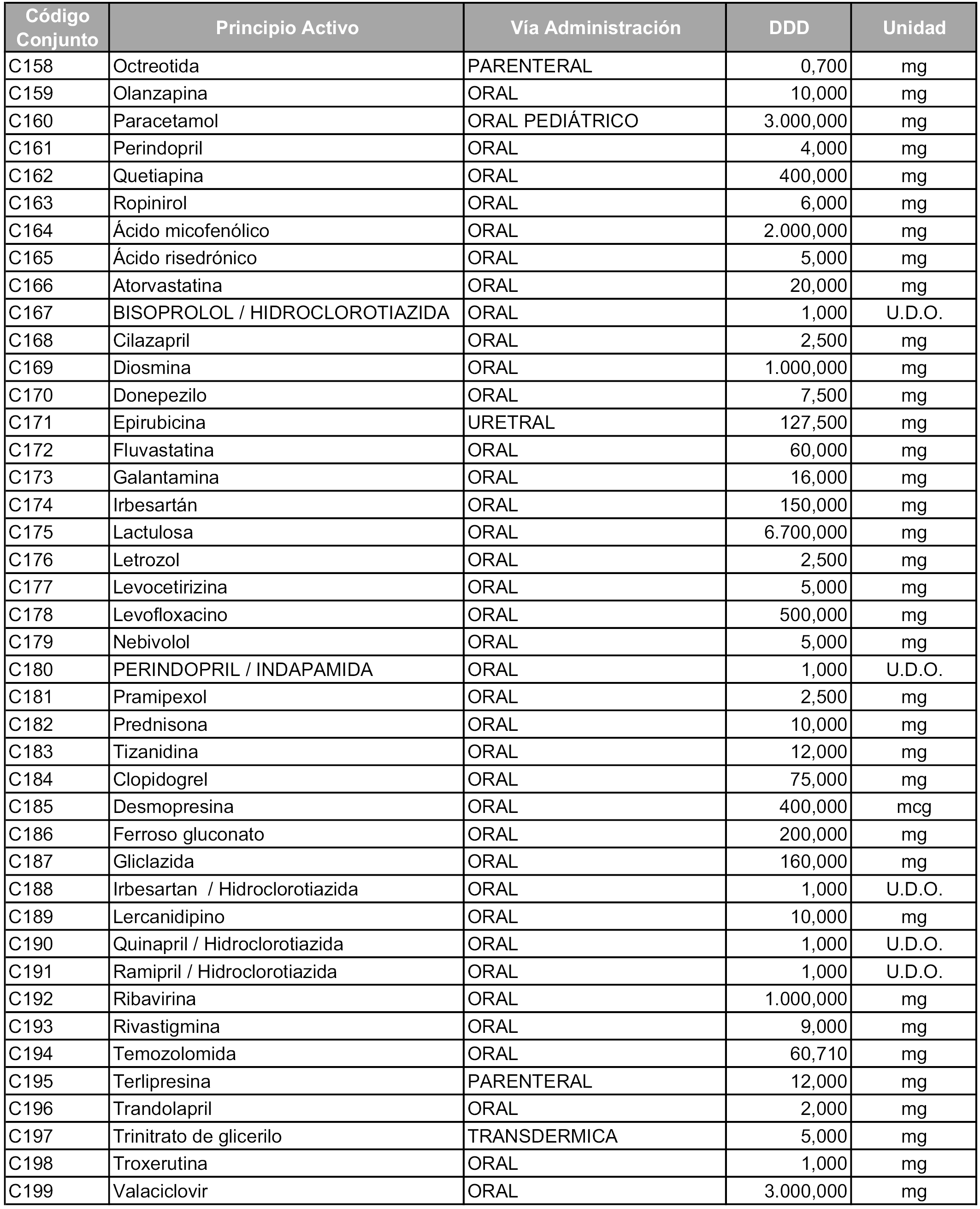
b) Las dosis diarias definidas son las relacionadas en el anexo 2.
En virtud de la potestad conferida por el párrafo segundo del artículo 93.2 de la Ley 29/2006, de 26 de julio, se fija en 3,12 euros de precio de venta al público, impuestos incluidos, el umbral mínimo de los precios de referencia objeto de la presente orden.
1. Para declarar un medicamento como innovación galénica de interés terapéutico deberá concurrir, al menos, alguno de los siguientes requisitos:
a) Que el medicamento se presente por primera vez bajo una vía de administración diferente a la autorizada y que esta nueva vía suponga una mejora significativa en la utilidad terapéutica del producto, basada en su eficacia, seguridad o utilidad en poblaciones especiales.
b) Que, aun presentándose bajo una vía de administración ya autorizada, se demuestre que la novedad galénica incorporada en el medicamento añade una mejora significativa en la utilidad terapéutica del producto, basada en su eficacia, seguridad o utilidad en poblaciones especiales.
2. Las ventajas terapéuticas, mejoras y facilidades a que se refieren los párrafos anteriores deberán ser objeto de evaluación y declaración por la Agencia Española de Medicamentos y Productos Sanitarios, conforme se establece en el artículo 4 de esta orden.
3. No podrán ser declarados como innovación galénica de interés terapéutico los medicamentos que cumplan la definición de medicamento genérico ni tampoco aquellos medicamentos de los que exista en el mercado formulación genérica con la misma composición cualitativa y cuantitativa en principio activo y la misma forma farmacéutica.
1. El procedimiento se iniciará a solicitud de persona interesada dirigida a la Agencia Española de Medicamentos y Productos Sanitarios, en el plazo de tres meses desde que la nueva forma farmacéutica haya sido autorizada, de acuerdo con lo dispuesto en el capítulo II del título II de la Ley 29/2006, de 26 de julio. Para los medicamentos que hayan sido autorizados por procedimiento centralizado, el plazo anterior de tres meses comenzará a contar a partir de la fecha de la comunicación de la Agencia Española de Medicamentos y Productos Sanitarios del material de acondicionamiento definitivo para su comercialización en España y la asignación de un código nacional. En la solicitud, que podrá presentarse en cualquiera de los lugares previstos en el artículo 38.4 de la Ley 30/1992, de 26 de noviembre, de Régimen Jurídico de las Administraciones Públicas y del Procedimiento Administrativo Común, deberá justificarse el cumplimiento de los criterios fijados en el artículo 3 de esta Orden.
2. La Agencia dictará propuesta de resolución y se iniciará el trámite de audiencia de acuerdo con lo dispuesto en el artículo 84 de la citada Ley 30/1992, de 26 de noviembre.
3. La resolución del titular de la Agencia Española de Medicamentos y Productos Sanitarios se dictará y notificará en un plazo no superior a seis meses, a contar desde la fecha de entrada de la solicitud en el registro de la Agencia, y pondrá fin a la vía administrativa.
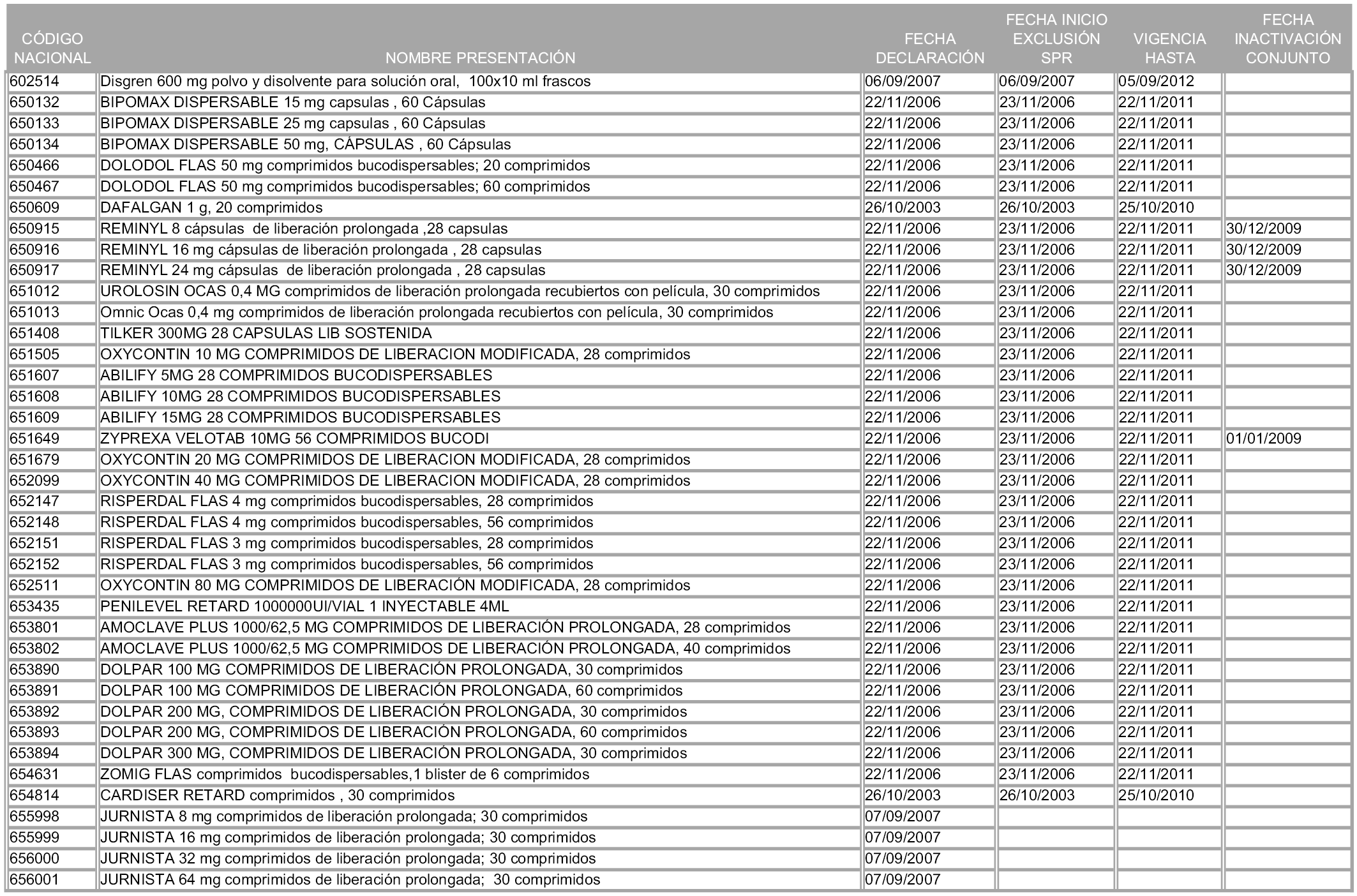
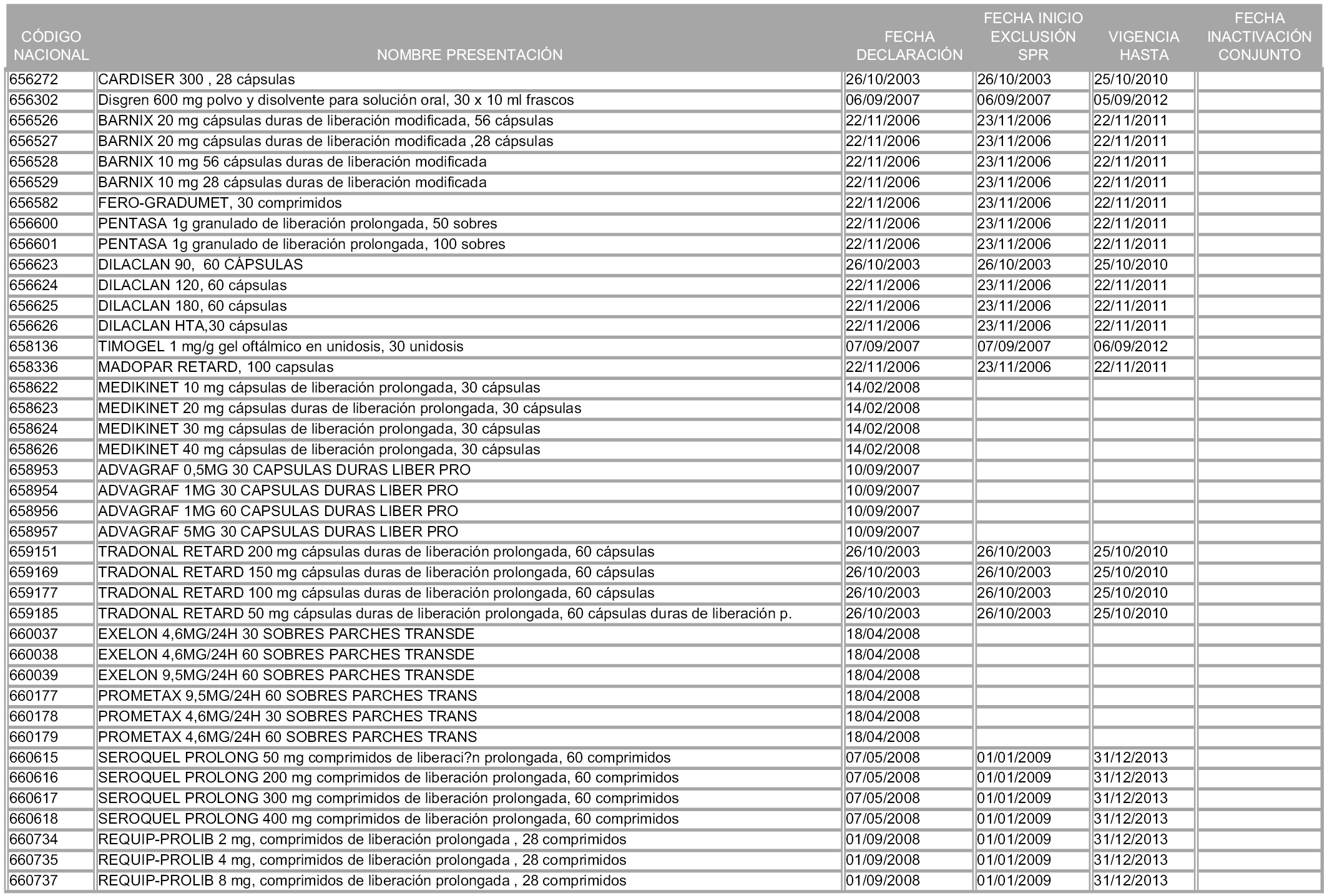
1. Los medicamentos que sean declarados innovaciones galénicas quedarán excluidos del sistema de precios de referencia durante un período de cinco años computables desde la fecha de entrada en vigor de la orden ministerial que determine el conjunto correspondiente a su principio activo y precio de referencia. Transcurrido dicho plazo, se integrarán en el conjunto de referencia.
2. En el supuesto de que la citada calificación sea posterior a la creación del conjunto correspondiente al principio activo y precio de referencia, el plazo de exclusión de cinco años se computará desde la fecha de la declaración de innovación galénica, debiendo reponerse, a partir de ese momento, el precio que el medicamento tuviera con anterioridad a la creación de aquel conjunto.
1. Las presentaciones de medicamentos cuya declaración como innovación galénica expire a partir de la entrada en vigor de la presente orden, se incorporarán a los conjuntos correspondientes a partir del primer día del mes siguiente a expirar la mencionada declaración, de conformidad con lo dispuesto en el artículo 93.2 de la Ley 29/2006, de 26 de julio, en relación con el artículo 5 de esta Orden.
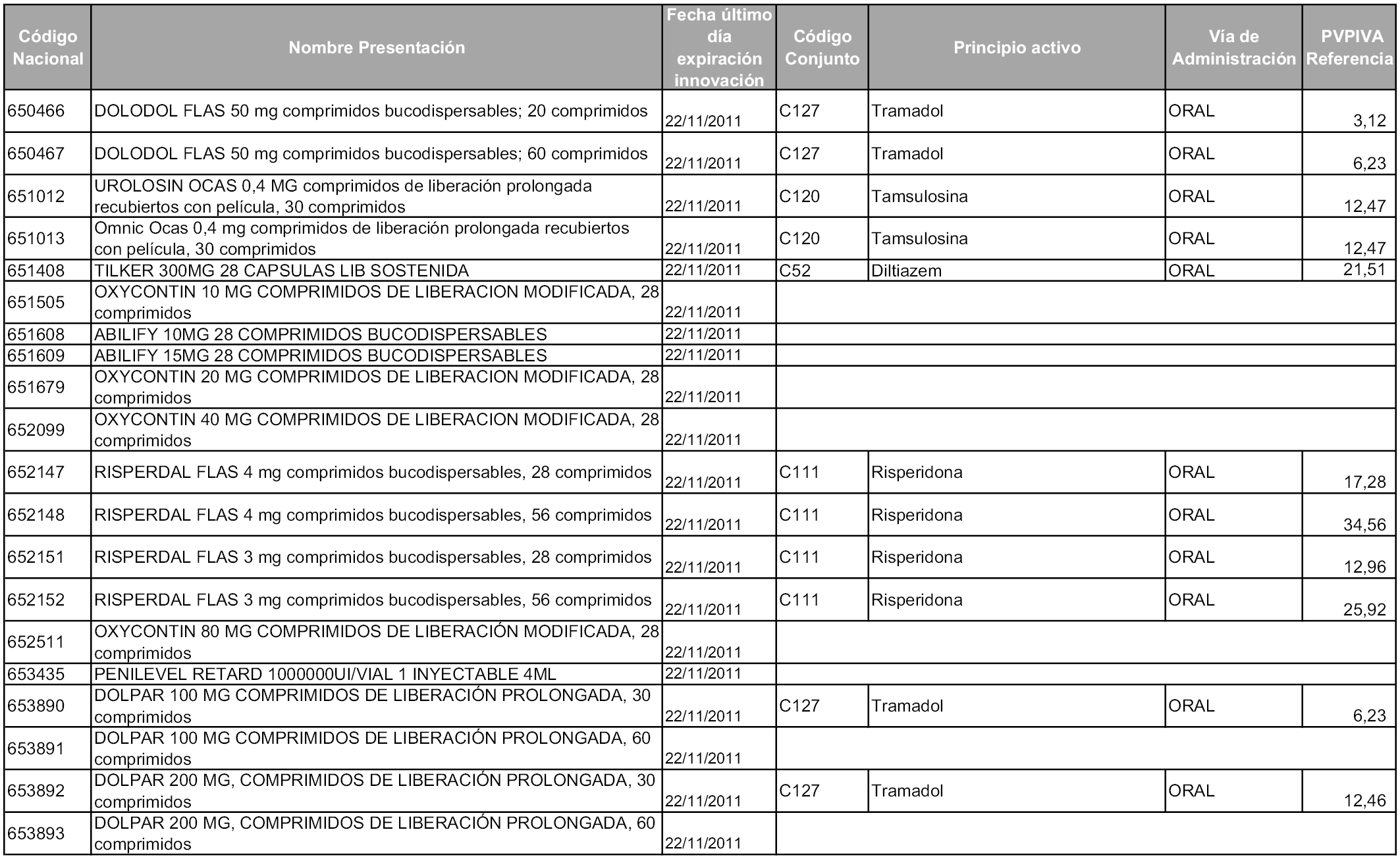
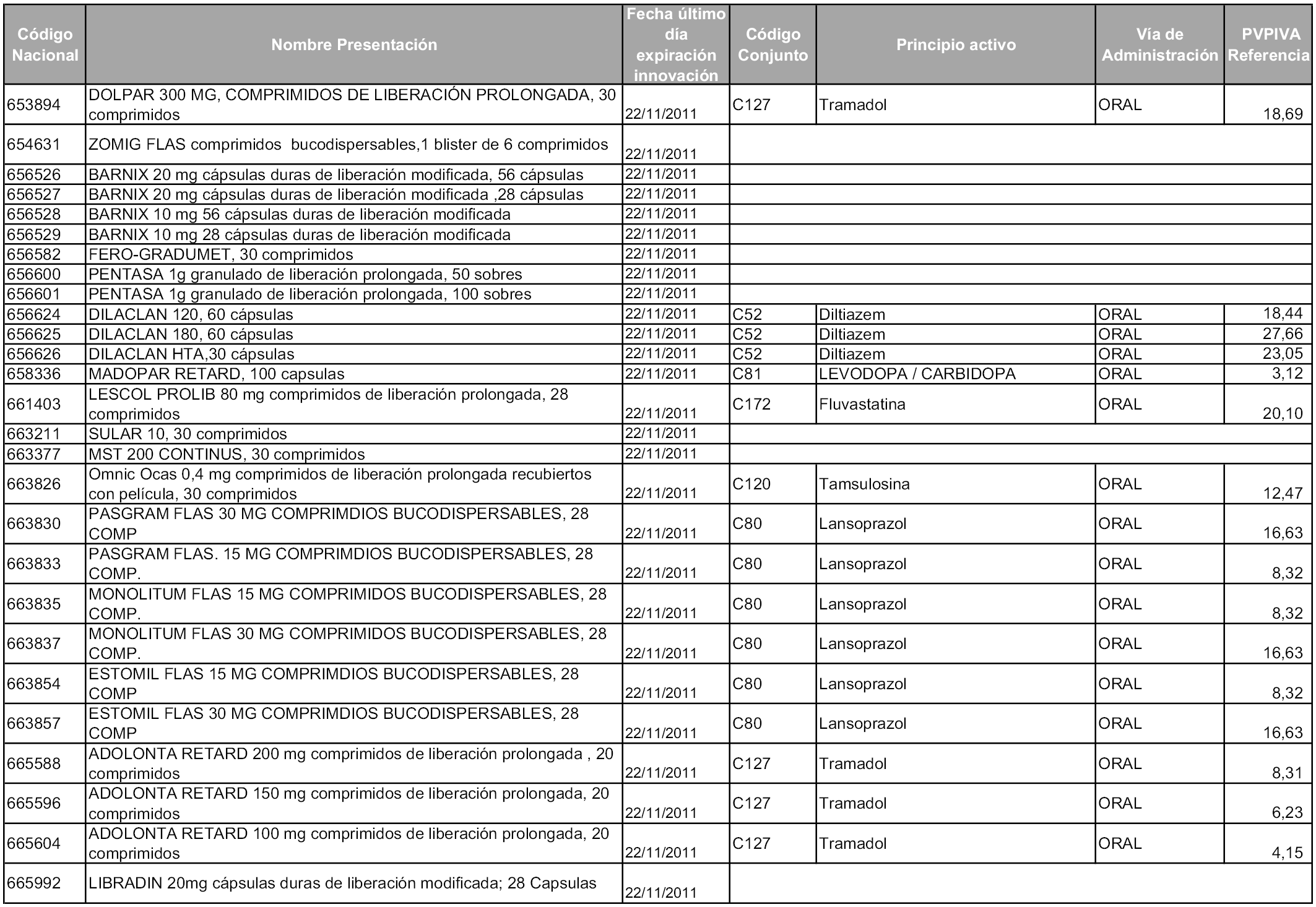
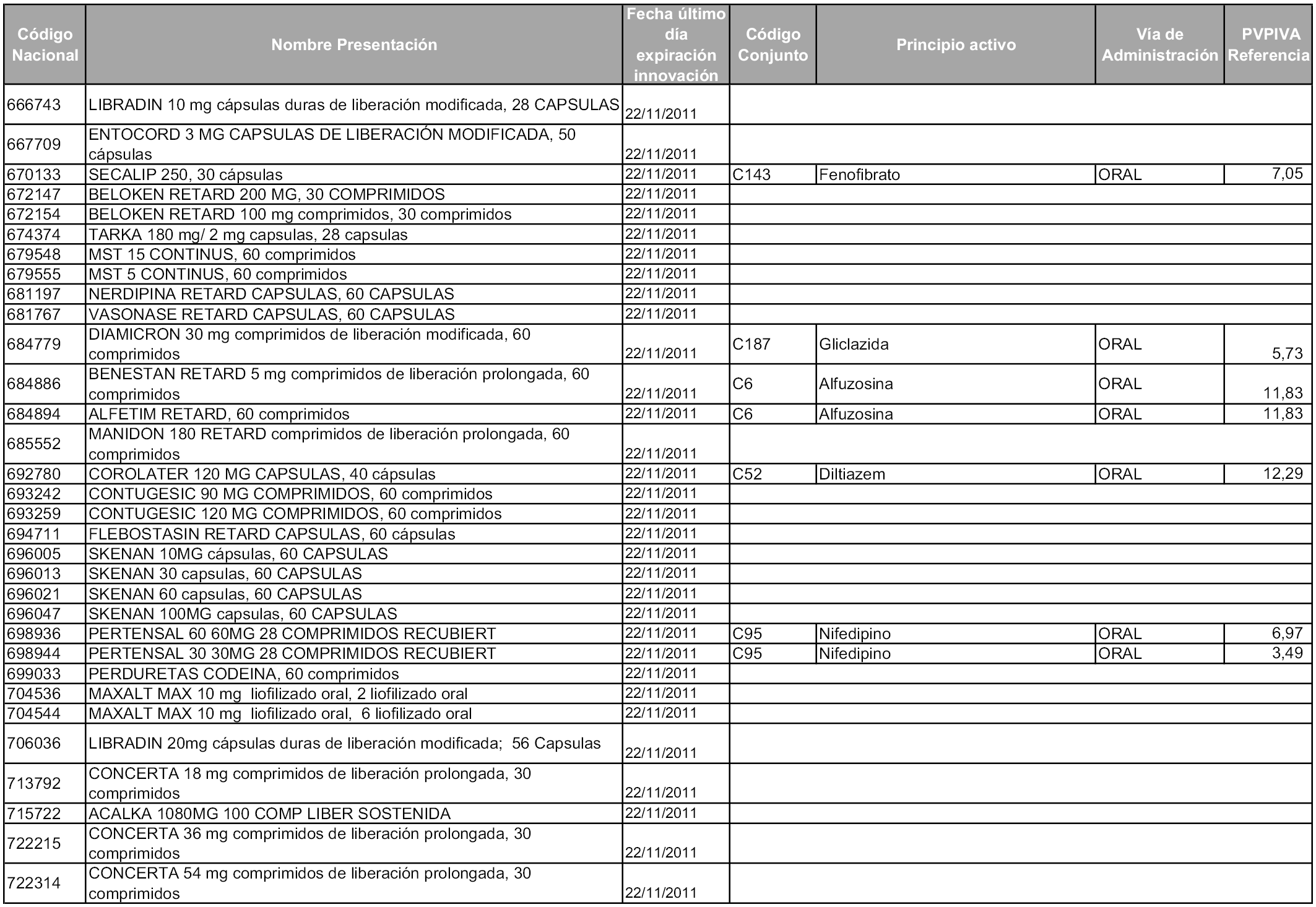
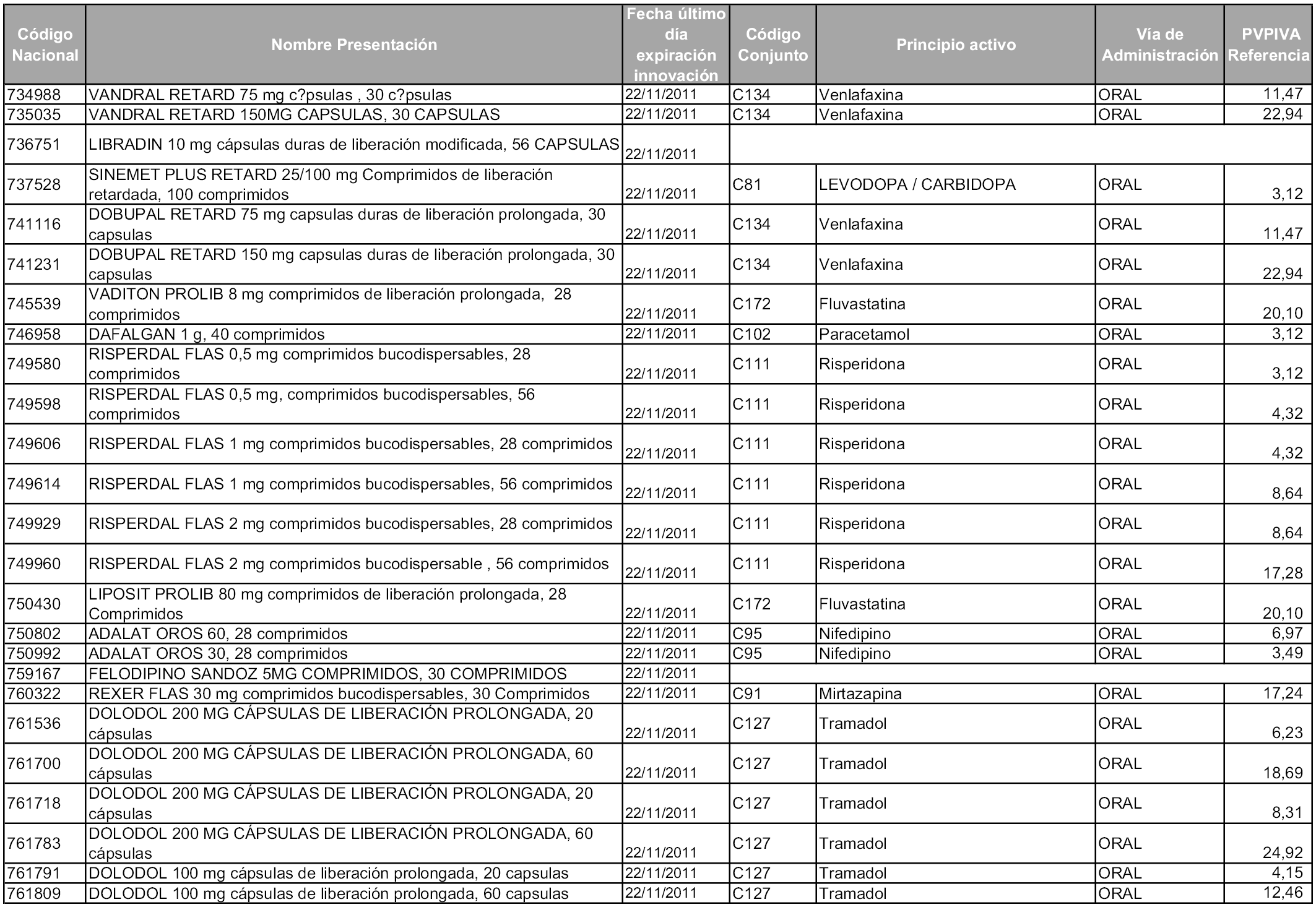
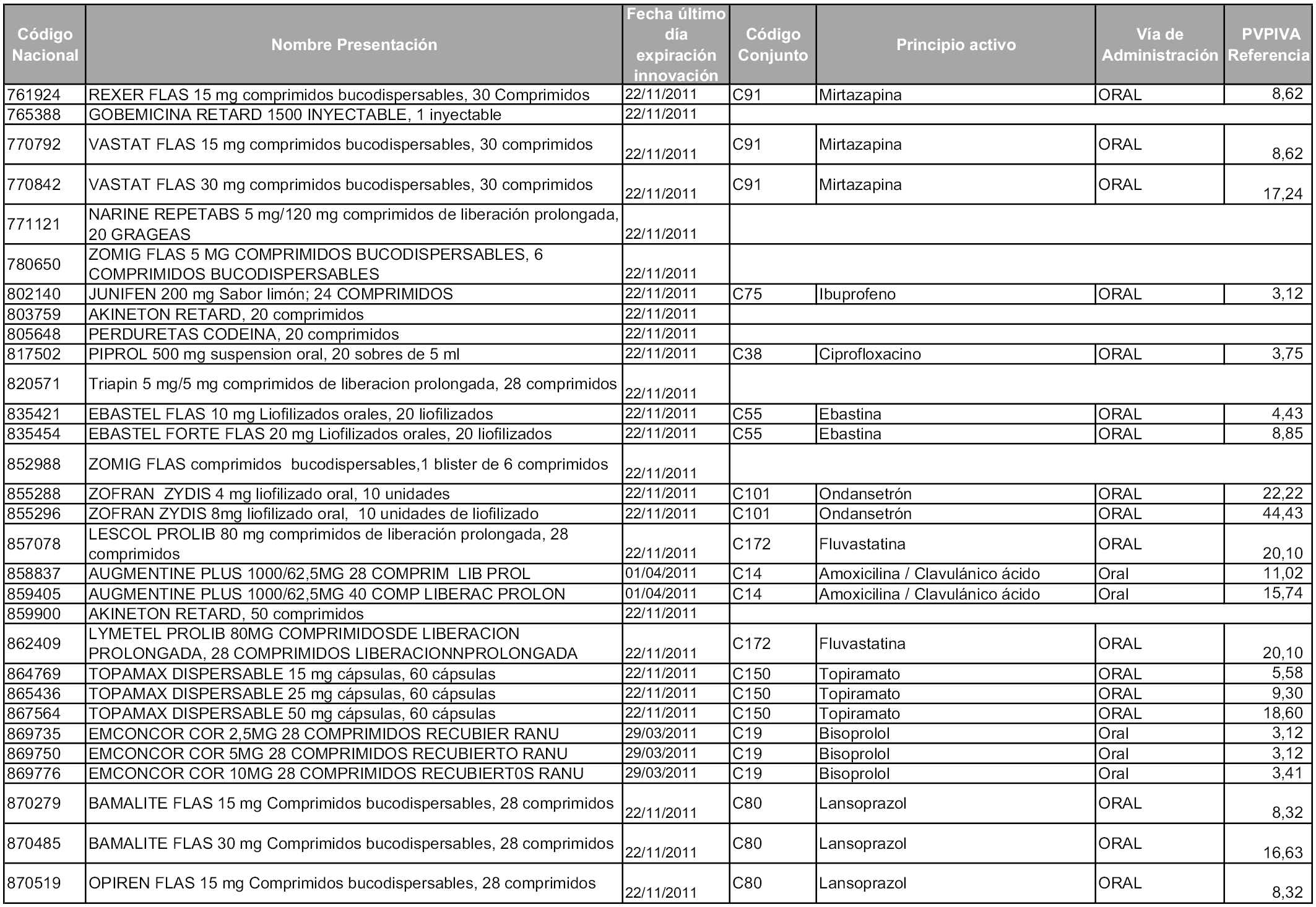
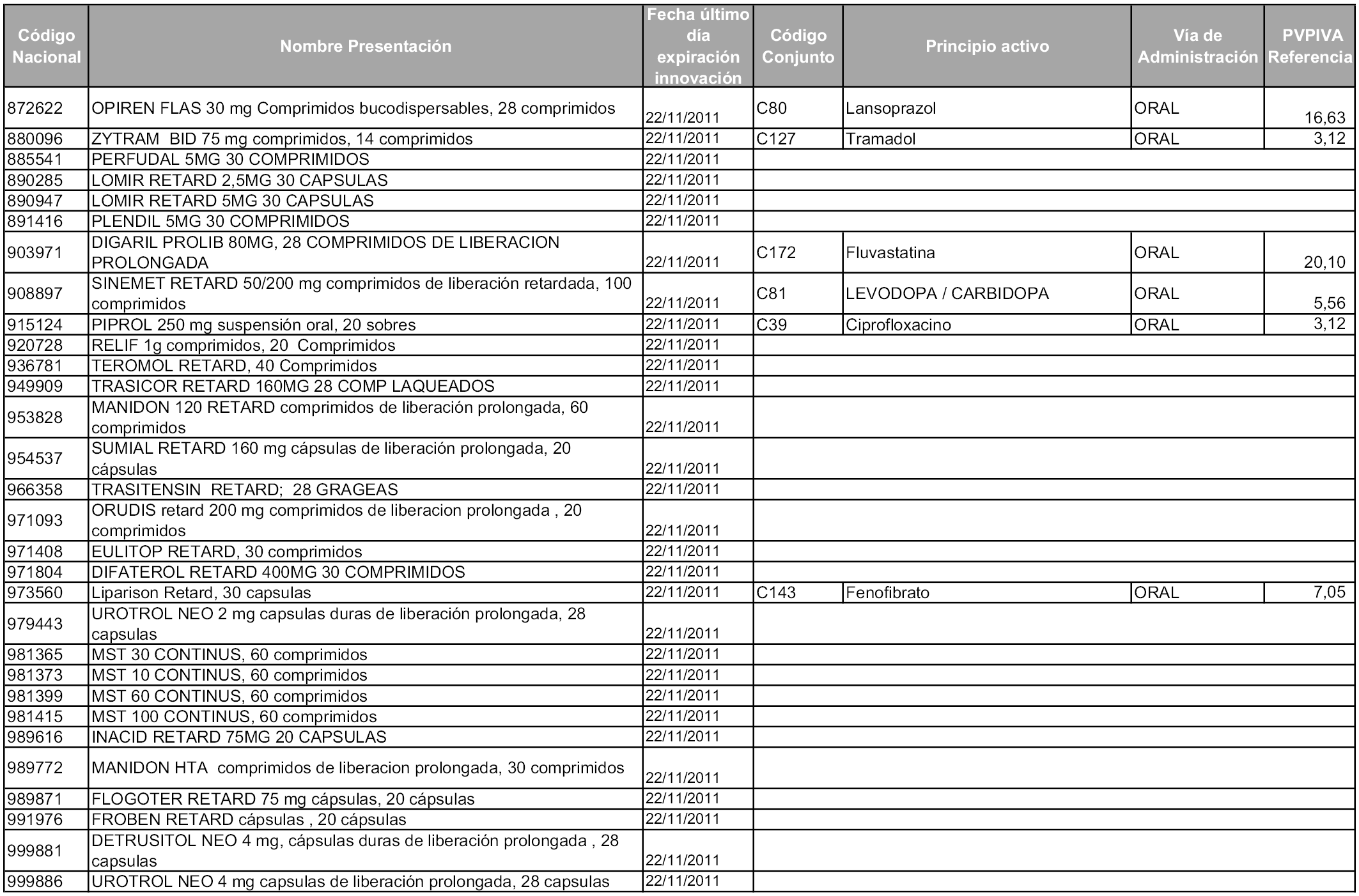
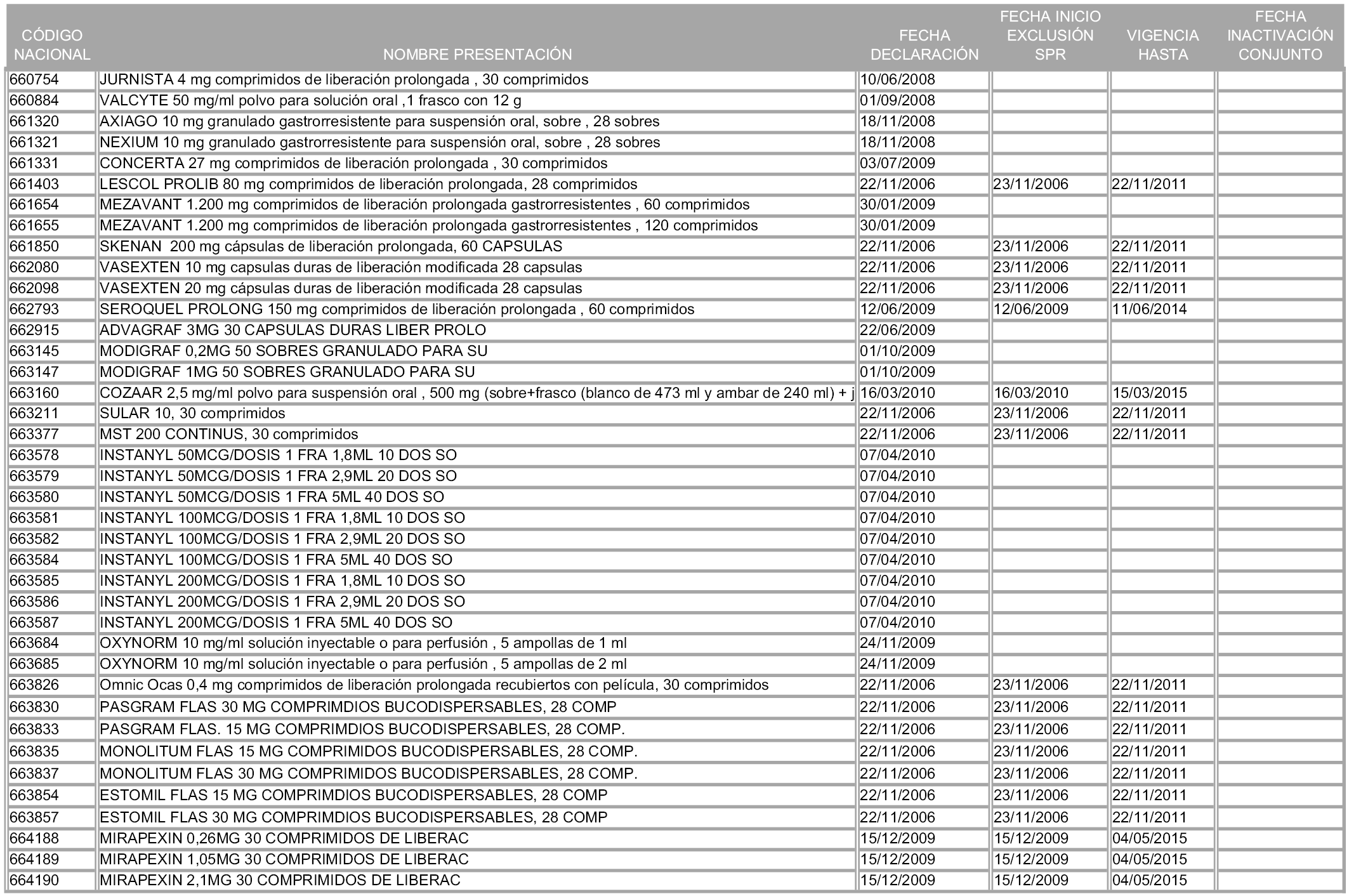
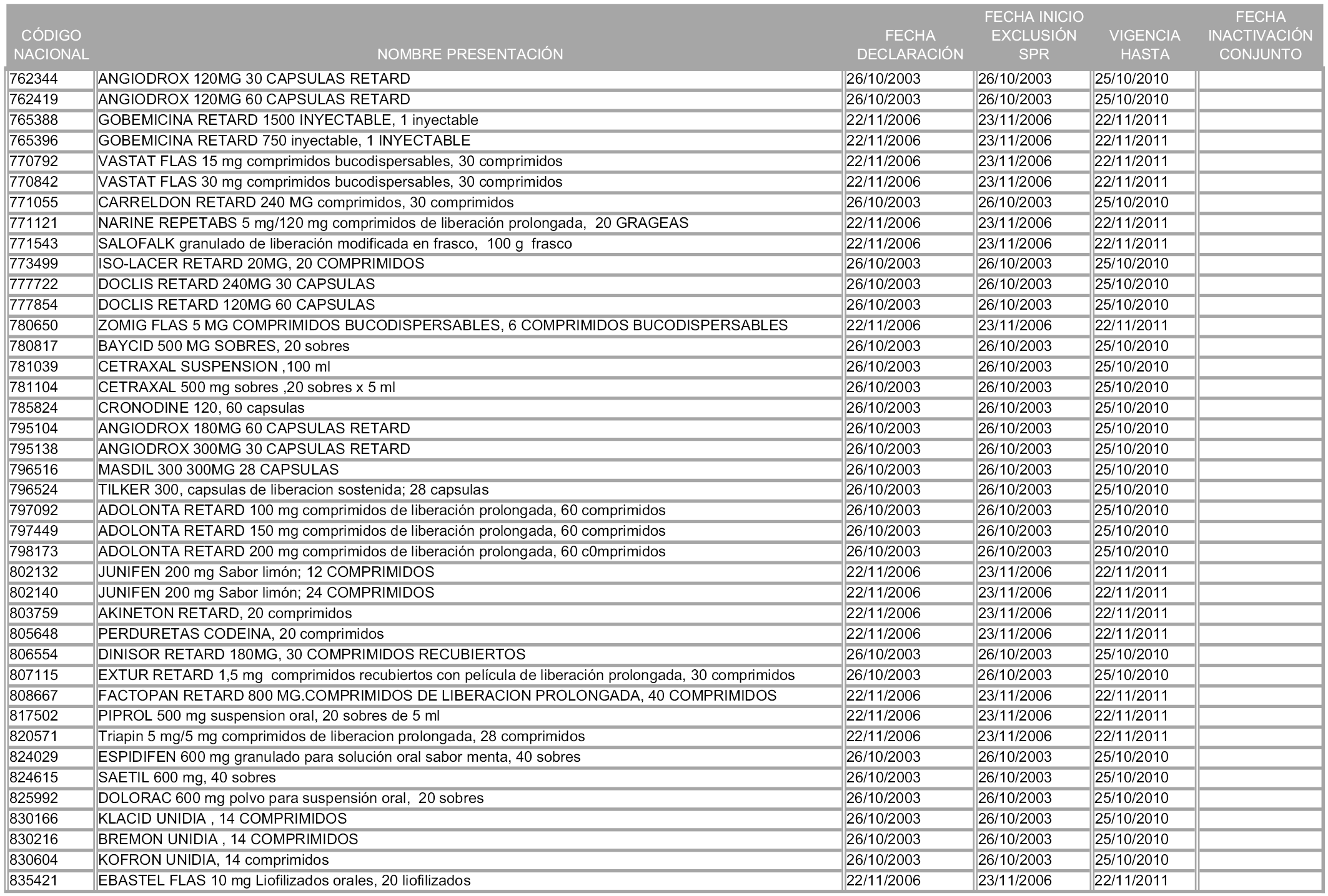
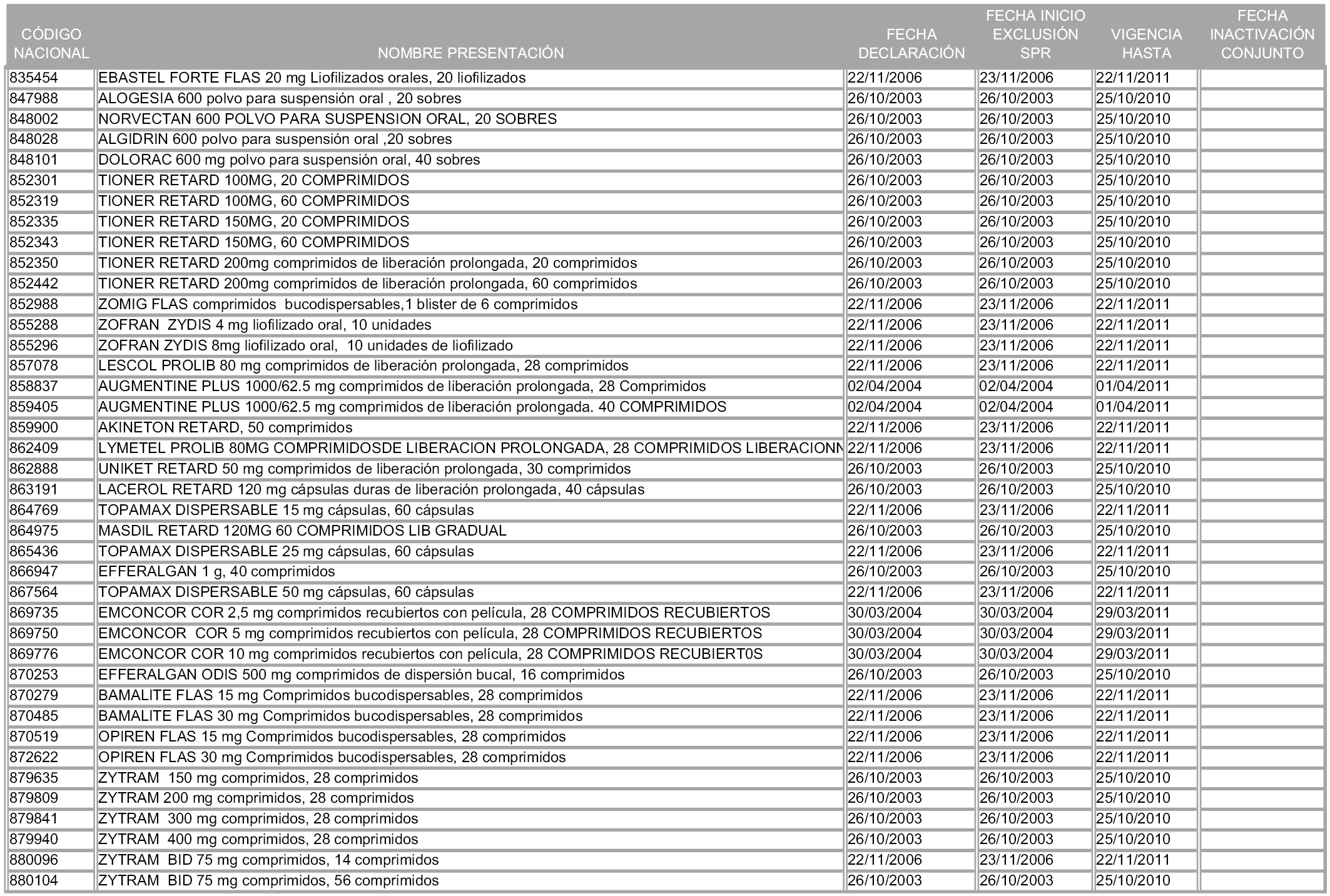
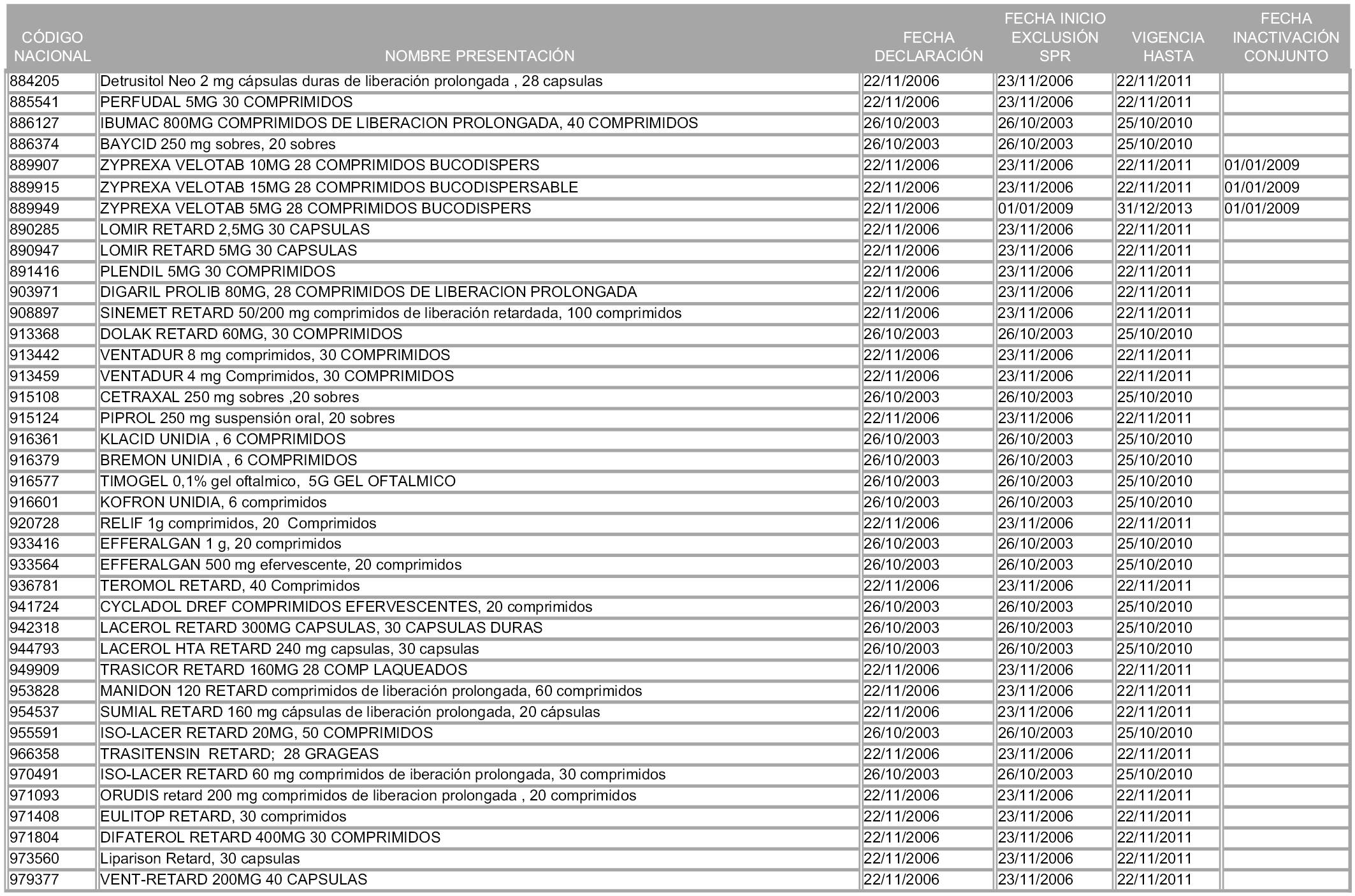
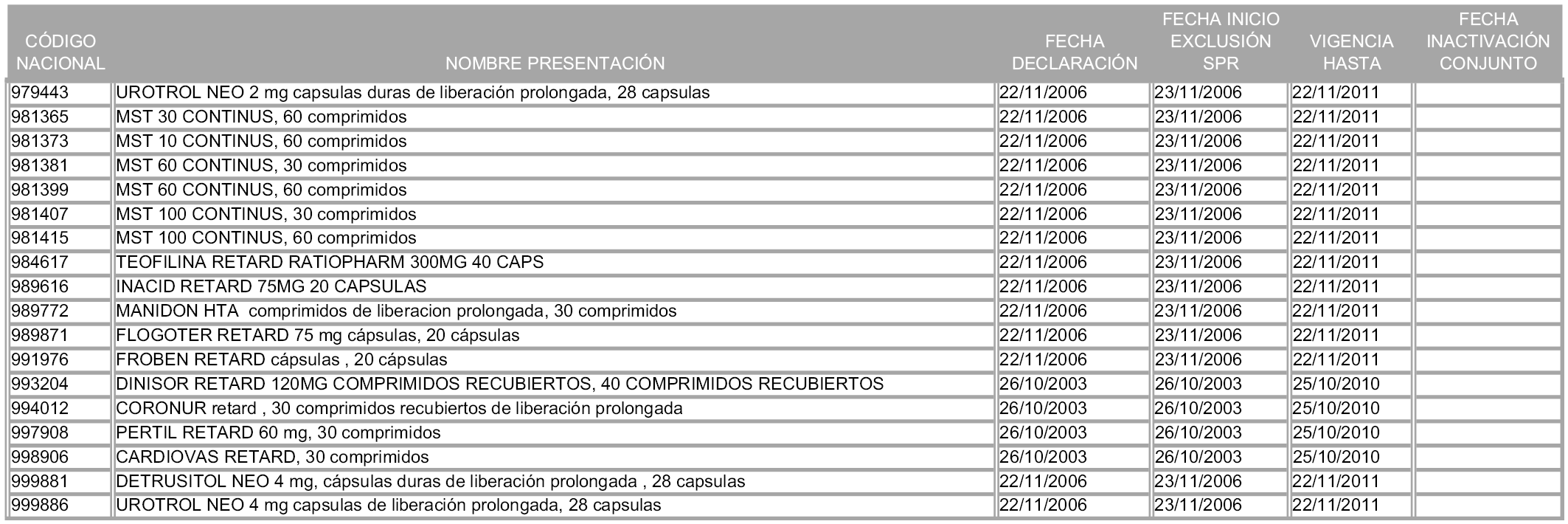
2. A efectos informativos para facilitar su aplicación y seguimiento, se relacionan en el anexo 3 de la presente Orden las presentaciones de medicamentos cuya declaración como innovación galénica expira en el plazo comprendido entre diciembre de 2010 y noviembre de 2011, así como la fecha de su expiración.
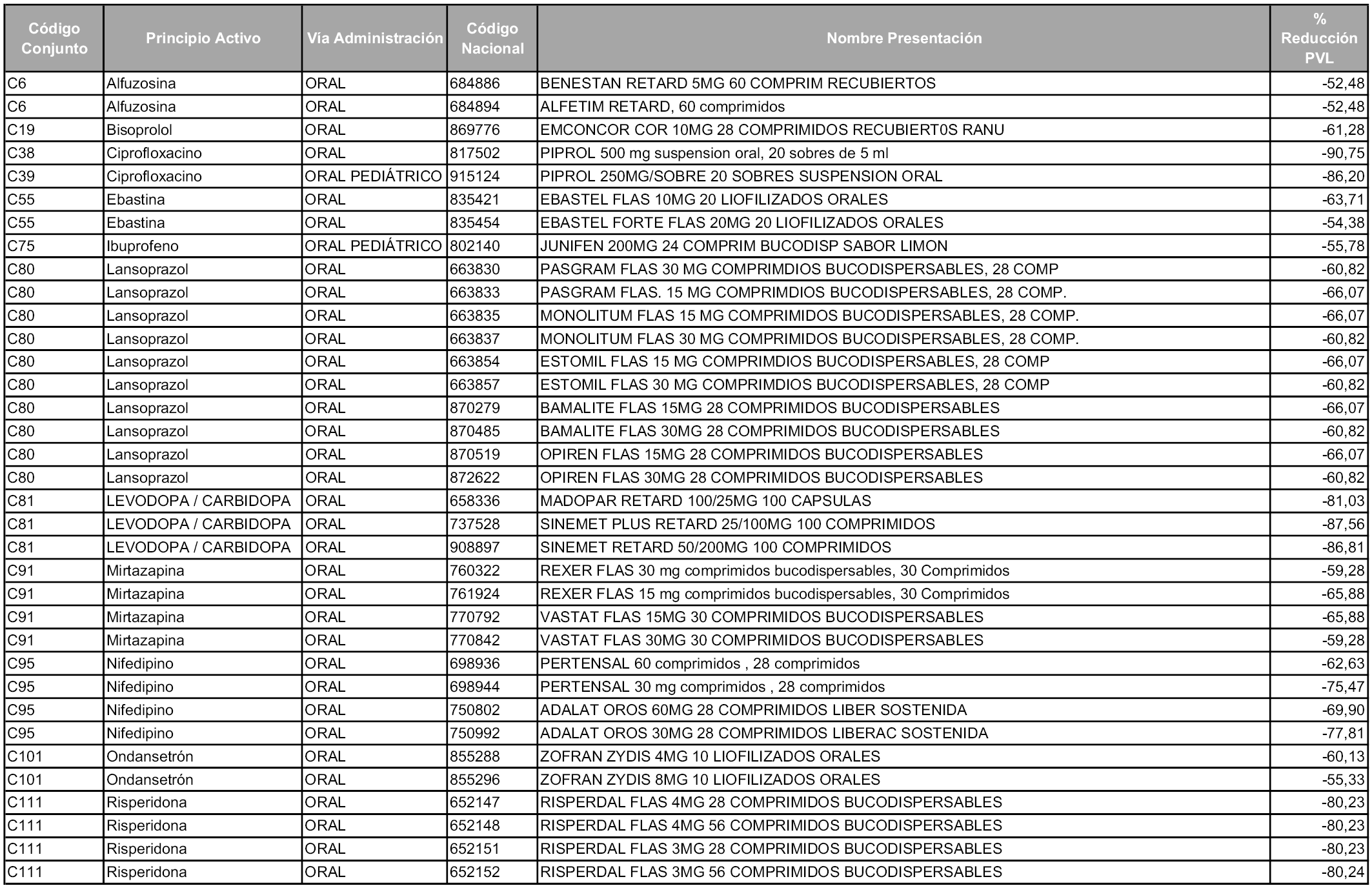
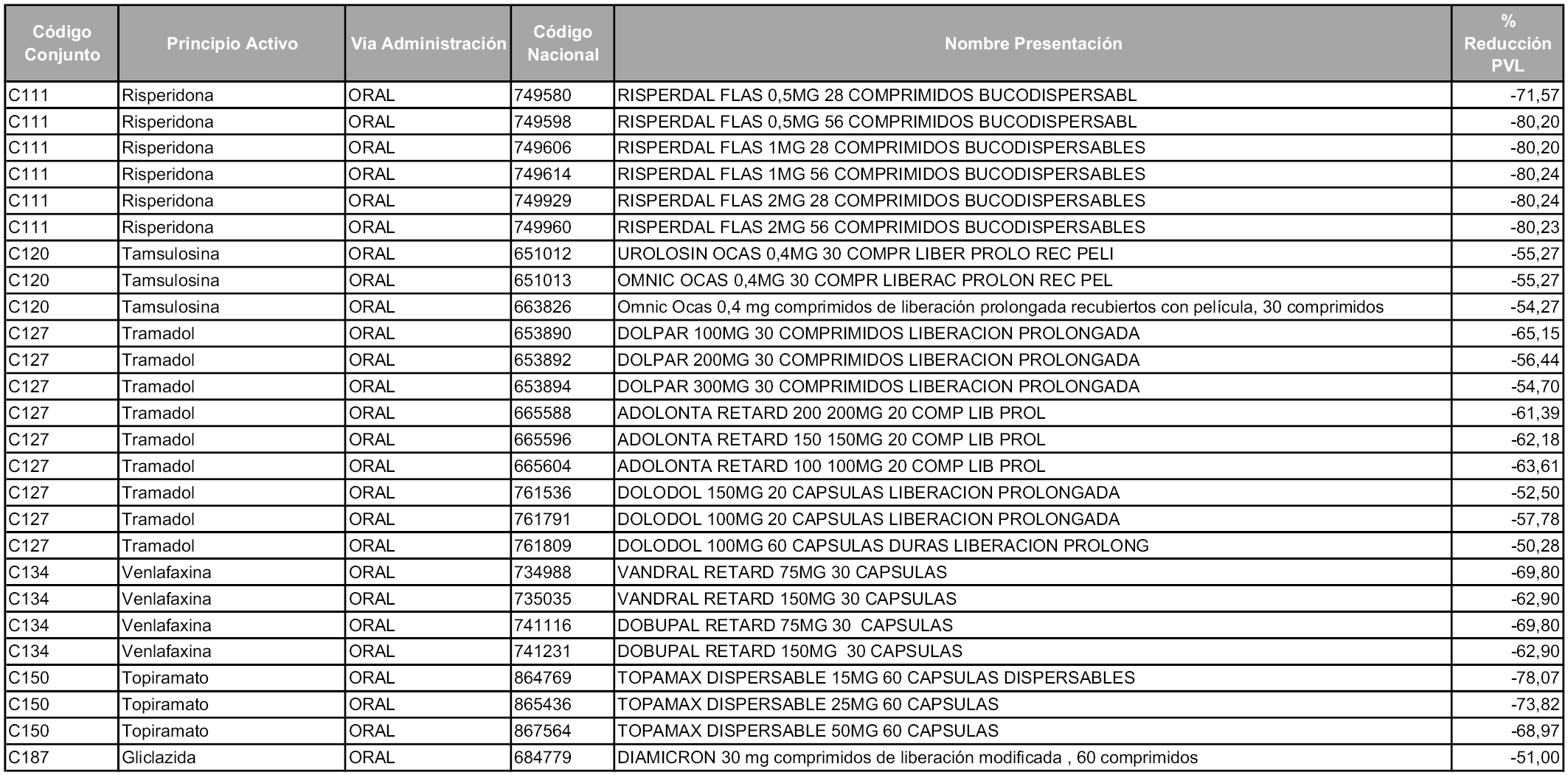
1. Los laboratorios farmacéuticos titulares de las presentaciones de medicamentos cuyos precios industriales se vean afectados en un porcentaje superior al cincuenta por ciento como consecuencia de la aplicación del sistema de precios de referencia, deberán relacionarse en el anexo a la orden de precios de referencia correspondiente, junto con la presentación del medicamento afectado y su respectivo precio de referencia.
Los citados laboratorios podrán optar, conforme establece el apartado 5 del artículo 93 de la Ley 29/2006, por asumir toda la reducción en la fecha de entrada en vigor de la orden ministerial o hacerlo en dos años, en mínimos de un cincuenta por ciento del precio al año, hasta alcanzar el precio de referencia.
2. En el caso de que el laboratorio farmacéutico decida asumir la reducción del precio industrial del medicamento en mínimos de un cincuenta por ciento del precio al año, deberá ejercitar dicha opción durante el plazo de los diez días naturales siguientes a la fecha de entrada en vigor de la orden correspondiente.
A tales efectos, el laboratorio farmacéutico deberá comunicar formalmente la decisión a la Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad, Política Social e Igualdad, especificando en dicha comunicación la cantidad anual por la que se dispensarán los respectivos productos hasta alcanzar el precio de referencia que en cada momento le sea de aplicación.
La fecha en la que será efectiva la cantidad comunicada se establecerá en la correspondiente orden de precios de referencia.
1. Los conjuntos señalados como inactivos en el Anexo 1 no producirán efectos en tanto no se incorpore una presentación de medicamento genérico comercializada no sometida a medidas cautelares de inmovilización o se notifique, por parte del Tribunal o Juzgado al Ministerio de Sanidad, Política Social e Igualdad, la sentencia firme que desestime las pretensiones del titular de la patente del medicamento o el auto por el que se dejen sin efecto las medidas cautelares de inmovilización del medicamento genérico.
2. En el Nomenclátor oficial de productos farmacéuticos del Sistema Nacional de Salud se anotará esta circunstancia. Una vez concurra uno de los supuestos contemplados en el apartado precedente, se procederá a cancelar la anterior anotación y se formulará la oportuna declaración expresa de activación del conjunto para dejar constancia de ello, aplicándose a las presentaciones contenidas en dichos conjuntos las disposiciones contenidas en esta orden.
1. De conformidad con lo dispuesto en el artículo 93.3 de la Ley 29/2006, de 26 de julio, en el plazo de cincuenta días naturales desde la fecha de entrada en vigor de la orden, las presentaciones de medicamentos genéricos con precio superior al de referencia se suministrarán por los laboratorios a un precio industrial que se corresponda con uno igual o inferior al de referencia. En estos supuestos, no se modificará el Código nacional de la presentación del medicamento.
2. Lo establecido en el apartado anterior será también de aplicación a las presentaciones de medicamentos con precio superior al de referencia que no dispongan de iguales presentaciones de medicamentos genéricos, a efectos de la sustitución prevista en el artículo 93.4 de la citada ley y en tanto se mantenga la situación de no disponibilidad.
3. En el supuesto de las presentaciones de medicamentos afectadas por el apartado 1 de la disposición adicional primera de esta orden, los apartados anteriores serán de aplicación en el plazo de cincuenta días naturales a contar desde que se notifique por el Ministerio de Sanidad, Política Social e Igualdad, a todos los interesados, la declaración expresa a la que se refiere el apartado 2 de la disposición adicional primera. En caso necesario, el plazo será ampliado por razón de exigencias de gestión de la prestación farmacéutica del Sistema Nacional de Salud hasta hacer coincidir su finalización con el último día natural del mes correspondiente.
1. Los laboratorios que voluntariamente decidan comercializar las presentaciones de medicamentos a un precio inferior al autorizado para adecuarlo a un nivel igual o inferior al de referencia, sin modificar el Código Nacional, deberán comunicarlo así a la Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad, Política Social e Igualdad en el plazo de los diez días naturales siguientes a la fecha de entrada en vigor de la orden.
2. Las presentaciones de medicamentos a las que se refiere el apartado anterior se suministrarán por los laboratorios al nuevo precio en el plazo de cincuenta días naturales desde la fecha de entrada en vigor de la orden.
3. En el supuesto de las presentaciones de medicamentos afectadas por lo establecido en el apartado 1 de la disposición adicional primera de esta orden, el apartado 1 de esta disposición será de aplicación en el plazo de diez días naturales y el apartado 2 en el plazo de cincuenta días naturales, contados ambos desde que se notifique por el Ministerio de Sanidad, Política Social e Igualdad, a todos los interesados, la declaración expresa a la que se refiere el apartado 2 de la disposición adicional primera.
4. A los medicamentos afectados por lo dispuesto en el artículo 6 de la presente Orden, se les aplicará lo previsto en los apartados 1 y 2 de este artículo. En tal supuesto, el plazo fijado en el apartado 1 se aplicará en los mismos términos. No obstante, lo indicado en el apartado 2 podrá ser de aplicación a partir de los cincuenta días naturales previos a la fecha en que se produzca la expiración de la declaración de innovación galénica según lo señalado en el Anexo 3, debiendo suministrarse en todo caso a partir del primer día del mes siguiente a aquel en que se produzca la citada expiración.
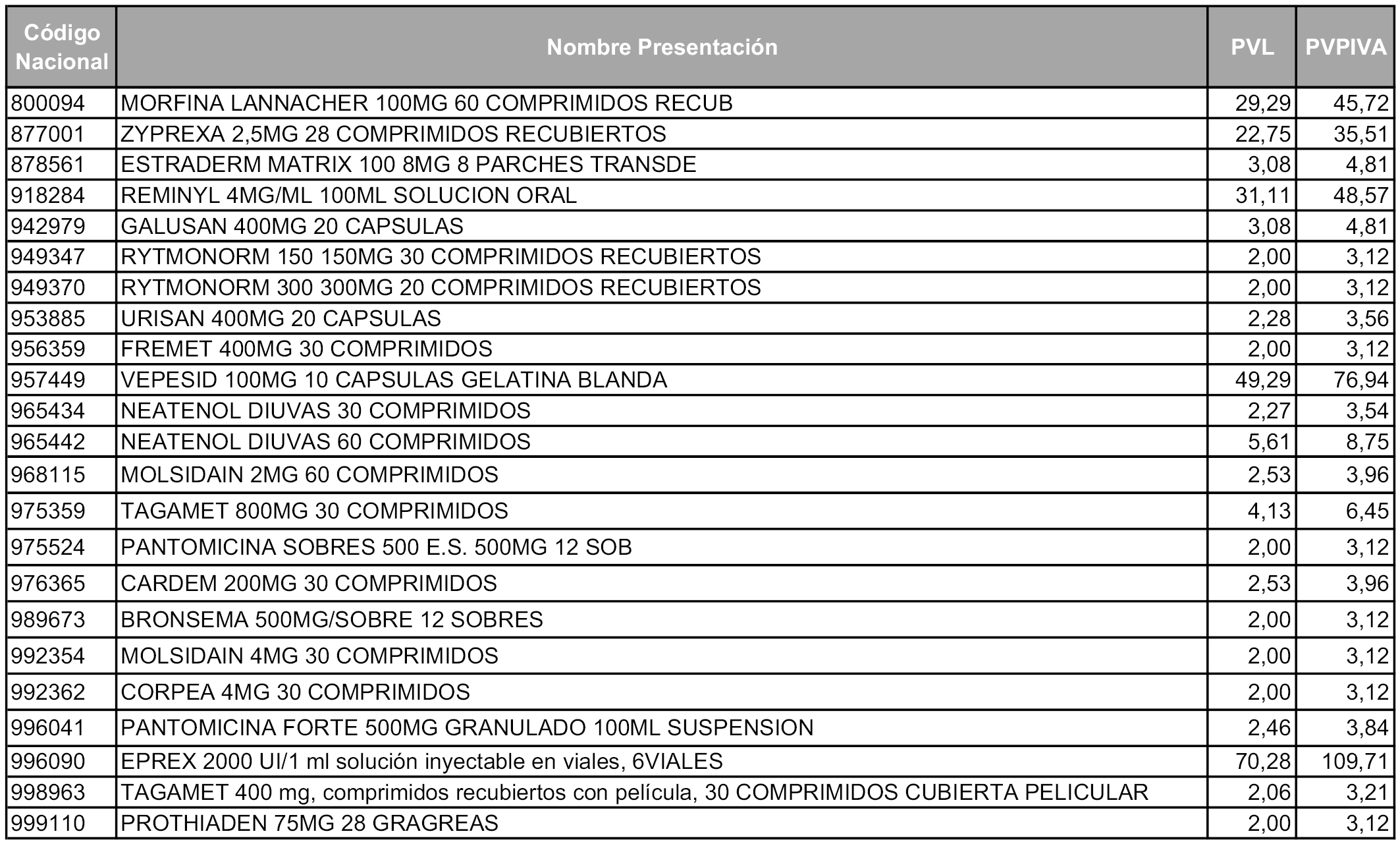
A partir de los cincuenta días naturales desde la fecha de entrada en vigor de la orden, las presentaciones de medicamentos afectadas por lo dispuesto en los apartados 6 y 7 del artículo 93 de la Ley 29/2006, de 26 de julio, que se relacionan en el Anexo 4, tendrán el precio industrial que figura en dicho anexo, sin que sea necesario modificar su Código nacional.
1. Los laboratorios farmacéuticos titulares de los medicamentos relacionados en el Anexo 5 que, conforme a lo establecido en el artículo 93.5 de la Ley 29/2006, de 26 de julio, en relación con el apartado 1 del artículo 7 de la presente Orden, decidan asumir la reducción resultante de la aplicación del sistema de precios de referencia a los precios industriales de sus productos en mínimos de un cincuenta por ciento al año, deberán ejercitar dicha opción de acuerdo con lo dispuesto en el apartado 2 del artículo 7 y la disposición adicional sexta de esta orden. La cantidad comunicada será efectiva a partir de los cincuenta días naturales desde la fecha de entrada en vigor de la orden.
2. En el supuesto de las presentaciones de medicamentos afectadas por lo establecido en el apartado 1 de la disposición adicional primera de esta orden, los plazos a los que se refiere el apartado anterior se computarán desde el momento en que se notifique por el Ministerio de Sanidad, Política Social e Igualdad, a todos los interesados, la declaración expresa a la que se refiere el apartado 2 de la disposición adicional primera. En caso necesario, el plazo será ampliado, por razón de exigencias de gestión de la prestación farmacéutica del Sistema Nacional de Salud, hasta hacer coincidir su finalización con el último día natural del mes correspondiente.
3. Los laboratorios farmacéuticos titulares de los medicamentos afectados por lo dispuesto en el artículo 6 de esta Orden que se relacionen en el anexo 6, y que decidan asumir la reducción resultante de la aplicación del sistema de precios de referencia a los precios industriales de sus productos en mínimos de un cincuenta por ciento al año, podrán ejercitar tal opción en los términos y plazos establecidos en el apartado primero. No obstante, en estos supuestos, la cantidad comunicada será efectiva a partir del primer día del mes siguiente a aquel en que expire la declaración de innovación galénica.
Para todas las actuaciones que los laboratorios deban realizar con la Administración de conformidad con lo dispuesto en esta orden, aquéllos deberán presentar obligatoriamente las comunicaciones mediante registro telemático a través del enlace http://registrotelematico.mspsi.es/, en aplicación de lo dispuesto en el artículo 27.6 de la Ley 11/2007, de 22 de junio, de acceso electrónico de los ciudadanos a los servicios públicos.
1. Para facilitar la aplicación de los supuestos de dispensación y sustitución por el farmacéutico previstos en los artículos 85, 86 y 93.4 de la Ley 29/2006, de 26 de julio, el Nomenclátor oficial de productos farmacéuticos del Sistema Nacional de Salud incorporará la información de las agrupaciones de las presentaciones de medicamentos, incluidas o no en el sistema de precios de referencia. A estos efectos, el medicamento de menor precio será aquel cuyo precio sea el de inferior cuantía de entre las presentaciones incluidas en cada agrupación.
2. La información sobre los precios menores a que se refiere el apartado anterior se actualizará el día siguiente a la finalización del plazo contemplado en el apartado 1 de la disposición transitoria quinta de la presente orden. A efectos informativos esta actualización se relacionará junto al Nomenclátor con un mes de antelación a la fecha de su efectividad.
3. Si las variaciones experimentadas en los precios de los medicamentos así lo aconsejaran, y previo acuerdo de la Comisión Permanente de Farmacia del Consejo Interterritorial del Sistema Nacional de Salud, la información mencionada en los apartados precedentes podrá ser objeto de revisión en el momento en que las circunstancias lo permitan, pudiendo afectar dicha actualización bien a todo el listado incluido en la relación, bien a los grupos de intercambio que se consideren oportunos. A efectos informativos esa actualización se relacionará junto al Nomenclátor con un mes de antelación a la fecha de su efectividad.
De acuerdo con lo dispuesto en el artículo 93.2 de la Ley 29/2006, de 26 de julio, las declaraciones como innovación galénica de interés terapéutico de los medicamentos afectados que se hubieran determinado al amparo de lo dispuesto por el Real Decreto 1338/2006, de 21 de noviembre, se entenderán válidas desde el momento de su declaración y continuarán surtiendo efecto.
1. Las presentaciones de medicamentos que hayan sido declaradas como innovación galénica de interés terapéutico con anterioridad a la entrada en vigor de la presente orden, quedarán, a partir de su entrada en vigor, excluidas de la aplicación del sistema de precios de referencia teniendo en cuenta las fechas relacionadas en el anexo 7, que incluye igualmente las presentaciones contenidas en el anexo 3 de la presente Orden.
2. En el supuesto de los conjuntos declarados inactivos, los plazos de exclusión del sistema de precios de referencia se entenderán suspendidos desde la fecha de inactivación del conjunto correspondiente, reanudándose su cómputo una vez se produzca la activación del mismo de conformidad con lo señalado en el apartado 2 de la Disposición adicional primera de esta orden.
Los procedimientos iniciados con anterioridad a la entrada en vigor de la presente orden y pendientes de resolución, se regirán conforme a lo dispuesto en la presente orden.
Se otorga un plazo de quince días naturales desde la entrada en vigor de la presente orden para presentar solicitudes de declaración de innovación galénica de interés terapéutico a los titulares de nuevas formas farmacéuticas que hayan sido autorizadas entre el 9 de diciembre de 2009 y la entrada en vigor de la presente orden, y que no hayan solicitado tal declaración.
1. Las existencias de las presentaciones de medicamentos afectadas por las reducciones de precios previstas en esta orden que obren en poder de los almacenes, podrán seguir comercializándose al precio anterior a esta reducción en el plazo de los setenta días naturales siguientes a la fecha de entrada en vigor de la orden.
2. Las existencias de las presentaciones de medicamentos afectadas por las reducciones de precios previstas en esta orden que obren en poder de las oficinas de farmacia, podrán seguir comercializándose al precio anterior a esta reducción en el plazo de los noventa días naturales siguientes a la fecha de entrada en vigor de la orden. En caso necesario, el plazo será ampliado, por razón de exigencias de gestión de la prestación farmacéutica del Sistema Nacional de Salud, hasta hacer coincidir su finalización con el último día natural del mes correspondiente. En este último supuesto el período en que resulte ampliado el plazo inicial se repartirá a partes iguales entre los almacenes y las oficinas de farmacia, salvo cuando ello no fuera posible, en cuyo caso la mitad más un día de dicho período le corresponderá a las oficinas de farmacia.
3. Al amparo de lo previsto en el artículo 6.2.5 del Real Decreto 726/1982, de 17 de marzo, por el que se regula la caducidad y devoluciones de las especialidades farmacéuticas a los laboratorios farmacéuticos, los almacenes de distribución y las oficinas de farmacia, sin coste adicional alguno para ellas, podrán devolver a los laboratorios farmacéuticos, a partir del día siguiente a la finalización del plazo contemplado en el apartado anterior y conforme a lo establecido en el artículo 8 del citado Real Decreto, las existencias de las presentaciones con precio en el embalaje anterior a las reducciones establecidas en esta orden.
4. En el supuesto de las presentaciones de medicamentos afectadas por lo establecido en el apartado 1 de la disposición adicional primera de esta orden, los plazos a los que se refieren los apartados anteriores se computarán desde el momento en que se notifique por el Ministerio de Sanidad, Política Social e Igualdad, a todos los interesados, la declaración expresa a la que se refiere el apartado 2 de la disposición adicional primera.
1. El Sistema Nacional de Salud, incluidos los regímenes especiales de la Mutualidad General de Funcionarios Civiles del Estado (MUFACE), del Instituto Social de las Fuerzas Armadas (ISFAS) y de la Mutualidad General Judicial (MUGEJU), mantendrá, durante el plazo de los noventa días naturales siguientes a la fecha de entrada en vigor de la orden, el precio anterior de los medicamentos afectados por lo establecido en las disposiciones adicionales, segunda, tercera y cuarta en relación con esta disposición transitoria segunda, a efectos de facturación y en lo que se refiere, exclusivamente, a la parte del gasto satisfecho directamente por dicho Sistema. En caso necesario, el plazo será ampliado, por razón de exigencias de gestión de la prestación farmacéutica del Sistema Nacional de Salud, hasta hacer coincidir su finalización con el último día natural del mes correspondiente.
2. Se liquidarán con los nuevos precios las facturaciones al Sistema Nacional de Salud, incluidos los regímenes especiales mencionados en el apartado anterior, cerradas a partir del día siguiente a la finalización del plazo contemplado en el apartado anterior.
3. En el supuesto de las presentaciones de medicamentos afectadas por lo establecido en el apartado 1 de la disposición adicional primera de esta orden, los plazos a los que se refieren los apartados anteriores se computarán desde el momento en que se notifique por el Ministerio de Sanidad, Política Social e Igualdad, a todos los interesados, la declaración expresa a la que se refiere el apartado 2 de la disposición adicional primera. En caso necesario, por razón de las exigencias relativas a la facturación, ambos plazos serán ampliados hasta hacer coincidir su finalización con, respectivamente, el último día natural del mes correspondiente y el primer día del mes siguiente.
Quedan derogadas cuantas normas de igual o inferior rango se opongan a lo dispuesto en esta orden.
Esta orden se dicta al amparo de la competencia estatal en materia de legislación sobre productos farmacéuticos, de acuerdo con lo dispuesto en el artículo 149.1.16.ª de la Constitución.
La presente orden entrará en vigor el día siguiente al de su publicación en el «Boletín Oficial del Estado».
Madrid, 26 de noviembre de 2010.–La Ministra de Sanidad, Politica Social e Igualdad, Leire Pajín Iraola.
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid