Suscrito el 24 de junio de 2021, Convenio entre la Organización Nacional de Trasplantes, O.A., la Fundación para la calidad en Transfusión, Terapia Celular y Tisular, La European Society for Blood and Marrow Transplantation y el Grupo Español de Trasplante de Progenitores Hematopoyéticos y Terapia Celular, para el establecimiento de un programa de certificación de calidad de centros autorizados para la obtención, procesamiento e implante de progenitores hematopoyéticos en España, en cumplimiento de lo dispuesto en el artículo 48.8 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, procede la publicación en el «Boletín Oficial del Estado» de dicho Convenio, que figura como anexo de esta Resolución.
Madrid, 2 de julio de 2021.–La Secretaria de Estado de Sanidad, Silvia Calzón Fernández.
En Madrid, a 24 de junio de 2021.
REUNIDOS
De una parte, doña Beatriz Domínguez-Gil González, en su condición de Directora de la Organización Nacional de Trasplantes, conforme a lo dispuesto por Real Decreto 501/2017, de 12 de mayo, y en uso de las atribuciones que le confiere el artículo 9.2.a) del Estatuto de la Organización, aprobado por Real Decreto 1825/2009, de 27 de noviembre.
De otra, don José Manuel Cárdenas Díaz de Espada, con DNI ***8053**, en su condición de Presidente de la Fundación para la Calidad en Transfusión, Terapia Celular y Tisular, actuando en nombre y representación conforme a las atribuciones que le confieren en la reunión del Patronato de la Fundación, el día 18 de diciembre de 2019, entidad inscrita en el Registro de Fundaciones del Ministerio de Educación y Formación Profesional con el número 1.113, con sede social en calle Aravaca, 12, 1b, 28010 Madrid y NIF G-64953094.
De otra, don Andreu Gusi Puig, en su condición de Director Ejecutivo de la European Society for Blood and Marrow Transplantation, con DNI ***2673**, actuando en nombre y representación conforme a las atribuciones que le confieren el poder firmado el día 28 de junio de 2013, en París ante el Notario Maitre Pascal Dufour, entidad inscrita en el Registre de Fundacions de la Generalitat de Catalunya, con sede social en Pg. Taulat 116, 08005 de Barcelona y NIF W3031179I.
Y de otra, doña Anna Sureda Balari con DNI ***4831**, en su condición de Presidenta del Grupo Español de Trasplantes Hematopoyéticos y Terapia Celular, actuando en nombre y representación conforme a las atribuciones que le confieren el acta n.º 12.166 del Registro Nacional de Asociaciones del Ministerio del Interior de fecha 7 de octubre de 2020. El Grupo Español de Trasplantes Hematopoyéticos y Terapia Celular está inscrito con el número 590689 en el Registro Nacional de Asociaciones y tiene su sede social en calle Aravaca, 12, 1b, 28010 Madrid y NIF G-85467041.
Las Partes se reconocen mutua y recíprocamente capacidad legal necesaria para la formalización del presente Convenio y, a tal efecto,
MANIFIESTAN
La Organización Nacional de Trasplantes, O.A. (en adelante ONT) es un organismo público que tiene entre sus fines coordinar las actividades de donación, extracción, preservación, distribución, intercambio y trasplante de órganos, tejidos y células en el conjunto del sistema sanitario español, así como la docencia, investigación, gestión del conocimiento y cooperación internacional en estas materias.
La European Society for Blood and Marrow Transplantation (en adelante EBMT), en colaboración con la International Society for Cellular Therapy, ha desarrollado JACIE, un organismo sin ánimo de lucro cuyo objetivo primordial es la promoción de la calidad en la práctica médica de los centros y de los laboratorios que participan en la extracción, procesamiento y trasplante de progenitores hematopoyéticos a través del desarrollo de un programa voluntario de acreditación de centros a nivel internacional.
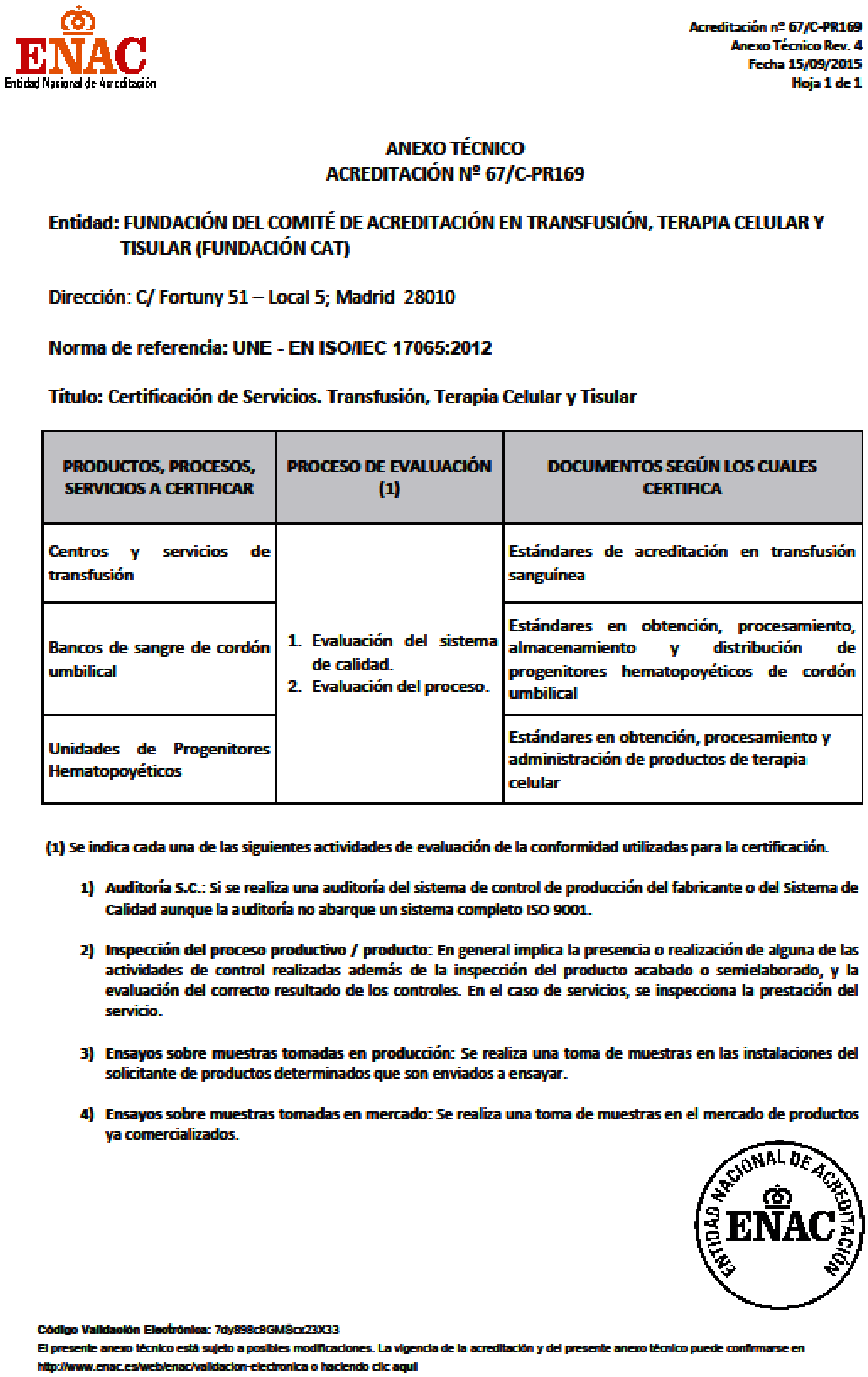
La Fundación para la Calidad en Transfusión, Terapia Celular y Tisular (en adelante FCAT) es una entidad privada sin ánimo de lucro, que tiene como finalidades la mejora continua de la calidad en medicina transfusional y en terapia celular, mediante la actualización y edición periódica de las normas de calidad para centros de transfusión, servicios de transfusión, bancos de sangre de cordón umbilical, bancos de tejidos y unidades de trasplante de células progenitoras hematopoyéticas; la certificación de los centros de transfusión, servicios de transfusión, bancos de sangre de cordón umbilical, bancos de tejidos y unidades de trasplante de células progenitoras hematopoyéticas; y la promoción del programa de certificación. Esta constituida por la SETS y por la SEHH, que cuenta desde 2010 con la acreditación ENAC para el desarrollo de sus actividades de certificación, incluido el trasplante de progenitores hematopoyéticos.
El Grupo Español de Trasplantes Hematopoyéticos y Terapia Celular (en adelante GETH) es una asociación de carácter científica sin ánimo de lucro, que tiene por finalidad colaborar con otras organizaciones sanitarias nacionales e internacionales, fomentar la divulgación de los conocimientos relativos a este tipo de actividad tanto para los profesionales como para el público en general y actuar como órgano de opinión en temas relacionados con el trasplante hematopoyético.
La ONT, la EBMT, la FCAT y el GETH tienen una amplia concordancia de objetivos, entre otros, en el ámbito de los progenitores hematopoyéticos y la terapia celular, reuniendo conocimiento, estructuras, protocolos y métodos orientados a la calidad de las actividades que con ellos se relacionan, de reconocido prestigio, sobre las que han desarrollado diversos programas de colaboración científica y técnica.
De otra parte, la ONT y la FCAT disponen de un Convenio de colaboración en el ámbito de la certificación y la auditoría de bancos de sangre de cordón umbilical y de centros de obtención, procesamiento y administración de productos de terapia celular desde junio de 2012, renovado en septiembre de 2020 con una vigencia de 4 años.
Las Partes están interesadas en seguir manteniendo la colaboración para la certificación de calidad de los centros autorizados para trasplante de progenitores hematopoyéticos en España y para aunar esfuerzos entre las administraciones sanitarias, las organizaciones de certificación técnicas especializadas en esta materia, las sociedades científicas y los centros de trasplante hematopoyético españoles.
La colaboración institucional que ampara este Convenio contribuye al desarrollo de la función social encomendada a las entidades firmantes, ya que por la vía de la certificación y de las auditorías de calidad a los centros acreditados se incentivan las buenas prácticas y el cumplimiento de la legalidad. Además de constituir un valioso instrumento para las administraciones sanitarias en el fomento y mejora continua de la calidad y de la seguridad biológica, es una garantía para los profesionales, para las autoridades de otros estados y para los ciudadanos como destinatarios últimos de esos servicios.
Por lo expuesto, las Partes acuerdan suscribir el presente Convenio que se regirá por las siguientes,
CLÁUSULAS
1. Colaborar en el desarrollo, impulso y mantenimiento de un programa de certificación de calidad de centros autorizados para la obtención, procesamiento e implante de progenitores hematopoyéticos en España, de carácter voluntario para los mismos, bajo criterios objetivos y estándares únicos, avalados por la ONT como autoridad competente en trasplante de progenitores hematopoyéticos y creadora del modelo español de trasplantes.
2. Promover que los centros españoles de trasplante de progenitores hematopoyéticos adopten el programa de certificación definido en este acuerdo como modelo de calidad.
3. Velar por que la actividad de certificación, que se regirá por los criterios de independencia, imparcialidad e integridad, se realice sin ánimo de lucro (sin perjuicio del resarcimiento de los costes incurridos) y sin detrimento de las competencias sobre la materia de las comunidades autónomas y de la Administración General del Estado.
Las Partes se comprometen a realizar el mayor esfuerzo para la realización del objeto al que se refiere la cláusula primera.
Por la FCAT:
1. Fomentar y promover el programa de certificación objeto de este Convenio entre las administraciones sanitarias españolas.
2. Garantizar que las certificaciones conjuntas incluyan los estándares reconocidos por JACIE y FCAT, así como el cumplimiento de los requisitos FCAT no incluidos en los estándares JACIE, recogidos en los Impresos CAT (anexo 1), manteniendo la acreditación ENAC otorgada a la FCAT.
3. Mantener los canales de comunicación necesarios para el buen funcionamiento del proceso de certificación.
4. Garantizar que el proceso de certificación se lleve a cabo según lo acordado entre FCAT y JACIE
5. Resolver las discrepancias en la decisión de certificación de acuerdo a los procedimientos JACIE-FCAT consensuados.
6. Participar activamente y colaborar en el proceso de certificación de progenitores hematopoyéticos con arreglo a los medios y capacidades de cada institución.
7. Difundir el reconocimiento internacional de las certificaciones otorgadas a centros españoles en virtud de este Programa de Certificación.
8. Respaldar y colaborar en los cursos de formación de auditores y evaluadores en España.
9. Impulsar este modelo de colaboración entre entidades científicas y la administración sanitaria española en busca del reconocimiento internacional y como patrón a seguir en otros países.
10. Favorecer la máxima difusión del Programa de certificación de trasplante de progenitores hematopoyéticos entre los centros autorizados para extracción, procesamiento y trasplante de progenitores hematopoyéticos en España.
11. Evaluar las oportunidades para promover el modelo español de trasplante entre los países latinoamericanos, ahora en fase de desarrollo, en base al reconocido prestigio internacional de la ONT y las redes internacionales tejidas entre el JACIE y otras organizaciones profesionales del sector.
Por la EBMT:
1. Fomentar y promover el programa de certificación objeto de este Convenio entre las administraciones sanitarias españolas.
2. Garantizar que las certificaciones conjuntas incluyan los estándares reconocidos por JACIE y FCAT, así como el cumplimiento de los requisitos FCAT no incluidos en los estándares JACIE, manteniendo la acreditación ENAC otorgada a la FCAT según anexos 1 y 2.
3. Mantener los canales de comunicación necesarios para el buen funcionamiento del proceso de certificación.
4. Garantizar que el proceso de certificación es el descrito en el anexo 3.
5. Resolver las discrepancias en la decisión de certificación de acuerdo a los procedimientos JACIE-FCAT consensuados atendiendo las recomendaciones y comentarios emanados del Comité de Partes de la FCAT.
6. Participar activamente y colaborar en el proceso de certificación de progenitores hematopoyéticos con arreglo a los medios y capacidades de cada institución.
7. Difundir el reconocimiento internacional de las certificaciones otorgadas a centros españoles en virtud de este Programa de Certificación.
8. Respaldar y colaborar en los cursos de formación de auditores y evaluadores en España.
9. Impulsar este modelo de colaboración entre entidades científicas y la administración sanitaria española en busca del reconocimiento internacional y como patrón a seguir en otros países.
10. Favorecer la máxima difusión del Programa de certificación de trasplante de progenitores hematopoyéticos entre los centros autorizados para extracción, procesamiento y trasplante de progenitores hematopoyéticos en España.
11. Evaluar las oportunidades para promover el modelo español de trasplante entre los países latinoamericanos, ahora en fase de desarrollo, en base al reconocido prestigio internacional de la ONT y las redes internacionales tejidas entre el JACIE y otras organizaciones profesionales del sector.
Por la ONT:
1. Fomentar y promover el programa de certificación objeto de este Convenio entre las administraciones sanitarias españolas.
2. Garantizar que las certificaciones conjuntas incluyan los estándares reconocidos por JACIE y FCAT, así como el cumplimiento de los requisitos FCAT no incluidos en los estándares JACIE, manteniendo la acreditación ENAC otorgada a la FCAT según Anexos 1 y 2.
3. Mantener los canales de comunicación necesarios para el buen funcionamiento del proceso de certificación.
4. Garantizar que el proceso de certificación es el descrito en el anexo 3.
5. Resolver las discrepancias en la decisión de certificación de acuerdo a los procedimientos JACIE-FCAT consensuados atendiendo las recomendaciones y comentarios emanados del Comité de Partes de la FCAT.
6. Participar activamente y colaborar en el proceso de certificación de progenitores hematopoyéticos con arreglo a los medios y capacidades de cada institución.
7. Difundir el reconocimiento internacional de las certificaciones otorgadas a centros españoles en virtud de este Programa de Certificación.
8. Respaldar y colaborar en los cursos de formación de auditores y evaluadores en España.
9. Impulsar este modelo de colaboración entre entidades científicas y la administración sanitaria española en busca del reconocimiento internacional y como patrón a seguir en otros países.
10. Favorecer la máxima difusión del Programa de certificación de trasplante de progenitores hematopoyéticos entre los centros autorizados para extracción, procesamiento y trasplante de progenitores hematopoyéticos en España.
11. Evaluar las oportunidades para promover el modelo español de trasplante entre los países latinoamericanos, ahora en fase de desarrollo, en base al reconocido prestigio internacional de la ONT y las redes internacionales tejidas entre el JACIE y otras organizaciones profesionales del sector.
Por el GETH:
1. Fomentar y promover el programa de certificación objeto de este Convenio entre las administraciones sanitarias españolas.
2. Aportar el conocimiento de los centros de trasplante y de los expertos en el trasplante hematopoyético y la terapia celular que lo forman sobre los procesos de acreditación a fin de mejorar el mismo.
3. Mantener los canales de comunicación necesarios para el buen funcionamiento del proceso de certificación.
4. Colaborar en el proceso de certificación de progenitores hematopoyéticos con arreglo a los medios y capacidades de cada institución.
5. Difundir el reconocimiento internacional de las certificaciones otorgadas a centros españoles en virtud de este Programa de Certificación.
6. Respaldar y colaborar en los cursos de formación de auditores y evaluadores en España.
7. Impulsar este modelo de colaboración entre entidades científicas y la administración sanitaria española en busca del reconocimiento internacional y como patrón a seguir en otros países.
8. Favorecer la máxima difusión del Programa de certificación de trasplante de progenitores hematopoyéticos entre los centros autorizados para extracción, procesamiento y trasplante de progenitores hematopoyéticos en España.
9. Evaluar las oportunidades para promover el modelo español de trasplante entre los países latinoamericanos, ahora en fase de desarrollo, en base al reconocido prestigio internacional de la ONT y las redes internacionales tejidas entre el JACIE y otras organizaciones profesionales del sector.
La implicación de las organizaciones firmantes en las actividades definidas en el presente Convenio se llevará a cabo por su cuenta, y fundamentalmente consistirán en la certificación de calidad de centros autorizados para la obtención, procesamiento e implante de progenitores hematopoyéticos en España.
Las Partes se obligan al cumplimiento de la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales, así como a observar lo establecido por el Reglamento (UE) 2016/679 del Parlamento Europeo y el Consejo de 27 de abril de 2016 relativo a la protección de las personas físicas en lo que respecta al tratamiento de datos personales y a la libre circulación de estos datos y por el que se deroga la Directiva 95/46/CE, por sus normas internas en el ámbito de la seguridad, calidad y confidencialidad, y a adoptar las medidas necesarias a efectos de exigir a su personal la máxima discreción y secreto profesional con respecto a cualquier información a la que tengan acceso con motivo del presente Convenio. Asimismo se comprometen a no publicar ni divulgar ningún dato que se considere confidencial, excepto con permiso expreso de la contraparte.
Para el seguimiento, vigilancia, control y resolución de cuantas cuestiones se susciten en torno a la interpretación y aplicación de la ejecución del presente Convenio se constituirá una Comisión de Seguimiento integrada por dos (2) representantes de cada una de las Partes, designados por cada uno de los firmantes.
Dicha Comisión Mixta se constituirá en el plazo de 15 días contados desde la publicación en BOE del presente Convenio y dictará las normas internas de su funcionamiento, debiéndose reunir siempre que lo solicite alguna de las Partes.
Supletoriamente se le aplicarán las normas contenidas para los órganos colegiados en la sección 3.ª del capítulo II del título preliminar de Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
El presente Convenio queda sometido al régimen jurídico de Convenios previsto en el título preliminar, capítulo VI, de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
Las dudas y controversias que pudieran suscitarse con motivo de la interpretación y aplicación del presente Convenio y que no puedan ser resueltas de forma amistosa por las Partes a través de la Comisión Mixta regulada en la cláusula cuarta, serán de conocimiento y competencia del Orden Jurisdiccional Contencioso-Administrativo.
El presente Convenio no lleva aparejada obligación económico-financiera alguna para las Partes, toda vez que las actividades descritas en la cláusula segunda forman parte de su actividad y vienen llevándose ya a cabo de manera ordinaria por las organizaciones firmantes.
El presente Convenio se perfecciona con el consentimiento de las Partes y comenzará a surtir efectos desde su publicación en el «Boletín Oficial del Estado», previa inscripción en el Registro Electrónico Estatal de Órganos e Instrumentos de Cooperación del sector público estatal (REOICO).
Tendrá una vigencia de cuatro (4) años, renovándose de forma expresa, por acuerdo unánime de las Partes, por un periodo de cuatro años adicionales. Esta renovación producirá efectos a partir de su inscripción en REOICO y su publicación en el «Boletín Oficial del Estado».
En el caso de que se modificara el texto, las nuevas condiciones a aplicar deberán quedar reflejadas en adenda al presente Convenio, suscrita previo acuerdo por todas las Partes firmantes, en relación con el artículo 49.g) de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
Este Convenio se extinguirá por el cumplimiento de las actuaciones que constituyen su objeto o por incurrir en causa de resolución.
Son causas de resolución:
a) El transcurso del plazo de vigencia del Convenio sin haberse acordado la prórroga del mismo.
b) El acuerdo unánime de todos los firmantes.
c) El incumplimiento de las obligaciones y compromisos asumidos por parte de alguno de los firmantes.
d) Por decisión judicial declaratoria de la nulidad del Convenio.
e) Por cualquier otra causa distinta de las anteriores prevista en el Convenio o en otras leyes.
Si cuando concurra cualquiera de las causas de resolución del Convenio existen actuaciones en curso de ejecución, las Partes, a propuesta de la Comisión de Seguimiento, podrán acordar la continuación y finalización de las actuaciones en curso que consideren oportunas, estableciendo un plazo improrrogable para su finalización, transcurrido el cual deberá realizarse la liquidación de las mismas.
En caso de incumplimiento de las obligaciones, cualquiera de las Partes podrá notificar a la Parte incumplidora un requerimiento para que cumpla en un plazo de un (1) mes con las obligaciones o compromisos que se consideran incumplidos. Este requerimiento será comunicado al responsable del mecanismo de seguimiento, vigilancia y control de la ejecución del Convenio y a las demás Partes firmantes.
Si trascurrido el plazo indicado en el requerimiento persistiera el incumplimiento, la Parte que lo dirigió notificará a las otras Partes firmantes la concurrencia de la causa de resolución y se entenderá resuelto el Convenio, en cuyo caso a la Parte incumplidora le deparará el perjuicio a que en Derecho hubiere lugar.
Y en prueba de conformidad con cuanto antecede, las Partes firman todas las páginas del presente Convenio, en el lugar indicado al inicio.–Por la Organización Nacional de Trasplantes, la Directora General, Beatriz Domínguez-Gil González.–Por la Fundación para la Calidad en Transfusión, Terapia Celular y Tisular, el Presidente, José Manuel Cárdenas Díaz de Espada.–Por la European Society for Blood and Marrow Transplantation, el Director Ejecutivo, Andreu Gusi Puig.–Por el Grupo Español de Trasplantes Hematopoyéticos y Terapia Celular, la Presidenta, Anna Sureda Balari.



Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid